美洲大蠊内生菌的分离鉴定及酶活性、抑菌作用测定
阮传清, 刘 波* , 吴珍泉, 苏明星, 蔡怀锦, 李 涛
(1.福建省农业科学院 农业生物资源研究所,福建 福州 350003; 2.福建农林大学 植物保护学院,福建 福州 350002)
美洲大蠊内生菌的分离鉴定及酶活性、抑菌作用测定
阮传清1, 刘 波1*, 吴珍泉2, 苏明星1, 蔡怀锦1, 李 涛2
(1.福建省农业科学院 农业生物资源研究所,福建 福州 350003; 2.福建农林大学 植物保护学院,福建 福州 350002)
分离美洲大蠊内生细菌并测定菌体的淀粉、纤维素降解酶活性及抑菌特性。对虫体表面消毒,以LB和高氏一号培养基分离虫体内部细菌并进行16S rRNA基因序列分析。变色圈法测定降解酶活性,抑菌圈法测定抑菌活性。结果共分离到11株细菌,4株属于链霉菌属(Streptomyces),6株分别属于肠杆菌属(Enterbacter)、变形菌属(Proteus)、肠球菌属(Enterococcus)、沙雷氏菌属(Serratia)、芽胞杆菌属(Bacillus)和漫游球菌属(Vagococcus)。另有1株菌在NCBI中与肠杆菌的相似度最高, 为95%,可能代表着一个潜在的新种。4株链霉菌均有淀粉和纤维素降解能力。有3株菌对青枯雷尔氏菌有抑制效果。研究结果表明,美洲大蠊内生菌具有某些功能,甚至含有尚未发现的新菌种,是重要的菌种资源。
美洲大蠊;内生菌;链霉菌;酶活性;抑菌作用
美洲大蠊(Periplanetaamericana(Linnaeus))属蜚蠊目蜚蠊科大蠊属昆虫,俗称蟑螂,是一种世界性卫生害虫,为我国南方室内蜚蠊的优势种群[1]。该虫食性杂,可咬坏衣物,传播多种人、畜病原生物[2]。但它更是一种重要的药材,《神农本草经》记载其“味咸、寒,生川泽,治血瘀坚、寒热,破积聚、咽喉痹、内寒无子”,《本草纲目》记载,干燥或新鲜全体入药,有活血化瘀、解毒消疳、利水消肿等功效[3]。大量研究报道,美洲大蠊含有抗菌肽、P10蛋白、脂多糖结合蛋白、外源凝集素等多种活性物质,可抑制多种细菌、真菌、病毒、原虫,对多种癌细胞及动物实体瘤具有明显的杀伤效果,且对正常细胞温和[1,4]。除了药用价值之外,美洲大蠊还因抗病力强,易饲养,富含蛋白质、脂肪、氨基酸、微量元素等营养物质,被作为优质蛋白饲料而进行工厂化大量生产[5]。昆虫体内存在着大量的正常微生物(以下称作昆虫内生菌),这些微生物有助于昆虫维持正常生命活动[6],为昆虫合成某些必需的维生素,或者分泌多种消化酶,促进昆虫对脂肪和碳水化合物的吸收与利用。昆虫内生菌在昆虫抵御外来病菌的侵入与定殖,提高昆虫免疫系统的功能中也起着重要作用。研究昆虫内生菌不仅有利于深入了解昆虫生命活动规律,促进昆虫资源的开发利用及害虫防治,而且可以从中挖掘有特殊功能的微生物资源[9]。美洲大蠊携带着大量的细菌。Rivault 等[7]从不同区域的美洲大蠊虫体中分离出56种细菌。Lamiaa 等[8]分析了不同区域美洲大蠊体表携带的细菌组成。但这些研究主要关注美洲大蠊携带者和传播病菌的潜力,分离细菌时未对其体表进行消毒。本研究以美洲大蠊成虫为研究材料,对其体表进行严格消毒后,分离、纯化虫体内的可培养性细菌,对获得的菌株进行16S rRNA基因序列分析,再初步测定所分离菌株对纤维素、淀粉的分解效果,及对青枯雷尔氏菌的抑菌效果,由此了解美洲大蠊内生细菌种类及功能。
1 材料与方法
1.1 材料
1.1.1 虫源 美洲大蠊为福建农林大学生物防治研究所提供。
1.1.2 培养基 LB平板培养基、高氏一号平板培养基[9];检测培养基[10]:蛋白胨10 g,牛肉膏3.0 g,NaCl 5 g,可溶性淀粉20.0 g,琼脂20 g,加蒸馏水定容至1 000 mL, pH 7.2~7.4,121 ℃灭菌20 min,倒平板;路戈氏碘液:0.5 g碘和5.0 g碘化钾研磨溶于少量蒸馏水中,定容至100 mL,贮于棕色瓶中备用。
1.2 方法
1.2.1 美洲大蠊内生菌分离 选取美洲大蠊成虫10只,虫体表面用自来水冲洗干净,然后在75%酒精里浸泡30 s。在无菌操作条件下取出虫体,转至10%次氯酸钠浸泡5 min,再用无菌水漂洗10次,达到虫体表面消毒的效果。为了检验表面消毒效果,将最后一次清洗过的无菌水涂板后30 ℃培养2 d,若无菌落出现,证明该虫体表面灭菌彻底,该样品得到的结果可信。将上述经过表面消毒的虫体放在灭菌研钵中研磨,将研磨液用灭菌水稀释至10-1~10-4。取10-3和10-4的稀释液,在LB和高氏一号平板培养基上进行内生菌的涂布分离培养,每个浓度每块平板涂布100 μL,重复3次。涂布好的平板置于STK BI-250AG培养箱28 ℃培养。LB和高氏一号平板分别放置2 d和2周后取出,挑取表征各异的菌落在相应的新平板上划线、纯化、培养。将纯化的菌落再移植到相应的斜面培养基上,编号保存。
1.2.2 美洲大蠊内生菌的16S rRNA基因序列分析 从斜面培养基上分别挑取纯化的内生菌菌株,采用TRIS饱和酚提取DNA模板[11]。采用细菌16S rRNA基因序列通用引物9f (5′-GAG TTT GAT CCT GGC TCA G-3′)和1542R (5′-AGA AAG GAG GTG ATC CAG CC-3′)进行PCR扩增、测序。通用引物合成及PCR扩增产物测序均由上海博尚生工生物工程技术服务有限公司完成。获得各菌株16S rRNA基因序列后,通过NCBI BLAST(http: //www.ncbi.nlm.nih.gov)与GenBank数据库中的已知序列进行比对,下载相似度高的序列。采用BioEdit软件的Clustal W对测定和下载的多序列进行匹配排列,再通过MEGA 4.1软件[12]利用邻接法(Neighbor-joining)构建系统发育树,分析各菌株的系统发育地位,将16S rRNA基因序列相似度大于98%的归于同一个物种[13-14]。
1.2.3 美洲大蠊内生菌淀粉酶、纤维素酶及抑菌活性的检测 ①淀粉酶的检测:用灭菌的竹签挑取保存在斜面培养基的分离菌株,点于检测培养基上。将处理好的检测培养基平板放入28 ℃恒温箱静置培养。细菌培养2 d,放线菌培养5 d。取出平板,加入路戈氏碘液,涂布均匀,观察平板上的菌落旁是否出现水解圈,记录菌株号。②内生菌纤维素酶的检测:参考江意义等[15]的方法,配制刚果红纤维素琼脂培养基(K2HPO40.5 g,MgSO40.25 g,琼脂 20 g,羧甲基纤维素1.88 g,刚果红0.2 g,水1 000 mL,pH 7.5)。从斜面培养基上挑取待测菌株,点于刚果红纤维素琼脂培养基平板上,28 ℃恒温静置培养,细菌培养2 d,放线菌培养5 d。观察平板上的菌落旁是否出现透明圈,记录菌株号。③抑菌活力的测定:以本实验室分离的青枯雷尔氏菌(Ralstoniasolanacearum) FJAT-91为指示菌,测定所分离菌株对指示菌的抑菌效果。测定前用LB培养基摇瓶培养FJAT-91,并通过血球计数法调节培养液的菌体浓度至8.0×108cfu/mL。在200 mL LB半固体培养基(45 ℃)中加入20 mL FJAT-91培养液,摇匀后加入事先制好的LB平板上,制成双层培养基。待凝固后,在每个双层培养基平板上打5个孔(∅=0.5 cm),分别加入100 μL无菌水(作为阴性对照)、50 U/mL链霉素(作为阳性对照)和待测菌株培养液,28 ℃恒温培养2 d,观察抑菌圈大小。
2 结果与分析
2.1 菌体的形态和培养性状
通过LB和高氏一号培养基,从表面消毒的美洲大蠊成虫分离到11个不同的菌株,各菌株菌落特征如表1所示。
2.2 美洲大蠊内生菌的16S rRNA基因序列分析
2.2.1 美洲大蠊内生菌16S rRNA基因序列的扩增 将提取的各菌株基因组DNA经电泳检验后作为模板,利用细菌16S rRNA基因序列通用引物进行PCR扩增,结果见图1。各菌株的PCR扩增产物片断大小为1.5 kb左右,与16S rRNA基因片断大小接近,表明扩增产物是16S rRNA基因片断。测序结果表明,扩增产物为1 422~1 440 bp的序列。将各序列提交至GenBank,并利用Blastn 软件搜索与之具有最高相似度的模式标准菌株序列。结果表明,所分离的菌株共属于8个属,9个种(表2)。
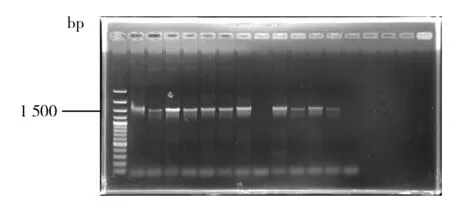
图1 部分菌株16S rRNA基因序列的PCR扩增结果Fig.1 The agarose gel electrophoresis results of PCR amplification products of the 16S rRNA gene sequence
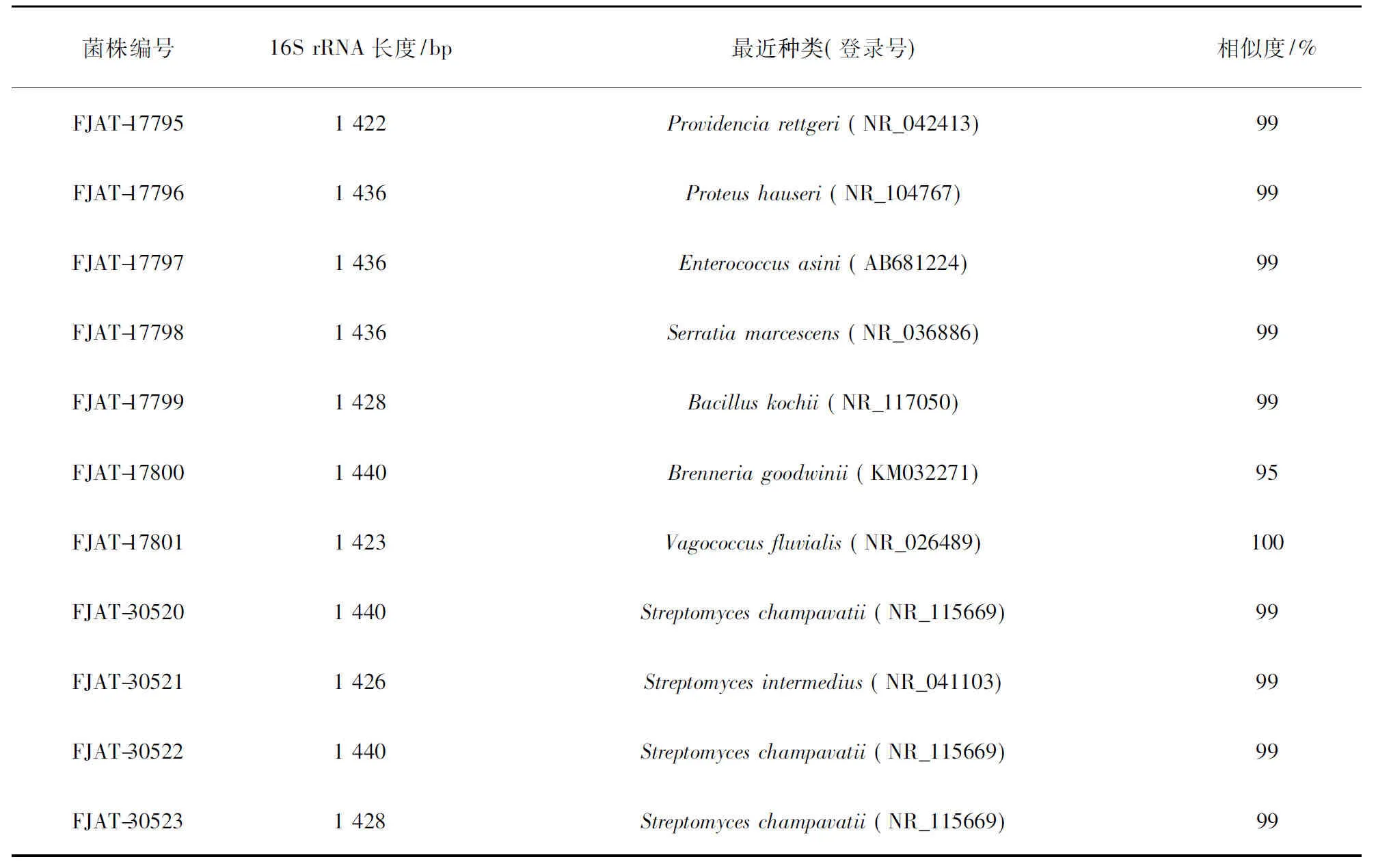
表2 美洲大蠊内生菌的16S rRNA基因序列比对结果
2.2.2 美洲大蠊内生菌系统发育 对于从美洲大蠊分离到的内生链霉菌菌株FJAT-30520、FJAT-30521、FJAT-30522、FJAT-30523,通过BLAST比对,选取同源性在98%以上的16S rRNA基因序列,构建系统发育树(图2)。结果表明,菌株FJAT-30520和FJAT-30522在同一个小分支上,两者与Streptomyceschampavatii(NR_15669)的遗传距离最近,相似度为99%;FJAT-30521则与Streptomycesintermedius(NR_041103)同在另一个小分支上,相似度为99%。对其他从美洲大蠊分离到的内生细菌进行系统发育树分析,结果表明,FJAT-17795与Providenciarettgeri(NR_042413)在同一小分支上(相似度99%);而FJAT-17796则与P.hauseri(NR_104767)遗传距离最近(相似度99%);FJAT-17798与Serratiamarcescens(NR_036886), FJAT-17799与Bacilluskochii(NR_117050), FJAT-17801与Vagococcusfluvalis,及FJAT-17797与Enterococcusasini(NR_113929)均分别处于一小分支上,同一小分支上的2株菌相似度在99%以上。FJAT-17800与GenBank的序列最高相似度95%,所选择的参考序列未能与FJAT-17800在同一小分支上。
2.3 美洲大蠊内生菌淀粉酶、纤维素酶及抑菌活性的检测
平板检测结果初步表明,能分泌淀粉酶和纤维素酶,使检测培养基产生透明圈的菌株有FJAT-30520、30521、30522、30523(表3、图3),均由高氏一号培养基从美洲大蠊分离到的内生菌。FJAT-30520淀粉酶活性显著高于FJAT-30521和FJAT-30522,其纤维素降解酶活性显著高于其余菌株(表3)。
对青枯雷尔氏菌具有抑菌圈的菌株有FJAT-17796、17797和30523,前两株是采用LB培养基分离得到的美洲大蠊内生菌(图4)。FJAT-30523和17796对青枯雷尔氏菌的抑菌活性高于FJAT-17797,前2个菌株的圈径比显著大于FJAT-17797所引起的圈径比(表3)。

菌株编号属名淀粉酶降解圈径比纤维素酶降解圈径比对青枯雷尔氏菌抑菌圈径比FJAT-30520Streptomyces2.80±0.14a1.75±0.07a-FJAT-30521Streptomyces1.45±0.02c1.19±0.05c-FJAT-30522Streptomyces2.32±0.28bc1.23±0.01bc-
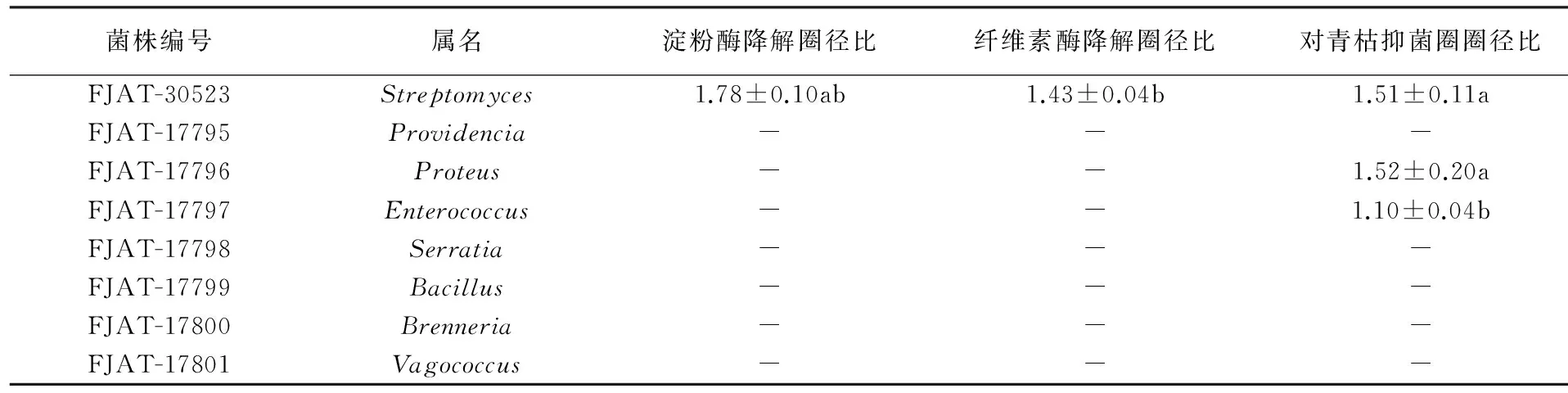
续表3
注:同一栏字母不同,表示差异显著(P<0.05);“-”表示无降解圈
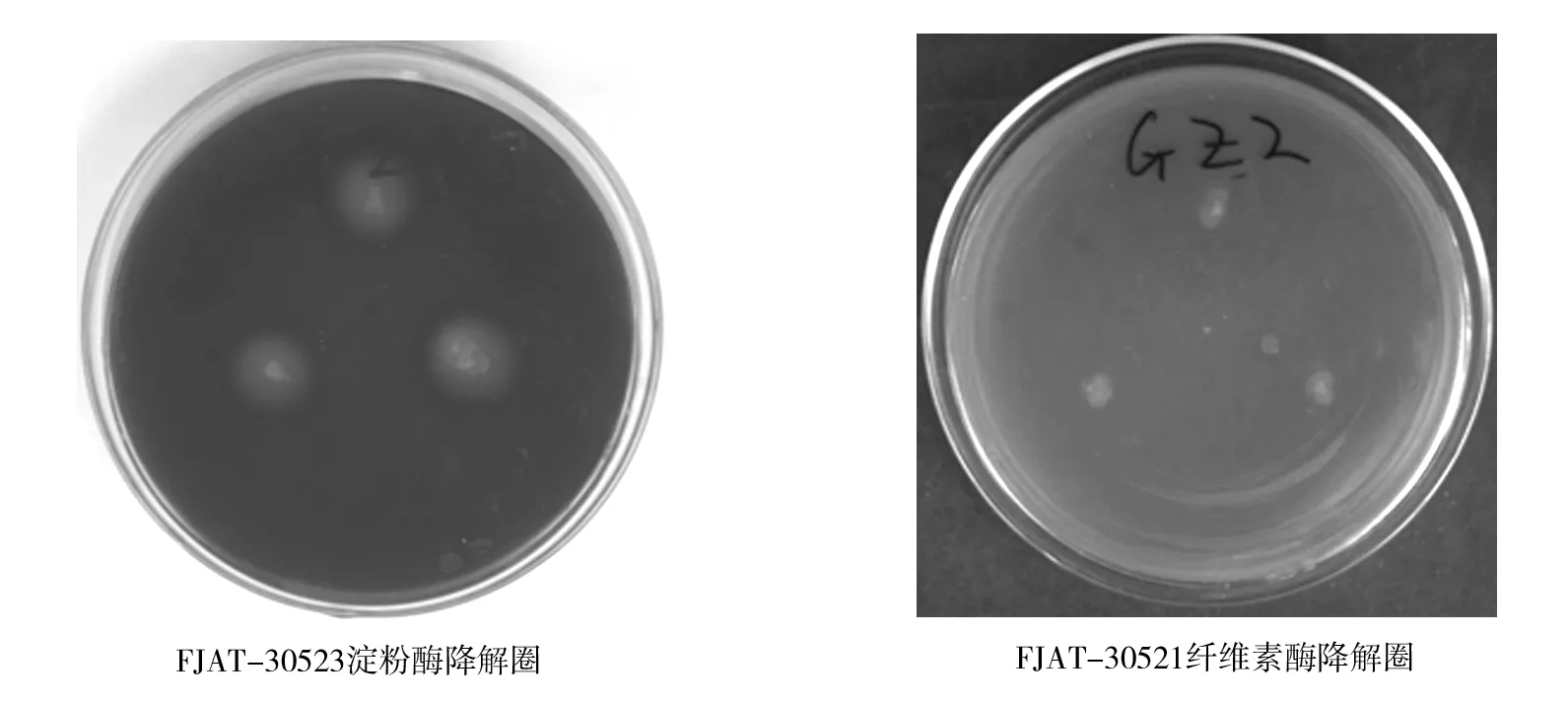
图3 淀粉酶及纤维素酶降解圈Fig.3 Transparent hydrolysis circle by amylase and cellulase

图4 美洲大蠊内生菌对青枯雷尔氏菌的抑制作用Fig.4 Antimicrobial effect of bacteria isolated from the inside of adult Periplaneta americana with Ralstonia solanacearum FJAT-91 as indicator
3 讨 论
本研究采用LB和高氏一号平板培养基,从美洲大蠊成虫分离到7株细菌菌株和4株放线菌。16S rRNA基因序列分析结果表明,高氏一号培养基分离到的4株放线菌菌株均属于链霉菌属(Streptomyces),但4株菌株间的亲缘关系不同,表明它们可能是不同的种;以LB培养基分离到的7株菌株,其中6株分别属于肠杆菌属(Enterbacter)、变形菌属(Proteus)、肠球菌属(Enterococcus)、沙雷氏菌属(Serratia)、芽胞杆菌属(Bacillus)和漫游球菌属(Vagococcus),另有1株为新种,在NCBI中与肠杆菌的相似度最高,为95%。Rivault等[7]从市区的6个不同卫生环境的场所采集美洲大蠊,整虫研磨,分离培养,得到15~30种细菌,含肠杆菌属和变形菌属,但不含芽胞杆菌、肠球菌和漫游球菌。这可能是采集地点和分离方法不同所致。本研究的虫源采自人工饲养的人工种群,环境较干静,且经过体表消毒后进行细菌分离培养。肠杆菌是昆虫体内常见的一种内生菌,低等白蚁和高等白蚁肠道中均可分离到[16]。家蚕肠道也存在着芽胞杆菌和沙雷氏菌,这一点与本文所用的美洲大蠊相似[17]。
初步测定所分离菌株的部分功能,结果表明美洲大蠊体内存在着可分解淀粉和纤维素的链霉菌,同时还存在一些细菌,可以抑制其他细菌生长。孙佑赫等[18]从思茅松毛虫肠道中分离到产蛋白酶和脂肪酶的菌株。小蠹虫肠道中则存在纤维素降解菌[19],而家蝇幼虫肠道中存在粪产碱菌[20]。由此可见,昆虫体内这一特殊环境中可获得特殊的细菌资源。
[1] 张李香,范锦胜,吴珍泉. 美洲大蠊雌成虫混配饲料的优化配方[J]. 福建农林大学学报(自然科学版),2010,39(4):351-355.
[2] 尹卫平,姜亚玲,李鹏飞,等. 昆虫美洲大蠊天然产物的研究及其化学分类学意义[J]. 河南科技大学学报(自然科学版),2012,33(5):101-104.
[3] 苏金仁,陈瑾,黄秀深,等. 美洲大蠊对小鼠移植性肝癌的药效研究[J]. 山西中医学院学报,2012,13(5):14-16.
[4] 蓝江林,吴珍泉,周先治,等. 美洲大蠊血淋巴抗菌活性诱导差异比较[J]. 中国农学通报,2008,24(2):59-62.
[5] 周琼,吴珍泉,李忠荣,等. 美洲大蠊的营养价值与饲用安全性的分析[J]. 福建农业学报,2007,22(3):276-278.
[6] 黄云,詹先进,蓝家样,等. 昆虫肠道微生物的研究进展[J]. 湖北农业科学,2009,48(11):2889-2890.
[7] Rivault C, Cloarec A, Leguyader A. Bacterial load of cockroaches in relation to urban environment[J]. Epidemiol. Infect., 1993, 110(2): 317-325.
[8] Lamiaa B, Mariam L, Ahmed A. Bacteriological analysis ofPeriplanetaamericanaL. (Dictyoptera: Blattidae) andMuscadomesticaL. (Diptera: Muscidae) in ten districts of Tangier, Morocco[J]. African Journal of Biotechnoloty, 2007, 6(17): 2038-2042.
[9] 陈天寿. 微生物培养基的制造与应用[M]. 北京:中国农业出版社,1995.
[10]李堆淑. 不同植被土壤产淀粉酶放线菌的分离与筛选[J]. 河南农业科学,2013,42(2):152-156.
[11]赵春喜,马利华,杨同文. TRIS饱和酚一步法提取食用菌DNA[J]. 安徽农业科学,2008,36(28):12122,12200.
[12]Tamura K, Dudley J, Nei M, et al. MEGA 4 molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24(8): 1596-1599.
[13]Kasai H, Tamura T, Harayama S. Intrageneric relationships among Micromonospora species deduced from gyrB-based phylogeny and DNA relatedness[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 127-130.
[14]Stach J E, Maldonado L A, Masson D G, et al. Statistical approaches for estimating actinobacterial diversity in marine sediments[J]. Applied and Environmental Microbiology, 2003, 69(10): 6189-6200.
[15]江意义,宗斯,李洋,等. 纤维素酶高产菌株的筛选及产酶条件的研究[J]. 安徽农学通报,2010,16(21):48-52.
[16]陈虹,梅建凤,闵航. 白蚁肠道微生物[J]. 微生物学杂志,2005,25(2):75-79.
[17]袁志辉,蓝希钳,杨迁,等. 家蚕肠道细菌群体调查与分析[J]. 微生物学报,2006,46(2):285-291.
[18]孙佑赫,周开艳,熊智. 思茅松毛虫肠道产脂肪酶菌株的筛选鉴定及酶学性质初步研究[J]. 微生物学杂志,2012,32(2): 64-67.
[19]康柳,熊智,杜健伟,等. 小蠹虫肠道中纤维素降解菌的分离及其产酶性质[J]. 西南林业大学学报,2012,32(2):7-10.
[20]丁友真,张书芳,高锦亚,等. 家蝇幼虫体内的粪产碱菌有抑菌能力[J]. 中国媒介生物学及控制杂志,1997,8(3):181-183.
Isolation & Enzymatic Activity, Antimicrobial Effect of Bacteria Harbored Inside Adult American Big Cockroach Periplaneta americana (Linnaeus)
RUAN Chuan-qing1, LIU Bo1, WU Zhen-quan2, SU Ming-xing1, CAI Huai-jin1, LI Tao2
(1.Agric.Bio-Res.Res.Inst.,FujianAcad.ofAgric.Sci.,Fuzhou350003; 2.Schl.ofPlantProtect.,FujianAgric. &Forest.Uni.,Fuzhou350002)
Bacteria inside adult American big cockroach (Periplanetaamericana) (Linnaeus) were isolated and tested for starch and cellulose degradase activities, as well as bacteriostasis properties. The insects were sterilized on their surfaces. The bacteria inside the insects were isolated with LB and Gause’s No. 1 media and subjected to sequences analysis of their 16S rRNA gene. The degradase and bacteriostatic activities of the isolated bacteria strains were determined by testing color-changing circle and bacteriostatic circle respectively. The results isolated 11 strains in total, 4 of them belong to genusStreptomyces, 6 belong toEnterbacter,Proteus,Enterococcus,Serratia,BacillusandVagococcusrespectively. There was another strain in NCBI having a similarity of 95% with that ofEnterbacterspp., possibly belongs to a potential new species. The 4Streptomycesstrains all had the capability of degrading starch and cellulose. Three strains exhibited bacteriostatic effect on green rot pathogen (Ralstoniasolanacearum). The results showed that the bacteria inside the bodies of American big cockroach possessed some functions, even undiscovered new species; it is an important strain resource.
American big cockroach (Periplanetaamericana) (Linnaeus); endosymbiotic bacteria;Streptomyces; enzymatic activity; bacteriostatic activity
国家自然科学基金项目(31370059);福建省自然科学基金项目(2012J01106)
阮传清 男,博士,副研究员。主要从事昆虫内共生菌研究。Tel: 0591-87882571, E-mail: ruanchuanqing@163.com
* 通讯作者。男,研究员,博士生导师。主要从事微生物生物技术与农业生物药物研究。Tel: 0591-87882571, E-mail: fzliubo@163.com
2014-10-13;
2015-01-22
Q93-331
A
1005-7021(2015)05-0036-07
10.3969/j.issn.1005-7021.2015.05.007