ATP敏感钾通道在丹参酮ⅡA对抗高糖诱导血管内皮功能损伤中的作用
ATP敏感钾通道在丹参酮ⅡA对抗高糖诱导血管内皮功能损伤中的作用
胡海燕李跃艳1李春霞2李兴3陈梦华3周寿红3
(安化县第二人民医院心内科,湖南安化413522)
摘要〔〕目的探讨ATP敏感钾通道(KATP)在丹参酮ⅡA(TSA)对抗高糖诱导血管内皮功能损伤中的作用。方法采用离体血管环灌流方法,检测高糖诱导大鼠血管内皮依赖性舒张功能损伤以及血管组织中一氧化氮(NO)、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性和KATP抑制剂格列本脲(Gly)对TSA的作用。结果高糖显著降低了大鼠血管内皮依赖性舒张反应,TSA以浓度依赖的方式抑制了高糖诱导的损伤。高糖显著降低了血管组织中NO含量和SOD活性而增加了MDA含量,TSA逆转了高糖的作用,而Gly部分取消了TSA的作用。结论TSA能对抗高糖诱导的血管内皮依赖性舒张功能损伤,其机制可能与TSA增加NO的释放,抑制氧化应激有关; Gly能部分地阻断TSA的这种保护作用。
关键词〔〕ATP敏感性钾通道;丹参酮ⅡA(TSA);高糖;内皮细胞;内皮依赖性舒张;一氧化氮;氧化应激
中图分类号〔〕R363.2+1〔
通讯作者:周寿红(1976-),男,医学博士,副教授,硕士生导师,主要从事心血管和老年生理学研究。
1南华大学附属第一医院心内科
2安化县清塘铺镇计划生育技术服务站
3南华大学医学院生理学教研室
第一作者:胡海燕(1977-),男,硕士,主治医师,主要从事心内科及老年疾病的防治研究。
血管内皮细胞功能紊乱与糖尿病血管并发症以及动脉粥样硬化等心脑血管疾病密切相关〔1~4〕。高血糖是导致血管内皮细胞功能损伤的主要原因〔5,6〕。在高糖环境下,内皮细胞氧化应激增加导致细胞因子合成及活性的改变是糖尿病血管病变发病机制之一〔7,8〕。丹参酮ⅡA(TSA)是丹参的脂溶性有效单体,具有抗缺血、缺氧、改善微循环、抑制血小板黏附聚集功能和抗血栓形成作用〔9,10〕。研究表明丹参的有效成分丹参素具有钾通道开放的作用〔11〕。本研究观察TSA对血管组织一氧化氮(NO)的产生以及氧化应激的影响。
1材料与方法
1.1材料TSA磺酸钠(上海第一生化药业有限公司)。新福林、乙酰胆碱、和阿托品ATP敏感性钾通道抑制剂格列本脲(Gly)均为Sigma公司产品。D-葡萄糖、甘露醇、NaCl、NaHCO3等其他无机试剂均为国产分析纯。NO检测试剂盒、超氧化物歧化酶(SOD)和 丙二醛(MDA)检测试剂盒购自南京建成生物工程公司。BCA蛋白定量试剂购自Pierce公司。BL420F生物信号采集处理系统(成都泰盟);雄性SD大鼠(南华大学实验动物学部提供)。
1.2离体动脉环实验设计与分组实验分为以下各组:①对照组:血管环用K-H液孵育6 h;②高糖损伤组:血管环用含D-葡萄糖(44 mmol/L)的K-H液孵育6 h诱导血管内皮功能的损伤〔4,15〕;③甘露醇组:血管环用含甘露醇(44 mmol/L)的K-H液孵育6 h;④TSA单独处理组:血管环用含TSN(10-5,10-4,10-3mol/L)的K-H液孵育6 h;⑤不同浓度TSA和D-葡萄糖共同处理组:血管环用含TSA(10-5,10-4,10-3mol/L)和D-葡萄糖(44 mmol/L)的K-H液共同孵育6 h;⑥ATP敏感性钾通道抑制剂Gly组:血管环先用Gly(10 μmol/L)预处理30 min后,再用含TSA(10-3mol/L)和D-葡萄糖(44 mmol/L)的K-H液共同孵育6 h。孵育后检测乙酰胆碱介导的内皮依赖型舒张反应。动脉舒张反应以血管舒张张力占新福林(10-6mol/L)预收缩时引起的最大收缩张力的百分比表示。并计算各剂量反应曲线的半数抑制浓度(IC50),以其负对数值(PD2)表示。
1.3离体动脉环的制备和血管张力的测定清洁级成年雄性SD大鼠脱颈椎处死,迅速剥取胸主动脉,放入预冷的K-H液中,清除周围结缔组织,取长约3 mm的血管环,固定于加有K-H液的恒温(37 ℃)浴槽中,持续通入含95%O2和5%CO2混合气体。通过BL420F生物信息采集处理系统记录胸主动脉张力的变化。1.0 g前负荷下平衡1 h,每15 min换液1次。稳定后用100 mmol/L的氯化钾(KCl)预刺激,以激发最大收缩,检查血管活性。1 μmol/L的新福林预收缩后,用10 μmol/L的乙酰胆碱舒张胸主动脉以检查血管内皮的完整性。各组大鼠胸主动脉环分别进行乙酰胆碱介导的舒张反应测定。动脉舒张反应以血管舒张最小张力占新福林(10-6mol/L)预收缩时引起的最大收缩张力的百分比表示。
1.4血管组织中NO含量的测定取长约4 cm的血管环,按上述实验分组,每组6个血管环(分别来自6只不同的SD大鼠),孵育结束后取出血管环,滤纸上吸干水分,秤重,用电动玻璃匀浆器制成10%组织匀浆,匀浆离心(3 000 r/min,10 min)后,取上清液,保存于-20℃冰箱。取不同组血管匀浆的上清液100 μl,按试剂盒说明分别检测NO2-/NO3-的量,以此代表NO的含量。按BCA蛋白定量试剂盒说明进行蛋白定量。
1.5血管组织中SOD活性和MDA含量测定取不同组血管组织匀浆的上清液100 μl,按试剂盒说明检测SOD活性和MDA含量。按BCA蛋白定量试剂盒说明进行蛋白定量。
1.6统计学处理采用SPSS14.0软件进行方差分析及t检验。
2结果
2.1TSA抑制高糖诱导的胸主动脉内皮依赖性舒张功能损伤与对照组相比,高糖(44 mmol/L)处理显著降低了乙酰胆碱介导的内皮依赖性舒张反应,表现为浓度-舒张效应曲线右上移位,PD2值显著降低(PD2值对照组和高糖组分别为6.86±0.45和5.53±0.34,P<0.05);甘露醇组乙酰胆碱介导的内皮依赖性舒张反应和PD2值与对照组间差异无显著性(PD2值为6.85±0.53,P>0.05)。单独TSA(10-5,10-4和10-3mol/L)处理浓度依赖性地增加了乙酰胆碱介导的内皮依赖性舒张反应,表现为浓度-舒张效应曲线右下移位,PD2值显著性增加(PD2值分别为7.24±0.71,7.73±0.83和7.98±0.91,均P<0.05);TSA(10-5,10-4,10-3mol/L)浓度依赖性地抑制了高糖诱导的内皮依赖性舒张功能损伤,表现为浓度-舒张效应曲线右下移位,PD2值显著性增加(PD2值分别为6.05±0.45,6.52±0.64和7.17±0.81,均P<0.05)。
2.2KATP抑制剂拮抗抑制高糖诱导的胸主动脉内皮依赖性舒张功能损伤与对照组相比,KATP抑制剂Gly均没有影响胸主动脉环乙酰胆碱介导的内皮依赖性舒张反应(PD2值Gly组为6.80±0.57,P>0.05)。与高糖组相比,Gly组没有影响胸主动脉环乙酰胆碱介导的内皮依赖性舒张反应(PD2值高糖+Gly组为5.59±0.43,P>0.05)。而高糖+TSA+Gly组与高糖+ TSA组相比,内皮依赖性舒张反应明显降低,表现为浓度-舒张效应曲线右上移位,PD2值显著性降低(PD2值分别为5.87±0.48和7.17±0.81,P<0.05),这表明Gly部分取消了抑制高糖诱导的内皮依赖性舒张功能损伤的作用。见表1。
2.3ATP敏感钾通道抑制剂拮抗抑制高糖诱导的NO水平降低与对照组相比,高糖处理显著降低了血管组织中NO的含量(P<0.05),TSA处理则显著增加了血管组织中NO的含量(P<0.05),ATP敏感钾通道抑制剂Gly单独处理没有影响血管组织中NO含量(P>0.05);与高糖组相比,高糖+ TSA组血管组织中NO含量显著增加(P<0.05);而高糖+ TSA+Gly组与高糖+TSA组相比,血管组织中NO含量显著降低(P<0.05),这表明ATP敏感钾通道抑制剂Gly部分取消了TSA抑制高糖诱导的NO含量降低的作用。
2.4ATP敏感钾通道抑制剂拮抗TSA抑制高糖诱导的氧化应激见表1。与对照组相比,高糖处理显著增加了血管组织中MDA的含量,而降低了血管组织中SOD的活性(均P<0.05),导致了氧化应激的产生;TSA处理则显著降低血管组织中MDA含量,增加了血管组织中SOD活性(均P<0.05)。ATP敏感钾通道抑制剂Gly单独处理没有影响血管组织中MDA含
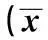

组别NO(mmol/g)MDA(μmol/g)SOD(kU/g)对照组3.87±0.467.85±0.84182.34±21.461)高糖组1.27±0.151)12.69±1.361)87.66±9.131)TSA组(10-3mol/L)7.68±0.861)5.36±0.711)248.12±34.231)Gly组(10μmol/L)4.03±0.547.91±0.96179.22±19.42高糖+TSA组3.55±0.462)7.74±0.642)174.26±15.322)高糖+TSA+Gly组1.32±0.173)12.38±1.423)92.46±8.753)
与对照组比较:1)P<0.05,与高糖组比较:2)P<0.05,与高糖+TSA组比较:3)P<0.05
量和SOD活性(均P>0.05);与高糖组相比,高糖+ TSA组血管组织中MDA的含量显著降低而增加了血管组织中SOD的活性水平显著增加(均P<0.05);而高糖+ TSA +Gly组与高糖+ TSA组相比,血管组织中MDA的含量显著增加而SOD的活性水平显著降低(均P<0.05),这表明ATP敏感钾通道抑制剂Gly部分取消了TSA抑制高糖诱导的氧化应激的作用。
3讨论
临床研究显示糖尿病病人易出现血管内皮损伤,而高糖是导致内皮功能损伤的重要原因〔12〕。本实验发现高糖能显著降低乙酰胆碱介导的血管内皮依赖性舒张反应,而相同浓度的甘露醇没有损伤血管内皮依赖性舒张反应,这说明高糖环境损伤了内皮的功能与渗透压的改变无关。TSA以浓度依赖的方式抑制了高糖所诱导的血管内皮依赖性舒张反应损伤,同时TSA也直接导致了血管内皮依赖性舒张。
内皮细胞中的NO是以L-精氨酸为底物在一氧化氮合酶的作用下产生的。NO 是一种重要的血管舒张因子,能激活血管平滑肌内的鸟苷酸环化酶,使cGMP 浓度升高,降低细胞内游离Ca2+浓度,导致血管舒张。研究显示TSA能刺激内皮细胞分泌NO,舒张血管〔11〕。本结果表明TSA抑制高糖诱导的血管内皮依赖性舒张反应损伤,可能是通过增加NO的产生而实现的。
氧化应激是机体在遭受有害刺激后,产生了过量的活性氧簇,超出了系统对其消除能力,过剩的活性氧对细胞的DNA、蛋白质、脂质等造成巨大的损伤〔13〕。血管组织中的氧化应激可以损伤内皮功能,从而导致内皮依赖性舒张功能损伤。活性氧可以攻击生物膜中的多不饱和脂肪酸,并因此形成脂质过氧化物,其代谢产物MDA是一种有害的过氧化产物,它的含量反映氧自由基的水平及脂质过氧化的程度〔14〕。SOD是体内重要的氧自由基消除剂,消除活性氧对体内脂质、蛋白质、糖等代谢的影响及其对细胞的损伤,使机体免受损害〔15〕。研究显示TSA能抑制糖尿病患者体内的氧化应激〔16〕。糖尿病患者体内的高糖环境是导致机体产生氧化应激的重要原因〔17〕。本实验结果说明TSA抑制高糖诱导的血管内皮依赖性舒张功能损伤可能与TSA抑制了高糖诱导的氧化应激有关。
研究发现丹参素异丙酯有明显的扩血管作用,其通过抑制受体介导的外钙内流和内钙释放而舒张血管,血管平滑肌细胞膜上的钾通道参与了丹参素异丙酯的扩血管作用〔11〕。KATP通道开放能保护心肌细胞对抗氧化应激,防止心肌细胞的凋亡〔18〕。本结果表明KATP开放可能是TSA对抗高糖损伤内皮舒张功能的机制之一。总之,TSA能对抗高糖诱导的血管内皮依赖性舒张功能损伤,这种保护作用可能与TSA增加NO的释放,抑制氧化应激有关;KATP抑制剂格列本脲能部分地阻断TSA的这种保护作用,提示KATP开放可能是TSA对抗高糖损伤内皮舒张功能的机制之一。
4参考文献
1Tziomalos K,Athyros VG,Karagiannis A,etal.Endothelial dysfunction in metabolic syndrome:prevalence,pathogenesis and management 〔J〕.Nutr Metab Cardiovasc Dis,2010;20(2):140-6.
2Xu J,Zou MH.Molecular insights and therapeutic targets for diabetic endothelial dysfunction 〔J〕.Circulation,2009;120(13):1266-86.
3董宇,崔治华,宋鄂,等.糖尿病性视网膜病变血管内皮生长因子与糖基化终末产物的关系〔J〕.中国老年学杂志,2011;31(14):2693-5.
4王瑞英,禹远远,王绵,等.血管内皮功能与2型糖尿病患者大血管病变的关系〔J〕.中国老年学杂志,2010;30(12):1731.
5Wang SX,Xiong XM,Song T,etal.Protective effects of cariporide on endothelial dysfunction induced by high glucose 〔J〕.Acta Pharmacologica Sinica,2005;26(3):329-33.
6Singh H,Brindle NP,Zammit VA.High glucose and elevated fatty acids suppress signaling by the endothelium protective ligand angiopoietin-1 〔J〕.Microvasc Res,2010;79(2):121-7.
7Madsen-Bouterse SA,Zhong Q,Mohammad G,etal.Oxidative damage of mitochondrial DNA in diabetes and its protection by manganese superoxide dismutase 〔J〕.Free Radic Res,2010;44(3):313-21.
8Matsumoto T,Noguchi E,Ishida K,etal.Metformin normalizes endothelial function by suppressing vasoconstrictor prostanoids in mesenteric arteries from OLETF rats,a model of type 2 diabetes 〔J〕.Am J Physiol Heart Circ Physiol,2008;295(3):1165-76.
9Xu S,Little PJ,Lan T,etal.Tanshinone Ⅱ-A attenuates and stabilizes atherosclerotic plaques in apolipoprotein-E knockout mice fed a high cholesterol diet 〔J〕.Arch Biochem Biophys,2011;515(1-2):72-9.
10李艳平,保春华.丹参酮ⅡA通过阻断MAPK抑制糖尿病大鼠血管平滑肌细胞增殖〔J〕.基础医学与临床,2007;27(12):1370-3.
11Wang SP,Zang WJ,Kong SS,etal.Vasorelaxant effect of isopropyl 3-(3,4-dihydroxyphenyl)-2-hydroxypropanoate,a novel metabolite from Salvia miltiorrhiza,on isolated rat mesenteric artery 〔J〕.Eur J Pharmacol,2008;579(1-3):283-8.
12黄敬泽,王健.2型糖尿病肾病氧化应激与血管内皮损伤的关系〔J〕.中国老年学杂志,2009;29(18):2377-8.
13Usuki S,Tsai YY,Morikawa K,etal.IGF-1 induction by scylated steryl β-glucosides found in a pre-germinated brown rice diet reduces oxidative stress in streptozotocin-induced diabetes 〔J〕.PLoS One,2011;6(12):e28693.
14Thangjam GS,Kondaiah P. Regulation of oxidative-stress responsive genes by arecoline in human keratinocytes 〔J〕.J Periodontal Res,2009;44(5):673-82.
15Park L,Min D,Kim H,etal.The combination of metallothionein and superoxide dismutase protects pancreatic β cells from oxidative damage〔J〕.Diabetes Metab Res Rev,2011;27(8):802-8.
16罗旭敏,蔡伟,徐积兄,等.丹参酮ⅡA对2型糖尿病患者氧化应激的作用〔J〕.江西医学院学报,2009;49(4):90-5.
17Descorbeth M,Anand-Srivastava MB.Role of oxidative stress in high-glucose- and diabetes-induced increased expression of Gq/11α proteins and associated signaling in vascular smooth muscle cells〔J〕.Free Radic Biol Med,2010;49(9):1395-405.
18Akao M,Ohler A,O'Rourke B,etal.Mitochondrial ATP-sensitive potassium channels inhibit apoptosis induced by oxidative stress in cardiac cells 〔J〕.Circ Res,2001;88(12):1267-75.
〔2012-11-03修回〕
(编辑赵慧玲/曹梦园)

