沉默G250基因对肾癌786-0细胞移植瘤Skp2表达的影响
沉默G250基因对肾癌786-0细胞移植瘤Skp2表达的影响
赵俊峰肖耀军1姜耀东2赵善超2杨旭凯3郑少斌2
(河南省中医院河南中医学院第二附属医院泌尿外科,河南郑州450002)
摘要〔〕目的探讨沉默G250基因对肾癌786-0细胞移植瘤S期激酶相关蛋白2(Skp2)表达的影响。方法构建靶向G250的siRNA表达质粒pshRNA-G250并转染肾癌786-0细胞,12只BALB/c裸鼠分为阴性对照组和干扰成瘤组,干扰成瘤组每只裸鼠皮下接种5×106个G250基因沉默后的肾癌786-0细胞(786-0/si-G250-b),以转染空质粒的细胞(786-0/si-G250-0)为对照。成瘤3 w后,处死裸鼠后切取瘤块,采用组织芯片技术及免疫组化SP法检测Skp2的表达。结果5×106个细胞皮下接种BALB/c裸鼠3 w后均成瘤,Skp2在阴性对照组和干扰成瘤组裸鼠的肿瘤组织中表达率分别为83.33%(5/6)和16.67%(1/6),两者有显著性差异(P=0.04)。结论G250基因表达沉默抑制了肾癌细胞移植瘤Skp2的表达。
关键词〔〕G250基因;S期激酶相关蛋白2;肿瘤相关抗原;RNA干扰;肾细胞癌;体内
中图分类号〔〕R737.11〔
基金项目:郑州市科技攻关项目(No.109TGS486-9)
通讯作者:杨旭凯(1970-),男,副主任医师,主要从事肾癌的基础及临床研究。
1广东省武警医院泌尿外科
2南方医科大学附属南方医院泌尿外科
3兰州军区总医院泌尿外科
第一作者:赵俊峰(1966-),男,主任医师,主要从事肾脏肿瘤的RNA干扰以及临床方面的研究。
肾癌是老年人常见的恶性肿瘤,其发生发展的分子生物学机制至今不清,多数研究显示G250(又称MN/CAⅨ)基因可诱导细胞恶性表型〔1〕,并参与了肾脏肿瘤细胞的生长与转移。也有研究显示S期激酶相关蛋白2(Skp2)对肾脏肿瘤的形成有一定影响〔2〕。本研究在成功构建肾癌相关抗原G250 siRNA表达载体〔3〕和完成G250基因沉默后裸鼠成瘤体内实验〔4〕的基础上,利用RNA干扰(RNAi)技术阻断G250基因表达,观察了G250基因沉默对肾癌786-0细胞体内成瘤及生长的影响。
1材料和方法
1.1材料与试剂人肾透明细胞癌786-0细胞株(以下称肾癌786-0细胞)及大肠杆菌(DH5α)由南方医科大学南方医院泌尿外科保存。4~6 w的12只BALB/c裸鼠为SPF级,体重15~20 g,雌雄各半,购自南方医科大学实验动物中心,在南方医院SPF实验动物中心饲养。OPTI-MEMⅠ培养基及RPMI 1640培养基、胎牛血清(GIBCO公司),lipofectamineTM2000(Invitrogen 公司),G418及DEPC(Sigma公司),空质粒pRNAT-U6.1/Neo (GenScript公司),限制性内切酶BamHⅠ、Hind Ⅲ、KpnⅠ、T4 DNA连接酶、T4磷酸化酶、质粒提取试剂盒、磷酸盐缓冲液(PBS)(Promega公司)、鼠抗人Skp2 mAb、SP试剂盒及二氨基联苯胺(DAB)显色剂(中杉金桥生物技术有限公司)。
1.2方法
1.2.1siRNA靶序列的设计和质粒的构建G250 mRNA的全长序列从NCBI基因库(Genebank登录号:AJ010588)检索得出。应用Primer express软件按照siRNA的设计原则寻找含21个碱基的特异性序列。在前期实验的基础上,选择最有效的G250的siRNA片段,靶位点293~313,根据pRNAT-U6.1/Neo质粒的结构,设计出特异性干扰片段的核苷酸序列:5′-GGATCCCATTTAGGCTTAACTTCAGGTATTGATATCCGTACCTGAAGTT AAGCCTAAATTTTTTTCCAAAAGCTT-3′,5′-AAGCTTTTGGAAA AAAATTTAGGCTTAACTTCAGGTACGGATATCAATACCTGAAGT TAAGCCTAAATGGGATCC-3′。序列送由南京金思特公司合成。将退火后shRNA寡核酸双链和pRNAT-U6.1/Neo酶切产物按3∶1混合,T4DNA连接酶27℃连接过夜,转化感受态DH5α。然后提取待测的重组质粒。酶切鉴定正确后取1 ml转化菌液,送金思特公司测序。
1.2.2siRNA转染及建立稳定干扰G250基因抗性单克隆肾癌786-0细胞培养时,培养基为含10%胎牛血清的RPMI1640。转染前24 h,传代至24孔板,每孔1.5×105个细胞。用LipofectamineTM2000进行转染。转染后6 h换成完全培养基,继续培养72 h,加入选择性培养基进行筛选,根据G418对肾癌786-0细胞在14 d内的杀灭效果,选择600 μg/ml作为筛选浓度。筛选培养2 w后可见抗性克隆长出,挑取单克隆转入24孔板逐渐扩大培养,4 w左右可获得稳定干扰抗性单克隆。
1.2.3实验分组和建立肿瘤动物模型将皮下注射转染空质粒的肾癌细胞的(786-0/si-G250-0)裸鼠作为对照组,转染RNA干扰片断细胞(786-0/si-G250-b)的为实验组,每组6只。对数生长期的786-0/si-G250-0和786-0/si-G250-b细胞经胰酶消化,离心收集,计数后分别重悬于无血清RPMI 1640培养基中,配制成每0.1 ml含5×106个肿瘤细胞的悬液,用1 ml注射器将0.1 ml细胞悬液皮下注射于BALB/c裸鼠背部皮下,每一个部位注射5×106个细胞的悬液。
1.2.4肿瘤生长情况监测自肿瘤细胞注射第10日起,每天观察裸鼠成瘤情况,待肿瘤出现后每3 d用毫米游标卡尺测量肿瘤的长、宽、高最大垂直直径(mm),分别以a、b、c表示,依据肿瘤体积计算公式:V(mm3)=a×b×c/2〔5〕。在成瘤后的第3周处死裸鼠,切取肿瘤组织备用。
1.2.5组织芯片的制作
1.2.5.1制作组织蜡块切取肿瘤组织,约1.0 cm×1.0 cm×0.5 cm。用10%中性甲醛固定,常规脱水石蜡包埋。对所有标本组织蜡块常规切片、苏木素-伊红HE染色并作形态学观察,选择有代表性的肿瘤区域,在相应位置进行标记。
1.2.5.2制作包含120个点的组织芯片使用组织微阵列仪(MTA-1)制作受体空白蜡块。大小2.0 cm×2.0 cm×1.0 cm,设计12×10点组织阵列。每个微阵列蜡块包含120个标本。根据各标本HE染色切片标记的部位。用直径为0.6 mm的供体针在蜡块相应部位取样。每例标本选定2个不同取样位点,将供体组织芯放入受体蜡块,组织芯间距0.4 mm。在组织样本填入蜡孔时记录每个样本在二维阵列中的具体位置。并在一定位置上标记出组织微阵列的方位。置入烤箱低温烘烤约1 h,封蜡,冷却,制成两个组织微阵列蜡块。再以4 μm厚切片,裱于载玻片,制成组织芯片备用。
1.2.6免疫组化检测SP免疫组化染色方法严格按SP试剂盒说明书操作。DAB溶液显色。用已知乳腺癌标本作阳性对照,用TBS代替一抗作阴性对照。
1.2.7结果判定参考Langner等〔6〕的经验制定判定标准:Skp2在胞核或胞核胞质中均表达为阳性,仅在胞质中表达为阴性。随机取5个高倍视野,计算每个高倍视野中阳性细胞数占肿瘤细胞总数的百分比,最后计算5个高倍视野的平均百分比。Skp2阳性细胞数<10%为阴性(-),>10%为阳性(+)。结果判定由两人共同完成,取二者平均值。
1.3统计学方法应用SPSS18.0统计学软件进行χ2检验及方差分析。
2结果
2.1G250基因表达沉默对肾癌786-0细胞体内成瘤的影响将786-0/si-G250-0和786-0/si-G250-b细胞接种6只裸鼠均成瘤,成瘤率分别为100%。实验组的成瘤时间(15±2.4)d较对照组延长〔(11±1.5)d〕(t=3.381,P=0.007),说明G250基因表达水平降低后肾癌786-0细胞在动物体内的成瘤能力受到抑制。
2.2两组肾细胞癌组织中Skp2的表达成瘤3 w后,处死裸鼠,切取肿块用组织芯片技术及免疫组化SP法检测Skp2的表达,Skp2主要在细胞核中表达,在细胞质中也有部分表达。阳性染色呈现粗大棕黄色颗粒,见图1。Skp2在对照和实验组裸鼠的肿瘤组织中表达率分别为83.33%(5/6)和16.67%(1/6)差异显著(P=0.04)。
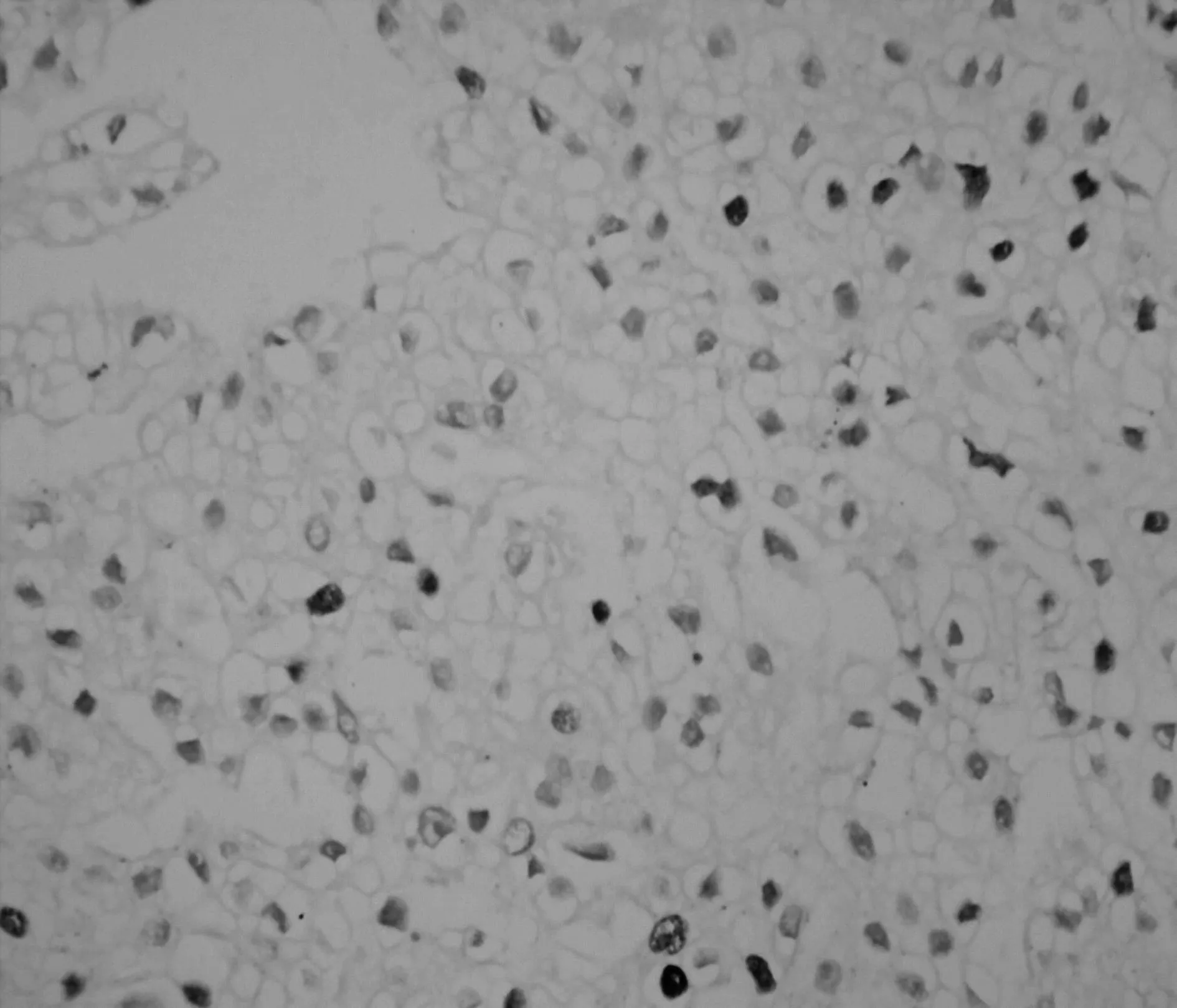
实验组
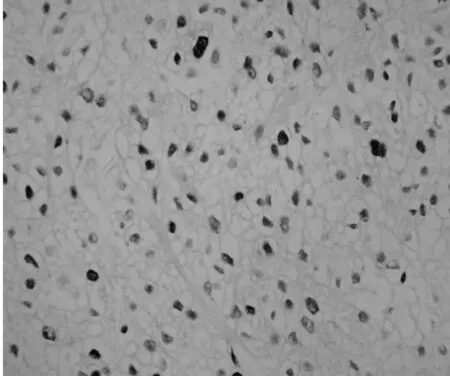
对照组
图1两组裸鼠肿瘤组织中Skp2表达(DAB,×400)3讨论
肾肿瘤是泌尿系最常见的恶性肿瘤,死亡率高〔7〕。2013年美国统计新发肾肿瘤占所有新发实体肿瘤的3%〔8〕。肾癌的发生发展与多种癌基因及抑癌基因的异常激活、表达有关。G250基因表达在肾透明细胞癌发病中的作用尚不明确,研究显示G250基因可能是一种癌基因,而且对肿瘤转移有促进作用〔9〕。为进一步了解该基因在肾癌发生、发展中的作用,在成功设计构建、筛选及鉴定G250基因有效siRNA干扰序列基础上,通过人工诱导RNA干扰(RNAi)技术实现了对G250基因持续稳定的抑制,观察到G250基因表达沉默后,肾癌786-0细胞成瘤时间较对照组明显延长,同一时期肿瘤体积较对照组明显减小,说明G250基因沉默能有效抑制肾癌786-0细胞裸鼠皮下移植瘤的生长,不仅进一步证实G250基因在促进细胞增殖、转化方面有重要的作用〔10〕,也提示该基因的作用可能比目前了解的要多,需要进一步探讨。
恶性肿瘤的发生也与细胞周期调控机制出现紊乱从而导致细胞的失控性生长有关。而细胞周期主要由正负调控因子调控。其中细胞周期负性调控因子能够抑制多种G1期cyclin-CDK激酶活性,使细胞不能通过G1期,从而防止细胞过度增殖形成肿瘤,其缺失与肿瘤的发生及发展有关。Skp2是一种泛素-蛋白酶体途径的底物识别序列。能特异作用于磷酸化的细胞周期负性调控因子,可使其通过泛素-蛋白酶体途径降解〔2〕。本研究提示在肾细胞癌的发生发展过程中,Skp2的高表达可能提示细胞周期负性调控因子的降解减少,这时细胞异常增殖不能得到有效抑制〔11〕,从而促进了肾细胞癌的发生和发展。因此,Skp2蛋白表达水平对判断肾细胞癌的发展和预后也可能具有重要意义。
由于观察到G250基因表达沉默后,体内肿瘤细胞成瘤能力明显下降,造成肿瘤生长速度减慢,说明本文设计的小分子干扰RNA在体内稳定的发挥了作用,导致G250基因沉默,同时Skp2也出现表达降低,不仅证实了siRNA技术的持久、高度特异和高效的抑制靶基因表达的优势〔12〕,也提示G250和Skp2在肾肿瘤的发生发展中可能有更多的作用。
4参考文献
1Li G,Feng G,Gentil-Perret A,etal.CA9 gene expression in conventional renal cell carcinoma:a potential marker for prediction of early metastasis after nephrectomy〔J〕.Clin Exp Metastasis,2007;24(3):149-55.
2Langner C,von Wasielewski R,Ratschek M,etal.Biological significance of p27 and Skp2 expresion in renal cell carcinoma〔J〕.Virchows Arch,2004;445(6):631-6.
3赵俊峰,郑少斌,姜耀东,等.G250基因siRNA表达载体的构建与鉴定〔J〕.山东医药,2008;48(6):23-5.
4赵俊峰,郑少斌,姜耀东,等.沉默G250基因对肾癌786-0细胞体内成瘤及生长的影响〔J〕.中国老年学杂志,2012;32(19):3775-7.
5Agrawal N,Dasaradhi PV,Mohmmed A,etal.RNA interference: biology,mechanism,and applications〔J〕.Microbiol Mol Biol Rev,2003;67(4):657-85.
6Langner C,von Wasielewski K,Ratschek M,etal.Expression of p27 and its ubiquitin ligase subunit Skp2 in upper urinary tract transitional cell carcinoma〔J〕.Urology,2004;64(3):611-6.
7Mulders P,Figlin R,deKernion JB,etal.Renal cell carcinoma: recent progress and future directions〔J〕.Cancer Res,1997;57(22):5189-95.
8Siegel R,Ma J,Zou Z,etal.Cancer statistics,2014〔J〕.CA Cancer J Clin,2014;64(1):9-29.
9Ivanov S,Liao SY,Ivanova A,etal.Expression of hypoxia-inducible cell-surface transmem-brane carbonic anhydrases in human cancer〔J〕.Am J Pathol.2001;158(3):905-19.
10Zavada J,Zavadova Z,Pastorek J,etal.Human tumor-associated cell adhension protein MN/CA IX:identification of M75 eptope and of the region mediating cell adhension〔J〕.Br J Cancer,2000;82(11):1808-13.
11Sui L,Dong Y,Watanabe Y,etal.Clinical significance of skp2 expression,alone and combined with Jab l and p27 in epithelial ovarian tumors〔J〕.Oncol Rep,2006;15(4):765-71.
12Wullner U,Neef I,Tur MK,etal.Targeted delivery of short interfering RNAs-strategies for in vivo delivery〔J〕.Recent Pat Anticancer Drug Discov,2009;4(1):1-8.
〔2013-11-15修回〕
(编辑袁左鸣)

