黄芩素对SCC15口腔癌细胞增殖和Caspase-3活性的影响
黄芩素对SCC15口腔癌细胞增殖和Caspase-3活性的影响
翟越赵海丰1
(燕山大学校医院,河北秦皇岛066004)
摘要〔〕目的探讨黄芩素(BAI)对人口腔癌细胞株 SCC15增殖和半胱氨酸蛋白酶(Caspase)-3活性的影响。方法以噻唑蓝比色法(MTT)检测BAI在不同浓度(终浓度的50、100、200 μg/ml)不同作用时间(0、12、24、36、48、60、72 h)条件下对SCC15口腔癌细胞增殖活性的影响。比色法检测Caspase-3活性的变化,通过流式细胞仪检测细胞周期的变化。结果BAI在体外对SCC15细胞株具有直接抑制增殖作用,并呈时间和剂量依赖性,对SCC15细胞的IC50是153.20 μg/ml。不同浓度BAI处理细胞后,SCC15细胞被阻止于G0/G1期,抑制SCC15细胞分裂而降低其增殖能力。结论BAI可对人SCC15口腔癌细胞株的凋亡具有促进作用,并且促凋亡作用呈时间-剂量依赖性。BAI体外具有增加HeLa细胞Caspase-3活性的作用,能明显上调SCC15细胞中Caspase-3活性,且呈时间与浓度依赖性。
关键词〔〕黄芩素;SCC15细胞;增殖;Caspase-3活性;细胞周期
中图分类号〔〕R737.33〔
基金项目:黑龙江省教育厅科学技术研究项目(12531664)
1佳木斯大学附属第一医院
第一作者:翟越(1965-),女,主治医师,主要从事口腔医疗及相关药物研究。
黄芩素(BAI)具有多种药理作用〔1〕。癌症的发生、发展是多因素、多基因、多途径相互作用的结果,其中细胞的增殖和凋亡的动态平衡失调是引起肿瘤发生发展的重要因素〔2〕。目前对于细胞凋亡与肿瘤的关系十分受关注。有关BAI的一些制剂已在临床应用于上呼吸道感染、急性扁桃体炎、咽炎、慢性阻塞性肺病、传染性肝炎、细菌性痢疾等多种疾病的治疗,并且疗效显著。半胱氨酸蛋白酶(Caspase)可催化多种细胞内特异蛋白的激活〔3〕。裂解相应的胞质胞核底物,最终导致细胞凋亡〔4〕。它在凋亡信号传导的许多途径中发挥着重要功能〔5〕。Caspase-3可经细胞色素C、Caspase-9途径激活,也可通过另外的途径激活。最终导致细胞凋亡,但在细胞凋亡的晚期和死亡细胞,Caspase-3活性明显下降〔5〕。
1材料与方法
1.1材料及仪器SCC15口腔鳞状癌细胞株(中科院上海细胞库),胎牛血清,DMEM培养基,BAI单体(纯度≥9 8%,南京泽朗医药科技有限公司),噻唑蓝(MTT,南京建成生物工程研究所),二辛可酸(BCA)蛋白测定试剂盒(Sigma),Caspase-3分光光度法检测试剂盒(南京凯基生物科技发展有限公司),Galaxy CO2培养箱MiniGalaxy A型(英国RS Biotech公司),MK3酶标仪(中国上海雷勃公司)。
1.2实验分组DMEM培养基中添加10%胎牛血清培养SCC15细胞,将SCC15细胞按5×104/孔的密度接种于96孔细胞培养板,空白对照组培养正常细胞不添加处理因素,BAI组分别给予终浓度为50、100、200 μg/ml的BAI进行处理。
1.3MTT方法检测细胞增殖作用将状态良好,生长至对数生长期的细胞弃去培养液,加0.25%胰酶消化数分钟,收集细胞于2 ml离心管中,700 r/min,离心5 min,弃上清,加入新鲜培养液,用台盼蓝进行细胞计数,根据计数的细胞数目,将SCC15细胞以5×104/孔接种于96孔培养板中,培养12 h,使细胞完全贴壁,加入不同浓度的黄芩素 (终浓度为),每个浓度设4个平行复孔,阴性对照组加入等体积DMEM完全培养液,设空白调零孔,于37℃,5%CO2培养箱中继续培养12、24、36、48、72 h,弃去上清,用DMEM洗3次,洗去药物,每孔加入MTT 20 μl,继续培养4 h后,加入150 μl二甲基亚砜(DMSO)溶解,10 min后于酶标仪492 nm处测OD值,计算药物的体外生长抑制率,用细胞生长抑制率对药物作用时间绘制回归曲线,求出半数抑制浓度(IC50)。细胞生长抑制率(%)=(对照组平均OD值-用药组平均OD值)/对照组平均OD值×100%。
1.4MTT检测Caspase-3活性的变化取对数生长期细胞(5×105/ml),对照组不添加药物,试验组加入不同浓度BAI(终浓度为50、100、200 μg/ml),继续培养12、24、48和72 h后,收集细胞,2 000 r/min离心5 min,以磷酸盐缓冲液(PBS)洗2次,弃上清;在收集的沉淀细胞中加入50 μl冰上预冷的Lysis Buffer;置冰上裂解20 min,蜗旋振荡至澄清,4℃,10 000 r/min,离心1 min;把离心上清液转移至新的管中,并放置冰上;测定蛋白浓度;吸取50 μl含50~200 μg蛋白的细胞裂解上清,如体积不足50 μl用Lysis Buffer补足至总体积50 μl;加入50 μl的2×Reaction Buffer;加入5 μl Caspase-3 Substrate,37℃避光孵育4 h;用酶标仪,在405 nm处测定其吸光值。
1.5流式细胞仪检测细胞周期的变化取对照组、BAI(终浓度200 μg/ml)处理48 h后的SCC15细胞单细胞悬液(1×106/ml)1 ml,SCC15细胞上清倒入标记试管中,培养瓶中加入0.25%胰酶消化,消化的SCC15细胞加入对应的试管中,1 500 r/min离心5 min,弃上清。0.01 mol/L pH 7.2,PBS洗2次,1 500 r/min离心5 min。将70%乙醇缓慢滴入试管中,边滴边摇动试管,使SCC15细胞分散、固定,置4℃备用。将上述固定的SCC15细胞离心去上清,用0.01 mol/L pH7.2 PBS洗2次,1 500 r/min离心5 min。取200 μl单细胞样品(1×106/ml),加200 μl RNase溶液(10 μg/ml),37℃水浴摇床30 min。将细胞过滤,去除聚积成团细胞,加入膜联蛋白荧光素(Annexin V-FITC)液5 μl和碘化丙啶(PI)液10 μl,混匀,室温避光染色15 min。PBS洗2次,去除多余染料,流式细胞仪检测(激发波长488 nm)。
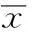
2结果
2.1BAI对SCC15口腔癌细胞株生长抑制作用BAI在体外对SCC15细胞株具有直接的抑制增殖作用,并且呈时间和剂量依赖性。利用回归曲线,BAI对SCC15细胞的IC50是153.20 μg/ml。见表1,图1。
2.2BAI对Caspase-3活性的影响50 μg/ml剂量的AAD作用12 h,Caspase-3活性并不明显上升,作用24 h后,Caspase-3活性才开始增加;作用72 h,Caspase-3活性明显增加;100和200 μg/ml AAD作用12 h,Caspase-3即开始增加,24 h时,与对照组比较显著增加(P<0.01),至72 h Caspase-3显著增加;而125 μg/ml的BAI作用24 h,Caspase-3活性即增加明显,随着浓度和作用时间的增加,Caspase-3显著增加,呈时间与浓度依赖性。见表2。
2.3BAI对细胞周期的影响BAI(终浓度200 μg/ml)诱导SCC15细胞48 h后,处于G0/G1期的SCC15细胞数由对照组的59.26%增加到67.36%和64.26%,而处于S期的细胞数,由对照组的25.88%减少到20.57%和21.67%,说明SCC15细胞被阻止于G0/G1期,而处于S期和G2/M期的细胞百分数都减少,而未经BAI作用的SCC15细胞增殖正常,提示BAI通过抑制SCC15细胞分裂而降低其增殖能力。
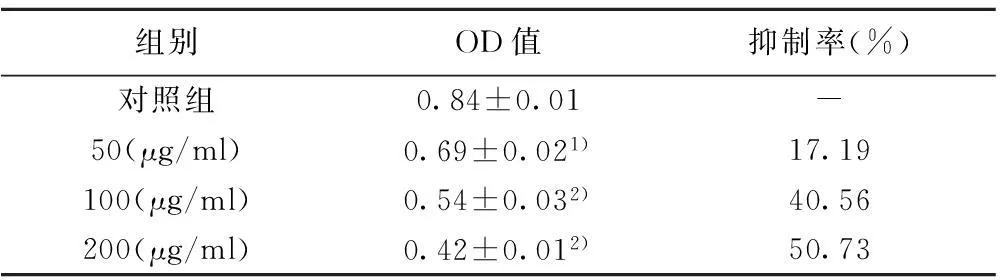
组别OD值抑制率(%)对照组0.84±0.01-50(μg/ml)0.69±0.021)17.19100(μg/ml)0.54±0.032)40.56200(μg/ml)0.42±0.012)50.73
与对照组比较:1)P<0.05,2)P<0.01

图1 黄芩素对SCC15细胞生长抑制作用
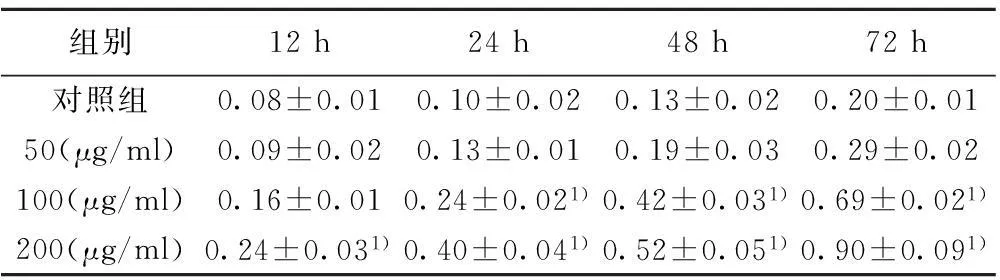
组别12h24h48h72h对照组0.08±0.010.10±0.020.13±0.020.20±0.0150(μg/ml)0.09±0.020.13±0.010.19±0.030.29±0.02100(μg/ml)0.16±0.010.24±0.021)0.42±0.031)0.69±0.021)200(μg/ml)0.24±0.031)0.40±0.041)0.52±0.051)0.90±0.091)
与对照组比较:1)P<0.01
3讨论
口腔癌是颌面部常见的黏膜上皮肿瘤,多发于40~60岁人群,以舌、颊、牙龈以及腭等为好发病部位,以鳞状细胞癌为主要病理类型,约80%〔6〕。早期的口腔癌主要为局部淋巴结转移,到达晚期时会逐渐发生远处转移〔7〕。该病恶性度较高,目前仍无有效治疗手段,治疗仍以早发现、早诊断、早治疗等措施为主。本研究也发现,BAI对SCC15口腔鳞状细胞癌的活力的抑制作用十分显著,且BAI浓度越高,对SCC15细胞的抑制作用越明显,并呈剂量依赖性。本试验通过对SCC15细胞Caspase-3活性的分析表明,BAI体外具有增加SCC15细胞Caspase-3活性的作用。BAI能明显上调SCC15细胞Caspase-3活性,并且这种作用呈时间与浓度依赖性,本文为BAI在口腔鳞状细胞癌治疗中作用的研究提供新的思路。
4参考文献
1Miura K,Fuiibchi W,Ishida K,etal.Inhibitor of apoptosis protein family as diagnostic markers and therapeutic targets of colorectal cancer〔J〕.Surg Today,2011;41(2):175-82.
2Oh BY,Lee RA,Kim KH.SiRNA targeting livin decreases tumor in a xenograft model for colon cancer〔J〕.World J Gastroenterol,2011;17(20):2563-71.
3Shen SC,Chen YC,Hsu FL,etal.Differential apoptosis-inducing effect of quercetin and its glycosides in human promyeloleukemic HL-60 cells by alternative activation of the caspase-3 cascade〔J〕.Cell Biochem,2003;89(5):1044-55.
4Way TD,Kao MC,Lina JK.Degradation of HER2/neu by apigenin induces apoptosis through cytochrome c release and caspase-3 activation in HER2/neu-overexpressing breast cancer cells〔J〕.FEBS Lett,2005;579(1):145-52.
5Woo DH,Han IS,Jung G.Mefenamic acid-induced apoptosis in human liver cancer cell lines through Caspase-3 pathway〔J〕.Life Sci,2004;75(20):2439-49.
6任宏宴,李善昌,唐大永.Livin、Bcl-2 在舌癌中的表达及临床意义〔J〕.口腔颌面部外科杂志,2010;20(5):334-7.
7Khan Z,Bisen PS.Oncoapoptotic signaling and deregulated target genes in cancer:special reference to oral cancer〔J〕.Biochim Biophys Acta,2013;1836(1):123-45.
〔2013-11-07修回〕
(编辑袁左鸣)

