以阿拉伯胶为原料生成一种含塔格糖的糖浆工艺优化
白亚琼 闫景通 郑建仙(华南理工大学轻工与食品学院,广东 广州 510640)
阿拉伯胶是最古老的、使用范围最广的一种树胶,它价格低廉,原料来源广泛。阿拉伯胶经过水解后,水解液中主要含有 L-阿拉伯糖(L-arabinose)、L-鼠李糖(L-rhamnose)、D-半乳糖以及D-葡萄糖醛酸等单糖[1],其中半乳糖单体可高达42%。塔格糖是一种罕见的己酮糖,天然微量地存在于一些奶制品和水果中[2]。目前商品用塔格糖主要是以乳糖或半乳糖为原料通过一系列生物或化学方法进行合成的。D-塔格糖(D-tagatose)是 D-半乳糖的同分异构体,在 C-4位置上是D-果糖的对映异构体[3]。L-阿拉伯糖和D-塔格糖都具有一些功能特性,如L-阿拉伯糖能降低人体对蔗糖的吸收,具有降血糖和减肥的功效[4],且L-阿拉伯糖还是重要的医药合成中间体[5];D-塔格糖是一种低能量甜味剂[6],能够调节肠道菌群、抑制齿蚀斑[7],是一种新型的能够抗糖尿病和控制肥胖的原料[3]。虽然L-鼠李糖不属于功能性糖,但在合成强心药物和合成香料Furaneol等领域应用越来越广泛[8]。由于生产方法受限,这几种单糖在市场上价格都比同类产品昂贵,尤其是塔格糖,价格高达850元/kg左右,导致其应用范围大大受限。目前化学法合成塔格糖的直接原料主要为半乳糖[9,10],关于半乳糖的来源研究较多的是乳糖[11],未见有研究利用阿拉伯胶作为原料来源的相关报道。鉴于阿拉伯胶的低廉价格和优良性质,本研究拟采用阿拉伯胶作为原料,将其水解后生成含有半乳糖的水解液。利用水解液中的半乳糖转化合成具有功能特性的塔格糖,以期获得一种含有高含量塔格糖的功能性糖浆,为阿拉伯胶的应用拓宽范围,为塔格糖的合成提供一种新的原料来源。
1 材料与方法
1.1 材料
阿拉伯胶粉:食品级,品种为Acacia Seyal,其中L-阿拉伯糖含量31%、半乳糖含量42%、鼠李糖含量13%,鑫宇食品添加剂有限公司;
浓硫酸、八水氢氧化钡:分析纯,广州化学试剂厂;
塔格糖标品:分析纯,美国Sigma公司;
L-半胱氨酸盐酸盐:层析纯,上海博奥生物科技有限公司;
咔唑:化学纯,中国上海试剂一厂;
无水乙醇、NaOH、活性炭、铝酸钠等:分析纯,广州市东红化工厂。
1.2 仪器
快速恒温水浴锅:HH-42型,常州国华电器有限公司;
高速冷冻离心机:Beckman Avanti J-E型,美国Beckman Coulter公司;
台式酸度计:pH211HANNA型,葡萄牙HANNA公司;
磁力搅拌器:JB-3型,上海雷磁仪器厂;
可见分光光度计:Spectrumlab22pc型,上海棱光技术有限公司;
高效液相色谱仪:LC-20A型,日本岛津公司。
1.3 试验方法
1.3.1 阿拉伯胶的水解 根据文献[12],修改如下:将阿拉伯胶粉末缓慢加入到80℃的稀硫酸溶液中进行水解反应,反应结束后,加入Ba(OH)2溶液进行中和。Ba(OH)2与稀硫酸溶液等摩尔,溶解在其两倍质量的80℃左右的蒸馏水中。中和结束后,冷却至30℃左右,离心(5 000r/min,15 min)去除沉淀,调节pH至8以上,4℃冰箱中储存以备异构化反应。本试验用水解液中半乳糖质量的多少来反应阿拉伯胶的水解程度,采用HPLC法[13]测定半乳糖浓度。
1.3.2 塔格糖的合成 根据文献[9]和[10],修改如下:取100mL的水解液,放置于水浴锅中加热,加入一定质量的铝酸钠(铝酸钠提前用10mL蒸馏水溶解),一定温度下水浴一段时间,反应结束后,立即冰浴冷却,加入一定体积的30%的硫酸溶液,待溶液中不再出现沉淀时,过滤除去沉淀,全程温度需低于10℃。上清液用活性炭进行脱色。
1.3.3 塔格糖含量的测定以及转化率的计算 采用半胱氨酸—咔唑法测塔格糖含量[14]。绘制塔格糖标准曲线见图1,以塔格糖作为标准品,得出其标准曲线为y=0.021x-0.001(R2=0.999)。测定反应液中塔格糖含量时,需将原液稀释1 500倍。塔格糖转化率按式(1)计算:


图1 D-塔格糖标准曲线Figure 1 The standard curve of D-tagatose
1.3.4 单因素试验 每次取100mL水解液,分别以不同的铝酸钠加入量、反应时间和反应温度进行处理,以D-塔格糖的转化率作为评价指标。试验设3个平行,结果取平均值。3个单因素的试验设计如下:
(1)铝酸钠的影响:固定反应温度50℃,反应时间3h,加入铝酸钠进行异构化反应。铝酸钠的添加量分别取2,4,6,8,10g。
(2)反应温度的影响:固定铝酸钠加入量4g,反应时间3h,在一定温度下反应。温度分别取30,40,50,60,70℃。
(3)反应时间的影响:固定铝酸钠加入量4g,反应温度50℃,反应一定时间。反应时间分别取2,3,4,5,6h。
1.3.5 塔格糖合成的响应曲面优化 在单因素试验的基础上,通过对试验结果的分析确定铝酸钠加入量、反应温度和反应时间作为即将优化的3个因素,每个因素设定3个水平。响应值确定为D-塔格糖的转化率,用响应曲面法对塔格糖的合成条件进行优化。
2 结果与分析
2.1 阿拉伯胶的水解
由表1可知,当硫酸浓度较低时,阿拉伯胶的水解程度不高,水解液中半乳糖的含量比较少,100mL水解液中仅含2~5g左右的半乳糖。随着硫酸浓度的增大,阿拉伯胶的水解程度也随之变大,水解液中的半乳糖含量逐步增多。但是当硫酸为2.0%时,水解液比较粘稠,流动性差,而反应溶液粘稠及半乳糖浓度稀薄均不利于转化反应中转化率的提高,故综合考虑选用1.5%的稀硫酸水解阿拉伯胶,得到的水解液中每100mL含有8.90g的半乳糖。

表1 水解液中半乳糖的质量Table 1 The weight of galactose in the hydrolysate
2.2 单因素试验
2.2.1 铝酸钠加入量对塔格糖转化率的影响 由表2可知,随着铝酸钠加入量的增大,塔格糖的转化率呈现出先增大后降低的趋势。当铝酸钠的加入量为2g时,塔格糖的转化率最低,只有21.03%。当铝酸钠的加入量为4g时,塔格糖的转化率达到最高点,有63.64%的半乳糖转化为塔格糖。当铝酸钠的加入量大于4g时,塔格糖的转化率变化不大。所以选用4,5,6g作为中心组合试验的3个水平。
2.2.2 反应时间对塔格糖转化率的影响 由表3可知,当反应时间为2h,塔格糖的转化率最低。反应时间太短,异构化反应未充分进行,转化半乳糖的量也很少。当反应时间达到3~4h时,异构化反应充分,塔格糖的转化率达到63%左右。随着反应时间的继续延长,塔格糖的转化率开始下降,反应液颜色也逐渐加深,发生很多副反应,生成很多非还原糖的其他物质。所以选用3.0,3.5,4.0h作为中心组合试验的3个水平。

表2 铝酸钠加入量对塔格糖转化率的影响Table 2 The influence of the addition of sodium aluminate on the conversion rate of tagatose
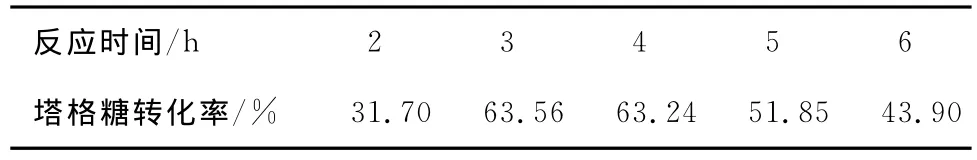
表3 反应时间对塔格糖合成的影响Table 3 The effect of time on the synthesis of tagatose
2.2.3 反应温度对塔格糖转化率的影响 任何化学反应都需要一定的反应温度,异构化反应也不例外。由表4可知,随着反应温度的升高,塔格糖的转化率呈现出先增大后降低的趋势。当反应温度为50℃时,塔格糖的转化率达到最大,有62.76%的半乳糖转化为塔格糖。反应温度低于50℃时,塔格糖的转化率逐渐上升。但当反应温度高于50℃时,塔格糖的转化率急剧下降,反应液的颜色加深,变为褐色,焦糖化反应加剧,副反应增大,非还原糖等的副产物增多。所以选用40,45,50℃作为中心组合试验的3个水平。

表4 反应温度对塔格糖转化率的影响Table 4 The influence of reaction temperature on the conversion rate of tagatose
2.3 响应面优化试验设计及结果分析
选取铝酸钠加入量、反应时间、反应温度作为响应面优化设计的3个因素,以塔格糖转化率作为响应值,在单因素试验的基础上,利用 Design-Expert V8.0.6软件中的Box-Behnken Design(BBD)对塔格糖的合成试验进行试验设计,并对试验结果进行分析。塔格糖合成试验的因素和水平设计见表5。

表5 塔格糖合成的因素与水平表Table 5 Elements and levels of the synthetic of tagatose
以铝酸钠加入量、反应时间、反应温度为自变量,以塔格糖转化率为响应值,响应面优化的试验方案与试验结果见表6。
用响应面分析法对表6中的数据进行方差分析和建立回归模型。方差分析结果见表7。
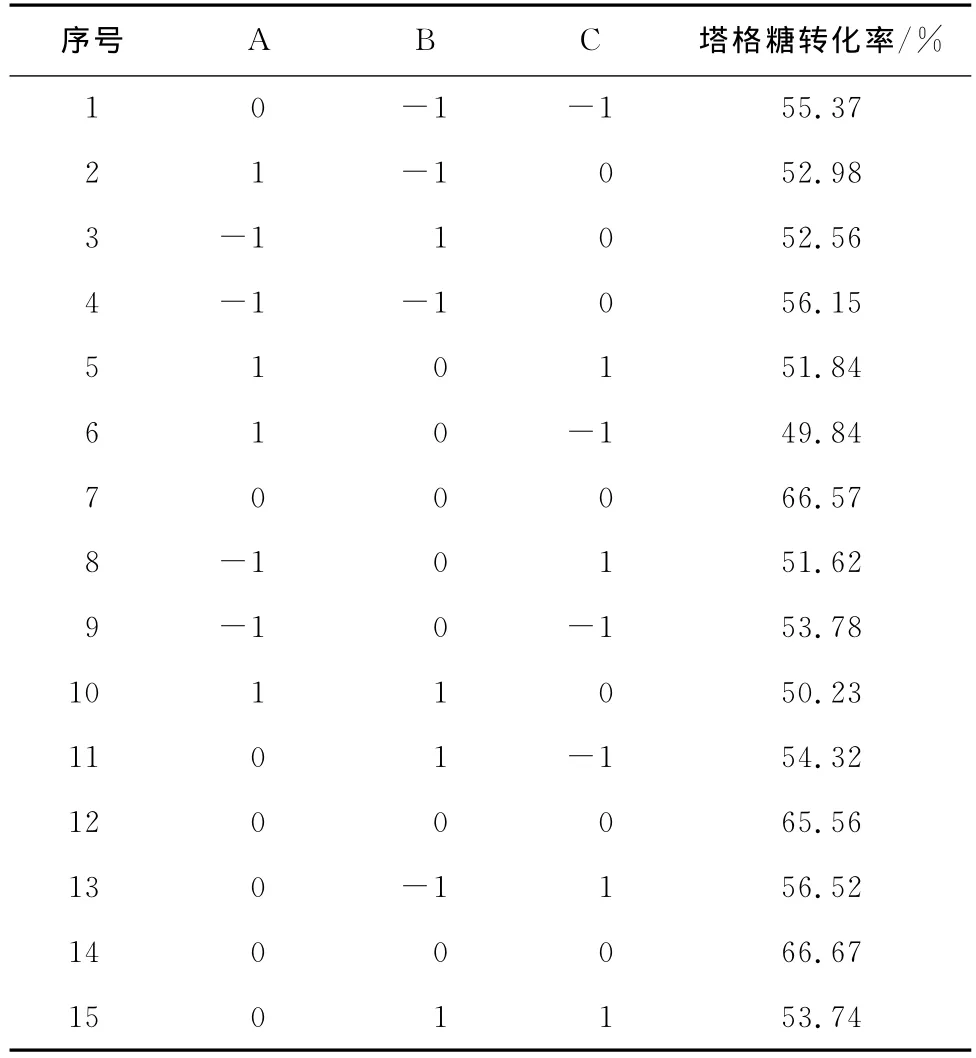
表6 塔格糖合成的试验设计及结果Table 6 Experimental design and result of the synthetic of tagatose
表7 试验结果的方差分析Table 7 Variance Analysis of results
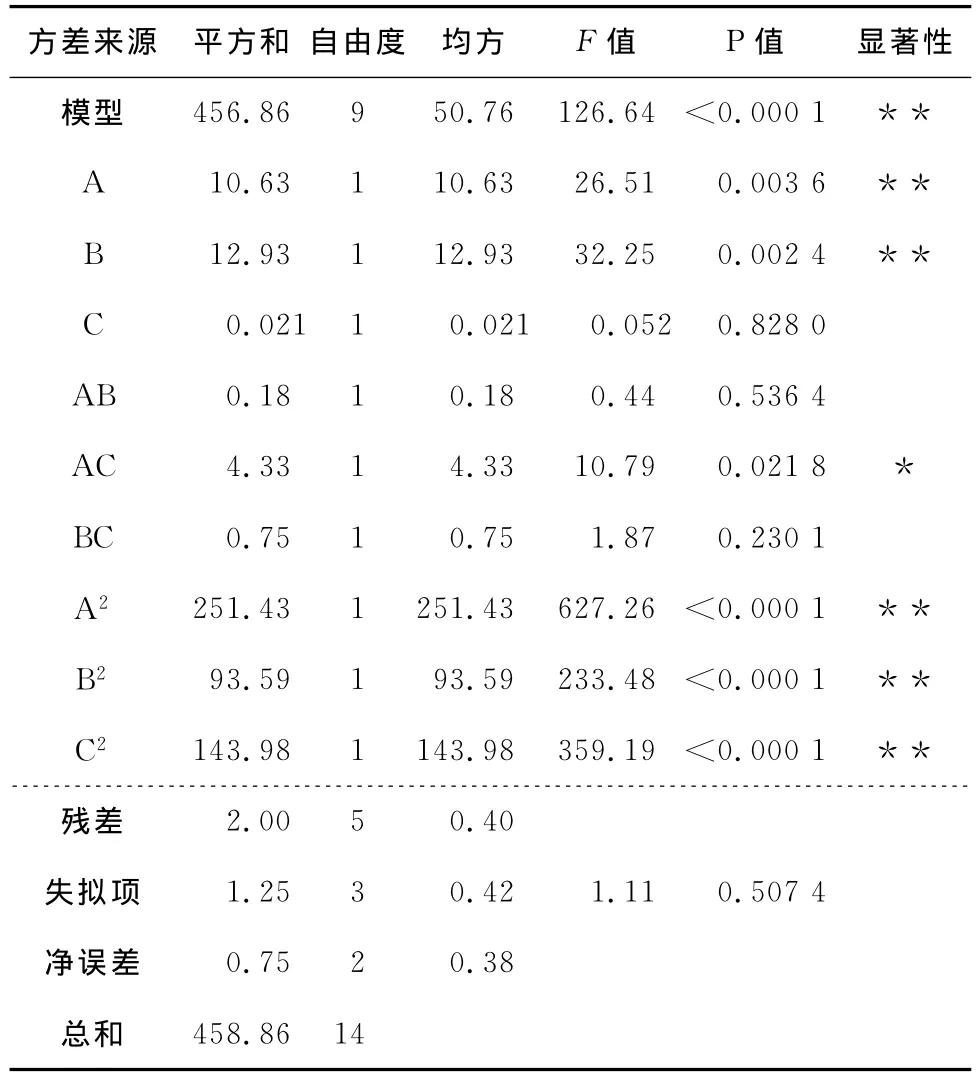
表7 试验结果的方差分析Table 7 Variance Analysis of results
*表示5%为水平显著,**表示1%为水平极显著。
方差来源 平方和 自由度 均方 F值 P 值 显著性模型 456.86 9 50.76 126.64 <0.000 1**A 10.63 1 10.63 26.51 0.003 6 **B 12.93 1 12.93 32.25 0.002 4 **C 0.021 1 0.021 0.052 0.828 0 AB 0.18 1 0.18 0.44 0.536 4 AC 4.33 1 4.33 10.79 0.021 8 *BC 0.75 1 0.75 1.87 0.230 1 A2 251.43 1 251.43 627.26 <0.000 1 **B2 93.59 1 93.59 233.48 <0.000 1 **C2 143.98 1 143.98 359.19 <0.000 1 **残差 2.00 5 0.40失拟项 1.25 3 0.42 1.11 0.507 4净误差 0.75 2 0.38总和458.86 14
由表7可知,塔格糖转化率模型的P值在0.01以下,说明该模型极显著;失拟项P值为0.507 4,大于0.05,可知失拟检验不成立,说明该模拟模型是比较理想的;从决定系数(R2=0.995 6)可知该模型与实际情况拟合程度比较好,试验的误差小;从模型的Radj(0.987 8)、(0.952 7)、信噪比(Adeq Precisior)(32.383,大于4)3个系数可以看出该模型具有较好的预测能力,信号强度很强,满足预测需求,且98.78%的试验结果都可以用这个模型进行解释,故该回归模型可以对塔格糖的转化率进行分析、对塔格糖合成的最佳条件进行确定。转化率模型中二次项A2、B2、C2以及一次项A、B和交互项AC对得率有显著影响(P<0.05),其余一次项C和交互项AB、BC对塔格糖转化率的影响均不显著(P>0.05)。对所得数据进行多元回归拟合,得到各因素与塔格糖转化率(Y)之间的二元多项回归方程为:
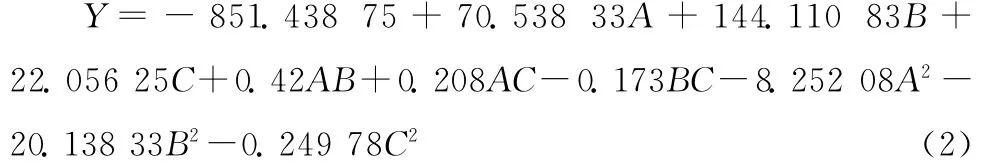
从表7还可以看出,3种因素对塔格糖转化率的影响程度大小依次为:B>A>C,即反应时间>铝酸钠加入量>反应温度。
2.4 塔格糖合成的验证实验
对转化率回归方程进行一阶偏导处理,使偏导后的式子等于零可计算得到:A=4.93、B=3.45、C=45.01,与其相对应的合成塔格糖的最佳反应条件为:铝酸钠加入量为4.93g、反应时间为3.45h、反应温度为45.01℃,理论最佳转化率为66.39%。
但考虑到实际的可操作性,将试验条件修改为铝酸钠加入量为4.93g,反应时间为3.5h,反应温度为45℃。在修改后的试验条件下进行塔格糖的合成,得到塔格糖的实际平均转化率为66.18%,与理论值(66.39%)相比较,得到的绝对误差不超0.05。由上可知,选用响应曲面法对铝酸钠催化合成塔格糖的反应条件进行优化是可靠的,优化获得的最佳工艺参数也能够运用到实际的生产操作过程中,具有一定的参考价值。
3 结论
塔格糖的合成经过响应曲面法优化和修正参数后确定出铝酸钠催化合成塔格糖的最优反应条件为:当铝酸钠加入量4.93g,反应时间3.5h,反应温度45℃,此时塔格糖的转化率可达到66.18%。得到的混合糖浆经过除杂净化后用HPLC法测定其单糖组成,每100mL糖浆中含有5.89g D-塔格糖、5.14g L-阿拉伯糖和1.75g鼠李糖,塔格糖、阿拉伯糖和鼠李糖是糖浆中的主要单糖。用阿拉伯胶作为原料,来源广泛、价格便宜,塔格糖的转化率也比较高,制得的糖浆中包括L-阿拉伯糖、D-塔格糖等功能性单糖在内的总还原糖含量也高达50%以上。本试验优化出的塔格糖合成工艺反应步骤简单、流程短,反应条件相对比较温和、对仪器的要求低,且由于阿拉伯胶原料的低廉价格,整个生产过程的成本也不高,非常适合于大规模工业化生产,为塔格糖的应用拓宽范围,为功能性糖浆的开发提供一定的理论基础。
1 郭铁柱.阿拉伯胶的性质和研究进展[J].河南科技,2014(6):62.
2 Skytte U.Sweeteners and sugar alternatives in food technology[M].Oxford,UK:Blackwell Publishing,2006:262~294.
3 梁敏,翟娅菲,邹洋,等.新型甜味剂塔格糖的应用及生产[J].食品与药品,2011,13(3):125~128.
4 Liu Xing-rong,Zhu Dao-chen,Sun Lu,et al.Effect of L-arabinose on the postprandial blood glutose and body weight[J].Journal of hygiene research,2013,42(2):295~297.
5 Cheng Hai-rong,Wang Heng-wei,Lv Ji-yang,et al.A novel method to prepare L-Arabinose from xylose mother liquor by yeast-mediated biopurification[J].Microbial Cell Factories,2011(10):1~11.
6 Tomomi Fujimaru,Jin-Hee Park,Lim Ju-yun.Sensory characteristics and relative sweetness of tagatose and other sweeteners[J].Journal of Food Science,2012,77(9):323~328.
7 郑建仙.功能性低聚糖[M].北京:化学工业出版社,2004:373~378.
8 浦跃武,刘卫斌,陈志明.鼠李糖的研究现状及其应用[J].食品工业科技,2002,23(2):84~85.
9 黄东东,寇秀颖,王学文,等.铝酸钠催化制备塔格糖的研究[J].化学世界,2008(3):187~189.
10 寇秀颖,于国萍,徐勇.铝酸钾法合成D-塔格糖的研究[J].食品科技,2010,35(4):93~94.
11 王晓哲,钱方,曹迪,等.乳糖酶水解生产低乳糖牛乳工艺的优化[J].食品与机械,2013,29(2):183~185.
12 冯亚青,刘燕,张晓东,等.从L-阿拉伯胶提取L-阿拉伯糖[J].精细加工,2003,20(5):288~290.
13 刘倩,康如龙,苏小建.高效液相色谱-蒸发光散射检测法测定果汁中单糖的含量[J].北方园艺,2012(21):36~38.
14 翁玮慧.L-阿拉伯糖异构酶的酶学性质及酶法制备塔格糖研究[D].无锡:江南大学,2006.

