亚热带樟树人工林土壤呼吸对凋落物处理的响应
刘益君 ,闫文德 ,3,伍 倩 ,张 超 ,张 力 ,粱小翠
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3.城市森林生态湖南省重点实验室,湖南 长沙 410004)
亚热带樟树人工林土壤呼吸对凋落物处理的响应
刘益君1,2,闫文德1,2,3,伍 倩1,2,张 超1,2,张 力1,2,粱小翠1,2,3
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.南方林业生态应用技术国家工程实验室,湖南 长沙 410004;3.城市森林生态湖南省重点实验室,湖南 长沙 410004)
2011年9月到2012年8月,选取湖南省长沙市湖南省森林植物园樟树Cinnamomum camphora人工林作为试验样地,设置添加凋落物(DL)、去除凋落物(RL)和对照(CK)3种处理,对不同处理下土壤呼吸速率进行12月的连续观测。研究结果表明:樟树人工林不同处理下土壤呼吸呈显著的季节动态,均呈单峰曲线。添加凋落物处理下(DL),土壤呼吸的年均值为2.816,去除凋落物处理下,土壤呼吸的年均值为1.943,与对照的2.534相比分别高14.33%和低23.01%。樟树人工林凋落物处理下土壤呼吸速率与5 cm土壤温度呈极显著线性相关(P<0.01),与5 cm土壤湿度相关性不显著(P>0.05)。樟树人工林添加和去除凋落物处理下土壤呼吸Q10值分别为2.04、2.02,均高于对照的1.87。由此可见凋落物对森林CO2通量有重要影响。
樟树人工林;土壤呼吸;凋落物;土壤温湿度;Q10值
土壤是一个巨大的碳库,全球大约66.67%的C以有机态的形式储存其中,因此土壤是陆地生态系统最大的碳库。每年全球由土壤所释放的CO2的量高达68 Pg·a-1,而每年全球因化石燃料的燃烧而释放出的CO2量仅为5.2 Pg·a-1,CO2的土壤释放量为化石燃料燃烧释放量的10倍以上[1]。因此,土壤碳库的微小变化或对气候变化产生影响,其原因主要是由于大气中二氧化碳的增加程度会受到土壤碳库的影响,而产生显著地变化。
土壤呼吸(Soil respiration)指的是土壤将其新陈代谢功能的过程中的产生大量CO2气体释放到大气中的过程,是全球土壤碳库循环的主要通量过程。土壤呼吸通常包括一个非生物过程和3个生物过程,其中一个非生物过程通常指含碳矿物质的化学氧化作用,3个生物过程通常指根系的呼吸、微生物的呼吸以及地下动物的呼吸[2]。作为大气中CO2浓度上升的关键生态学过程,以及土壤质量与土壤肥力的重要生物学指标[3],土壤呼吸还表明了土壤物质的代谢强度[4]。
樟树Cinnamomum camphora作为亚热带常见的树种,同时也是该气候带中极具代表性的森林群落之一,研究凋落物处理对樟树林土壤呼吸的影响,对探索人工林土壤养分的时空分布特征,亚热带陆地生态系统中森林群落的维护以及樟树人工林的持续经营都有一定的意义。
1 试验地概况
选取位于湖南省长沙市湖南省森林植物园内(113°02′~ 113°03′E,28°06′~ 28°07′N) 的 23年生樟树人工林作为试验样地。属于典型的亚热带湿润季风气候,年均温度18.7 ℃,1月份为最冷月,极端低温-11.3 ℃,平均气温4.7 ℃,7月份为最热月,极端高温40.6 ℃,平均气温29.4 ℃;样地森林覆盖率为90%,海拔50~100 m,面积140 hm2,坡度为12~21 °;全年无霜期为270~300 d,年均日照时数1 677.1 h;年均降雨量为1 400.6 mm,雨量充沛。样地属典型红壤丘陵区,地层岩性分布为第四纪更新世的冲积性网纹红土,土壤呈酸性,其pH值范围通常介于4.0~5.5间。研究对象为20多年生的樟树人工林(见表1),林下主要植被中,灌木层主要有:油茶Camellia oleifera、喜树Camptotheca acuminate、 大 青Clerodendron cyrtophyllum、 盐肤木Rhus chinensis及少量山苍子Litsea cubeba、杜荆Vitex agnus-castus;草本层发现主要由芒萁Dicranopteris ampla、鸡矢藤Paederia scandens、鳞毛蕨Dryopteris chinensis、苔草Carex tristachya等草本或草质藤本植物构成,另有少量狗脊蕨Woodwardia prolifera、 铁 线 蕨Adiantum capillusveneris、井栏边草Pteris multif i da等。
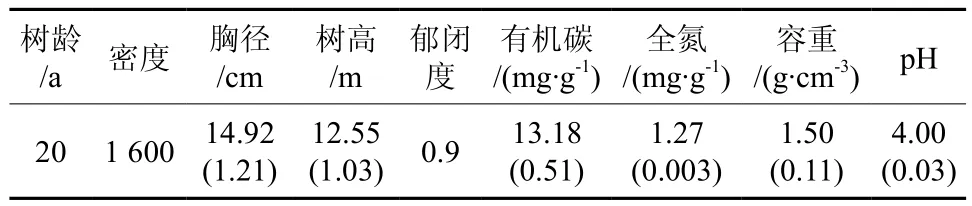
表1 樟树人工林的土壤理化性质、林分特征†Table 1 Stand characteristics and soil physical chemical properties in C. camphora plantation
2 研究方法
2.1 实验设计
2011年9月到2012年8月,在样地内选取20年生樟树人工林群落,分别设置对照(CK)、添加凋落物(DL)以及去除凋落物(RL)两种处理,每种处理设置6个3 m×4 m的样区,共18个样区,每个样区之间相距5 m。在样地选取3个能代表样地特征的随机点将3个PVC土壤环(Φ21 cm×H8 cm)夯入土中至少4 cm以上,并夯实基座外的土壤,试验期间不再移动PVC。
去除凋落物处理(RL):在样地内设置尺寸大小为3 m×4 m的尼龙网制的凋落物收集网,收集网离地垂直距离不超过0.5 m,以免凋落物进入处理范围,清除收集网垂直投影面积内的全部凋落物;沿收集网对角线安置两个PVC环。
添加凋落物处理(DL):按月将去除凋落物处理样地内凋落物收集网上的凋落物均匀的置于本处理中;沿收集网对角线安置两个PVC环。
对照(CK):有根处理即为对照,不做处理。
2.2 土壤呼吸及温度、湿度的测定
采用美国LI-COR公司生产的LI-8100A土壤碳通量自动测量系统对样地5 cm处的土壤呼吸速率、土壤温湿度同时进行测定。在每月9号和24号的9:00 ~11:00 am测定1次,全年共测定24次。
2.3 数据处理及分析方法
原始数据用Excel 2014软件进行整理,用Sigmplot 9.0软件作图,相关性分析用SPSS软件完成。月土壤呼吸速率采用每月两次测量的均值,年呼吸速率为12个月每月2次共24次测量的均值。Q10值使用下式计算:Q10=e10b,b代表温度反应系数。
3 结果与分析
3.1 土壤呼吸速率、土壤温度和土壤湿度的季节动态
从添加/去除凋落物和对照的土壤呼吸月平均值的动态变化可以看出(图1),不同处理下的土壤呼吸速率间均呈现极显著的季节性变化(P<0.001),且表现出相类似的曲线格局。樟树人工林不同处理方式下土壤呼吸的速率均从2月开始迅速上升,到6月达到最大值后又逐渐下降,DL、RL和CK处理的土壤呼吸速率变化范围分别为1.028~5.055、0.623~3.562和0.953~4.110 μmolCO2m-2s-1,差值分别为 4.027、2.939 和3.157 μmolCO2m-2s-1。DL和RL处理的土壤呼吸速率最低值均出现在2月,CK处理的土壤呼吸速率最小值出现在3月,3种处理的土壤呼吸速率最高值均出现在6月。DL、RL和CK处理的年均土壤呼吸速率分别为 2.857、1.943 和 2.493 μmolCO2m-2s-1,表现为DL>CK>RL处理。从数据可以明显看出RL处理对土壤呼吸速率表现出显著的抑制作用(P<0.01),DL处理对土壤呼吸速率表现为显著促进作用。
樟树人工林不同处理下5 cm处土壤温度均值在17.19~17.35 ℃之间,未表现出显著差异;不同处理下5 cm处土壤含水量在28.86%~39.11%现出显著地促进作用(P<0.01)。不同处理下,樟树人工林5 cm处土壤温度与土壤含水量均呈相似的显著季节变化(图1,P<0.01)。DL、RL和CK 3种处理土壤温度的最高值均出现在7月,最低值均出现在2月;土壤含水量最高值均出现在6月,最低值均出现在7月。11%之间,波动范围较大。
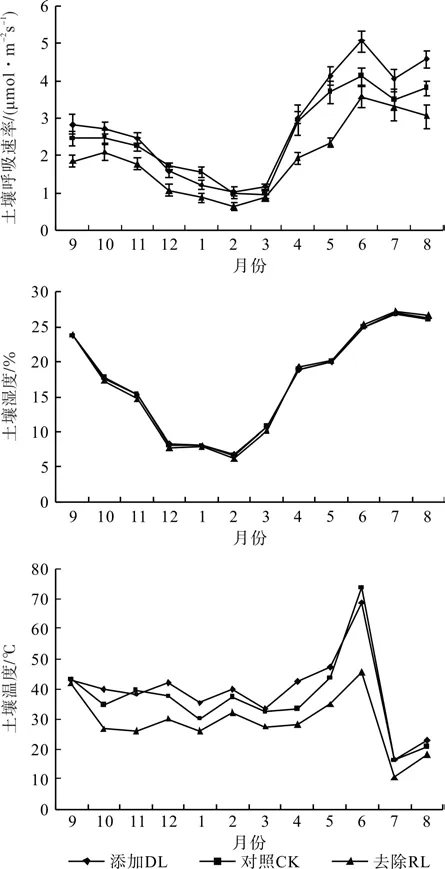
图1 不同处理下樟树人工林土壤呼吸速率、土壤温度和湿度的季节动态Fig.1 Seasonal dynamics of soil respiration rate, soil temperature and soil humidity in C. camphora plantation under different treatments
3.2 土壤呼吸与土壤温、湿度的关系
樟树人工林不同处理下土壤呼吸速率、5 cm土壤温度、5 cm处土壤湿度3者之间的相关关系(图2)表明:
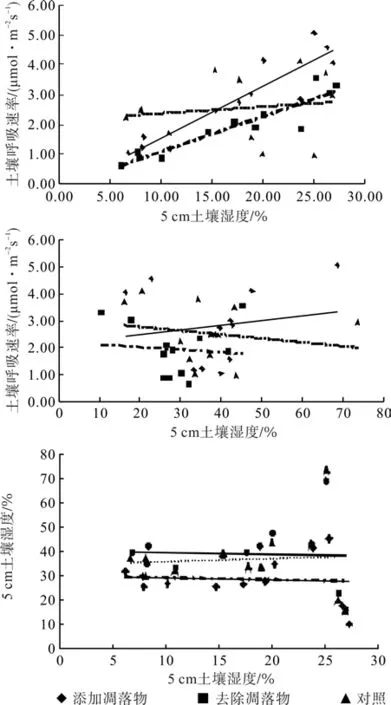
图2 不同处理下樟树人工林土壤5 cm处土壤呼吸、土壤温度、土壤含水量之间的相关关系Fig.2 Relationships among soil respirations rate, soil temperature and soil moisture in C. camphora plantation under different treatments in 5 cm depth
添加、去除凋落物与对照处理下,樟树人工林生态系统中土壤呼吸速率与土壤温度间均呈现显著线性相关(P<0.001)。其线性方程表达式分别为:
添加凋落物(DL):y=0.174 0x-0.20R2=0.845 9;
去除凋落物(RL) :y=0.117 9x-0.08R2=0.863 3;
对照(CK):y=0.083 8x+1.05R2=0.279 8。
樟树人工林不同处理下土壤呼吸速率与5 cm土壤湿度之间不存在相关性(P>0.05)。其线性方程表达式分别为:
添加凋落物(DL)y=0.017 8x+2.12R2=0.026 7;
去除凋落物(RL)y=-0.009 4x+2.22R2=0.008 1;
对照(CK)y=0.012 0x+2.18R2=0.018 0。
樟树人工林不同处理下5 cm处土壤温度和土壤湿度之间不存在相关性(P>0.05)。其线性方程表达式分别为:
添加凋落物(DL)y=-0.075 7x+40.43R2=0.001 9;
去除凋落物(RL)y=0.120 6x+34.78R2=0.004;
对照(CK)y=-0.074 9x+30.15R2=0.003 8。
3.3 凋落物对土壤呼吸速率的贡献
由不同月份凋落物处理对樟树人工林土壤呼吸速率的影响幅度(见图3)可以看出,添加凋落物(DL)处理下樟树人工林的土壤呼吸速率的变化百分比为正值,其中最大的月份是1月,增加了28.09%,最小的月份是4月,增加了2.37%,且与对照(CK)相比,添加凋落物处理下樟树人工林土壤呼吸年均速率增加了14.33%,表明添加凋落物的处理对樟树人工林土壤呼吸速率表现为显著地促进作用;去除凋落物(RL)处理下樟树人工林的土壤呼吸速率的变化百分比为负值,其中最大的月份是2月,降低了37.38%,最小的月份是7月,降低了5.08%,且与对照(CK)相比,去除凋落物处理使得樟树人工林土壤呼吸速率年均降低了23.01%,表明去除凋落物的处理对樟树人工林土壤呼吸速率表现为显著的抑制作用。
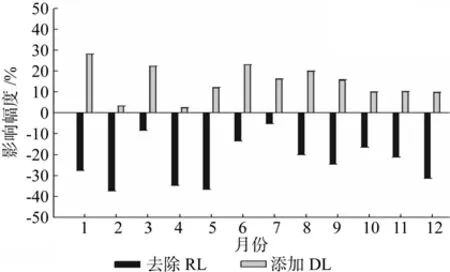
图3 不同处理对樟树林土壤呼吸速率影响的变化幅度Fig. 3 Fluctuation percent of soil respiration by different treatments in C. camphora plantation
3.4 凋落物对土壤呼吸Q10值的影响
樟树人工林不同处理下的土壤呼吸Q10值分别为:2.04(添加凋落物)、2.02(去除凋落物)和1.87(对照),表现为添加>去除>对照,3者之间呈显著差异(P<0.01)。添加和去除凋落物均表现出对土壤呼吸Q10值的促进作用,两种处理下土壤呼吸的Q10值较对照处理土壤呼吸Q10值分别增加了9.09%和8.02%。
4 结论与讨论
土壤呼吸中植物凋落物分解占据着及其重要的地位[5],它是土壤有机质输入的主要来源[6]。去除或添加凋落物使得土壤的有机碳输入改变,从而使得土壤呼吸速率产生显著的变化,即显著降低或显著增加。大量野外试验的结果表明,去除凋落物处理对土壤呼吸产生的抑制作用的程度远低于添加凋落物对土壤呼吸产生的促进作用[7-8],但也有实验得出了相反的结论[9]。本实验的研究结果表明,添加凋落物使得樟树林土壤呼吸速率增加了23.01%,而去除凋落物使得樟树林土壤呼吸速率仅降低了14.33%,添加凋落物处理下土壤呼吸的速率大大超过了去除凋落物处理下土壤呼吸的速率,这与Sulzman等人的得出的结论一致。这可能是因为额外的凋落物输入对现存有机质分解起正激发效应,而基质的添加会使得土壤有机质分解的减少(负激发效应)或增加(正激发效应)。激发效应(primingeffect)指的是土壤中的有机物因有机基质的添加而引起的短时间的变化[10]。
土壤温度对土壤呼吸的影响是通过影响土壤微生物活性以及植物根系的生长间接对土壤呼吸产生影响[11-12]。大量实验结果表明,森林生态系统的土壤呼吸与土壤表层温度之间呈现良好的相关性[13-15]。凋落物对土壤与外界大气的热量交换起到阻隔作用,从而使得对土壤温度产生影响,最终减缓土壤对外界环境敏感性。在限制因子为非土壤湿度条件的情况下,土壤呼吸速率变异的60%~80%可以由土壤温度解释。在本实验中,不同处理方式下,5 cm处土壤温度的变化是影响该层土壤呼吸速率主要因素,且在不同凋落物处理方式下,土壤5 cm处土壤温度与土壤呼吸间呈极显著的线性相关,这与Knapp[16]、Liu[17]等人在不同区域的生态系统中,研究土壤温度和土壤呼吸得到的研究结果是一致的。从观测期的年均温度看,不同处理方式下土壤温度表现为DL>CK>RL,虽然温度差异不显著,但与对应处理方式下土壤呼吸速率的大小关系相吻合。此现象说明凋落物处理下,土壤温度的变化使得土壤呼吸产生变化。这是因为植物的发育阶段、土壤微生物呼吸和植物根生长都受到温度的影响,因此温度直接或间接的对土壤呼吸产生影响。
土壤湿度同样对土壤呼吸有着重要影响。但是一些野外观测和试验的研究结果表明,土壤湿度会对土壤CO2通量会表现出抑制作用,且只有在土壤湿度最低和最高的情况下才会表现出该作用[18-19,23]。凋落物层的微生物控制着土壤中主要的生物化学过程,而凋落物作为土壤有机质的主要来源,为真菌或微生物的生命活动提供物质基础。本实验中土壤湿度在不同凋落物处理的情况下发生一定的差异,具体表现为表现为:DL>CK>RL。因此土壤湿度通过影响不同凋落物处理下根生长、土壤微生物活性变化和土壤微生物数量来间接影响土壤呼吸。
土壤Q10值(温度敏感性指数)是指温度增加10 ℃造成的呼吸速率改变的熵,该值反应了土壤呼吸对温度变化响应的敏感程度。通过大量长期研究结果表明,全球范围内,土壤Q10值通常在1.8~4.1之间[20-21],Q10中位值为2.4[22]。土壤呼吸温度敏感性会因土壤呼吸组分不同而不同,本实验中添加和去除凋落物处理土壤呼吸的Q10值分别为2.04、2.02,均大于对照的1.87,表明添加和去除凋落物两种处理使得土壤呼吸的温度敏感性增强。
本研究旨在说明樟树人工林土壤呼吸对添加和去除凋落物变化的响应程度,与水热因子在凋落物输入改变的条件下对其产生的影响。然而由于本研究只进行了1 a,所得的数据极为有限,因此所得结论具有一定的局限性,还需要进一步研究加以验证。
[1] Raich J W, Potter C S. 19951Global patterns of carbon dioxide emissions from soils[J]. Global Biochemical Cycles, 9: 23-36.
[2] Nadelhoffer K J,Boone R D, Bowden R D,et al. The DIRT experiment: litter androot influences on forestSoil organic matter stocks and llinction[C]. Forest Landscape Dynamics in NewEngland: Ecosystem Structure and Function as a Consequence of 5000 years of Change. Synthesis Volumeof the Harvard Forest LTER Program ed.Oxford University Press, 2004.300-315.
[3] Knoepp JD, Coleman DC, Crossley Jr.DA,et al.Biological indices of soil quality: an ecosystem case study of their use[J].Forest Ecology and Management. 2000,138(1-3):357-368.
[4] 杨 晶, 李凌浩. 土壤呼吸及其测定方法[ J] . 植物杂志,2003,(5): 36-37.
[5] Bowden R D,Nadelhoffer K J,Boone R D,et al.Contributions of aboveground litter,below ground litter and root respiration to total soil respiration in a temperate hardwood forest[J]. Can J ForRes,1993, 23: 1402-1407.
[6] Sulzman EW, Brant JB, Bowden R D,et al. Contribution of aboveground litter,belowground litter, and rhizosphere respiration to total soilC02 efflux in an old growth coniferous forest[J].Biogeochemistry, 2005,73: 231-256.
[7] Sulzman EW, Brant JB, Bowden R D,et al.Contribution ofaboveground litter, belowground litter, and rhizosphere respiration to total soil CO2 eff l ux in an old growth coniferous forest[J]. Biogeochemistry, 2005, 73: 231-256.
[8] NadelhofferK J, BooneR D, BowdenR D,et al.The DIRT experiment: litterand root influenceson forestsoilorganicmatter stocks and function. In: FosterD, Aber J[M]. eds. Forests in Time:The Environmental Consequences of 1000 Years of Change in New England, YaleUniversity Press, NewHaven, 2004. 300-315.
[9] Boone R D, Nadelhoffer K J, Canary J D,et al.19981Roots exert a strong influence on the temperature sensitivity of soil respiration[J]. Nature, 396:570-5721.
[10] Kuzyakov Y. Priming effects Interactions between living and de ad organic matter[J]. Soil Biology and Biochemistry, 2010, 42:1363-1371.
[11] Mikan C J, Schimel JP, DoyleA P. Temperature controls ofmicrobial respiration in arctic tundra soils above and below freezing[J]. SoilBiology and Biochemistry, 2002, 34: 1785-1795.
[12] Kutsch LW, StaackA, WÊtzel J,et al.Fieldmeasurements of root respiration and total soil respiration in an alder forest[J]. New Phytologist, 2001,150: 157-168.
[13] Ryan M G, Lavigne M B, Gower S T. Annual carbon cost of autotrophic respiration in boreal forest ecosystems in relation to species and climate[J]. Journal of Geophysical Research,1997,102(24): 871-883.
[14] Bowden R D, Nadelhoffer K J, Boone R D,et al.Contributions of aboveground litter,belowground litter,and root respirationto total soil respiration in a temperate mixed hardwood forest[J].Canadian Journal of Forest Research, 1993, 23(7): 1402-1407.
[15] Rey A, Pegoraro E, Tedeschi V,et al.Annual variation in soil respiration and its components in a coppice oak forest in Central Italy[J].Global Change Biology, 2002, 8(9): 851-866.
[16] Knapp AK, Conard SL, Blair JM. Determinants of soil CO2fl ux from a sub-humid grassland effect of fire and fire history[J].Ecological Application, 1998, 8(3):760-770.
[17] Liu JJ, Wang DX, Lei RD,et al. Turnover processes and energy change of fi ne roots of Pinus tablae form is and Quercus aliena var, acuteserrata natural forests in Qin ling Mountains[J].Soil Biology & Biochenistry, 2001,33:155-165.
[18] LIU W Y, FOX J E D, XU Z F. Litter1a11 and nutrient dynamics in a montance moist evergreen broachleaved forest in Ailao Mountains, SW China [J]. Plant Ecology, 2002, 164(2)157-170.
[19] XU I. K, BALDOC'C'HI D D, TANU J W. How soil moisture rain pulses,and growth alter the response of ecosystem respiratmn to temperature [J].Ulobal Biogeochemical Cycles, 2004, 18(4):1-10.
[20] Ohashi M, Gyokusen K, Saito A. Measurement of carbon dioxide evolution from a Japanese cedar (Cryptomeria japonica D. Don)forest floor using an open-flow chamber method [J]. Forest Ecology and Management, 1999, 123(2/3) : 105-114.
[21] Baath E, Wallander H.Soil and rhizosphere microorganisms have the same Q10for respiration in a model system [J]. Global Change Biology, 2003, 9(12): 1788-1791.
[22] Raich J W, Schlesinger W H. The global carbon dioxide fl ux in soil respiration and its relationship to vegetation and climate [J].Tellus B, 1992, 44(2) : 81-99.
[23] 衣晓丹,王新杰.杉木人工纯林与混交林下几种土壤养分对比及与生长的关系[J].中南林业科技大学学报,2013,33(2):34-38.
Response of soil respiration to litter treatment ofCinnamomum camphorain subtropical aera
LIU Yi-jun1,2, YAN Wen-de1,2,3, WU Qian1,2, CHANG Chao1,2, ZHANG Li1,2, LIANG Xiao-cui1,2,3
(1. School of Life Science and Technology, Central South University of Forestry and Technology; 2. National Engineering Lab. of Southern Forest Ecology Applied Technology; 3. Hunan Province Key Lab. of Urban Forest Ecology, Changsha 410004, Hunan, China)
From Sept. 2011 to August 2012, theCinnamomum camphoraplantation grown in Hunan Forest Botanical Garden,which located in southern suburbs of Changsha city, were selected as the experimental sample plots. Three treatments such as litter addition(DL), litter exclusion(RL) and control (CK) were set. The soil respiratory rate values of different treatments were continuously observed for 12 months. The results show that under different treatments the soil respiration ofC. camphoraplantation appeared signif i cant seasonal dynamics, and they all presented single peak curves; The annual average value of the soil respiration with litters addition treatment was 2.816, and the annual average value of the soil respiration with litters exclusion treatment was 1.943, which were 14.33% and 23.01% higher than that of the control, respectively; The soil respiration rate and soil temperature in 5 cm depth ofC. camphoraplantation showed a signif i cant linear correlation(P<0.01), and had no signif i cant correlation with soil moisture (P>0.05); TheQ10values ofC. camphoraplantation under DL and RL treatments was 2.04 and 2.02, respectively, which were all higher than the value of CK(1.87). Thus, the litters had important inf l uence on forest CO2fl ux.
Cinnamomum camphoraplantation; soil respiration; litters; soil temperature and humidity;Q10value
S792.23
A
1673-923X(2015)04-0083-06
10.14067/j.cnki.1673-923x.2015.04.015
2015-01-23
国家林业公益性行业科研专项(201404316); “十二五”农村领域国家科技计划课题(2011BAD38B0204);国家林业局软科学研究项目(2013-R09)
刘益君,硕士研究生 通讯作者:闫文德,教授,博士;E-mail:csfuywd@hotmail.com
刘益君,闫文德,伍 倩,等.亚热带樟树人工林土壤呼吸对凋落物处理的响应[J].中南林业科技大学学报, 2015, 35(4):83-88.
[本文编校:文凤鸣]

