成龄板栗组培快繁体系的建立及影响因素的研究
孙小兵,郭素娟
(北京林业大学 省部共建森林培育保护与利用教育部重点实验室,北京10083)
成龄板栗组培快繁体系的建立及影响因素的研究
孙小兵,郭素娟
(北京林业大学 省部共建森林培育保护与利用教育部重点实验室,北京10083)
以迁西板栗主栽品种‘燕山早丰’为试材,采集其成龄树上当年抽生营养枝的茎段为外植体,研究了取样时期、基本培养基种类及植物生长调节剂组合对板栗不定芽诱导的影响,并采用L9(34)正交试验设计对增殖培养基进行筛选。结果表明:(1)外植体最佳取材时间为新梢旺盛生长期到半木质化期,即5月初至6月上旬;(2)不定芽诱导最佳基本培养基为MS,采用正交试验设计筛选出最佳激素组合为6-BA2.0 mg/L+IBA0.1 mg/L,诱导率达80%以上;(3)最佳增殖培养基为GD+ZT2.0 mg·L-1+NAA0.1 mg·L-1,增殖系数可达3.24。
板栗‘燕山早丰’;茎段;离体培养;增殖培养;正交试验
板栗Castanea mollissimaBl.属于壳斗科Fagaceae栗属CastaneaMill植物,原产我国,在我国分布范围很广,并且不与粮农作物争地,是我国三大木本粮食树种之一。其营养价值丰富,兼具经济效益与生态效益,具有重要的发展前景。中国板栗主要利用它的坚果,其果实富含淀粉、糖、蛋白质、脂肪及多种维生素和矿物质,甘甜可口,并具有保健功效。中国板栗坚果品质高居各种栗的首位,尤其是北方板栗淀粉含量高,品质优良[1-3]。现今,栗实已成为是我国出口创汇的主要干果之一。
‘燕山早丰’Castanea mollissima‘Yanshanzaofeng’是‘中国的板栗之乡’河北省唐山市迁西县的主栽品种,具有果实品质优良、丰产性好、成熟期早、抗病、耐旱特点,是一个极受栗农欢迎的早实优良品种。但实际生产过程中,人们普遍沿用实生繁殖的方式,实生后代性状变异复杂,造成良种化程度低[4-5]。而通过组织培养可以快速繁殖,建立板栗良种繁育体系。目前,关于栗属植物组织培养国外已有大量报道[6-9],但国内关于板栗组织培养的研究较少,主要研究有板栗无菌体系建立[10-11]及再生体系的建立[12],‘锥栗’的愈伤组织诱导[13],胚珠培养[14],‘燕山红栗’的种胚培养[15]等。然而,目前尚无关于‘中国的板栗之乡’迁西县的主栽品种‘燕山早丰’组织培养研究的报道。因此,本实验采用‘燕山早丰’成龄树上当年抽生营养枝作为外植体,对其组培快繁体系的建立及增殖培养进行研究,以期为我国板栗育种和种苗繁殖提供理论依据和实践支撑,并为再生体系的建立及后续基因转化等奠定基础。
1 材料与方法
1.1 植物材料
2013年4月25日至7月9日,在河北省唐山市迁西县板栗产业研究发展中心板栗品种园(118°20′E,39°42′N),选取生长健壮,茎芽饱满,无病虫害的‘燕山早丰’优良结实单株(嫁接4 a)为母株,采集其当年抽生营养枝作为外植体。
1.2 试验方法
1.2.1 外植体消毒
根据前期预备试验,确定用5%的次氯酸钠(NaClO)溶液灭菌20 min,具体操作参照侯竞薇[12]的操作步骤。
1.2.2 母株取材时期
从2013年4月25日至7月09日,每隔约15 d取材一次,共设6个取材时期,分别为:4月25、5月10日、5月25日、6月09日、6月24日、7月09日,其中4月25取芽膨大期的枝条放在冰盒中带回实验室,以经水培后萌发的茎段为外植。MS为基本培养基,添加6-BA1.0 mg·L-1、蔗糖 30 g·L-1、琼脂 7 g·L-1,pH5.6 ~ 5.8,以下未特别说明,均用此培养基。每瓶接种1个外植体,每个处理接种30瓶,重复3次。放在组培室培养4周后统计污染率、褐化率和萌发率。
1.2.3 基本培养基筛选
2013年5月中旬取样,采用MS、WPM、GD、SH、DKW、B5、LS、Miller、White 9种木本植物常用培养基,考察不同基本培养基对不定芽诱导的影响。培养基中均添加6-BA1.0 mg·L-1、蔗糖 30 g·L-1、琼脂 7 g·L-1,pH5.6 ~ 5.8。每瓶接种1个外植体,每个处理接种30瓶,重复3次。放在组培室培养4周后统计萌发率,并观察记录生长状况。
1.2.4 不定芽诱导正交试验
采用L9(34)正交设计(参见表1),筛选不定芽诱导过程中最佳激素配比。以MS为基本培养基,分别添加如表1所示的生长调节剂组合,蔗糖 30 g·L-1、琼脂 7 g·L-1,pH5.6 ~ 5.8。每瓶接种1个外植体,每个处理40株,重复2次。接种后置于组培室培养4周后统计萌发率,观察记录生长状况。
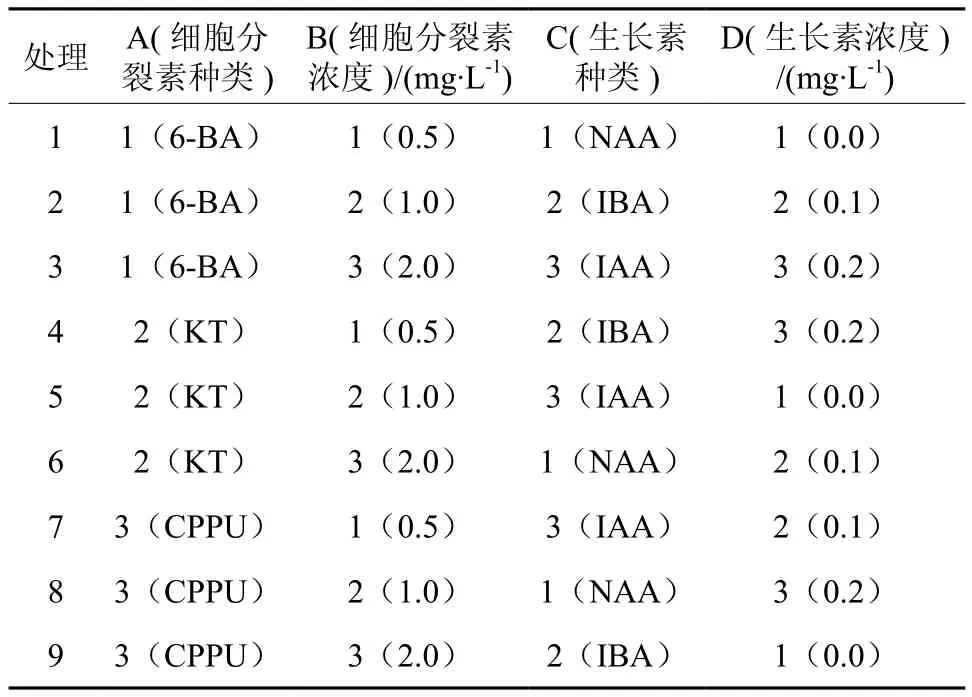
表1 不同生长调节剂组合诱导不定芽的L9(34)正交试验设计Table 1 L9(34) orthogonal design for different hormone combinations of induction of adventitious bud
1.2.5 继代培养正交试验
采用L9(34)正交设计(见表2),将萌发的不定芽(无菌材料)剪成1.0 cm小段,接种于正交设计的培养基中,培养基中均添加蔗糖30 g·L-1、琼脂7 g·L-1,pH5.6~5.8,每个处理40株,重复2次。接种后置于组培室培养4周,统计增殖系数,观察记录生长状况。
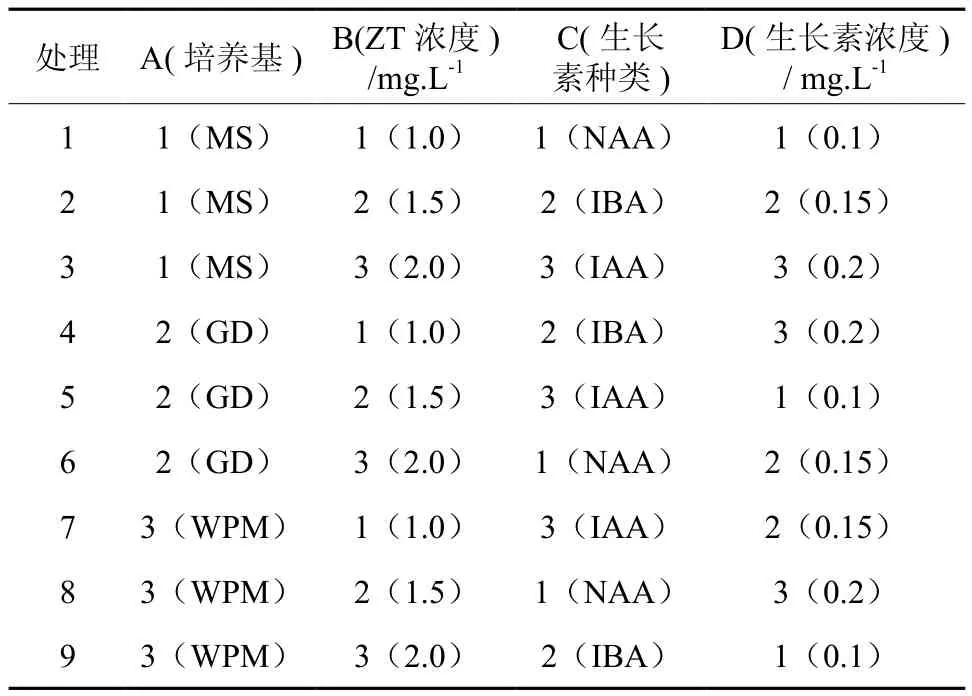
表2 不同激素组合诱导增殖的L9(34)正交试验设计Table 2 L9(34) orthogonal design for induced proliferation with different hormone combinations
1.2.6 培养条件
组培室温(24±1)℃,空气相对湿度60%,光照强度2 000~3 000 lx,光周期为光培养16 h(6:00~22:00)和暗培养8 h(22:00~6:00)。
1.2.7 数据处理与分析
试验采用Excel对数据进行处理、SPSS18.0进行方差分析,Duncan法进行差异显著性检验。
2 结果与分析
2.1 母株取材时期对板栗无菌体系建立的影响
从表3可以看出,萌发率受污染率和褐化率共同影响,且不同生长时期外植体的污染率、褐化率和萌发率有显著差异(p<0.01)。从图1可以看出,污染率随着取材时间的推移而升高,4月25日取材的污染率显著低于其它处理。褐化率在4月25日至5月25日取样时期最低,且与其它取样时期差异显著少。而萌发率随时间的推移先升高再降低,5月10日和5月25日萌发率最高分别为61.11%和63.33%。6月09日萌发率为34.45%,不定芽的诱导率仅次于5月份。而6月09日后新梢开始停止生长,含内生菌较多,污染率和褐化率增高、萌发率下降,不再适宜进行板栗的初代培养。
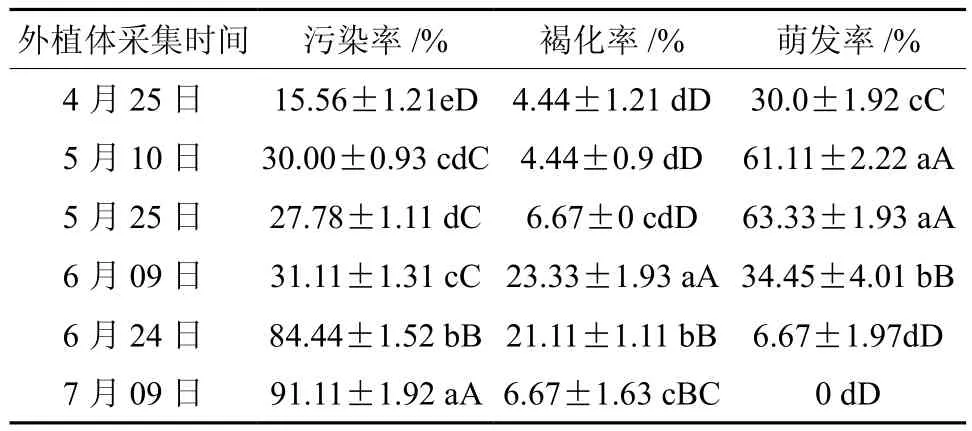
表3 不同取材时间对板栗不定芽启动培养污染率、褐化率、萌发率影响的多重比较Table 3 Multiple comparisons of effects of different sampling time on chestnut shoots start culture contamination rate, browning rate, germination rate
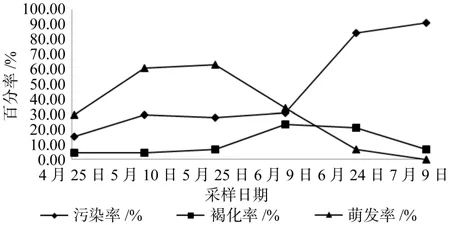
图1 不同取材时期对不定芽诱诱导的影响Fig.1 Effects of different sampling periods on induction of adventitious bud
所以,综合来看,生长季节板栗茎段初代培养外植体最佳取材时期以5月初到6月初最好,即新梢旺盛生长期到新梢半木质化期,此期间的枝条未木质化,营养充足,适宜做板栗组织培养的外植体。
2.2 基本培养基对不定芽诱导的影响
从图2可以看出,板栗带芽茎段接种在9种基本培养基上均能诱导出不定芽,但不定芽诱导率差异显著。其中萌发率最高的培养基为MS和SH,萌发率最分别为82.22%、81.11%。而GD萌发率最低仅为48.89%,其它培养基的不定芽诱导情况介于中间水平。由表4可知,MS和SH不定芽诱导率显著高于其它培养基,但MS和SH培养基之间不定芽诱导率差异不显著。芽生长较好的培养基为MS、SH、B5,不定芽在MS培养基中生长健壮,翠绿色,长势好。在WPM、B5培养基中,茎段基部产生大量的愈伤组织。而接种在GD培养基上的茎段只诱导出了少量不定芽,且长势差,有一定的褐化现象。所以,综合芽的平均诱导率和生长情况来看,不定芽诱导最佳培养基为MS。
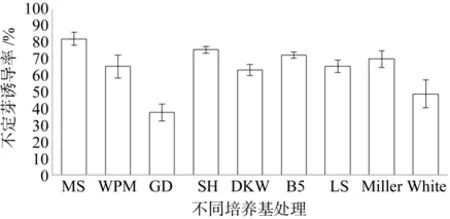
图2 不同培养基对不定芽诱导的影响Fig.2 Effects of different culture mediums on induction of adventitious buds
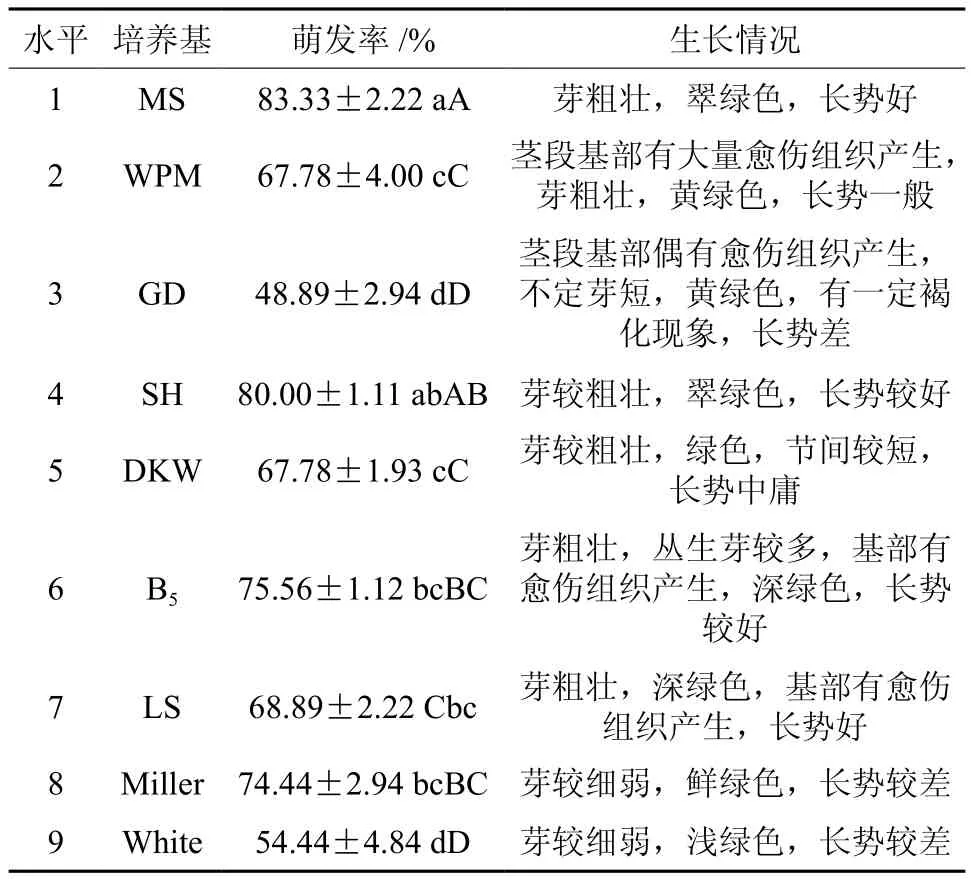
表4 不同培养基对不定芽诱导的影响†Table 4 Effects of different culture mediums on induction of adventitious buds
2.3 植物生长调节剂对不定芽诱导的影响
如表5所示,不同激素组合显著影响不定诱导率(p<0.01)。从表6可以看出,当细胞分裂素为6-BA时,不定芽诱导率达到82.59%,极显著高于其他水平。当细胞分裂素浓度为2.0 mg·L-1时,不定芽诱导率为75.93%,高于其他水平,但差异不显著。而对于生长素来说,当以IBA为生长素时,不定芽诱导率为78.33%,显著高于其他生长素的处理,添加一定量的生长素有利于不定芽的诱导,当生长素浓度为0.1 mg·L-1时,不定芽诱导率最高为80.19%,然而随着生长素浓度的提高,不定芽的诱导率却明显呈下降趋势。
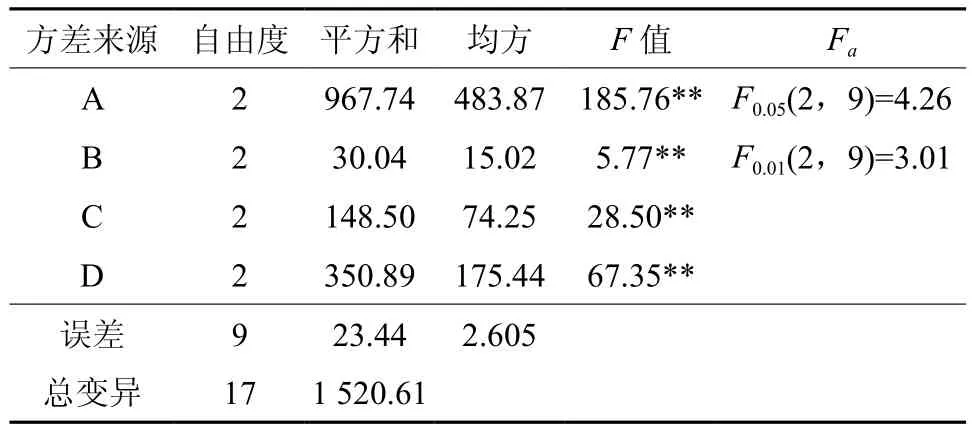
表5 不同激素组合诱导不定芽的L9(34)正交试验方差分析Table 5 Variance analysis of different hormone combinations rate to adventitious buds
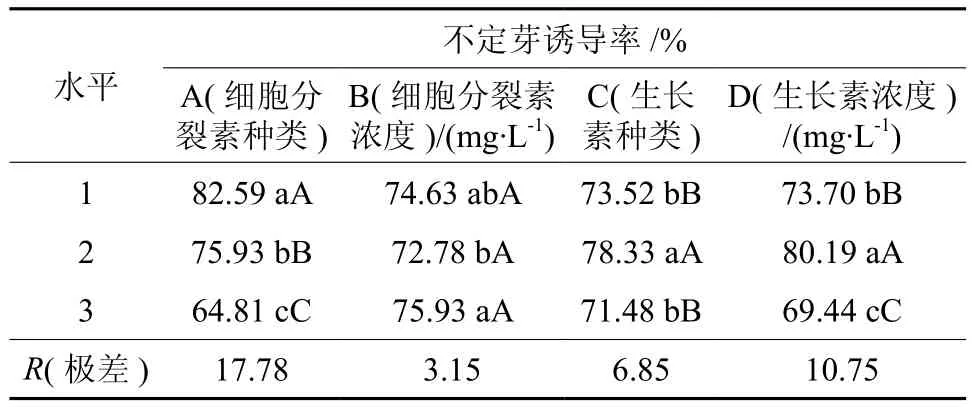
表6 不同激素组合不定芽诱导率的多重比较Table 6 Multiple comparisons of different hormone combinations to induction rate of adventitious buds
从极差值R(表6)直观分析可知,试验所考察的4个因素中,细胞分裂素与生长素共同使用比单独使用细胞分裂素时不定芽诱导效果好。其中细胞分裂素种类对不定芽诱导的影响最大,细胞分裂素浓度对不定芽诱导的影响最小。比较各水平均值,得知A1B3C2D2利于不定芽诱导,即6-BA2.0 mg·L-1+IBA0.1 mg·L-1配合使用。
2.4 培养基对增殖的影响
如表7所示,不同培养基及激素组合显著影响了增殖系数(p<0.01)。从表8的以看出,不同培养基种类对增殖有显著影响,当培养基为GD培养基时,增殖系数为3.24,极显著高于其他水平。当ZT浓度为1.5 mg·L-1和mg·L-1时,增殖系数分别为2.41和2.53差异不显著。生长素NAA浓度为0.1时,增殖系数最大。
从极差值R(表8)直观分析可知,试验所考察的4个因素组合中,A2B3C1D1的增殖效果最好,增殖系数最高 ,即 GD+ZT2.0 mg·L-1+NAA mg·L-1。在该培养其上,外植体经培养15 d左右即可诱导出新的腋芽。
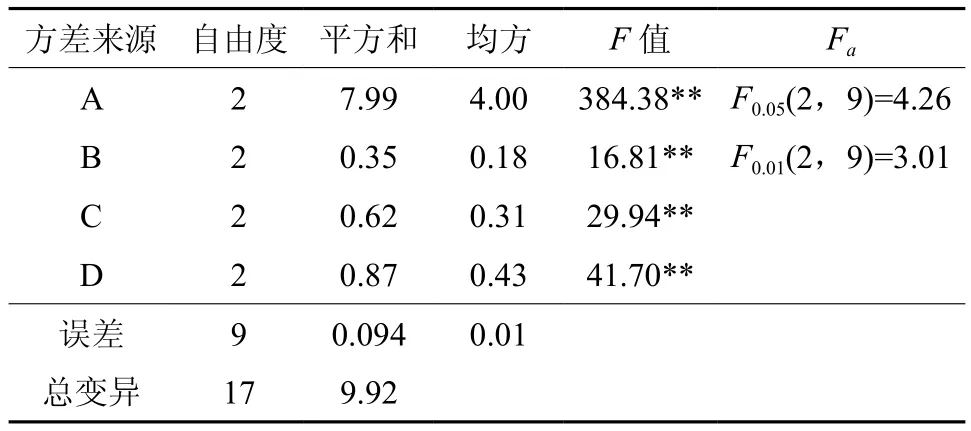
表7 不同培养基及激素组合的培养L9(34)正交试验设计各处理增殖系数的方差分析Table 7 Variance analysis of different combinations of hormone and culture mediums to multiplication factors
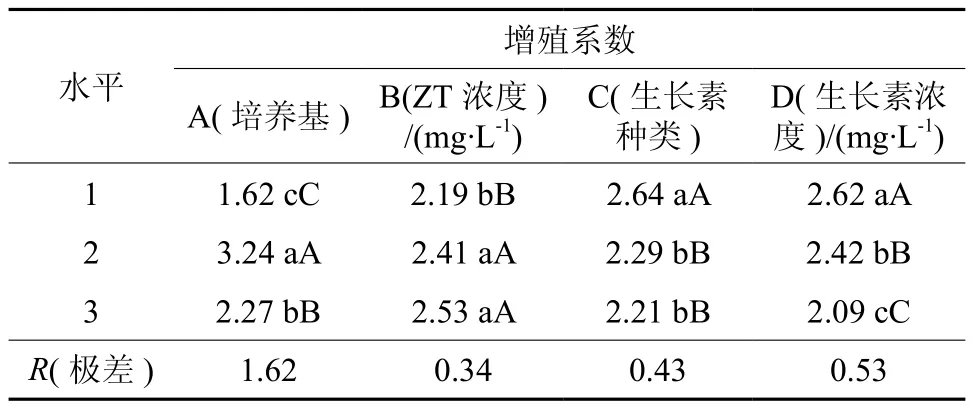
表8 不同培养基及激素组合增殖系数的多重比较Table 8 Multiple comparisons of different media and hormone combinations to multiplication factors
3 结论与讨论
(1)母株取材时期直接影响离体培养的结果。板栗是多年生木本植物,枝条暴露在田间,菌类滋生,还有的细菌甚至渗透到组织内部,因此,试验中外植体即使经过细致的表面灭菌,仍然有污染情况出现。本试验结果表明,外植体取材最佳时间是新梢旺盛生长期到新梢半木质化期,此时采集的外植体材料所含细菌少,生活力强,对外源激素敏感,反应强,分化能力也较强。
(2)在前人的研究中,板栗组织培养中褐化现象严重[16]。这主要是因为板栗体内含有酚类物质单宁[17],当外植体组织受到损伤时酚类物质被氧化成醌,导致褐化现象。但本实验中褐化现象对板栗组培体系建立的影响较小,分析原因可能有两点:其一,基因型不同。基因型是影响组织培养效果的重要因素,本实验的板栗品种“燕山早丰”可能在抗褐化方面更具优势。其二,灭菌方法不同。本实验采用NaClO溶液灭菌,虽然NaClO溶液的灭菌效果不及HgCl2[18],但是NaClO对外植体组织的伤害也较小,这可能也是本实中褐化现象较轻的原因。
(3)基本培养基提供了植物生长发育所需的营养元素,但因为各种植物的遗传特性、生物学特性和生态学特性不一致,所以它们对营养的要求也不相同,基本培养基的优化筛选极为重要[19-21]。本实验采用MS、WPM、GD、SH、DKW、B5、LS、Miller、White 9种木本植物常用培养基,考察不同基本培养基对不定芽诱导的影响。结果表明:茎段初代培养的最佳培养基为MS培养基,MS和SH培养基的不定芽诱导率最高,二者均为高硝态氮的培养基,这与任鹏的研究结果一致[22]。
(4)生长素和细胞分裂素的运用及其浓度大小直接影响外植体生长和分化的方向。本研究发现细胞分裂素和生长素共同使用对不定芽诱导效果较好,其中 6-BA2.0 mg·L-1+IBAmg·L-1组合不定芽诱导效果好。
(5)增殖培养中,GD培养基适于板栗增殖培养,增殖效果显著优于其它培养基,这可能是由于GD培养基中含有L-谷氨酰胺,能有效促进外植体内一些蛋白质的合成。其中以GD+ZT2.0 mg·L-1+NAA0.1 mg·L-1的培养基效果最好。
[1] 张宇和,柳 鎏,梁维坚,等.中国果树志:板栗榛子卷[M].北京:中国林业出版社,2005.7-10.
[2] 柳 鎏,蔡剑华,张宇和,等.板栗[M].北京:科学出版社,1988.169-171.
[3] 王向红,桑建新,张子德,等.不同品种板栗的营养价值和品质分析[J].食品科技,2004,(3):95-97.
[4] 刘国彬,兰彦平,曹 均,等.中国板栗生殖生物学研究进展[J].果树学报.2011,28(6):1063-1070.
[5] 佘远国,章承林,白 涛,等.修剪对板栗生长与结果的影响[J].经济林研究,2013,31(1): 156-160.
[6] MANZANERA J A, PARDOS J A. Micropropogation of juvenile and adultQuercussuberL.[J].Plant Cell Tissue and Organ Culture, 1990,(21):1-8.
[7] ROMANO A,MARTINE M A. Micropropogation of mature cork--oak (Quercussuber L.):establishment problems [J].Scientia Gerundensis,1992,(18):17-27.
[8] XING Z Z, SATCHWELL M F, POWELLW A,et al.Micropropagation of American chestnut: Increasing rooting rate andpreventing shoo-t tip necrosis [J].In vitro Cellular &Development Biology. 1997,33(1):43-48.
[9] YANG G C, LU Z G. In VitroCallus Induction and Shoot Initiation of American Chestnut (Castanea dentata)[J]. Journal ofJilin Agricultural University,2008,30(4):466-471.
[10] 侯竞薇.板栗组织培养及其不定根发生蛋白质组学探讨[D].北京:北京林业大学,2010.
[11] 陈建华,罗丽华,苏冬梅,等.不同板栗品种的组培技术[J].中南林业科技大学学报.2007,12(6):83-87.
[12] 郭素娟,任 鹏,王桂云.燕山红栗下胚轴再生体系的建立[J].西南林学院学报.2005,25(4):102-105.
[13] 苏冬梅,罗丽华,杨定海,等.板栗愈伤组织的诱导[J].经济林研究.2004,22 (3):17-19.
[14] 张 玲,尹伟伦,王华芳,等.板栗胚珠培养研究初报[J].北京林业大学学报[J].2007,(9):99-105.
[15] 徐 晨,陈双双,王金金,等.板栗高效组培体系的建立和优化[J].北京农学院学报[J].2013,28(3):6-9.
[16] Chevre AM. In vitro vegetative multiplication ofcheastnut[J] .Hort. Sci., 1983,58 (1):23-29.
[17] 贝奇YPS.树木和果树生物技术[M].张培杲译.北京:中国林业出版社,1991.179,283-284,362.
[18] 冯金玲,陈 辉,杨志坚,等.锥栗组织培养外植体消毒和选择[J].福建林学院学报2006,26(1): 22-25.
[19] 郭彦彤,梁坤南,黄桂华,等.柚木愈伤组织诱导培养的研究[J].中南林业科技大学学报.2012,32(3):53-58
[20] 彭邵锋,陈隆升,殷元良,等.油茶容器苗空气控根与分级培育技术的研究[J].中南林业科技大学学报,2013,33(10):66-68.
[21] 金亚征,俞凤芳,车瑞香,等.药用百合组织培养快繁技术研究[J].经济林研究,2013, 31(1):124-128.
[22] 任 鹏.板栗Castanea mollissimaBl.组织培养技术研究[D].北京:北京林业大学,2005.
Establishment and inf l uencing factors of micropropagation system in matureCastanea mollissima
SUN Xiao-bing, GUO Su-juan
(Key Lab. for Silviculture and Conservation Co-constructed by China Education Ministry and Beijing, Beijing Forestry University,Beijing 100083, China)
By taking variety ‘Yanshanzaofeng’ from Qianxi County of Hebei province as tested material, the tested mature tree’s current-year-birth nutrition branches nodal segments were collected as explants to study the effects of combination of sampling period,type of basic culture medium and plant growth regulator on adventitious bud induction of Chinese chestnut. The multiplication mediums of tested trees were optimized and selected by sifting through L9(34) orthogonal tests. The results show that (1) the optimal collecting period of stem primary was from early May to early June, in which were the vigorous shoots growing into semi-woody periods; (2)the best basic medium for adventitious bud induction was MS medium, the best hormone combination screened out by orthogonal test was 6-BA2.0 mg·L-1+ IBA0.1 mg·L-1, the induction rate was over 80%; (3) the optimal proliferation medium was GD + ZT2.0 mg·L-1+NAA0.1 mg·L-1, the multiplication factor was up to 3.24.
Castanea mollissima‘Yanshanzaofeng’; nodal segments; isolated culture; proliferation culture; orthogonal test
S722.3+7
A
1673-923X(2015)04-0051-05
10.14067/j.cnki.1673-923x.2015.04.009
2013-11-15
国家林业公益性行业科研专项重大项目“板栗产业链环境友好丰产关键技术研究与示范”(201204401)
孙小兵,硕士研究生 通讯作者:郭素娟,教授,博士生导师; E-mail:gwangzs@263.com
孙小兵,郭素娟.成龄板栗组培快繁体系的建立及影响因素的研究[J].中南林业科技大学学报,2015,35(4):51-55.
[本文编校:文凤鸣]

