关于“盖斯定律”
关于“盖斯定律”
陈明蓉衷明华
(韩山师范学院化学系,广东 潮州 521041)
摘要:在历年高考题中,常考查盖斯定律在热化学方程式中的应用。本文将对盖斯定律的重要知识点进行梳理,对解题进行分析,供读者参考。
关键词:盖斯定律高考
盖斯定律问题是高考的常考知识点,常以选择题和反应原理的大题的形式出现。盖斯定律是热化学中的一个重要的基本定律,一些复杂、难以测定其反应热的化学反应,可通过盖斯定律间接求出。通过对2010-2014年的广东高考化学卷的分析,可以发现其对盖斯定律的考查难度没有明显变化,题型也比较稳定。
一、知识梳理
1、概念:定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。即反应热效应取决于体系变化的始终状态而与过程无关。
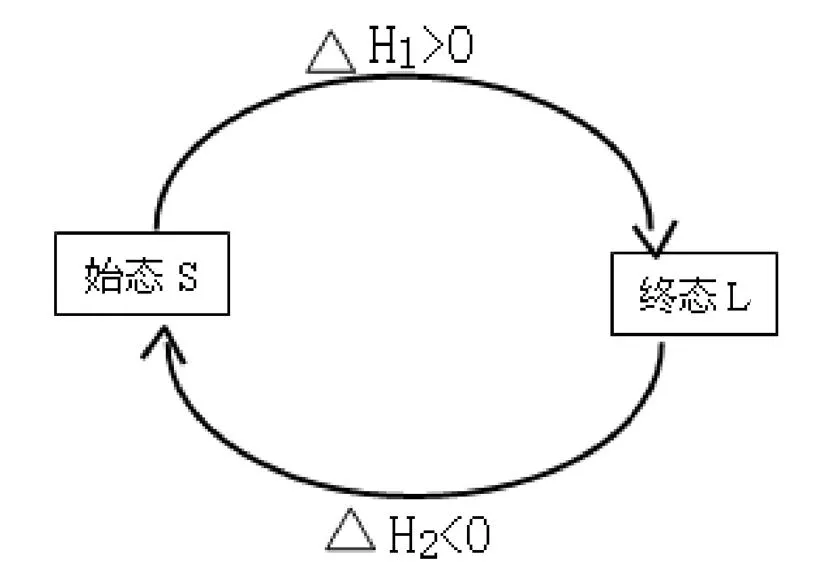
图 反应热效应
其中:△H1+△H2=0。
2、考点分析:

表 广东高考考题
从广东这5年的高考考题中可看出,热化学方程式之间可以进行代数变换数学处理,未知反应热可利用题设中所给的已知反应热来求得。从形式上看,用一般考生未接触到的反应方程式,考查学生对基础知识的理解和掌握、运用能力。当题设的已知方程较多时,复杂性会增加。
二、例题讲解
例(2014·广东高考)用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g);△H1=-47.3kJ/mol
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g);△H2=+210.5kJ/mol
△H3=-86.2kJ/mol
(1)反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=____。
答案:△H=4△H1+△H2+2△H3
解析:根据盖斯定律,①×4+②+③×2可得
2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H=4△H1+△H2+2△H3。
针对这类考题,只需对方程式间的代数关系有清晰的了解。计算要细心准确,往往不可粗心大意,想当然。
例:将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为____。
又已知H2O(g)=H2O(l),△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是____kJ。
答案:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol;1016.5kJ。
解析:0.3mol乙硼烷完全燃烧生成液态水放出的649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为1mol×649.5kJ/0.3mol=2165kJ。因此乙硼烷燃烧的热化学反应方程式为:
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165kJ/mol。由于1mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:3mol×44kJ/mol=132kJ,所以1mol乙硼烷完全燃烧产生气态水时放热2165kJ-132kJ=2033kJ,则11.2L(标准状况)乙硼烷完全燃烧产生气态水时放出的热量是0.5mol×2033kJ/mol=1016.5kJ。
此题既涉及热化学方程式的书写,又涉及生成物状态不同时求反应热的问题,运用盖斯定律会让解答变得很简单,但在计算过程还是要求细心对待。
三、总结
盖斯定律是一个高考常考点,但却不是难点。这类题易得分也易失分,考生只需理清各化学方程式间的代数关系,看清各个化合物的状态,在计算过程中做到细心,分数很容易就能拿到。
参考文献
[1]张虹.谈运用盖斯定律快速解题[J].职业技术教育研,2003,(7):45-46.

