microRNA-181b在胰腺癌患者血浆中的表达及意义
周晋航,王江华,陈先祥,吴黎明,吴士兴,王 伟(湖北医药学院附属人民医院普外科,十堰 442000;通讯作者,E-mail:zhoujinhangdr@126.com)
胰腺癌(pancreatic cancer)是一种常见的消化系统恶性肿瘤,临床上主要表现为腹痛、食欲不振、消瘦和黄疸等,由于其恶性程度高、早期诊断和治疗困难,是临床预后最差的恶性肿瘤之一。微小RNA(microRNA,miRNA,miR)是广泛存在于真核生物中的一类长度约为18-24个核苷酸、不编码蛋白质的的单链非编码RNA分子,参与了细胞生长、增殖、发育和凋亡等生理过程,与肿瘤的发生发展密切相关[1,2]。miR-181b是miRNA-181家族成员之一,研究证实miR-181b参与胃癌、肝癌、肺癌、胶质瘤、子宫颈癌、淋巴细胞白血病等肿瘤的发生发展[3-10],并与肿瘤细胞的侵袭、转移密切相关。国内外学者研究发现在胰腺癌细胞株和胰腺癌组织中高表达miR-181b[11-13],本研究通过检测胰腺癌患者血浆中miR-181b的水平,并分析miR-181b水平与年龄、性别、吸烟、局部淋巴结转移、远处转移、CA199浓度及肿瘤分期等病理参数之间的关系,初步探讨其临床意义。
1 资料与方法
1.1 研究对象
选取35例2013-091~2014-09在我院普外科住院确诊的胰腺癌患者,其中男性21例,女性14例,年龄44-79 岁,平均年龄(63.07 ±18.13)岁,所有病例均经过术后病理结果证实,采样前未进行手术、放疗或化疗等抗肿瘤治疗。临床分期:Ⅰ期2例、Ⅱ期9例、Ⅲ期11例、Ⅳ期13例。35例同期在我院健康体检中心进行体检的健康志愿者作为正常对照组,其中男性20例,女性15例,年龄42-73岁,平均年龄(58.74±14.85)岁。两组研究对象性别、年龄的比较差异均无统计学意义(P>0.05)。无菌采集两组研究对象外周静脉血5.0 ml,置于EDTA抗凝管中,分别2000 r/min离心10 min、4℃ 12000 r/min离心10 min后,收集上层血浆,-80℃保存待用。本实验经医院伦理委员会批准且所有研究对象知情同意。
1.2 方法
1.2.1 主要试剂及仪器 mirVanaTMmiRNA分离试剂盒购自美国 Ambion公司,miScript Reverse Transcription试剂盒购自美国Ambion公司,SYBR®Premix Ex TaqTMⅡ购自大连宝生物工程有限公司,荧光定量PCR扩增仪购自美国Bio-Rad公司。
1.2.2 实时定量PCR检测血浆中miR-181b水平 采用mirVanaTMmiRNA分离试剂盒提取血浆中总RNA,实验操作严格按照试剂盒说明书进行,提取的RNA溶于DEPC水中,利用紫外分光光度计测定RNA的浓度和纯度,A260/A280比值在1.8-2.1的RNA用于进行逆转录反应。根据文献[14]合成miR-181b茎环RT引物及PCR引物,见表1、表2。
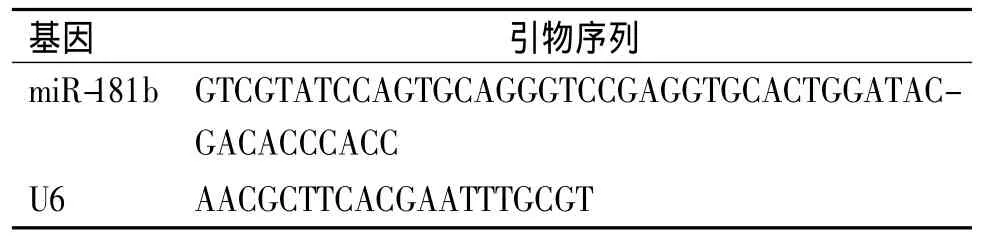
表1 逆转录引物Table 1 Reverse transcription primers
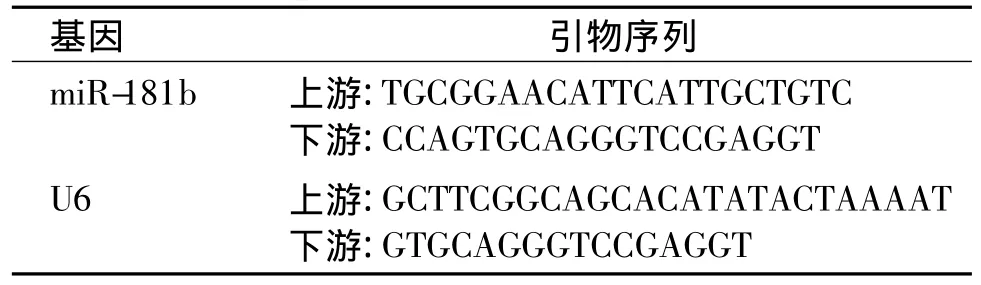
表2 合成miR-181b的PCR引物Table 2 PCR prim ers of miR-181b
利用miScript Reverse Transcription试剂盒进行cDNA 合成,10 μl反应体系包括2.0 μl总 RNA、1.0 μl茎环 RT 引物、5.0 μl逆转录缓冲液(2 × )、0.5 μl逆转录酶、0.5 μl RNA 酶抑制剂及 1.5 μl DEPC水。反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min。20 μl PCR反应体系包括上下游引物各1.0 μl、10 μl PCR 反应缓冲液(2 × )、4.0 μl模板、4.0 μl ddH2O;反应条件为95℃ 预变性3 min,95℃ 变性5 s、60℃退火延伸45 s,35个循环,扩增结束后获得循环阈值(CT值),每个样本做三个复孔,采用2-ΔΔCt分析 miR-181b 的表达水平,ΔΔCt= 实验组ΔCt(目的基因Ct-内参基因Ct)-对照组ΔCt(目的基因Ct-内参基因Ct)。
1.3 统计学分析
所有数据采用SPSS 16.0软件进行统计学处理,计量资料采用±s表示,计数资料比较采用χ2检验,miR-181b与临床病理参数的关系采用独立样本 t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 两组研究对象血浆中miR-181b水平比较
定量PCR结果显示:胰腺癌患者血浆中miR-181b 水平(0.63 ±0.24)明显高于正常对照组(0.32±0.12),差异具有统计学意义(t=6.835,P <0.01,见图1)。
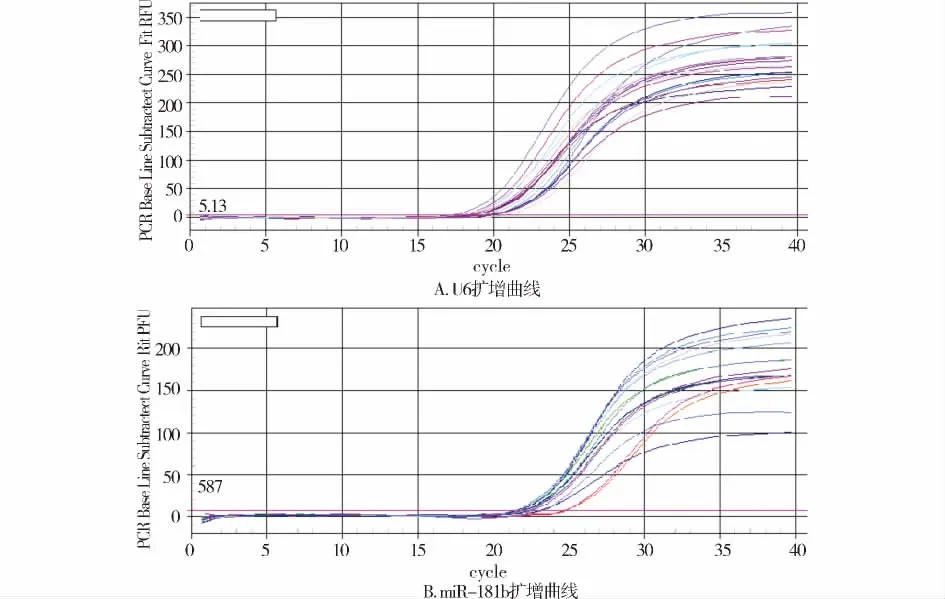
图1 miR-181b及U6基因扩增曲线Figure 1 Amplification curve of miR-181b and U6
2.2 血浆中miR-181b水平与胰腺癌临床病理特征的关系
胰腺癌患者血浆中miR-181b水平在不同年龄、不同性别、有无吸烟史、不同CA199浓度之间差异均无统计学意义(P>0.05),而Ⅲ-Ⅳ期胰腺癌患者血浆中miR-181b水平明显高于Ⅰ-Ⅱ期患者,差异具有统计学意义(P<0.05),有局部淋巴结转移的胰腺癌患者血浆中miR-181b水平明显高于未有局部淋巴结转移的胰腺癌患者,差异具有统计学意义(P<0.05),发生远处转移的胰腺癌患者血浆中miR-181b水平明显高于未发生远处转移的胰腺癌患者,差异具有统计学意义(P<0.05,见表3)。
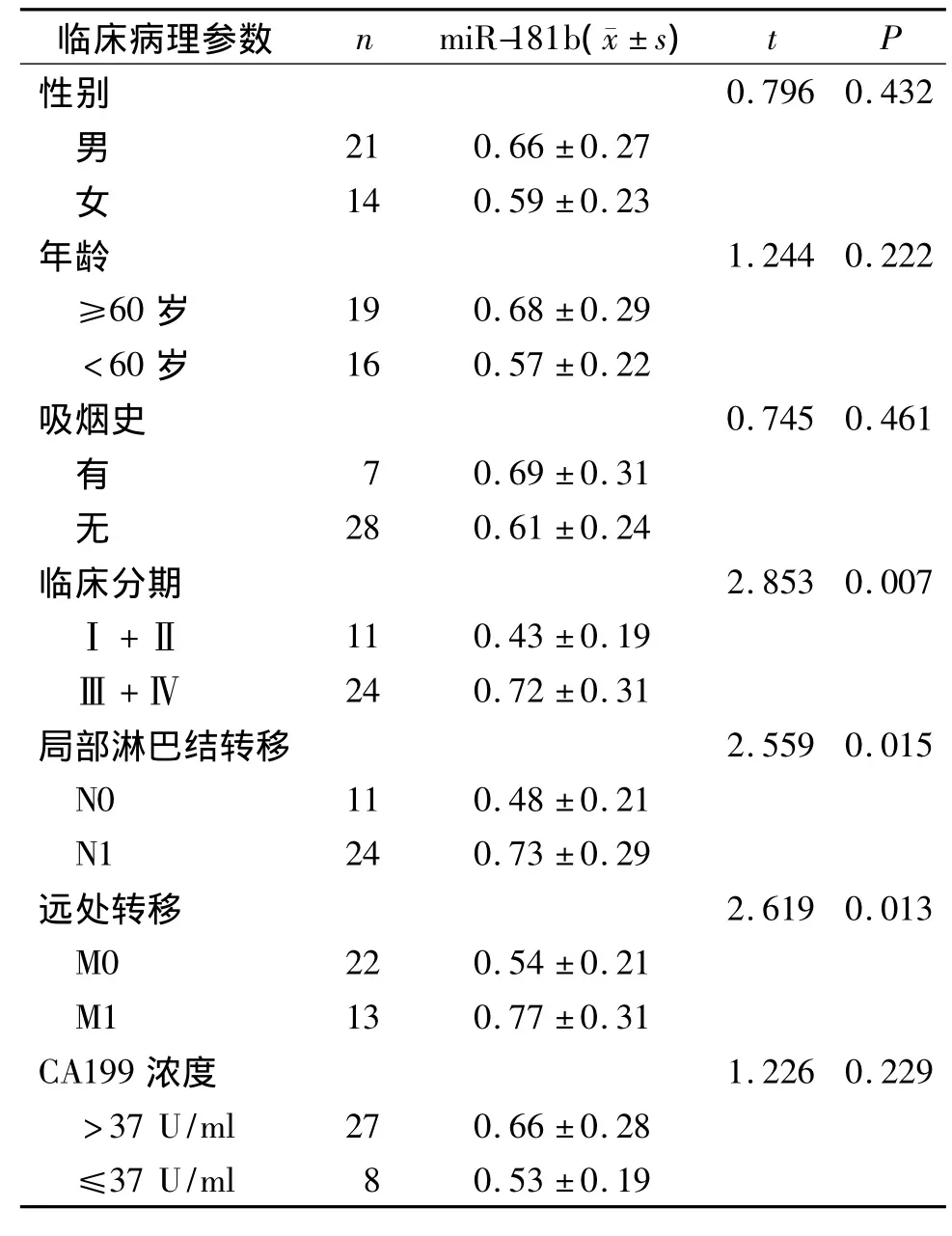
表3 血浆miR-181b水平与胰腺癌临床病理特征的关系Table 3 Relationships between the plasma levels of miR-181b and clinicopathological characteristics of pancreatic cancer
3 讨论
胰腺癌发病机制尚未完全明确,可能是多种因素长期共同作用的结果,与长期大量吸烟、饮酒、饮咖啡、糖尿病及慢性胰腺炎有关,遗传因素也可能与发病有关。胰腺癌治疗效果也不理想,死亡率很高,5年生存率<1%,目前胰腺癌诊断主要依靠临床症状和影像学检查,早期诊断非常重要。自从miRNAs被发现以来,越来越多的证据表明在许多人类肿瘤组织中miRNA较正常组织表达异常,在肿瘤的发生发展过程中发挥类似癌基因或抑癌基因的作用,与肿瘤细胞的增殖、侵袭、转移、凋亡和耐药等多种生物学过程密切相关[3-10]。
miRNA-181家族成员主要包括miR-181a、miR-181b、miR-181c和miR-181d,在心血管疾病、免疫性疾病及肿瘤疾病中发挥重要作用。miRNA-181家族发挥作用的机制也主要是通过靶mRNA的3'-UTR序列互补结合,抑制其翻译或降低其稳定性,进而达到精确调控基因表达的作用。miR-181b是近年来研究比较多的miRNA-181家族成员,在各种实体肿瘤和血液系统肿瘤中表达异常。国内学者研究发现miR-181b在胃癌组织中表达水平显著增高,提示miR-181b可能发挥促癌作用[4]。但也有学者研究发现miR-181b在胃癌组织中表达量显著下调,其靶基因为cAMP反应原件结合蛋白1(cAMP responsive element binding protein 1,CREB1)[5]。在肝癌的研究中发现4种miR-181家族成员在肝癌肝细胞中均表达上调,在肝癌的动物模型中也发现肝癌组织中miR-181b呈上调表达[6,7]。在耐药肺癌细胞株中发现miR-181b的表达水平显著低于其在非耐药肺癌细胞株中的表达水平,通过外源性转染过表达miR-181b可使耐药肺癌细胞恢复对相应药物的敏感性[8]。在胶质瘤组织中miR-181b表达显著降低,且与胶质瘤的临床分期及预后密切相关[9,10],Chen等[14]研究证实在急性髓性白血病细胞中miR-181b表达显著上调。
多种miRNA在胰腺癌中也表达异常,国外学者利用RT-PCR技术在胰腺导管内乳头状黏液瘤组织中筛选出10种高表达的miRNAs[11],多项研究发现胰腺癌组织中miR-21、miR-155、miR-21高表达,且与临床分期有关[15,16]。利用microRNA芯片研究发现与胰腺炎组织相比,miR-181b在胰腺癌组织中高表达[11]。Panarelli等[12]利用定量 RT-PCR 检测发现miR-181b在胰腺癌组织中高表达,microRNA芯片也验证了这一结果。国内学利用免疫组化检测胰腺癌组织中microRNA的表达情况,结果发现胰腺癌组织中miR-181b水平明显高于其在正常胰腺组织中的表达[13]。由于miRNA的长度较短,且在血液中与蛋白质结合在一起,在血液中可以稳定存在[17]。为了进一步研究miR-181b在胰腺癌中的作用,我们利用茎环RT-PCR方法检测了胰腺癌血浆中miR-181b水平,结果发现胰腺癌患者血浆中miR-181b水平显高于正常对照组(P<0.01),这与miR-181b在胰腺癌组织中的表达一致[11-13]。我们还分析了胰腺癌患者血浆中miR-16水平与临床病理特征之间的关系,胰腺癌患者血浆中miR-181b水平高低与患者年龄、性别、吸烟、CA199浓度均无明显相关(P>0.05),而与肿瘤分期、局部淋巴结转移及远处转移明显相关(P<0.05),提示miR-181b可能与胰腺癌的临床分期及预后有关,但这需要进一步扩大样本量,同时进行长期随访研究。
综上所述,在胰腺癌患者血浆中miR-181b的水平增高,且与肿瘤分期及远处转移有关,miR-181b可能参与胰腺癌的发生发展过程。随着对miR-181b研究的不断深入,miR-181b有可能成为胰腺癌早期诊断、临床分期及预后的新的分子标志物。
[1]Calin GA,Croce CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[2]Chou J,Shahi P,Werb Z.microRNA-mediated regulation of the tumor microenvironment[J].Cell Cycle,2013,12(20):3262-3271.
[3]Liu J,Shi W,Wu C,et al.miR-181b as a key regulator of the oncogenic process and its clinical implications in cancer(Review)[J].Biomed Rep,2014,2(1):7-11.
[4]Jiang J,Zheng X,Xu X,et al.Prognostic significance of miR-181b and miR-21 in gastric cancer patients treated with S-1/Oxaliplatin or Doxifluridine/Oxaliplatin[J].PLoS One,2011,6(8):e23271.
[5]Chen L,Yang Q,Kong WQ,et al.MicroRNA-181b targets cAMP responsive element binding protein 1 in gastric adenocarcinomas[J].IUBMB Life,2012,64(7):628-635.
[6]Ji J,Yamashita T,Budhu A,et al.Identification of microRNA-181 by genome-wide screening as a critical player in EpCAM-positive hepatic cancer stem cells[J].Hepatology,2009,50(2):472-480.
[7]Wang B,Hsu SH,Majumder S,et al.TGFbeta-mediated upregulation of hepatic miR-181b promotes hepatocarcinogenesis by targeting TIMP3[J].Oncogene,2010,29(12):1787-1797.
[8]Zhu W,Shan X,Wang T,et al.miR-181b modulates multidrug resistance by targeting BCL2 in human cancer cell lines[J].Int J Cancer,2010,127(11):2520-2529.
[9]Zhi F,Chen X,Wang S,et al.The use of hsa-miR-21,hsa-miR-181b and hsa-miR-106a as prognostic indicators of astrocytoma[J].Eur J Cancer,2010,46(9):1640-1649.
[10]Conti A,Aguennouz M,La Torre D,et al.miR-21 and 221 upregulation and miR-181b downregulation in human gradeⅡ-Ⅳastrocytic tumors[J].J Neurooncol,2009,93(3):325-332.
[11]Bloomston M,Frankel WL,Petrocca F,et al.MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J].JAMA,2007,297(17):1901-1908.
[12]Panarelli NC,Chen YT,Zhou XK,et al.MicroRNA expression aids the preoperative diagnosis of pancreatic ductal adenocarcinoma[J].Pancreas,2012,41(5):685-690.
[13]陈培勤,范钰.MicroRNAs在胰腺癌早期诊断中的应用研究[J].中国生化药物杂志,2014,34(3):52-54.
[14]Chen H,Chen Q,Fang M,et al.microRNA-181b targets MLK2 in HL-60 cells[J].Sci China Life Sci,2010,53(1):101-106.
[15]du Rieu MC,Torrisani J,Selves J,et al.MicroRNA-21 is induced early in pancreatic ductal adenocarcinoma precursor lesions[J].Clin Chem,2010,56(4):603-612.
[16]Ryu JK,Hong SM,Karikari CA,et al.Aberrant MicroRNA-155 expression is an early event in the multistep progression of pancreatic adenocarcinoma[J].Pancreatology,2010,10(1):66-73.
[17]Zen K,Zhang CY.Circulating microRNAs:a novel class of biomarkers to diagnose and monitor human cancers[J].Med Res Rev,2012,32(2):326-348.

