苦参素对实验性自身免疫性脑脊髓炎大鼠MCP-1的影响
田广平,石秋艳(秦皇岛市第二医院神经内科,秦皇岛 066600;河北联合大学附属医院神内重症室;通讯作者,E-mail:tgp 057@sohu.com)
多发性硬化(mutiple sclerosis,MS)是一种常见的中枢神经系统免疫性疾病,目前病因和发病机制不清,且无有效的治疗药物。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)的生化、免疫学、病理学改变和临床表现与多发性硬化相似,是国际公认的研究多发性硬化的经典动物模型[1,2]。苦参素具有抗炎、调节免疫等作用,本研究通过腹腔注射苦参素注射液的方法对EAE大鼠进行干预,观察EAE大鼠发病率、神经功能评分、病理学及脊髓MCP-1的变化,探讨苦参素对EAE的治疗作用及可能的机制,为其临床治疗MS提供实验依据。
1 材料和方法
1.1 实验对象与分组
6-8周龄雌性Wistar大鼠90只,体重160-200 g,豚鼠10只,体重400-500 g,雌雄各半,以上动物购自北京维通利华实验动物公司。采用随机数表将Wistar大鼠随机分为正常对照组(n=30)、EAE模型组(n=30)和苦参素治疗组(n=30)。每组取免疫后第7天、第14天、第21天3个观察时间点(相当于发病初期、高峰期及缓解期),每个时间点10只大鼠。
1.2 药品和试剂
苦参素注射液购自浙江普洛康裕天然药物有限公司;不完全福氏佐剂购自美国Sigma公司;卡介苗购自北京生物制品研究所;兔抗大鼠单核细胞趋化蛋白-1(MCP-1)多克隆抗体购自北京博奥森生物技术有限公司;二抗试剂盒及DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 EAE模型制备及药物干预
参照徐玉等[3]的方法,应用新鲜豚鼠全脊髓匀浆+完全福氏佐剂制成完全抗原,注射到模型组及苦参素治疗组大鼠四肢足垫皮下(按0.1 ml/足垫)建立EAE模型,正常对照组注射等量生理盐水。自免疫后当天起,苦参素治疗组大鼠给予腹腔注射苦参素注射液150 mg/(kg·d),EAE模型组大鼠给予腹腔注射生理盐水5 ml/(kg·d),用药持续到大鼠处死当天停用。正常对照组不给予干预。
1.4 临床神经功能评分
免疫后当天开始每天早、晚2次观察大鼠一般情况并进行神经功能评分[4]:0分,无异常表现;1分,尾部无力;2分,尾部和后肢无力;3分,后肢瘫痪;4分,双后肢严重瘫痪+前肢无力,被动翻身时不能复原;5分,全身瘫痪、濒临死亡或死亡。
1.5 标本取材
各组大鼠分别于免疫后第7,14,21天处死,取脊髓腰膨大处用4%多聚甲醛固定12 h,常规石蜡包埋,间隔50 μm间断切取6张切片,HE染色和免疫组化检测各用3张。
1.6 病理学观察
切片常规HE染色后置于100倍光镜下观察,以小血管周围呈现袖套样炎细胞浸润或超过15-20个炎细胞成簇浸润者为1个炎性病灶进行计数,每张切片随机计数5个不重叠视野,将每只大鼠15个视野炎性病灶相加后取平均数进行统计学处理。
1.7 脊髓MCP-1水平检测
应用兔抗大鼠MCP-1多克隆抗体及二抗试剂盒、DAB显色剂等对脊髓切片行免疫组化染色,在200倍光镜下观察,在白质区随机观测5个不同视野,采用Ipp6.0软件对MCP-1染色强度进行定量分析,结果用平均灰度值表示(灰度值是反映透光密度的定量指标,与蛋白表达量呈负相关,灰度值越低,蛋白表达量越多;反之亦然)。
1.8 统计学处理
2 结果
2.1 各组大鼠发病情况及神经功能评分
各组大鼠无死亡。正常对照组大鼠全程无发病,活动正常。免疫后7-9 d EAE模型组及苦参素治疗组大鼠均发病,表现为体重减轻,尾部及肢体无力、爬行缓慢等,免疫后第14 d左右症状达高峰,发病严重大鼠表现为双后肢或四肢瘫痪,总病程持续9-12 d,多在免疫后21 d缓解。EAE模型组和苦参素治疗组发病率分别为100%和47%。苦参素治疗组大鼠的发病率和发病不同时间点神经功能评分均低于EAE模型组(P<0.05,见表1)。
表1 实验各组不同时间点神经功能评分比较(±s,n=10)Table 1 Comparison of neurological scores among three groups at different time points(±s,n=10)

表1 实验各组不同时间点神经功能评分比较(±s,n=10)Table 1 Comparison of neurological scores among three groups at different time points(±s,n=10)
与正常对照组比较,△P<0.05;与EAE模型组比较,#P <0.05
组别 第7天 第14天 第21天正常对照组0.0 ±0.0 0.0 ±0.0 0.0 ±0.0 EAE 模型组 1.1 ±0.5△ 3.9 ±1.1△ 1.3 ±0.7△苦参素治疗组 0.4 ±0.5# 1.1 ±0.6# 0.6 ±0.7#
2.2 病理学观察
镜下显示正常对照组大鼠脊髓组织无炎性细胞浸润。EAE及苦参素治疗组大鼠脊髓白质中,大量炎细胞浸润在小血管周围,典型呈现的“袖套”样改变,或大量炎细胞成簇浸润(图1,见第608页)。与EAE模型组比较,苦参素治疗组的炎性病灶数量明显减少,差异有统计学意义(P<0.05,见表2)。
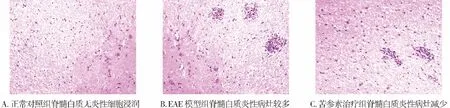
图1 实验各组第14天时脊髓白质内炎症细胞浸润情况 (HE染色,×100)Figure 1 Inflammatory cells infiltrated in spinal cord in different groups at 14 d (HE staining,×100)
表2 实验各组不同时间点炎性病灶数比较(±s,n=10)Table 2 Com parison of the number of inflammatory focus among three groups at different time points(±s,n=10)
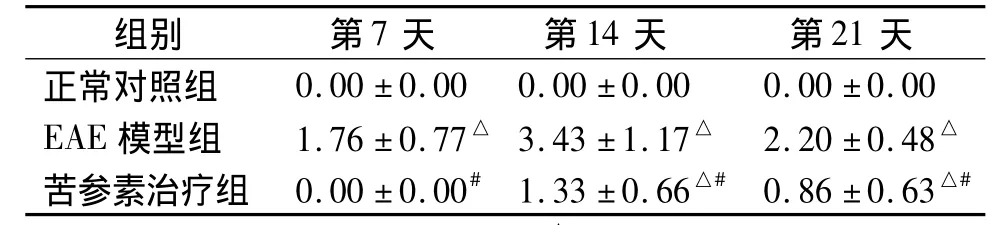
表2 实验各组不同时间点炎性病灶数比较(±s,n=10)Table 2 Com parison of the number of inflammatory focus among three groups at different time points(±s,n=10)
与同时间点正常对照组比较,△P<0.05;与同时间点EAE模型组比较,#P <0.05
组别 第7天 第14天 第21天正常对照组0.00 ±0.00 0.00 ±0.00 0.00 ±0.00 EAE 模型组 1.76 ±0.77△ 3.43 ±1.17△ 2.20 ±0.48△苦参素治疗组 0.00 ±0.00# 1.33 ±0.66△# 0.86 ±0.63△#
2.3 脊髓MCP-1水平比较
MCP-1表达阳性细胞主要为星型胶质细胞,表现为胞质着色,呈棕褐色(图2,见封3)。正常对照组大鼠脊髓内MCP-1阳性细胞少,染色较浅。与正常对照组比较,EAE模型组大鼠脊髓MCP-1灰度值在免疫后第7天时即降低,第14天时降低更加显著,第21天时升高。与同时间点EAE模型组相比,苦参素治疗组MCP-1灰度值明显升高,差异有统计学意义(P<0.05),说明苦参素治疗组MCP-1的阳性表达较EAE模型组大鼠降低(见表3)。
3 讨论
苦参素是从中药苦参、苦豆子或广豆根中提取的一种喹嗪啶类生物碱,其中氧化苦参碱的含量>98%,具有抗病毒、抗炎和抑制自身免疫反应等药理 作用[5,6]。研究发现,苦参素可以减轻EAE大鼠的症状,对EAE有明显的防治作用[7]。本研究显示与EAE模型组大鼠比较,苦参素治疗组大鼠的发病率和神经功能评分降低,脊髓病理学改变减轻,提示苦参素可以抑制EAE大鼠的炎症反应,减轻神经功能损伤的程度,促进临床症状的缓解,这一研究与国内报道相符[8]。
表3 实验各组不同时间点MCP-1平均灰度值比较(±s,n=10)Table 3 Com parison of the average gray of positive staining of MCP-1 among three groups at different time points(±s,n=10)
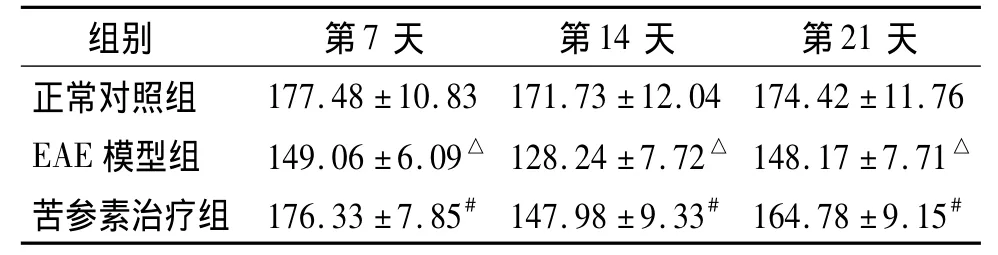
表3 实验各组不同时间点MCP-1平均灰度值比较(±s,n=10)Table 3 Com parison of the average gray of positive staining of MCP-1 among three groups at different time points(±s,n=10)
与正常对照组比较,△P<0.05;与EAE模型组比较,#P<0.05
组别 第7天 第14天 第21天正常对照组177.48 ±10.83 171.73 ±12.04 174.42 ±11.76 EAE 模型组 149.06 ±6.09△ 128.24 ±7.72△ 148.17 ±7.71△苦参素治疗组 176.33 ±7.85# 147.98 ±9.33# 164.78 ±9.15#
EAE是由抗原特异性CD4+T细胞介导的中枢神经系统自身统免疫性疾病。CD4+T细胞通过血脑屏障向中枢神经系统迁移并进一步破坏髓鞘及轴索是EAE发病的关键步骤,血脑屏障附近表达上调的一些免疫介质如趋化因子、黏附分子、金属蛋白酶等细胞因子对这一迁移过程起着重要的调控作用[8]。趋化因子通过与受体结合介导免疫细胞活化并向特定组织浸润、积聚。MCP-1由76个氨基酸组成,属于CC类趋化因子家族,主要与CC类趋化因子受体2结合,是引起单核细胞、巨噬细胞及活化淋巴细胞聚集的重要的趋化因子[10]。MCP-1在EAE中的表达水平明显升高,并且与EAE的临床症状密切相关[11]。研究发现在EAE小鼠中枢神经系统MCP-1的表达水平和动态变化与临床表现一致,提示 MCP-1是 EAE 发病中关键的致炎因子[12,13]。本研究发现,在发病初期,EAE大鼠脊髓MCP-1的表达上调,在症状高峰期MCP-1表达水平升高更加明显,缓解期下降。经苦参素干预后 EAE大鼠MCP-1表达水平明显下降,提示苦参素可以降低EAE大鼠MCP-1的表达,抑制中枢神经系统内的炎症反应。
本研究证实,苦参素可以降低EAE的发病率,减轻脊髓内炎症反应,从而缓解EAE的临床症状。苦参素对EAE的治疗作用可能与其下调EAE大鼠脊髓内MCP-1的表达水平有关。
[1]Petry KG,Boullerne AI,Pousset F,et al.Experimental allergic encephalomyelitis animal models for analyzing features of multiple sclerosis[J].Pathol Biol(Paris),2000,48(1):47-53.
[2]Herrero-Herranz E,Pardo LA,Gold R,et al.Pattern of axonal injury in murine myelin oligodendrocyte glycoprotein induced experimental autoimmune encephalomyelitis:implications for multiple sclerosis[J].Neurobiol Dis,2008,30(2):162-173.
[3]徐玉,刘瑞春,王颖,等.Wistar大鼠实验性自身免疫性脑脊髓炎模型的建立[J].脑与神经疾病杂志,2007,15(6):415-417.
[4]Nath N,Giri S,Prasad R,et al.Potential target s of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor for multiple sclerosis therapy[J].J Immunol,2004,172(2):1273-1286.
[5]Cheng H,Xia B,Zhang L,et al.Matrine improves 2,4,6-trinitrobenzene sulfonic acid-induced colitis in mice[J].Pharmacol Res,2006,53(3):202-208.
[6]Li T,Wong VK,Yi XQ,et al.Matrine induces cell anergy in human Jurkat T cells through Modulation of mitogen-activated protein kinases and nuclear factor of activated T-cells signaling with concomitant up-regulation of anergy-associated genes expression[J].Biol Pharm Bull,2010,33(1):40-46.
[7]Kan QC,Zhang S,Xu YM,et al.Matrine regulates glutamate-related excitotoxic factors in experimental autoimmune encephalomyelitis[J].Neurosci Lett,2014,560:92-97.
[8]郭小彬,阚全程,宋一帆,等.苦参素对大鼠实验性自身免疫性脑脊髓炎的防治作用[J].山东医药,2010,50(5):30-31.
[9]Levin MC,Lee SM,Kalume F,et al.Autoimmunity due to molecular mimicry as a cause of neurological disease[J].Nat Med,2002,8(5):509-513.
[10]Banisor I,Leist TP,Kalman B.Involvement of β-chemokines in the development of inflammatory demyelination[J].J Neuroinflammation,2005,2(1):7-22.
[11]Juedes AE,Hjelmstrom P,Bergman CM,et al.Kinetics and cellular origin of cytokines in the central nervous system:insight into mechanisms of myelin oligodendrocyte glycoprotein induced experimental autoimmune encephalo myelitis[J].J Immunol,2000,164(1):419-426.
[12]周文斌,刘晓英,肖波,等.趋化因子MCP-1mRNA在实验性自身免疫性脑脊髓炎中的表达及IFN-β1b的影响[J].中国神经免疫学和神经病学杂志,2003,10(3):166-170.
[13]徐全刚,王晓辉,田书娟,等.趋化因子MCP-1、MIP-1α在EAE小鼠脊髓中的表达[J].脑与神经疾病杂志,2007,15(3):216-218.

