传统奶豆腐中产胞外多糖乳酸菌的分离筛选及其潜在益生菌特性
杨亚威,赵爱梅,王辑,杨贞耐
(北京工商大学 食品质量与安全北京实验室,北京100048)
0 引言
乳酸菌(LAB)是一类可以利用碳水化合物发酵产生大量乳酸的细菌的总称。一些乳酸菌在发酵过程中能产生有利于人体健康的生理活性物质胞外多糖[1-7]乳酸菌胞外多糖作为生物大分子,能够改善发酵乳的流变学特性,增强产品的稳定性和持水能力,并赋予产品良好的口感和风味[2]。
传统内蒙古奶豆腐是采用新鲜牛奶或羊奶经乳酸菌的天然发酵而制成的具有独特风味的一类乳制品。自然发酵奶豆腐中蕴藏着许多具有优良特性的乳酸菌,为乳酸菌的研究开发提供了宝贵的资源。
本研究从内蒙古不同地区采集奶豆腐样品,对其中的乳酸菌进行分离鉴定,筛选具有优良功能特性的菌株,重点对产胞外多糖菌株的潜在益生菌特性进行研究,以期获得具有潜在应用价值的功能性乳酸菌菌株。
1 实验
1.1 材料与试剂
内蒙古不同地区牧民自制的奶豆腐样品;鼠李糖乳杆菌GG,由作者所在实验室保藏;牛胆盐、胆固醇、胃蛋白酶,氢氧化钾,国药集团;正己烷、冰醋酸、浓硫酸,蛋白酶K,PCR反应所需相关试剂,乳酸菌16S rDNA通用引物。
1.2 仪器与设备
高压蒸汽灭菌器(MLS-3750),立式高速冷冻离心机(CR21GⅢ),紫外可见分光光度计(U-3900),数显pH 计,正置荧光显微镜(BX53F),PCR仪(T100TM Thermal Cycler)。
1.3 培养基
SDM液体培养基:胰蛋白胨10 g,酵母氮源6.7 g,磷酸氢二钾2 g,无水乙酸钠5 g,柠檬酸钠5 g,七水硫酸镁0.2 g,硫酸锰0.05 g,葡萄糖20 g,吐温-80(聚氧乙烯油酸基脱水山梨酸)1 mL,加水至1 000 mL,浓度为1 mol/L乙酸调pH=6.6。
MRS液体培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母浸粉5 g,无水乙酸钠5 g,柠檬酸钠5 g,磷酸氢二钠2 g,吐温80 1 mL,七水硫酸镁0.5 g,硫酸锰0.05 g,加水至1 000 mL,浓度为1 mol/L乙酸调pH=6.6。
耐酸试验培养基:用浓度为1 mol/L的盐酸将MRS液体培养基的pH值调至2.5,115℃灭菌15 min。
耐胆盐试验培养基:配制胆盐质量分数为1.0%的MRS液体培养基,115℃灭菌15 min。
1.4 方法
1.4.1 菌株的分离鉴定及系统发育树的构建
称取1 g内蒙古奶豆腐样品,加入99 mL无菌PBS缓冲液(pH=6.5)中,充分振荡混匀后,稀释到10-4和10-5,取100 μL稀释液涂布于MRS琼脂平板上,置于37℃厌氧培养24~72 h,挑取典型单菌落,划线分离纯化。
提取菌株的基因组DNA进行片段扩增:采用乳酸菌16S rDNA基因的通用引物,正向引物:A27F 5'-AGCGGATCACTTCACACAGGACTACGGC TACCTTGTTACGA-3',反向引物:A1495R 3'-GCAGAGTTCTCGGAGTCACGAAGAGTTTATCCTGGCTCAG-5',1.5%琼脂糖凝胶电泳,目标片段长度约1 500 bp。PCR产物委托北京鼎国生物有限公司进行测序,将测序结果与NCBI数据库中的核酸序列进行比对。
将所测菌株的16S rDNA序列用Blast软件在GenBank数据库中进行相似性比较,选取同源性较高的相关菌株的16S rDNA区域序列作为参比对象,采用MEGA5.0软件构建系统发育树。
1.4.2 产胞外多糖乳酸菌的筛选
(1)胞外多糖标准曲线的绘制。葡萄糖标准曲线的绘制参照Dubois等[3]的方法
(2)胞外多糖产量的测定。将活化好的菌株按2%接种于灭菌的SDM培养基中,置37℃培养18 h,然后于100℃水浴加热15 min以灭活可能存在的降解多糖的酶类[4]。
胞外多糖的提取参照RIMADA[5]等的方法,往灭酶冷却的发酵液中加入质量浓度为800 g/L的三氯乙酸溶液至终质量浓度为40 g/L,室温下搅拌2 h。在10 000 r/min下离心45 min去除细胞和蛋白。取上清液并加入两倍体积的无水乙醇,4℃冷藏静置12 h后10 000 r/min离心30 min,沉淀用蒸馏水溶解,再加两倍体积无水乙醇,4℃静置12 h后于10 000 r/min离心30 min,沉淀用蒸馏水溶解,装入分子截流量为8 000~14 000的透析袋中透析24 h,每8 h换一次水。
1.4.3 菌株在模拟人工胃液中的耐受性测定
活化好的菌株按体积分数2%接种于pH值调至2.5的MRS液体培养基中;以MRS培养基(pH=6.6)为空白。在培养的第0,1,3 h时取出,用质量分数为0.9%的灭菌生理盐水进行梯度稀释,并于MRS平板上涂布,每个稀释梯度做3个平行样,37℃培养48 h后计数。
存活率=Nt/N0×100%,
式中:N0和Nt分别为经pH值为2.5的MRS液体培养基处理0和t小时后的活菌数(N0和Nt均为对数值)。
1.4.4 菌株对高浓度胆盐的耐受性测定
将活化好的菌液按体积分数2%接种于胆盐质量分数为0.5%的MRS培养基中,以未添加胆盐的MRS培养基为空白。在培养的第0,2,4 h时取出,用质量分数为0.9%的灭菌生理盐水进行梯度稀释,并于MRS平板上涂布,每个稀释梯度做3个平行样,37℃培养48 h后计数。
存活率=Nt/N0×100%,
式中:Nt为含牛胆盐MRS培养基处理t小时后活菌数;N0为含牛胆盐MRS培养基处理0小时后活菌数(N0和Nt均为对数值)。
1.4.5 菌株疏水性测定
参照WANG等的方法[6],将待测菌液于4℃、10 000 g下离心5 min,收集菌体,用灭菌的PBS缓冲液(pH=7.2)洗涤两次,以缓冲液作为调零液,用PBS调整菌体浓度使其在560 nm下吸光度为1.00。然后取3 mL吸光度为1.00的菌液,分别加入0.6 mL的十六烷和甲苯,漩涡震荡使其充分混合,待其静置分层后取下层水相测定其在560 nm下测吸光度。疏水率计算公式为疏水率=(A0-A)/A×100%,
式中:A0为菌液与吸附剂混匀前的吸光度;A为菌液与吸附剂混匀后的吸光度。
1.4.6 菌株的体外降胆固醇能力测定
将待测菌株依次传代活化3代后使其恢复活力,按体积分数为3%接种于含有质量浓度约100 μg/mL胆固醇的MRS-THIO培养基中,37℃恒温培养24 h后,采用邻苯二甲醛比色法[7]测定培养基中残留胆固醇质量浓度。
将培养后的菌液离心(6 000 g,4 ℃,10 min),取上清液0.5 mL于18 mm×18 cm试管中,依次加入3 mL体积分数为95%的乙醇和2 mL质量浓度为0.5 g/mL的氢氧化钾溶液,漩涡震荡混匀后置于60℃水浴中皂化10 min,迅速冷却后加入5 mL正己烷,漩涡震荡1 min进行萃取,静置10 min后加入3 mL水,重复震荡1 min后在室温下静置10 min,待分层后取2.5 mL正己烷层于15 mm×15 cm试管中,置于60℃水浴中用氮气吹干溶剂,加入4 mL邻苯二甲醛显色剂,漩涡震荡1 min后静置10 min,加入2 mL浓硫酸震荡1 min,室温下静置10 min后于550 nm处测吸光度,以不加菌株的含胆固醇培养基为空白对照,计算其胆固醇移除率(实验重复3次),即胆固醇移除率=(A0-A1)/A0×100%,式中:A0为未接菌的MRS-THIO液体培养基在550 mm处的吸光度;A1为发酵上清液在550 mm处的吸光度。
1.4.7 菌株的抑菌活性测定
采用改进的Hechard等[8]的琼脂平板扩散法。选取4株常见的致病菌:金黄色葡萄球菌CMCC26071、大肠杆菌CMCC44825、福氏志贺氏菌CMCC51061和鼠伤寒沙门氏菌CMCC50115,分别接种到适宜的琼脂培养基上,无菌条件下放置5 h。待琼脂板凝固后用直径为8 mm的牛津杯在琼脂培养基上打孔。将活化好的菌液,经1 000 g、4℃离心10 min,收集上清液备用。为了排除过氧化氢以及乳酸的干扰,上清液应经微孔滤膜过滤后再调pH6.0,同时添加无菌的过氧化氢酶(1 000 U/L)。取处理过的上清液50 μL加入到琼脂板上的孔中,然后放到适宜条件下培养48 h。用直尺测量抑菌圈的直径。抑菌效果按以下标准评定:当无抑菌圈时,代表无抑制作用(-);当抑菌圈直径在0~3 mm之间,代表抑菌效果弱(+);当抑菌圈直径在3~6 mm之间,代表抑菌效果良好(++);当抑菌圈直径大于6 mm,代表抑菌效果强(+++)[9]。
1.4.8 菌株的抗生素药敏性测定
采用改进的Charteris等[10]的方法。选用8种抗生素:青霉素、氯霉素、硫酸链霉素、硫酸庆大霉素、硫酸卡那霉素、盐酸万古霉素、头孢噻肟和利福平。将活化好的菌株按体积分数3%接种到MRS液体培养基中,37 ℃培养至对数期(106~107mL-1)。取50 μL菌液到MRS琼脂培养基平板上,涂布均匀,无菌条件下室温放置1 h。待平板凝固后将抗生素药敏纸片放至平板上,37℃培养24 h。抗生素的药敏性参照WHO提供的NCCLS最新版本的标准进行。
2 结果与讨论
2.1 奶豆腐中乳酸菌的分离鉴定
从15个内蒙古奶豆腐样品中共分离得到51株革兰氏染色阳性、过氧化氢酶阴性的菌株。对各菌株经过DNA提取,16S rDNA PCR扩增,并进行琼脂糖凝胶电泳,获得片段长度在1 500 bp左右的特异性条带。将获得的特异性片段纯化后进行测序,测序结果用Blast进行序列同源性比对,采用16S rDNA序列分析的方法鉴定,鉴定结果如表1所示。
由表1可以看出,从奶豆腐中分离得到的51株乳酸菌包括植物乳杆菌13株(占25.49%),发酵乳杆菌9株,鼠李糖乳杆菌8株,乳酸片球菌7株,戊糖片球菌6株,融合魏斯氏菌4株,粪肠球菌2株,瑞士乳杆菌1株和副干酪乳杆菌1株。采用MEGA5.0软件,选取本研究部分代表性菌株绘制系统发育树,如图1所示,这些菌株与对应NCBI上公布的菌株之间具有良好的亲缘关系,进一步佐证了上述鉴定结果。由此可见,奶豆腐中乳酸菌种类丰富,数量繁多,其中以乳杆菌为优势菌株。周雨霞[11]对内蒙古地区传统发酵乳制品中乳酸菌进行了分离鉴定,认为植物乳杆菌是该地区乳制品中的优势菌,与本文研究结果一致。
2.2 产胞外多糖乳酸菌的筛选

表1 奶豆腐中乳酸菌菌株鉴定结果
用苯酚-硫酸法绘制葡萄糖标准曲线,公式为
Y=0.0087X+0.0232,R2=0.9994,
式中:Y为波长为490 nm处的吸光度A,X为溶液中胞外多糖质量浓度。多糖产量质量浓度在0到220 mg/L范围内线性关系良好。本研究选取了SDM[12]培养基来检测乳酸菌代谢产生胞外多糖的情况。其中SDM培养基为改良的MRS培养基,去除了牛肉膏、蛋白胨等复杂成分的干扰。胞外多糖含量为样品含糖量减去空白培养基的背景干扰值[13]。
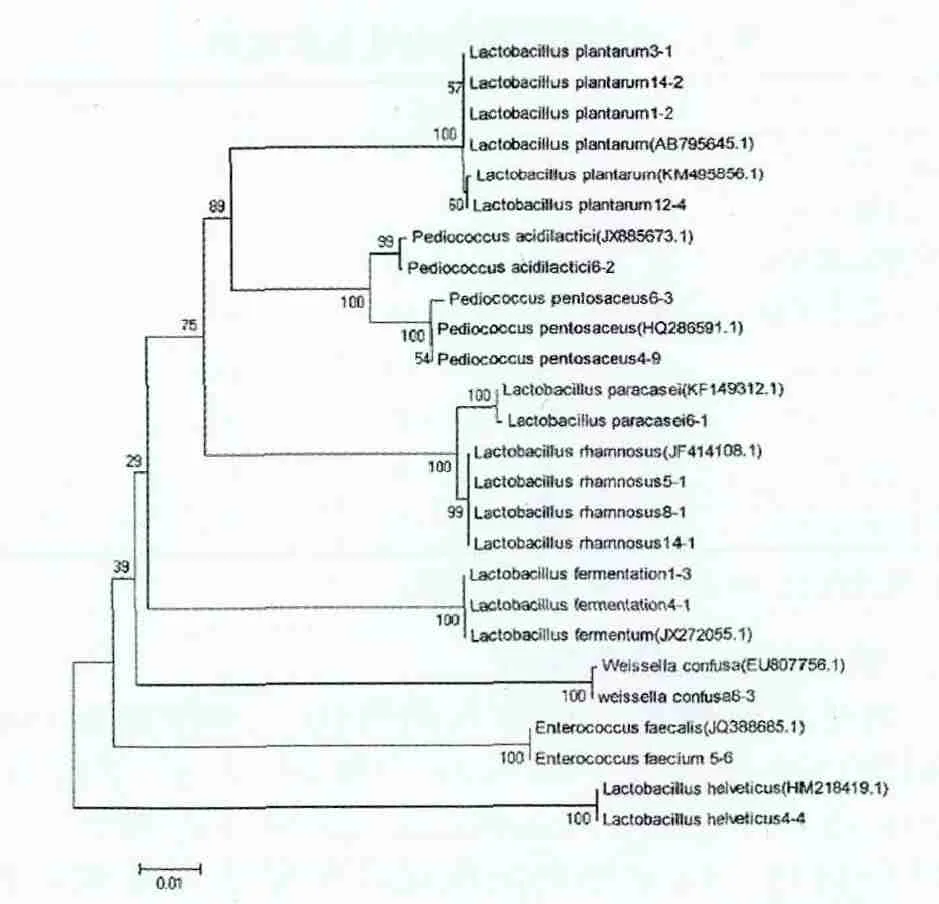
图1 基于16SrRNA基因序列建立的系统发育树
对奶豆腐样品中分离得到的51株乳酸菌在SDM培养基中的产胞外多糖情况进行了测定,结果表明,植物乳酸杆菌1-2、3-1、12-4和副干酪乳杆菌6-1在SDM培养基中的胞外多糖产量分别为31.27,15.04,22.02和24.10 mg/L,明显高于对照益生性鼠李糖乳杆菌菌株GG的胞外多糖产量(7.62 mg/L)。鉴定结果表明编号为1-2、3-1和12-4的菌株为植物乳杆菌(GenBank登录号分别为AB795645.1,EU419598.1和KM495856.2),编号为6-1的菌株为副干酪乳杆菌(GenBank登录号KF149312.1)。本研究以下实验对上述4株乳酸菌进行了潜在益生菌特性的分析测定,以鼠李糖乳杆菌GG作为对照菌株。
2.3 菌株在模拟人工胃液中的耐受性
益生菌通常是以食物携带或以制剂形式口服进入人体消化系统。然而,人体消化道系统不断分泌胃液的酸性环境构成了阻止大多数微生物进入肠道的天然屏障。人体空腹时胃液pH值一般在1.3~1.8之间,进食后上升到3.0左右或更高,食物在胃中需停留约3 h。因此,经口腔摄入的益生菌必须耐受胃液的酸性环境、肠道的胆盐环境和厌氧环境,并定植于肠道中,才能有效地在人体内发挥其益生作用[14]。图2为植物乳杆菌1-2、3-1和12-4和副干酪乳杆菌6-1对模拟人工胃液(pH=2.5)表现出不同程度的耐受性。在培养时间为1 h时,对照菌株鼠李糖乳杆菌GG的存活率为93.45%,而植物乳杆菌菌株1-2、3-1和12-4的存活率也均大于90%,副干酪乳杆菌6-1的存活率约80%。在模拟人工胃液中培养3 h后,各菌株的存活率明显下降,鼠李糖乳杆菌GG存活率为51.62%,植物乳杆菌1-2和3-1的存活率达到65%以上,而植物乳杆菌12-4和副干酪乳杆菌6-1的存活率较低,约为47%。

图2 乳酸菌菌株在模拟人工胃液中的耐受性
2.4 菌株对高浓度胆盐的耐受性
正常人体小肠中胆盐质量分数为0.03%~0.3%,经口腔摄入的活性乳酸菌必须有一定的胆盐耐受能力才能定植于小肠发挥其有益于人体健康的作用[15]。据报道,小肠是人体吸收胆固醇的重要场所,同时也是乳酸菌发挥其降胆固醇作用的主要部位[16]。由图3可以看出,各菌株在胆盐(0.5%)中的生长受到了不同程度的抑制。植物乳杆菌1-2、3-1和副干酪乳杆菌6-1对胆盐的耐受性较强,培养4h后菌株的存活率达到90%以上,高于植物乳杆菌12-4(低于70%)和对照菌鼠李糖乳杆菌GG(低于80%)。据Cotter等[17]报道,乳酸菌必须以活性状态能够耐受胃液的酸性环境和胆盐的抑制作用,才能顺利到达肠道,因此同时具备较好的耐酸和耐胆盐特性是益生菌的前提条件。本研究中,植物乳杆菌1-2和3-1的耐酸和耐胆盐特性相对较强。
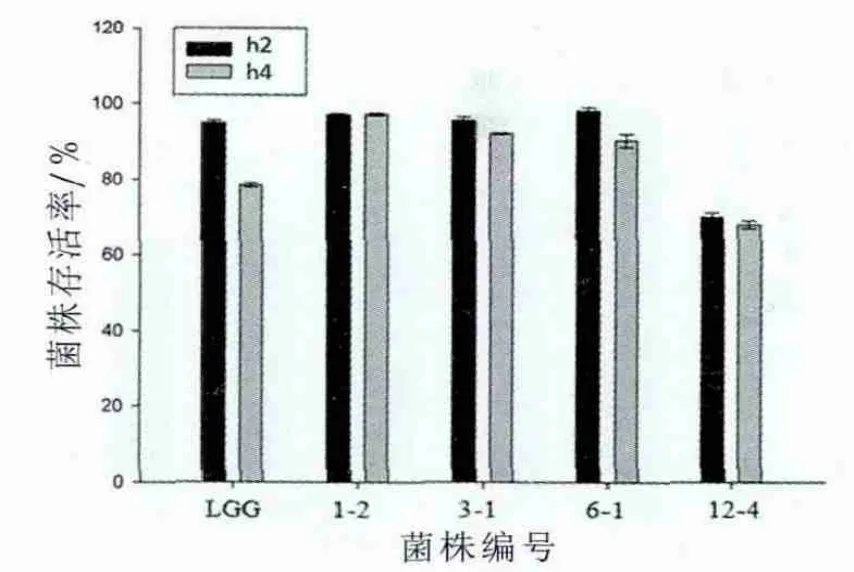
图3 不同胆盐质量分数下乳酸菌菌株的生长情况
2.5 菌株的疏水性
益生菌必须能够有效地粘附于肠道粘膜并形成稳定的生物屏障,才能抑制病原菌的入侵和增殖[18]。乳酸菌的疏水作用是乳酸菌与宿主之间相互作用的因素之一,与多种生物黏附现象有关,如组织表面的粘附、细菌间的集聚等[19]。本研究对各菌株的疏水性测定结果如图4所示。对照菌鼠李糖乳杆菌GG对甲苯和十六烷的疏水率分别为19.47和15.68%,高于实验菌株。而植物乳杆菌1-2的疏水性优于其他3株受试菌,其对甲苯和十六烷的疏水率分别为15.07%和14.03%。赵维俊[20]等研究发现,菌株的黏附特性与疏水性成正相关,疏水性高的菌株更有利于定植于肠道内。本实验筛选出的植物乳杆菌1-2具有较好的疏水性,有利于其黏附定植于肠道。
2.6 菌株的体外降胆固醇能力
血清胆固醇水平偏高易引起心脑血管疾病,虽然使用药物可有效地降低胆固醇含量,但是同时具有一定的副作用,如横纹肌溶解、肝功能损害以及使人嗜睡、恶心呕吐等[21]。有研究表明,服用乳酸菌及其相关制品可以有效地减少人体血清中胆固醇的含量。WANG等[22]和ZHANG等[23]分别从西藏灵菇中分离出植物乳杆菌菌株MA2和菌株K25,通过体内实验发现,2株植物乳杆菌均具有一定的降低小鼠体内胆固醇的能力。
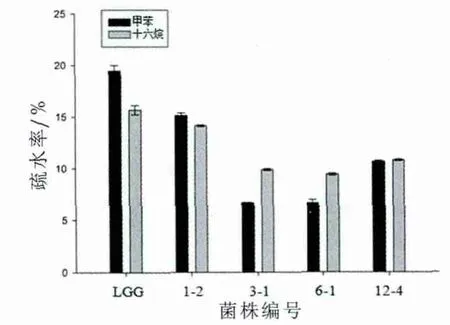
图4 乳酸菌菌株的疏水性比较
由图5中可以看出,本研究的4株乳酸菌均具有不同程度的体外降低胆固醇的能力。植物乳杆菌1-2的胆固醇降解率为44.33%。高于其他3株菌(降解率30%以上),但低于对照菌株鼠李糖乳杆菌LGG(降解率56%)。
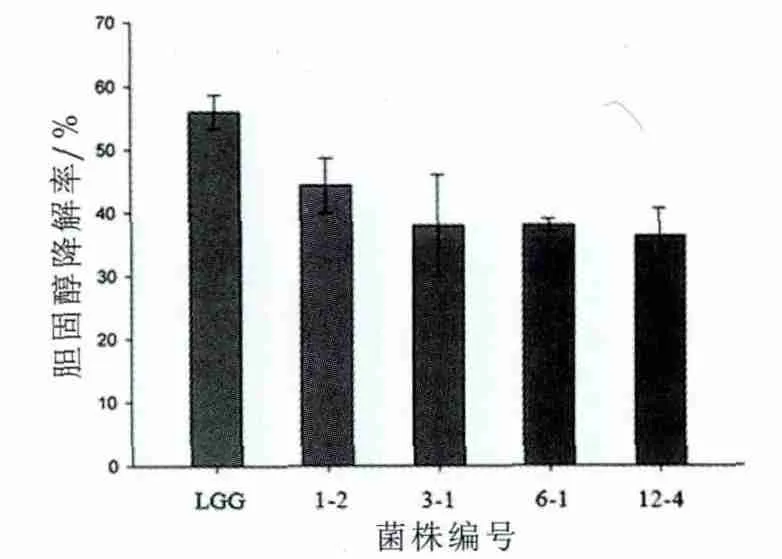
图5 乳酸菌菌株对培养基中胆固醇的移除率
2.7 菌株的抑菌活性
乳酸菌在代谢过程中能产生各种具有抑菌活性的成分,如有机酸、过氧化氢和细菌素等,这些代谢产物通过抑制胃肠道中的有害菌,如大肠杆菌、沙门氏菌等,可以改善胃肠道的微生态环境[24,25]。
由表2可知,本研究的4株乳酸菌对病原菌具有不同的抑制效果。4株受试菌株及对照菌株鼠李糖乳杆菌GG都对沙门氏菌和志贺氏菌具有较好的抑制作用,植物乳杆菌3-1和12-4还对大肠杆菌具有明显的抑制作用。韩省等[26]从自酿酸奶中筛选出一株具有高抑菌活性的乳杆菌,其对大肠杆菌和金黄色葡萄球菌具有良好的抑菌效果。

表2 乳酸菌菌株的抑菌作用
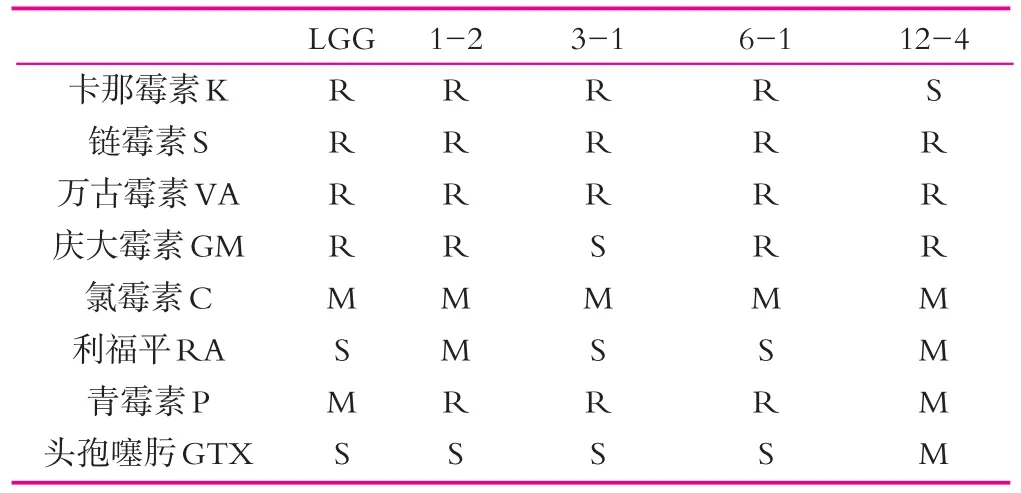
表3 乳酸菌菌株的抗生素药敏性
2.8 菌株的抗生素敏感性
抗生素药敏性一般分为耐药(R)、中度敏感(M)和敏感(S)3个等级。据Miller[27]和Simpson[28]等报道,Lactobacilli、Pediococci和 Leuconostoc spp.对万古霉素具有天然的抗性。Essid等利用琼脂片扩散法对分离自腌肉中的17株植物乳杆菌进行了药敏性分析,结果表明,所有菌株均对诺氟沙星、庆大霉素、卡那霉素、头孢呋辛和硫酸链霉素敏感,但对四环素具有耐药性。由表3可知,本研究的4株乳酸菌对不同抗生素具有不同程度的耐药性。4株乳酸菌对链霉素和万古霉素都表现为耐药,对卡那霉素、庆大霉素和青霉素的耐受性较好。而对于氯霉素、利福平和头孢噻肟较为敏感。植物乳杆菌1-2和副干酪乳杆菌6-1可以耐受5种抗生素,而植物乳杆菌12-4可以耐受3种抗生素。
3 结论
本研究从内蒙古奶豆腐中分离出51株乳酸菌,经16S rDNA鉴定和菌株产胞外多糖情况分析,其中乳杆菌32株,有4株乳杆菌产胞外多糖,即植物乳杆菌菌株1-2、3-1和12-4以及副干酪乳杆菌6-1。对这些产胞外多糖菌株进行了模拟人工胃液耐受性、胆盐耐受性、疏水性、体外降胆固醇、抗生素耐受性和过氧化氢耐受性的测定分析,植物乳杆菌菌株1-2和12-4具有良好的潜在益生菌特性,可应用于功能性产品的研究开发。
[1]孙宝国,曹雁平,李健,等.食品科学研究前沿动态[J].食品科学技术学报,2014,32(2):1—11
[2]RUAS-MADIEDOP,AL TINGAC,ZOONP.Effect of exopolysaccharides and proteolytic activity of Lactococcus lactis subsp.cremoris strains on the viscosity and structure of fermented milks[J].International Dairy Journal,2005,15:155-164.
[3]DUBOIS M,GILLES K A,HAMILTOM H K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[4]RIMADAPS,ABRAHAMAG.Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey[J].Lait,2003,83(1):79-87.
[5]RIMADA P S,ABRAHAM A G.Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey[J].Lait,2003,83(1):79-87.
[6]WANG Y C,YU R C,CHOU C C.Antioxidative activities of soymilks fermented with lactic acid bacteria and bifidobacteria[J].Food Microbiology,2006,23(2):128-135.
[7]GILLILAND S E,NELSON C R,MAXWELL C.Assimilation of eholesterol by Laetobaeillus aeidophilus[J].Applied and Environmental Microbiology,1985,49(2):377-381.
[8]HECHARDY,DHERBOMEZM,CENATIEMPO Y.et al.Antagonism of lactic acid bacteria from goat's milk agains pathogenic strains acessed by sandwich method.Lett.Appl.Microbiol,v.11,p.185-188,1990.
[9]PAN XIAO DONG,CHEN FE QIN,WU TIAN-XING,et al.The acid,bile tolerance and antimicrobial property of Lactobacillus acidophilus NIT[J].Food Control,2009,20:598-602
[10]CHARTERIS W P,KELLY P M,MORELLI L,et al.Antibiotic Susceptibility of Potentially Probiotic Lactobacillus Species[J].Food Prot,1998,61:1636-1643.
[11]周雨霞.内蒙古牧区传统乳制品中乳杆菌生物学特性及其益生作用的研究[D].呼和浩特:内蒙古农业大学,2005.
[12]KIMMEL S A,ROBERTS R F.Development of a growth medium suitable for exopolysaccharide production by Lactobacillus delbrueckiissp.bulgaricus RR[J].International Journal of Food Microbiology 1998,40(1/2):87-92.
[13]RIMADAP S,ABRAHAMAG.Comparative study of different methodologies to determine the exopolysaccharide produced by kefir grains in milk and whey[J].Lait,2003,83(1):79-87.
[14]王玉华,高晶,冯印,等.鼠李糖乳杆菌耐酸及胆盐能力研究[J].食品科学,2008,29(12):449-451.
[15]GILL ILAND S E,STALEY T E,BUSH L J.Importance in bile tolerance of Lactobacillus acidophilus used as diatery adjunct[J].J Dairy Sci,1984,67:3045-3051.
[16]刘长建,刘秋,姜波.类植物乳杆菌的耐酸、耐胆盐及降解胆固醇特性[J].微生物学报 49(9):1176-1179.
[17]COTTER P D,HILL C.Surviving the acid test:Responses of gram positive bacteria to low pH[J].Microbiol Mol Bio Rev,2003,67:429-453.
[18]郭兴华.益生菌基础与临床[M].北京科学技术出版社,20021361.
[19]JONES D S,GORMAN S P,Mc CAFFERTY D F,et aL The effects of three non-antibiotic,antimicrobial agents on the surface hydrophobicity of certain micro-organisms evaluated by different methods[J].Applied Microbiology,1991,71:218-227.
[20]赵维俊,吕嘉枥,马强,等.嗜酸乳杆菌的表面疏水性分析[J].乳品工业,2011,39(10):8-11.
[21]MASON W F CHRISTINE J.The Harvard Medical School Guide to Lowering Your Cholesterol[M].侯米莎等,译.北京:中国妇女出版社,2006:100-10.
[22]WANG YAN PING,XU NV,XI AO-DENG,et al.Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet[J].Applied Microbiology and Biotechnology,2009,84(2):341-347.
[23]ZHANG LI,ZHANG XUE,LIU CHUN HONG,et al.Manufacture of Cheddar cheese using probiotic Lactobacillus plantarum K25 and its cholesterol-lowering effects in a mice model[J].World Journal of Microbiology and Biotechnology,2013,29(1):127-135.
[24]GULAHMADOV S G,ABDULLAEVA N F,GUSEINOVA N F,et al.Isolation and characterization of bacterio cinlike inhibitory Substances from lactic acid bacteria isolated from azerbaijan Cheeses[J].Applied Biochemistry and Microbiology,2009,45:266-271.
[25]郭本恒.益生菌[M].北京:化学工业出版社,2004:5-120.
[26]韩省,冯书珍.高抑菌活性乳酸杆菌的筛选及性质[J].生物加工过程,2011,9(2):45-48.
[27]HAMILTON-MILLER J M T,SHAH S.Vancomycin susceptibility as an aid to the identification of lactobacilli[J].Letters in Applied Microbiology,1998,26(2):153-154.
[28]SIMPSON W J,HAMMOND J R M,MILLER R B.Avoparcin and vancomycin:useful antibiotics for the isolation of brewery lactic acid bacteria[J].Journal of Applied Microbiology,1988,64(4):299-309.

