不同乳酸菌抗氧化能力的比较与分析
刘少敏 ,周文琦,李婷,满朝新,郭鸰,姜毓君,
(东北农业大学a.食品学院乳品科学教育部重点实验室;b.黑龙江省乳品工业技术开发中心,哈尔滨150030)
0 引言
氧化应激是导致机体衰老和与衰老相关疾病的根本原因[1,2],不仅如此,它还可能引起多种疾病,如动脉粥样硬化、高血脂、糖尿病、关节炎、神经退行性疾病、心脑血管疾病等[3,4]。因此,对氧化应激的防治成为近年来的研究热点。大量研究表明,乳酸菌具有多种益生功能,不仅能够调节机体的免疫系统,维持肠道菌群平衡,还具有一定的抗氧化能力,能够清除肠道内的活性氧分子,使机体内活性氧分子保持在相对稳定的状态[5-7]。
本研究选取三株乳酸菌作为研究对象,分别是目前研究最为广泛的嗜酸乳杆菌NCFM(Lactobacillus aci⁃dophilus NCFM)、植物乳杆菌植物亚种模式菌株——植 物 乳 杆 菌 ATCC 14917(Lactobacillus plantarum ATCC 14917)、从内蒙古通辽地区传统发酵乳制品中分离而来、具有多种益生功能的植物乳杆菌NDC 75017(Lactobacillus plantarum NDC 75017),对三株乳酸菌清除自由基的能力进行了比较,并分析和比较其对受到氧化损伤的Caco-2细胞胞内抗氧化酶活性的影响,初步探究了乳酸菌抗氧化作用的机制。
1 材料与方法
1.1 菌株与培养
菌株来源:嗜酸乳杆菌NCFM、植物乳杆菌ATCC 14917、植物乳杆菌NDC 75017均为东北农业大学乳品科学教育部重点实验室保藏菌株。
三株乳酸菌均培养于MRS培养基,37℃培养12 h,传3代后即为实验菌株。6 000 r/min,4℃离心10 min,收集上清液即为实验所需发酵液;离心后的菌体用无菌PBS洗涤三次,6 000 r/min,4℃离心10 min,即为实验所需菌体;将菌体在沸水浴中处理20 min,无菌PBS洗涤3次,6 000 r/min,4 ℃离心10 min,即为灭活菌体。
1.2 细胞培养
Caco-2细胞购自于中国科学院上海生命科学研究院细胞资源中心。Caco-2细胞培养于含10%胎牛血清、100 U/mL青霉素、质量浓度100 μg/mL链霉素,质量分数1%非必需氨基酸的高糖DMEM培养液中,在37℃质量分数为5%的CO2条件下培养。
1.3 清除自由基实验
1.3.1 羟自由基清除实验[8]
将1 mL的邻二氮菲(浓度0.75 mmol/L)、2 mL的PBS(pH=7.4)和1mL的FeSO4(浓度0.75 mmol/L)混合均匀,加入1 mL的H2O2(质量分数0.12%)后分别加入三株乳酸菌菌液及其发酵液,混合均匀后37℃静置孵育90 min,在536 nm处测量吸光值。
羟自由基清除活性=(As-Ac)/(Ab-Ac)×100%,
式中:As为样品组吸光值;Ac为对照组吸光值(包括邻二氮菲、PBS、FeSO4和H2O2);Ab为空白组吸光值(包括邻二氮菲、PBS和FeSO4)。
1.3.2 超氧阴离子自由基清除实验[9]
每1 mL反应液中包含浓度为20 mmol/L的PBS(pH=7.4),浓度为50 μmol/L的NBT,75 μmol/L的NADH,15 μmol/L的PMS和50 μL的菌液或发酵液,在37℃条件下孵育5 min,560 nm处测量吸光值。
超氧阴离子自由基清除活性=[(As-Ac)/As]×100%,
式中:As为样品组吸光值;Ac为对照组吸光值(用蒸馏水取代样品)。下同。
1.3.3 DPPH自由基清除实验[10]
将DPPH溶于甲醇溶液配制成浓度为0.1 mmol/L的DPPH溶液,取此溶液2 mL分别与1 mL四株乳酸菌菌液及其发酵液混合均匀,室温避光孵育30 min,在517 nm处测量吸光值。
DPPH自由基清除活性=[(Ac-As)/Ac]×100%,
1.4 缓解Caco-2细胞氧化损伤能力评价
1.4.1 氧化损伤模型构建
用MTT法[11]确定构建氧化损伤模型所需H2O2浓度,具体操作如下:Caco-2细胞以每孔1×105的浓度接种于96孔板,待细胞贴壁后开始实验,用无血清无双抗的 DMEM 配制浓度为0,25,50,100,150,200,250,500,1 000,2 000 μmol/L的H2O2,每孔加100 μL培养30 min,吸去H2O2,每孔加入20 μL的MTT溶液培养4 h,终止培养,每孔加入150 μL二甲基亚砜,低速振荡10 min,在490 nm处测量各孔吸光值。
1.4.2 细胞分组
Caco-2细胞以每孔3×105的浓度接种于六孔板,连续培养18 d。实验共分为9组,每组3个重复,具体分组如下,空白组;损伤组:根据2.4.1结果选择出的最佳H2O2浓度,每孔加入3 mL浓度为500 μmol/L的H2O2,30 min后移除并清洗,DMEM继续培养4 h;阳性对照组:氧化损伤过的细胞清洗后,每孔加入3 mL质量分数为0.01%的Vc,继续培养4 h;NCFM组、L.p 14917组、L.p 75017组:氧化损伤过的细胞清洗后,每孔加入3 ml DMEM配制的活菌数为108mL-1的三种菌悬液,继续培养4 h;灭活NCFM组、灭活L.p 14917组、灭活L.p75017组:氧化损伤过的细胞清洗后,每孔加入3 mL的DMEM配制的菌落数为108mL-1的三种灭活菌体的菌悬液,继续培养4 h。
1.4.3 抗氧化酶活性的测定
实验结束后,用冷的无菌PBS迅速清洗3次,收集细胞,4℃条件下2 000 g离心10 min,弃上清,用1 mL冷PBS清洗,4℃条件下2 000 g离心10 min,加入1 mL质量分数为1%的Triton X-100充分混匀,4℃条件下4 000 g离心15 min,收集上清。分别测量不同处理组上清液SOD活性、GPx活性。
1.5 数据处理
实验数据均为平行测三次的值,用平均数±标准差表示,用SPSS 17.0软件进行统计分析,差异显著水平为P<0.05。
2 结果与分析
2.1 自由基清除能力
2.1.1 羟自由基清除能力
羟自由基能够降解DNA、损伤细胞膜和多糖化合物,是最主要的能够导致脂质过氧化和多种人体细胞损伤的自由基[12,13],在本研究中,羟自由基来源于Fenton反应。图1为3株乳酸菌羟自由基清除活性。
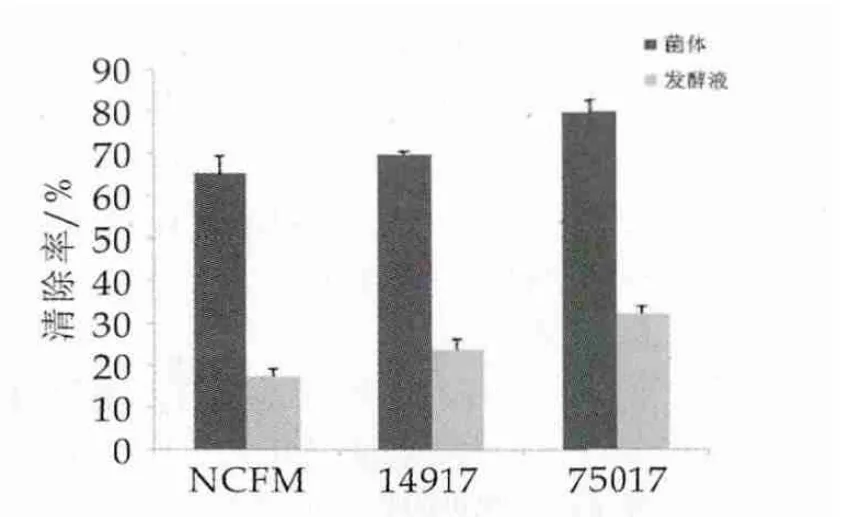
图1 3株乳酸菌羟自由基清除活性
由图1可以看出,3株乳酸菌菌体及发酵液均有一定的羟自由基清除能力。其中菌体的羟自由基清除能力分别为NDC75017(79.87%±0.027)>ATCC14917(69.74%±0.008)>NCFM(65.17%±0.042),发酵液羟自由基清除能力分别为NDC75017(32.13%±0.017)>ATCC14917(23.65% ± 0.025)>NCFM(17.28% ±0.018)。分析其结果可发现,在羟自由基清除活性方面3株乳酸菌菌体均大于发酵液,其中植物乳杆菌NDC75017表现出最强的羟自由基清除活性,乳酸菌菌体具有较强的羟自由基清除能力可归结为在乳酸菌细胞内存在着针对Cu2+和Fe2+的天然螯合物质,这些物质能够螯合Cu2+和Fe2+,从根本上减少羟自由基的产生[6]。
2.1.2 超氧阴离子自由基清除能力
由PMS/NADH组成的非酶促反应系统可以产生超氧阴离子自由基,超氧阴离子自由基能够将NBT还原成紫色的甲瓒,甲瓒在560 nm处具有最强的吸光值,在反应过程中加入3株乳酸菌菌体或发酵液,通过吸光值的减少量可计算出超氧阴离子清除率。图2为3株乳酸菌超氧阴离子自由基清除活性。
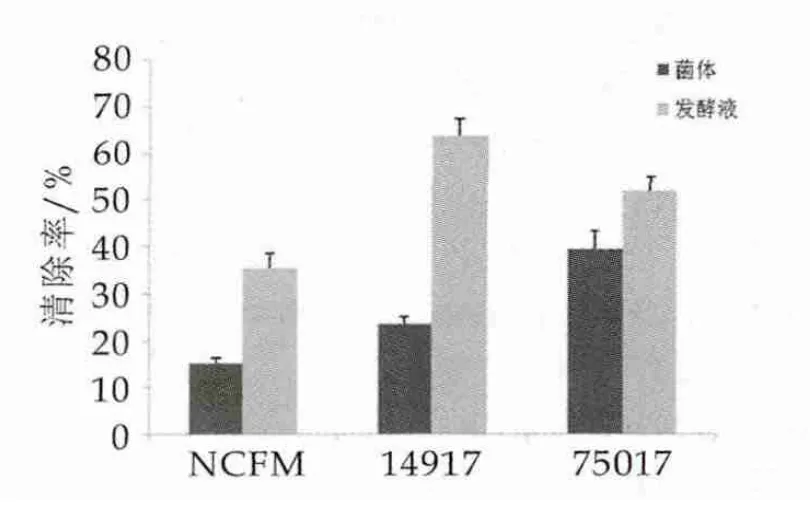
图2 3株乳酸菌超氧阴离子自由基清除活性
由图2可以看出,3株乳酸菌菌体超氧阴离子自由基清除率为NDC75017(39.45%±0.040)>ATCC14917(23.63%±0.015)>NCFM(15.25%±0.013),发酵液超氧阴离子自由基清除率为ATCC14917(63.62%±0.036) >NDC75017(51.83% ± 0.029) >NCFM(35.40%±0.031)。在超氧阴离子自由基清除活性方面3株乳酸菌发酵液均大于菌体,其中菌体方面植物乳杆菌NDC75017表现出最强的超氧阴离子自由基清除活性,发酵液方面植物乳杆菌ATCC14917的发酵液具有最强的超氧阴离子自由基清除能力。乳酸菌菌体及发酵液具有超氧阴离子自由基清除能力可能是由于其菌体细胞及代谢产物中存在SOD,有报道显示,SOD、CAT、NADH氧化酶和NADH过氧化物酶等都存在于乳酸菌中,并且这些抗氧化酶是乳酸菌防御氧化应激的重要酶促防御系统[14]。
2.1.3 DPPH自由基清除能力
目前,清除DPPH自由基实验被广泛应用于抗氧化能力评价实验中,其原理是,DPPH自由基含有单电子,在517 nm处有一强吸收,其醇溶液呈紫色,当有自由基清除物质存在时,自由基清除物质会提供H+与DPPH中单电子对配对而使DPPH醇溶液褪色,吸光值也降低。图3为3株乳酸菌DPPH自由基清除活性。
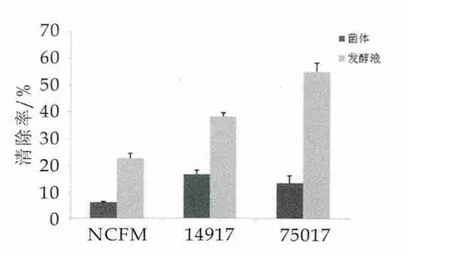
图3 三株乳酸菌DPPH自由基清除活性
由图3可以看出,3株乳酸菌菌体DPPH自由基清除率为 ATCC14917(16.55%±0.016)>NDC75017(13.32%±0.017)>NCFM(5.99%±0.002),发酵液DPPH自由基清除率为NDC75017(55.13%±0.032)>ATCC14917(38.02% ± 0.015)>NCFM(22.55% ±0.018)。在DPPH自由基清除活性方面3株乳酸菌发酵液均大于菌体,其中菌体方面植物乳杆菌ATCC14917表现出最强的DPPH自由基清除活性,发酵液方面植物乳杆菌NDC75017的发酵液具有最强的DPPH自由基清除能力。有报道显示,乳酸菌具有DPPH自由基清除活性可能和菌体产生的胞外多糖有关,Xu等[15]的研究显示DPPH自由基的清除活性与由双歧杆菌分离出的胞外多糖的浓度呈正相关。
2.2 缓解Caco-2细胞氧化损伤能力评价
2.2.1 过氧化氢浓度的选择
为构建合理的氧化损伤模型需要对H2O2的浓度进行选择,本研究选择0,25,50,100,150,200,250,500,1000,2000 μmol/L的 H2O2,与Caco-2细胞分别接触30 min和1 h后,测定细胞存活率。图4为过氧化氢浓度与细胞存活率关系。
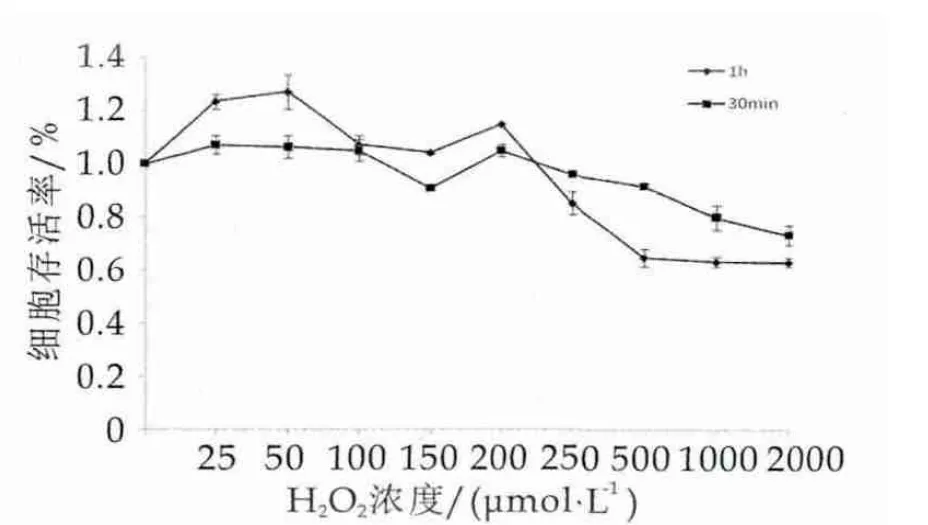
图4 过氧化氢浓度与细胞存活率关系
由图4可以看出,过氧化氢与细胞生长状态之间存在着一定的关系,与H2O2接触后Caco-2细胞活性呈现先略微上升后急速下降的趋势,这与杨瑞华[16]等研究所称低浓度的过氧化氢可刺激细胞增殖这一结论相吻合。Wijeratne[18]等研究显示,构建氧化损伤模型的原则为仅让细胞处于氧化损伤的环境下,使细胞做出氧化损伤应答,但并不会导致细胞大量死亡,细胞存活率大约维持在95%左右为宜。目前大量研究显示,当Caco-2细胞接触的H2O2浓度>500 μmol/L,时间长于1 h则会引起细胞死亡或脱壁,因此根据本实验结果及参考文献,最终选择H2O2浓度为500 μmol/L,处理时间为30 min。
2.2.2 抗氧化酶活性的测定
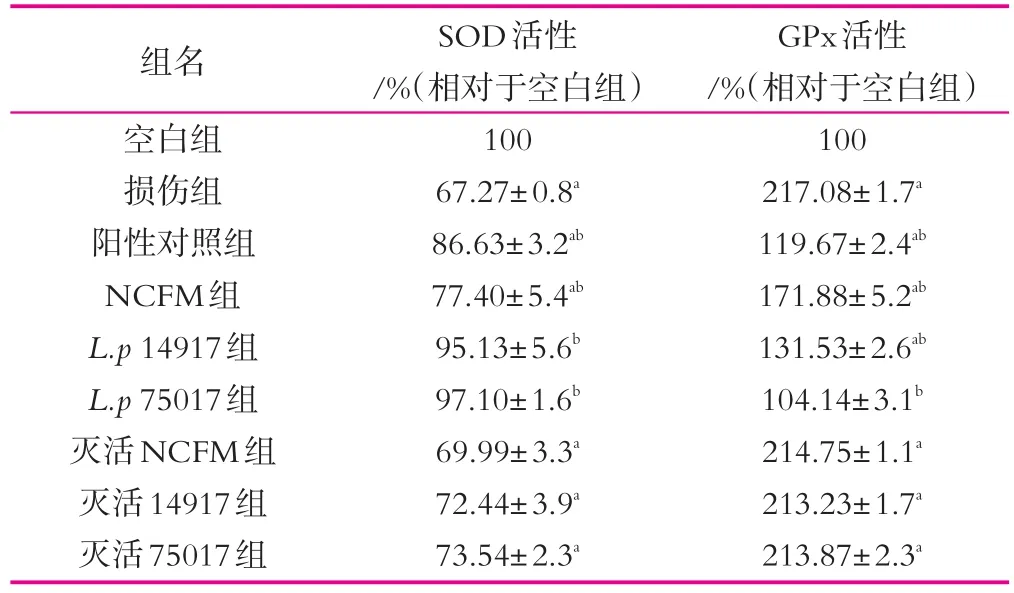
表1 不同处理组抗氧化酶活性
如表1所示,SOD活性方面,与空白组相比,氧化损伤组SOD活性显著降低,说明Caco-2细胞已受到氧化损伤,Wijeratne等[17]研究显示当Caco-2细胞处于不同浓度H2O2的条件下,随着H2O2浓度的升高,Caco-2细胞胞内SOD活性呈现先上升后下降的趋势,当细胞处于氧化环境下,首先通过增加胞内SOD的活性来缓解其受到的氧化损伤,当氧化物的浓度达到一定值时将会对细胞造成损伤,SOD的活性也因此受到损伤因此而显著下降。与损伤组相比,3株乳酸菌活菌处理组SOD活性均显著升高,且L.p14917组和L.p75017组已与空白组没有显著差别;但3株乳酸菌灭活菌体组SOD活性变化均不显著。
GPx活性方面,与空白组相比,氧化损伤组GPx活性显著升高,说明Caco-2细胞在低浓度H2O2环境中也会呈现GPx活性上升的趋势,以缓解其受到的氧化损伤。与损伤组相比,3株乳酸菌活菌处理组GPx活性均显著下降,其中以L.p75017组效果最为明显,GPx活性恢复到与空白组没有显著差异,其次是L.p 14917组,最后为NCFM组;但3株乳酸菌灭活菌体组GPx活性变化均不显著。
3 结果与讨论
自由基清除能力是评价物质抗氧化能力的重要指标,目前大量研究显示乳酸菌发挥抗氧化作用与其具有自由基清除能力密切相关[18]。Deeplina等由发酵乳饮料中分离出1株具有抗氧化活性和高产GABA的植物乳杆菌DM5,并通过清除羟自由基、超氧阴离子自由基、DPPH自由基等实验证实了其具有较强的抗氧化能力[9]。Takashi等自鱼肠道及发酵鱼中分离出了75株乳酸菌,通过DPPH自由基清除实验、超氧阴离子自由基清除实验及Fe还原能力实验,从中筛选出了6株具有较强抗氧化活性的菌株,其中4株为植物乳杆菌,1株为戊糖片球菌,1株为乳酸乳球菌[19]。本研究也对3株乳酸菌的自由基清除能力进行了比较,由实验结果发现,在3株乳酸菌的菌体及发酵液中,菌体的羟自由基清除率要优于发酵液,而发酵液的DPPH自由基、超氧阴离子自由基清除能力要优于菌体;植物乳杆菌NDC 75017菌体具有最强的羟自由基清除能力;植物乳杆菌NDC 75017的发酵液具有最强的DPPH自由基清除能力,植物乳杆菌ATCC 14917发酵液具有最强的超氧阴离子自由基清除能力。因此,乳酸菌菌体自身的成分以及发酵液中的部分代谢产物能够起到清除自由基的作用,不同菌株清除自由基的活性成分不同且清除能力也不同,它们能够清除机体多余的自由基,防止自由基对机体细胞造成损伤,这也是乳酸菌发挥抗氧化作用的机制之一。
另一方面,抗氧化酶也是发挥抗氧化作用的重要重要物质,它们普遍存在于机体各个细胞内,主要包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等,当机体受到外界不良环境的刺激,抗氧化酶就会做出相应的应答[20]。Gao等分析了一株植物乳杆菌FC225的抗氧化机制,证实了其能够显著提升高血脂小鼠肝细胞中SOD和GPx活性,降低肝细胞中丙二醛(MDA)的含量;接着又从细胞通路角度证实其发挥抗氧化作用可能与提高Nrf2基因表达量有关[10]。李盛钰等发现植物乳杆菌C88在活菌数达1011mL-1浓度下,能够显著提高受到氧化损伤的Caco-2细胞细胞裂解液中GPx活性、SOD活性、羟自由基清除率和总抗氧化(T-AOC)能力,对由H2O2诱导引起的Caco-2细胞氧化损伤起到一定的保护作用[21]。本研究证实了3株乳酸菌活菌能够不同程度的缓解由H2O2所造成的Caco-2细胞氧化损伤,尤其是植物乳杆菌NDC 75017具有最为显著的缓解SOD活性降低及GPx活性激增的效果,可能是菌体产生的胞外多糖及多种代谢产物起到了一定的抗氧化作用,但3株乳酸菌灭活菌体对Caco-2细胞氧化损伤的缓解作用并不明显,可能是在灭活过程中抗氧化成分也随之失效。
综上所述,植物乳杆菌NDC 75017在清除自由基和缓解由H2O2诱导引起的Caco-2细胞氧化损伤方面均具有显著效果,是一株具有较强抗氧化功能的菌株。
[1]MARTINDALE J L,HOLBROOK N J.Cellular response to oxida⁃tive stress:signaling for suicide and survival[J].Journal of cellular phys⁃iology,2002,192(1):1-15.
[2]SIES H.Oxidative stress:oxidants and antioxidants[J].Experimental physiology,1997,82(2):291-5.
[3]ADLY A A M.Oxidative Stress and Disease:An Updated Review[J].Research Journal of Immunology,2010,3:129-45.
[4]HYBERTSON B M,GAO B,BOSE S K,et al.Oxidative stress in health and disease:the therapeutic potential of Nrf2 activation[J].Mo⁃lecular aspects of medicine,2011,32(4-6):234-46.
[5]HATHOUT A S,MOHAMED S R,EL-NEKEETY A A,et al.Abil⁃ity of Lactobacillus casei and Lactobacillus reuteri to protect against oxi⁃dative stress in rats fed aflatoxins-contaminated diet[J].Toxicon:offi⁃cial journal of the International Society on Toxinology,2011,58(2):179-86.
[6]KULLISAAR T,ZILMER M,MIKELSAAR M,et al.Two antioxi⁃dative lactobacilli strains as promising probiotics[J].International jour⁃nal of food microbiology,2002,72(3):215-24.
[7]LEE J,HWANG K T,HEO M S,et al.Resistance of Lactobacillus plantarum KCTC 3099 from Kimchi to oxidative stress[J].Journal of medicinal food,2005,8(3):299-304.
[8]KANMANI P,SATISH KUMAR R,YUVARAJ N,et al.Produc⁃tion and purification of a novel exopolysaccharide from lactic acid bac⁃terium Streptococcus phocae PI80 and its functional characteristics ac⁃tivity in vitro[J].Bioresource technology,2011,102(7):4827-33.
[9]DAS D,GOYAL A.Antioxidant activity and γ-aminobutyric acid(GABA)producing ability of probiotic Lactobacillus plantarum DM5 isolated from Marcha of Sikkim[J].LWT-Food Science and Tech⁃nology,2015,61(1):263-8.
[10]GAO D,GAO Z,ZHU G.Antioxidant effects of Lactobacillus plan⁃tarum via activation of transcription factor Nrf2[J].Food&function,2013,4(6):982-9.
[11]O’SULLIVAN A M,O’CALLAGHAN Y C,O’GRADY M N,et al.In vitro and cellular antioxidant activities of seaweed extracts pre⁃pared from five brown seaweeds harvested in spring from the west coast of Ireland[J].Food Chemistry,2011,126(3):1064-70.
[12]COOKE M S,EVANS M D,DIZDAROGLU M,et al.Oxidative DNA damage:mechanisms,mutation,and disease[J].FASEB jour⁃nal:official publication of the Federation of American Societies for Experimental Biology,2003,17(10):1195-214.
[13]HAZRA B,BISWAS S,MANDAL N.Antioxidant and free radical scavenging activity of Spondias pinnata[J].BMC complementary and alternative medicine,2008,8:63.
[14]LEE B-J,KIM J-S,KANG Y M,et al.Antioxidant activity and γ-aminobutyric acid(GABA)content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J].Food Chemistry,2010,122(1):271-6.
[15]XU R,SHANG N,LI P.In vitro and in vivo antioxidant activity of exopolysaccharide fractions from Bifidobacterium animalis RH[J].Anaerobe,2011,17(5):226-31.
[16]杨瑞华,海春旭,李瑞珍,等.过氧化氢与细胞生长状态的剂量反应关系研究[J].癌变畸变突变,1997,2:24-31.
[17]WIJERATNE S S,CUPPETT S L,SCHLEGEL V.Hydrogen per⁃oxide induced oxidative stress damage and antioxidant enzyme re⁃sponse in Caco-2 human colon cells[J].Journal of agricultural and food chemistry,2005,53(22):8768-74.
[18]彭新颜,于海洋,李杰,等.乳酸菌抗氧化作用研究进展[J].食品科学,2012,23:370-4.
[19]KUDA T,KAWAHARA M,NEMOTO M,et al.In vitro antioxi⁃dant and anti-inflammation properties of lactic acid bacteria isolated from fish intestines and fermented fish from the Sanriku Satoumi re⁃gion in Japan[J].Food Research International,2014,64:248-55.
[20]MCCORD J M.Oxygen-derived free radicals in postischemic tissue injury[J].The New England journal of medicine,1985,312(3):159-63.
[21]李盛钰,李达,赵玉娟,等.植物乳杆菌C88对H2O2诱导氧化损伤的Caco-2细胞的保护作用[J].中国农业科学,2013,03:606-13.

