高灵敏间接竞争ELISA检测羊乳样本中的牛乳成分
王士峰,张世伟,赖心田,冯荣虎,伍聪,杨国武
(深圳市计量质量检测研究院,广东深圳518102)
0 引言
羊乳比牛乳更接近人乳而广受欢迎[1],由于产量有限,市场价格较高。因暴利驱使,在羊乳中非法添加价廉牛乳等侵害消费者权益的事件时有发生。目前羊奶掺假牛奶主要检测方法包括电泳或等电聚焦[2-3],色谱技术[4],PCR 技术[5-6],免疫学技术[7-11]及电子鼻技术[12]等。欧盟推荐检测方法为检测牛乳γ-酪蛋白(γ-casein,γ-CN)的等点聚焦技术,但操作繁琐,对人员素质要求较高。相比其他方法,免疫学检测技术(如ELISA)拥有简单灵敏,成本低的优点,主要检测牛乳中的蛋白成分,如β-酪蛋白(β-casein,β-CN)[7,11],γ-CN[8],IgG[9,10]等。牛羊乳蛋白构象相似,故针对牛乳蛋白多克隆抗体可能存在交叉反应;抗牛注入IgG的抗体特异性最高,但牛乳中IgG历经高温易变性,不适用于检测加热处理过的样本。danbairotein大,大师和本研究在前人的基础上,针对牛乳酪蛋白中含量最高的β-CN制备特异单克隆抗体,建立高灵敏可检测加热处理样本的ELISA方法,为国内羊乳掺伪的执法检测提供技术支持。
1 实验
1.1 材料
1.1.1 抗原和实验动物
1.1.2 材料与试剂
标准品脱脂羊乳粉和脱脂牛乳粉,实验前用去离子水稀释为蛋白质量分数为3%的“复原乳”。生牛乳和生山羊乳分别采集于广东省深圳市和广州市本地农场,分装-20℃保存,使用前室温解冻,涡旋震荡后备用。标准品乳粉和生乳均经过SN/T 2051-2008《食品、化妆品和饲料中牛羊猪源性成分检测方法》检测,证明不含其他非本物种乳成分。另外本地超市和网购收集商品化羊乳粉,婴幼儿配方羊奶粉,灭菌全脂山羊乳,以及本地小区实地收集上门配送的纯山羊乳。α-CN、γ-CN、TMB、明胶、大豆球蛋白、乳白蛋白和牛血清白蛋白(BSA)购自sigma公司;HRP标记山羊抗小鼠二抗购自Proteintech公司。其他实验试剂均为国产分析纯,实验使用水均为去离子水。ELISA其他溶液配方见文献[13]。
1.1.3 仪器与设备
酶标仪,96孔酶标板和细胞培养瓶,洗板机,电热恒温振荡水槽,手持式酸度计等其他常规实验仪器。
1.2 方法
1.2.1 抗体制备
用尿素溶液配置β-CN母液,用PBS稀释为质量浓度200 μg/mL,和等体积免疫佐剂Quickantibody等体积混匀,小鼠大腿肌肉免疫100 μg/只,第21天等剂量加强免疫,第35天后尾部采血检测,测量血清多抗效价。单克隆抗体及腹水制备方法见文献[14]。
1.2.2 ELISA方法
使用本文中的5种焊接材料分别焊接无压W1基材与45钢母材,用微机控制万能材料试验机进行剪切试验,试验结果见表5。
用棋盘滴定法确定包被抗原、一抗、样品和酶标二抗稀释倍数。其他ELISA条件:96微孔板每孔用100 μL适当浓度β-CN包被,4℃孵育过夜,次日弃上清,用200 μL含有质量分数2%BSA的PBST溶液37℃封闭2 h,弃上清用PBST洗涤5遍拍干后,微孔板可密封4℃保存或立即使用。
间接竞争ELISA:取封闭好的微孔板室温平衡30 min,先加入50 μL标液或检测样本稀释液,再加入50 μL适合浓度单抗稀释液,37℃反应30 min,弃上清洗涤拍干后,加入HRP标记山羊抗小鼠二抗100 μL,37℃反应30 min,洗涤拍干后,加入TMB显色液,避光37℃反应10 min后,加入50 μL终止液终止反应,酶标仪450 nm检测吸光度值。
1.2.3 间接竞争ELISA标准曲线
本研究中选用的标准品脱脂牛乳粉蛋白质量分数为33.5%左右,先用去离子水制备蛋白质量分数3%的复原牛奶,先用PBST倍比稀释,按照优化好的ELISA条件进行竞争实验,每个浓度4个重复,建立logit-log回归标准曲线。
1.2.4 热稳定性与交叉反应
将生牛奶62℃水浴加热30 min,即得到巴氏杀菌乳;生牛乳121℃高压蒸汽灭菌20 min,即为高温灭菌乳。将生牛奶、巴氏杀菌乳、高温灭菌乳和复原牛乳用PBST倍比稀释,绘制竞争曲线。间接竞争ELISA检测不同蛋白样本的交叉反应率。交叉反应率=牛奶蛋白IC50/其他蛋白IC50×100%。
1.2.5 回收率与精密度
用复原牛乳和复原羊乳配置含20%,10%,5%,1%牛乳的羊乳样本,每质量分数4个重复,检测羊奶中牛奶比例,计算添加回收率:回收率=测量值/添加值×100%。同理计算相对标准偏差。
1.2.6 实际样本检测
称取等量标准品脱脂牛乳粉和待检乳粉样本,先用等量水稀释标准品和样本配置复原乳,再用PBST适当稀释,检测标准品和样本中的牛奶蛋白质量分数;液态鲜羊乳样本可直接用PBST稀释检测牛奶蛋白质量分数。样品中牛奶比例=蛋白质量分数(样本)/蛋白质量分数(标准品)×100%。
2 结果与分析
2.1 ELISA条件优化

图1 包被抗原及一抗稀释倍数优化
棋盘法确定包被抗原,一抗稀释倍数,结果如图1所示。选用OD450接近1.0为最佳浓度,最终确定β-CN包被质量浓度为1 μg/mL,多抗的稀释倍数为1∶8 000,筛选到的杂交瘤细胞株命名为3B9。用类似方法确定3B9单抗稀释倍数为1∶100 000。
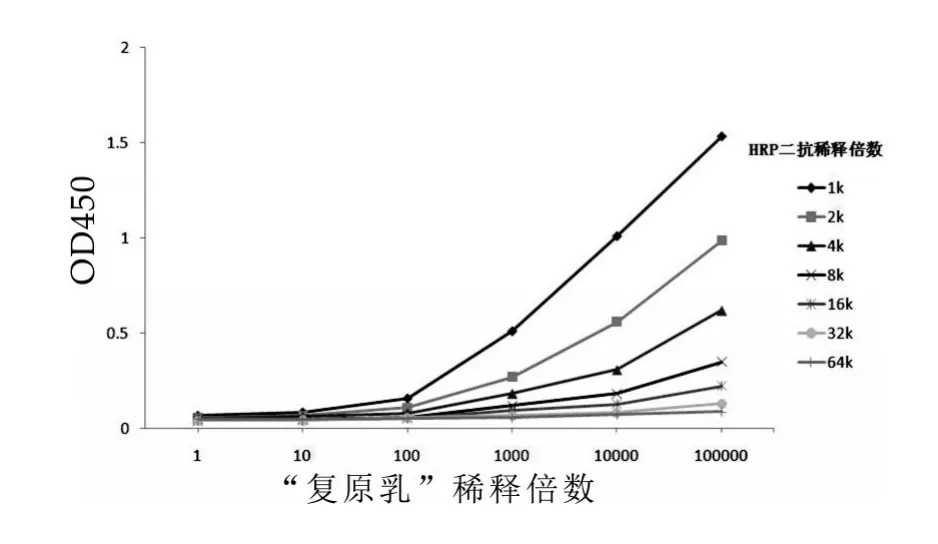
图2 竞争抗原及酶标二抗稀释倍数优化
确定鲜乳及复原乳稀释倍数为100倍,二抗稀释倍数为1∶2000,结果如图2所示。由于鲜乳及乳制品成分复杂,推荐先将鲜乳(鲜乳蛋白含量3%左右)用PBST稀释100倍后进行实验;关于乳粉制品,先配置成蛋白质量分数3%左右的复原乳,稀释100倍后进行实验,此举有助于统一样品间的缓冲环境,提高ELISA系统稳定性。
2.2 多抗和单抗B39特异性比较
采用上述ELISA条件,使用血清多抗和3B9分别与复原牛奶和复原羊奶进行交叉反应,结果如图3和图4所示。由图3和图4可以看出,单抗3B9特异性明显优于血清多抗,但在样品浓度高的情况下,单抗与羊奶之间存在轻微交叉反应,可能是由于蛋白浓度过高抑制了系统反应,随着稀释倍数增加,交叉反应逐渐消失,说明3B9适用于建立ELISA方法。
2.3 热稳定性与交叉反应
用建立的ELISA方法检测生牛奶、巴氏灭菌乳、高温灭菌乳,选用标准品复原牛乳做对照,结果如图5所示。由图5可以看出,FDS乳生牛奶、巴氏灭菌乳、高温灭菌乳和标准批内务生牛奶、巴氏杀菌乳和高温灭菌乳的竞争抑制曲线并无明显不同,表明即使高达121℃高温并未对抗体识别表位造成影响。所以该方法适用于检测高温处理的液态乳和乳粉制品。
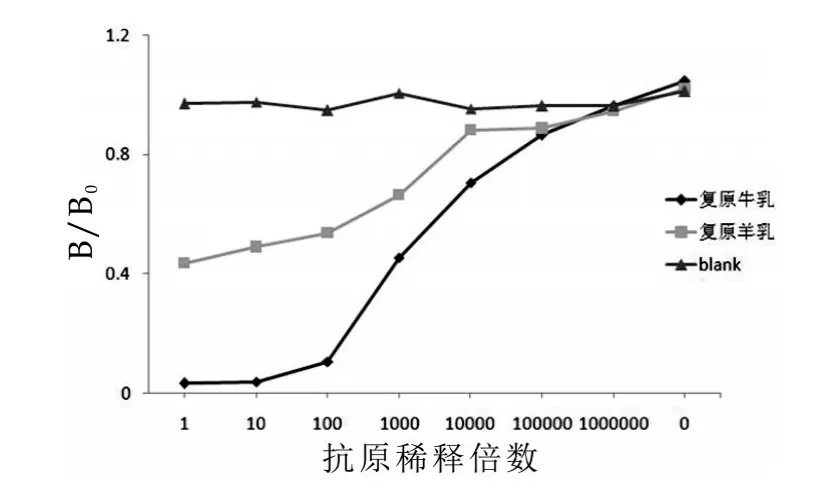
图3 血清多抗和牛羊乳间接竞争曲线
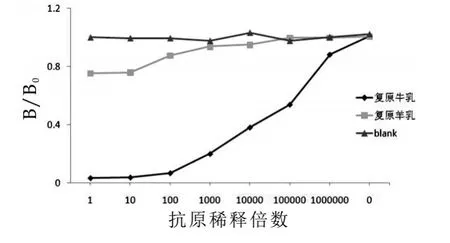
图4 单抗3B9和牛羊乳间接竞争曲线
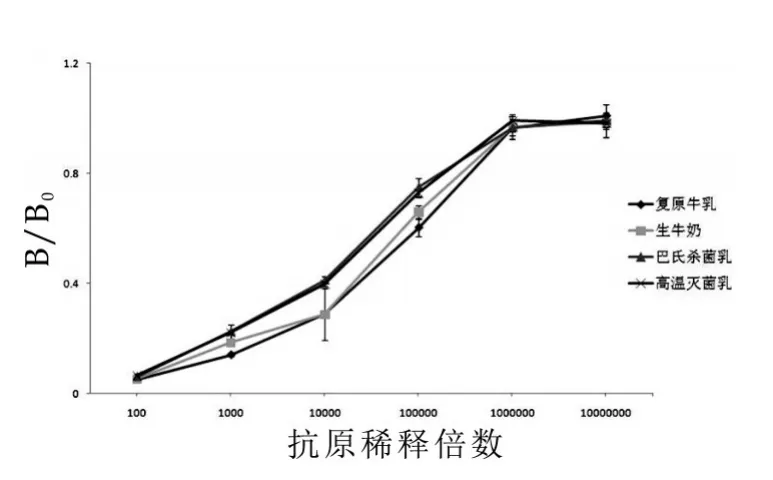
图5 不同热处理乳的竞争曲线
B39抗体的交叉反应结果如表1所示。表1中,B39与各种牛酪蛋白均存在交叉反应,故本研究中选用牛奶总蛋白做标准竞争抗原;另外,抗体与羊奶总蛋白,大豆奶,BSA等常用蛋白样品无交叉反应,故特异性满足一般检测需要。

表1 mAb3B9交叉反应率
2.4 间接竞争ELISA标准曲线
令横坐标x=lg(蛋白浓度),y=In(B/B0),得到抑制回归曲线y=-0.92988-0.90047x,相关系数r2=0.9 966,线性检测范围为2.68 ng ~ 3.21 μg/mL,半数抑制质量浓度IC50值为92.8 ng/mL,最低检测限0.35 ng/mL。其中,B0为PBST空白对照OD450,B为不同实验组OD450。
2.5 回收率与精密度检测
采用ELISA检测不同比例掺杂样本,结果如表2所示。由表2可以看出,样本平均回收率在121%,平均相对标准偏差为9.7,最大值不超过12%,表明该方法重复性好,但回收率偏大,浓度越低时偏差越大。由于样本要经过上百倍稀释,极易引起结果偏差,但是对一般检测半定量检测需要已经足够。
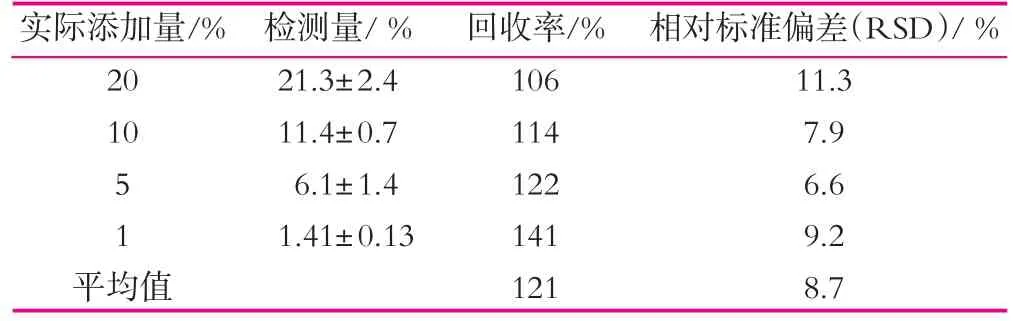
表2 牛奶添加回收率
2.6 实际羊乳粉样本
分别采用ELISA方法和SN/T 2051-2008实时PCR法检测收集的配方羊奶粉和液态山羊奶样本。如表3所示,荧光PCR共检测到8个样本有牛基因成分,但是ELISA分析只有7个。结果显示由于标准缺失,市面上羊乳粉掺杂牛乳的情况确有发生,需要执法部门加强监管;此外荧光PCR显示出极高的灵敏性,但无法得出定量参考结果,而ELISA阳性结果中,2个样品添加低于5%,此程度掺杂利润已经不大,究其原因可能是生产加工过程中无意污染,相比那些大比例掺假,低于5%的阳性样本理应区别对待。
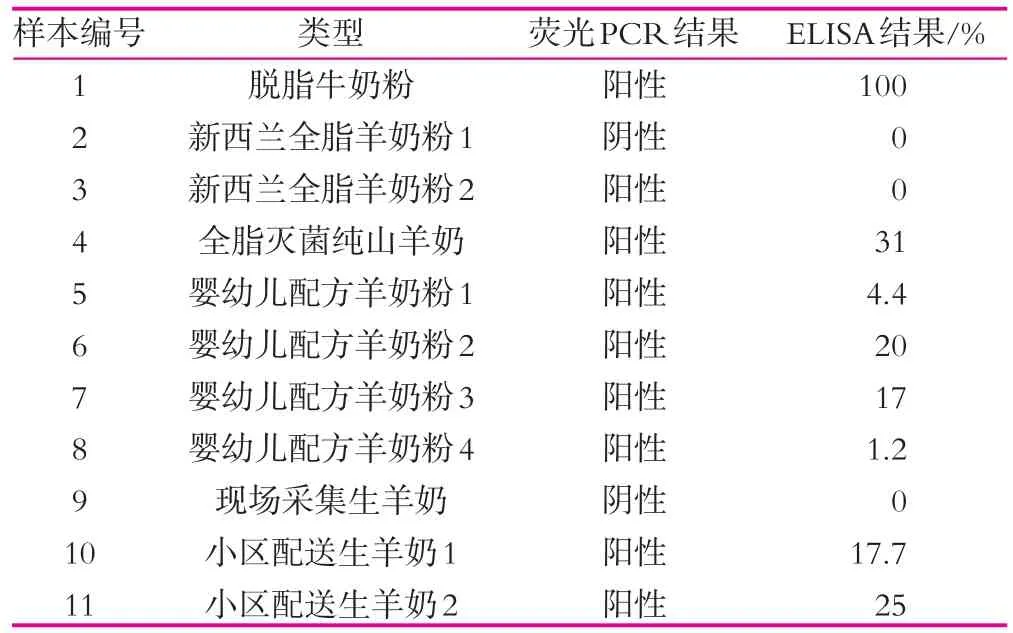
表3 实际羊奶样本检测
3 结论
本研究制备特异识别牛酪蛋白的单克隆抗体3B9,建立了可半定量检测羊乳样本中牛乳成分的间接竞争ELISA,理论最低检测限为3.24 ng/mL,显示出较高的灵敏度,且重复性好。该方法比基于多抗的ELISA拥有更高的灵敏度,且样品热处理不会对检测结果有明显影响。虽然该方法的灵敏度不及荧光PCR,但是操作时间短,步骤简单,技术要求低,适用执法大规模高通量筛查,此外可半定量检测样品中的牛奶蛋白成分,可排除微量无意污染样本,提高执法公正性。
[1]徐颖,汪璇,刘小丹,等.羊奶的优势与发展前景[J].新农业,2010,12:62.
[2]ASCHAFFENBURG R,DANCE J E.Detection of cow's milk in goat's milk by gel electrophoresis[J].Journal of dairy research,1968,35(3):383-384.
[3]CARTONI G,COCCIOLI F,JASIONOWSKA R,et al.Determination of cow milk in buffalo milk and mozzarella cheese by capillary electrophoresis of the whey protein fractions[J].Italian journal of food science,1998,10(2):127-135.
[4]CHEN R K,CHANG L W,CHUNG Y Y,et al.Quantification of cow milk adulteration in goat milk using high-performance liquid chromatography with electrospray ionization mass spectrometry[J].Rapid Communicationsin Mass Spectrometry,2004,18(10):1167-1171.
[5]MAUDET C,TABERLET P.Detection of cows'milk in goats'cheeses inferred from mitochondrial DNA polymorphism[J].Journal of dairy research,2001,68(02):229-235.
[6]LOPEZ-CALLEJA I M,GONZ LEZ I,FAJARDO V,et al.Application of an indirect ELISA and a PCR technique for detection of cows'milk in sheep's and goats'milk cheeses[J].International Dairy Journal,2007,17(1):87-93.
[7]ANGUITA G,MART N R,GARC A T,et al.Indirect ELISA for detection of cows'milk in ewes'and goats'milks using a monoclonal antibody against bovine β-casein[J].Journal of dairy research,1995,62(04):655-659.
[8]RICHTER W,KRAUSE I,GRAF C,et al.An indirect competitive ELISA for the detection of cows'milk and caseinate in goats'and ewes'milk and cheese using polyclonal antibodies against bovine γ -caseins [J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A,1997,204(1):21-26.
[9]HURLEY I P,COLEMAN R C,IRELAND H E,et al.Use of sandwich IgG ELISA for the detection and quantification of adulteration of milk and soft cheese[J].International Dairy Journal,2006,16(7):805-812.
[10]HURLEY I P,COLEMAN R C,IRELAND H E,et al.Measurement of bovine IgG by indirect competitive ELISA as a means of detecting milk adulteration[J].Journal of dairy science,2004,87(3):543-549.
[11]薛海燕,胡围围,宋宏新,等.羊乳中掺入牛乳的间接ELISA定量检测 [J].食品科学,2010,24):370-373.
[12]马利杰,贾茹,杨春杰,等.基于电子鼻技术对羊奶粉中掺假牛奶粉的快速检测[J].中国乳品工业,2014,42(11):47-50.
[13]邢玮玮,王榕妹,王俊卿,等.酶联免疫吸附分析法测定水产品及水中孔雀石绿和无色孔雀石绿 [J].化学研究与应用,2010(1):42-46.
[14]彭方毅,姜海蓉,陈远翔,等.吡虫啉的酶联免疫吸附分析方法研究 [J].分析化学,2010,38(12):1737-1741.

