酶菌联合降解羽毛的研究
杨 婷, 廖美德, 刘偲嘉, 贺玉广, 林志峰
(华南农业大学天然农药与化学生物学教育部重点实验室,广东广州510642)
羽毛角蛋白粗蛋白质含量约在80%以上,氨基酸含量在70%以上(傅红梅,1997),并且含有矿物质元素、维生素以及一些未知的生长因子,是良好的饲料用蛋白资源(张启等,2007)。但由于其结构中含有大量二硫键,一般方法很难将其降解,因此利用率较低。本实验室初步筛选得到两株可降解羽毛的真菌,分别为米曲霉和淡紫拟青霉。本试验对两种菌种降解羽毛能力进行初步对比,筛选出较适合生产需要的菌种,并添加枯草芽孢杆菌酶液,对酶菌联合降解羽毛的能力进行研究,为工业化生产提供理论参考。
1 材料与方法
1.1 试验材料 米曲霉菌 (Aspergillus oryzae)、淡紫拟青霉(Paecilomyces lilacinus)和枯草芽孢杆菌(Bacillus subtilis)由华南农业大学实验室保存;羽毛粉由广州康顺饲料公司提供。
1.2 含羽毛的察氏培养基制作 以察氏培养基为出发培养基,以羽毛替代其原有氮源,制作改良察氏培养基,在1000 mL的锥形瓶中,每个锥形瓶中均装入200 mL液态培养基,灭菌后备用。
1.3 孢子悬液的制备 将米曲霉 (或淡紫拟青霉)接种到固体PDA中,置于28℃恒温培养箱中保温培养,待培养基表面大量形成孢子时,向培养皿中加入无菌水,洗涤米曲霉孢子,合并洗涤孢子悬液后备用。
1.4 羽毛降解试验 在制备好的羽毛培养基中,分别按2%的接种量接种米曲霉或淡紫拟青霉的孢子悬液,置于30℃、180 r/min的恒温摇床中培养,每24 h取样,抽滤,测定滤液中氨基酸的含量。
1.5 氨基酸含量测定 甲醛滴定法:将滤液置于适当大小的烧杯中,加入20 mL蒸馏水混匀。开动磁力搅拌器,用0.01 mol/L NaOH标准溶液滴定至pH为8.20,然后快速加入5.0 mL的甲醛溶液(38%)混匀,接着加入NaOH标准溶液继续滴定至pH为9.20,记录加入甲醛后消耗NaOH溶液的量V1。以20 mL的蒸馏水作空白对照,重复上述操作,记录加入甲醛后的NaOH的消耗量V0(pH=9.20)。

式中:X为样品中氨基酸的含量,mg/mL;V1为测定用试液加入甲醛后滴定至pH=9.20时NaOH消耗量,mL;V0为空白对照加入甲醛后滴定至 pH=9.20时 NaOH消耗量,mL;C为 NaOH标准溶液的浓度,mol/L;m为样品体积,mL。
1.6 枯草芽孢杆菌蛋白酶液的制备 取出实验室内保存的枯草芽孢杆菌,接种到LB液态培养基中,培养24 h致成熟。然后取出培养液,于3000 r/min离心30 min,上清液为活性蛋白酶液。取活性酶液100 mL于烧杯中,放于100℃水浴锅水浴加热1 h,得到失活蛋白酶液。
1.7 酶菌联合降解羽毛试验 设置4个试验组,A组:200mL粗羽毛察氏培养基+4 mL的淡紫拟青霉孢子水+5 mL活蛋白酶液;B:200 mL粗羽毛察氏培养基+4 mL的淡紫拟青霉孢子水+5 mL失活蛋白酶液;C:200 mL绒羽毛察氏培养基+4 mL的淡紫拟青霉孢子水+5 mL活蛋白酶液;D:200 mL绒羽毛察氏培养基+4 mL的淡紫拟青霉孢子水+5 mL失活蛋白酶液。置于30℃、180 r/min的恒温摇床中培养,每24 h取样,抽滤,测定滤液中氨基酸的含量。并且观察其结成胨状的时间以及解除胨状的时间。
2 结果
2.1 淡紫拟青霉与米曲霉降解羽毛能力对比 由图1可见,淡紫拟青霉在第4天氨基酸的含量出现高峰期,随后氨基酸含量回落,可能是淡紫拟青霉需要继续生长发育,利用培养液中的氨基酸合成自身的生长物质,导致测出的氨基酸含量下降。米曲霉培养液中的氨基酸含量变化不算太大,基本上维持在0.025左右。可能是米曲霉一边降解羽毛,一边利用所得的氨基酸充当氮源,供自身生长。

图1 淡紫拟青霉和米曲酶降解羽毛能力对比
2.2 酶菌联合降解羽毛角蛋白试验结果 试验过程中发现使用粗毛作氮源的A、B组的初始pH从第2天开始便一直呈弱碱性,前3 d的培养基中液体较为清,为水状;第4天开始变黏稠,第6天开始有结胨现象出现,到第14天,培养液的胨状解除,再变为水状培养基。整个过程没有明显的刺激性气味,解胨后培养液比绒毛培养基的清稀。
使用绒毛作为氮源的C、D组从接种后的第2天起就有强烈的腐酸气味,所测初始pH为5,之后几天所测初始pH均在4~5,第3天C、D组开始较为黏稠,第4天C、D组的酸味减轻,第5天C、D组的酸味再次变重了一点,第7天开始结胨,到第14天培养液的胨状解除,但是培养液还是比较黏稠。整个培养过程一直有腐酸的气味,一直到第25天清洗培养基气味还存在,而且培养基仍然比较黏稠。
由于NaOH的消耗量与溶液中的氨基酸含量成正比,从图2和图3可知,加入蛋白酶液后,有利于淡紫拟青霉降解羽毛获得氨基酸。而且淡紫拟青霉开始结胨时间为第6天,解除胨状的时间为第14天,比单独使用淡紫拟青霉降解羽毛提早6 d解胨。加入失活蛋白酶组的氨基酸含量比加入活蛋白酶组的低,但比单独使用淡紫拟青霉降解羽毛的要高,可能是失活酶液并非完全失活,或者是还有残留的枯草芽孢杆菌所致。试验证明了枯草芽孢杆菌产生的酶液对于淡紫拟青霉降解羽毛有较为明显的促进作用。
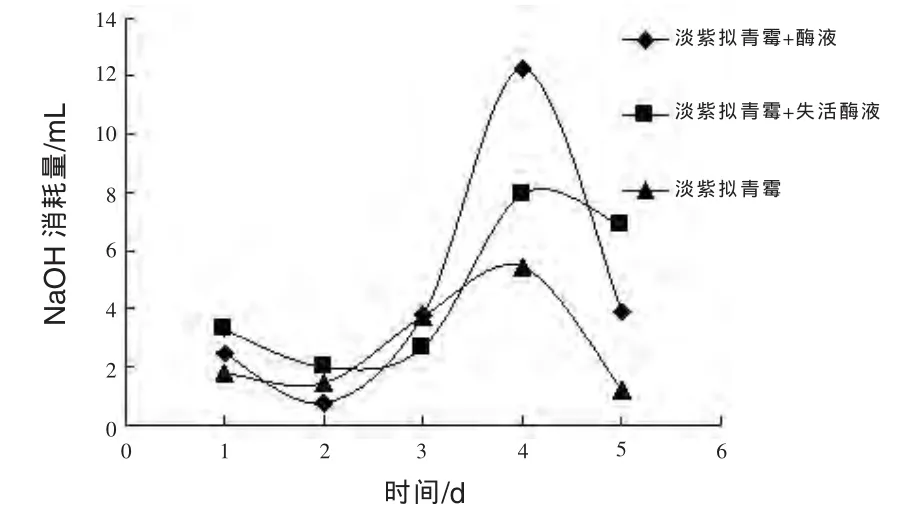
图2 粗毛培养基NaOH消耗量对比

图3 绒毛培养基NaOH消耗量对比
3 讨论
羽毛角蛋白的主要结构中存在大量的二硫键,交联成为复杂的三维网状结构,具有良好的稳定性和难溶性,一般方法很难将其水解(Wang等,2008)。因此,这些羽毛废弃物大多未被充分利用,有的甚至污染环境,造成公害,同时也存在蛋白质资源浪费等问题(Gousterova等,2005)。利用角蛋白酶降解羽毛角蛋白,可将羽毛等废弃角蛋白直接转变成蛋白质或复合氨基酸,变废为宝,既保护环境又可以实现资源再利用(张启等,2008)。角蛋白的降解是一个非常复杂的过程,目前普遍认为,微生物降解角蛋白的过程可分为变性作用、水解作用和转氨基作用三个步骤。王秋影等(2012)研究表明,淡紫拟青霉降解羽毛会出现特有的胨化现象,推测淡紫拟青霉角蛋白酶是很好的复合酶,具有很好的角蛋白二硫键水解能力,但将单链蛋白水解为氨基酸能力较弱。本研究中加入蛋白酶液的处理组比没有加蛋白酶液的处理组氨基酸含量高出很多,证明蛋白酶液可促进淡紫拟青霉将单链蛋白水解成氨基酸,提高了角蛋白酶活力。
本试验中还发现,绒毛培养时培养基呈酸性,粗毛培养时培养基呈弱碱性,猜测是培养基本身氮源组成成分不同所导致的,在绒毛培养的条件下,由于绒毛降解之后可能会产生一些酸性物质,所以会呈现出培养液总体呈酸性的状态;而在粗毛培养的条件下,粗毛降解产生一些中性至弱碱性的物质,所以会呈现出弱碱性的状态。而且,在相同的培养环境下,发现在使用绒毛作为培养基时,氨基酸含量较使用粗毛作培养基时高出近一半的数量。推测原因为由于绒毛中的羽毛较细较软,羽毛梗相对于粗毛的更少,因此作为培养氮源,与培养液中的菌与酶的接触面积比粗毛的要大,更容易使其充分反应;虽然绒毛与粗毛都属羽毛,但是成分有所不同,绒毛中的角蛋白二硫键可能较少,在相同时间内,酶降解的速率相同,所以绒毛相对降解的较充分。
4 结论
淡紫拟青霉比米曲霉降解羽毛能力更强,并且降解过程中有很好的富集点,更适合在工业化生产中降解羽毛制备氨基酸;淡紫拟青霉降解羽毛过程中加入枯草芽孢杆菌酶液,能显著促进羽毛的降解,比单独使用淡紫拟青霉降解羽毛提前6 d解胨,说明酶菌联合降解羽毛角蛋白效果更好。
[1]傅红梅.羽毛粉水解制取可溶性蛋白的工艺研究[J].四川联合大学学报(工程科学版),1997,6:65~71.
[2]王秋影,廖美德.角蛋白酶的研究进展[J].中国饲料,2012,22:12~16.
[3]王秋影,廖美德,王刘庆,等.淡紫拟青霉角蛋白酶特性初步研究[J].西北农林科技大学学报(自然科学版),2012,40(11):192~196.
[4]张启,王晶,曹张军,等.嗜麦芽窄食单胞菌DHHJ角蛋白酶的理化性质[J].农业环境科学学报,2007,26(增刊):605~608.
[5]张启,魏冬凯,曹张军,等.嗜麦芽窄食单胞菌DHHJ角蛋白酶的纯化及酶解研究 [J].环境污染与防治,2008,30(4):40~43.
[6]Gousterova A,Braikova D,Goshev I,et al.Degradation of keratin and collagen containing wastes by newly isolated thermoactinomycetes or by alkaline hydrolysis[J].Lett Appl Microbiol,2005,40:335~340.
[7]Wang S L,Hsu W T,Liang T W,et al.Purification and characterization of three novel keratinolytic metalloproteases produced by Chryseobacterium indologenes TKU014 in a shrimp shell powder medium[J].Bioresour Technol,2008,99:5679~5686.

