我国口蹄疫流行现状与控制策略
何继军,郭建宏,刘湘涛
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室国家口蹄疫参考实验室,甘肃兰州 730046)
我国口蹄疫流行现状与控制策略
何继军,郭建宏,刘湘涛
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室国家口蹄疫参考实验室,甘肃兰州 730046)
[目的]科学研判我国口蹄疫流行形势,明确今后我国口蹄疫防控的重点工作。[方法]以口蹄疫分子流行病学和我国口蹄疫疫情情况、国家口蹄疫参考实验室疫情监测、主动监测数据为基础,分析了我国口蹄疫流行的现状和特点。[结果]目前,我国口蹄疫流行呈零星散发,毒株复杂,但总体疫情形势平稳。通过口蹄疫分子流行病学分析,表明我国目前主要流行有O型Mya-98毒株、A型Sea-97毒株,而这些毒株均来源于东南亚国家,污染面广,危害严重。[结论]境外流行毒株的威胁依然存在,防堵境外毒株的传入,加强威胁毒株的储备研究,加强免疫与免疫监测仍然是今后工作的重点。
中国;口蹄疫;流行;防控
口蹄疫(Foot and Mouth Disease,FMD)是由口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)引起的偶蹄动物传染病[1]。世界动物卫生组织(Office International des Epizooties,OIE)将其列为法定报告动物疫病,我国将其列为一类动物疫病。FMDV属小RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphtho-virus),有O、A、C、Asia1和SAT1、SAT2、SAT3等7个血清型,血清型间无交叉免疫现象[2-3]。我国目前主要流行O型和A型口蹄疫,Asia1型自2009年之后未见临床病例报道。2012年,国务院办公厅印发了《国家中长期动物疫病防治规划(2012—2020年)》,将口蹄疫列为优先防治病种之一。科学、客观地研判我国口蹄疫的流行形势,采取积极有效的防控措施,是实现规划目标的重要环节。
1 疫情形势
2005年5月至2014年年底,我国共计向OIE
报告115次疫情。其中,Asia1型疫情(2005—2009年)46次,A型 疫 情(2009—2010年,2011—2014年)31次,O型疫情(2010—2014年)38次。2005—2006年、2009—2010年和2013年为3个疫情高发阶段,详见表1。
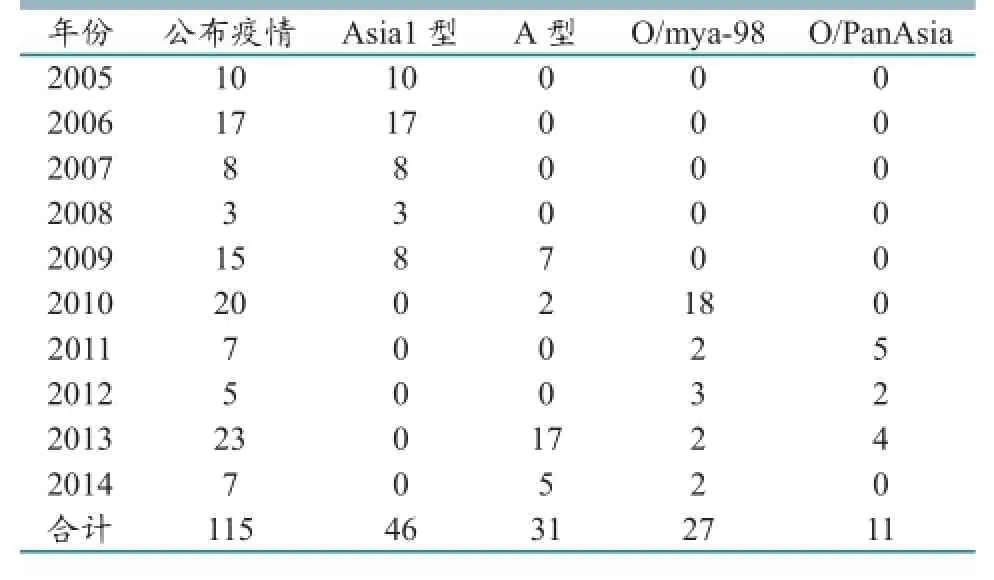
表1 2005—2014年我国公布口蹄疫疫情次数统计表
由表1可看出,近10年来,我国主要流行有O型、A型和Asia1型等3个血清型。我国目前口蹄疫表现为毒株复杂、疫情散发、在部分区域呈流行态势,仍然存在免疫带毒和免疫临床发病现象,但总体流行平稳。
2 疫情监测
根据国家口蹄疫参考实验室疫情监测和主动监测结果,我国当前主要流行O型和A型2个血清型。流行毒株主要有3个:O型Mya-98毒株和PanAsia毒株以及A型Sea-97 G2毒株,引发疫情的毒株较为复杂。以O型口蹄疫疫情为例,自我国2010年首次向OIE正式报告O型疫情到2014年,5年间累计公布O型疫情38次,涉及13个省、直辖市、自治区,但疫情次数呈逐年下降趋势,2010年18次,2011年7次,2012年5次,2013年6次,2014年仅2次疫情。2013年,出现一个新情况,即A型Sea-97毒株的出现和流行。2013—2014年,我国共计报告发生A型疫情22次,疫点分布在广东、青海、新疆、西藏、云南和江苏等6个省、自治区。
从分子流行病学分析结果来看,近年来引起我国口蹄疫疫情发生的3个流行毒株均来源于东南亚国家[4-5]。境外毒株高频次、强穿透力的传入我国和周边国家(如韩国、日本、朝鲜、蒙古、俄罗斯等)并引起疫情发生,成为近年来全球口蹄疫疫情的一个新特点,引起了广泛关注[6-7]。而且,每次从境外传入我国一个新毒株,就会引发一轮疫情。如2005年Asia1型、2009年A型Sea-97 G1毒株、2010年O型Mya-98毒 株、2013年A型Sea-97 G2毒株,分别在我国引起4次高发。近年,在全球范围内也常见毒株跨区域传播流行的例子,如2011年中东地区O型PanAsia-2毒株在欧洲的保加利亚引发疫情[8-10];2012年SAT2型在北非埃及、利比亚等国家强势流行,甚至在亚洲的巴勒斯坦等国家也监测到SAT2型毒株[11];2013年9月南亚Ind-2001毒株在北非利比亚等国家引发疫情[12]。因此,如何防堵境外毒株的传入,是我国口蹄疫防控工作面临的一个新课题,或者说如何控制流行毒株的跨区域传播,是今后口蹄疫防控面临的共同难题。
从发病动物与毒株的偏嗜性来看,我国O型Mya-98毒株目前主要引起猪发病(25次疫情,19次疫情为猪发病,占76%;牛Mya-98疫情主要集中在2010年间,2011年之后未见由Mya-98毒株引起牛疫情发生);PanAsia毒株主要感染牛和羊(越南报道猪PanAsia疫情流行情况严重);A型Sea-97毒株主要感染牛(田间流行情况和实验室感染试验证明,A型Sea-97毒株也可引起猪发病,尤其是A/Sea-97 G2分支毒对猪的感染致病性更强)。从现有疫苗对流行毒株的保护性来看,我国现有口蹄疫疫苗对目前的流行毒株全部有效。2005年以来,国家口蹄疫参考实验室联合中监所、相关疫苗企业,先后开展了Asia1型(2006年)、O型Mya-98毒株(2010年)、A型Sea-97(2009年、2013年)疫苗毒株效力评价,并根据检验结果,驯化和推荐疫苗种毒,为快速控制疫情提供了保障。针对2013年新发A型疫情,中国兽医药品监察所和国家口蹄疫参考实验室联合开展了A型AF72毒株、Re-A/WH/09毒株疫苗免疫攻毒试验,结果表明两种疫苗均可有效保护当前流行的A型病毒,这一结论已应用在2013年秋防及以后的防控工作
当中。
从监测阳性区域分布来看,我国口蹄疫病毒污染面较广,病原长期存在,清除难度大。2010年,在全国19省重点屠宰场和交易市场口蹄疫主动监测中,在湖南、安徽、重庆、广西等省、直辖市、自治区的4个屠宰场和黑龙江、吉林、辽宁、河北、贵州、广西、山东等省、自治区的7个活畜交易市场监测到病原阳性。2011年在10省重点屠宰场监测中,检测到猪O型阳性样品6份,来自于四川省、福建省、湖北省、安徽省的5个屠宰场。地方区域性监测也说明了这一点,如2013年在内蒙古边境地区专项监测中,共监测到A型口蹄疫阳性样品15份(其中牛14份、羊1份)。阳性样品来自内蒙古自治区巴彦淖尔市乌拉特中旗(羊1份)、包头市固阳县(牛1份)、锡林郭勒盟东乌珠穆沁旗(牛8份)和兴安盟阿尔山市(牛5份)。由此可以看出,主动监测为更加准确定位我国口蹄疫流行形势、科学制定防控政策提供了参考数据。另外,主动监测也在一定程度上弥补了我国在疫情传播路线和途径分析方面流行病学信息的缺失。
3 形势研判
根据国家口蹄疫参考实验室掌握的数据,我国口蹄疫流行的形势主要有以下两点:
3.1 O型毒将持续存在,A型散发流行,Asia1型趋于消亡
目前,我国O型口蹄疫优势流行毒株是SEA拓扑型Mya-98毒株,且Mya-98毒株在我国的流行历经了从牛、羊等反刍动物发病进而逐渐引起猪发病的转变[13]。下一个值得关注的O型病毒是PanAsia 2011年毒株,虽然我国未见或少见由该毒株引起猪发病的报道,但越南猪O型PanAsia疫情十分严重,我国PanAsia 2011年毒株源于越南等东南亚国家,毒株特性应具有相似之处,对猪PanAsia毒株的监测是今后重点任务之一。
对于A型毒株,Sea-97 G1毒株在2013年的监测中再未发现,引发疫情的可能性较低,目前主要是Sea-97 G2毒株。从目前公布的疫情情况来看,G2毒株主要在西藏地区流行,2013年暴发的17次疫情中,西藏地区有10次,发病动物主要是牛。从口蹄疫流行情况来看,某病毒株如果对猪易感或牛源毒发生宿主转变适应猪后,在短期内将难以清除,相反,某病毒如果仅对牛易感,而对猪不易感,控制相对容易一些,如Asia1型江苏毒、A型武汉毒等。因此,目前应重点关注猪A型病毒感染、发病情况。
2009年5月之后Asia1型毒株,未见引发疫情的报告,而且我国Asia1型的流行与东南亚地区各国类似,2009年之后呈消亡趋势。
3.2 境外毒株传入风险增加,对我国口蹄疫防控构成重大威胁
如前所述,近年来引起我国疫情发生的毒株均来源于东南亚国家,而且频度极高,从2009—2013年,几乎一年传入一个新毒株。结合我国所处的地理位置和周边国家口蹄疫流行情况,我们认为境外口蹄疫传入的通路有3个:第一个西南区通路,广西、云南为高风险地区,目前O型、A型均通过该通道传入我国。第二个西北区通路,新疆为高风险地区,主要受中亚、西亚和中东等地区流行毒株威胁,这一通路也是目前最受关注的,因为目前全球关注的3个毒株A型Iran-05、O型PanAsia-2和Asia1型sindh-08毒株主要在中东、中亚、西亚地区流行[14-15],这3株毒株普遍表现为流行强度大,致病力强,抗原变异复杂,现有疫苗的免疫保护性差等特点[15-18],而且主要流行国家如土耳其、伊朗、阿富汗、巴基斯坦等国口蹄疫防疫水平较差,对我国的威胁最大。第三个南亚通路,众所周知,印度号称“口蹄疫病毒库”,目前主要流行O型Ind-2001,A型和Asia1型也持续流行[19-21],威胁长期存在。
4 存在的问题及建议
4.1 田间流行情况不尽清楚,流行毒株传播路径不明
2013年,5省报告发生A型疫情,结合地方监测和口蹄疫参考实验室主动监测,阳性省份有9个(广东、青海、西藏、新疆、云南、内蒙古、辽宁、黑龙江、河北)。田间流行病学信息的缺少和
缺失,直接导致了流行毒株传播路径不明,表现为疫点呈跳跃性分布,首发点与次发点之间无法查明流行病学关系。近年来,借助分子流行病学分析平台,成功、准确分析了毒株的来源,解决了国家或地区层面之间的传播关系,但仍然不能回答国内疫情之间到底如何传播。
鉴于此,应从阻碍疫情报告的原因上做工作,切实落实疫情报告制度,帮助地方打消困惑和顾虑,鼓励地方动物疫控部门将监测的阳性样品或临床疑似样品送国家口蹄疫参考实验室检测、确诊。
4.2 免疫状况参差不齐,免疫工作仍然是重点
我国目前实行以免疫与扑杀相结合的防控政策,免疫效果在很大程度上决定着防控成败。因此,需加强强制免疫和疫情监测,建立有效的防疫屏障。同时,针对疫苗生产,建议统一疫苗生产种毒。
4.3 跨省区动物移动频繁,给防疫工作造成困难
近年来,常见由于动物跨省区移动引发的疫情。2007年以后,我国Asia1型疫情进入全面控制时期,疫情次数逐年下降。但2009年,我国Asia1型口蹄疫疫情次数陡然增加,共在7个省、自治区共发生8次疫情,其中4个省属首次发生。在2009年7省发生的8次Asia1型口蹄疫疫情中,新疆(塔城)、四川、湖南、贵州、陕西、广西的6次疫情毒株间的同源性高达99%以上,而与2005—2008年疫情毒株的同源性仅为95%左右,这7省的生态环境差异明显,即便这些地方存在江苏毒感染,也不可能同时衍生成几乎完全一样的病毒。唯一合理的解释是,由某地的动物通过流通环节将该地存在的病毒传播到别处。再如2013年2起O型Mya-98疫情,均为生猪跨省移动引起(公路检查站或屠宰场检疫发现)。相似的情况还出现在西藏地区,经参考实验室分析,2013年西藏地区发生的A型疫情和O型疫情均沿西藏地区主要交通公路线分布,也从侧面反映了动物移动与疫情发生的关联。因此,应加强动物移动控制,限制重点地区、高风险地区动物移动。
4.4 针对境外流行毒种,加强技术储备和疫苗储备
2005年,Asia1型口蹄疫传入我国,当时我国没有任何对于Asia1型口蹄疫防控方面的储备,没有可用疫苗,对传入毒株的致病力、传染性以及生物学特性没有一点积累,导致疫情迅速扩散至内地,发生大流行,造成了巨大的经济损失。形成鲜明对比的是,2009年A型病毒经东南亚传入我国,因有A型口蹄疫疫苗的储备,我国很快控制了疫情。这些实例说明,在当前我国以防堵境外流行毒株为重点防控任务的背景下,战略储备研究和物资储备对快速扑灭疫情和减少经济损失至关重要。而且,战略储备应注重系统化,在加强诊断技术研究的同时,要注重疫苗研发和疫苗储备,借助生物安全实验室在必要时开展外来病病原学研究和活毒实验,借助反向遗传操作平台,及早开展战略疫苗研究。
[1] Grubman M J,Baxt B. Foot-and-mouth disease[J]. Clinical microbiology reviews,2004,17(2):465-493.
[2] 谢庆阁.口蹄疫[M].北京:中国农业出版社,2004:25-27.
[3] 谢庆阁,翟中和.畜禽重大疫病免疫防制研究进展[C].北京:中国农业科技出版社,1996:1-31.
[4] Knowles N J,He J,Shang Y,et al. Southeast Asian footand-mouth disease viruses in Eastern Asia [J]. Emerg Infect Dis,2012,18(3):499-501.
[5] Le V P,Nguyen T,Lee K N,et al. Molecular characterization of serotype A foot-and-mouth disease viruses circulating in Vietnam in 2009 [J]. Vet Microbiol,2010,144:58-66.
[6] Muroga N,Hayama Y,Yamamoto T,et al. The 2010 foot-and-mouth disease epidemic in Japan [J]. J Vet Med Sci,2012,74(4):399-404.
[7] Park J H,Lee K N,Ko Y J,et al. Control of foot-andmouth disease during 2010-2011 epidemic,South Korea [J]. Emerg Infect Dis,2013,19(4):655-659.
[8] Alexandrov T,Stefanov D,Kamenov P,et al. Surveillance of foot-and-mouth disease(FMD)in susceptible wildlife and domestic ungulates in Southeast of Bulgaria following a FMD case in wild boar [J]. Vet Microbiol,2013,166(1-2):84-90.
[9] Valdazo-Gonzalez B,Polihronova L,Alexandrov T,et al. Reconstruction of the transmission history of RNA virus outbreaks using full genome sequences:foot-and-mouth
disease virus in Bulgaria in 2011 [J]. PLoS ONE,2012,7(11):e49650.
[10] Breithaupt A,Depner K,Haas B,et al. Experimental infection of wild boar and domestic pigs with a foot and mouth disease virus strain detected in the southeast of Bulgaria in December of 2010 [J]. Vet Microbiol,2012,159(1/2):33-39.
[11] Kandeil A,El-Shesheny R,Kayali G,et al. Characterization of the recent outbreak of foot-and-mouth disease virus serotype SAT2 in Egypt [J]. Arch Virol,2013,158(3):619-627.
[12] Valdazo-Gonzalez B,Knowles N J and King D P. Genome Sequences of Foot-and-Mouth Disease Virus O/ME-SA/Ind-2001 Lineage from Outbreaks in Libya,Saudi Arabia,and Bhutan during 2013 [J]. Genome Announc,2014,2(2).
[13] 何继军,杨亚民,马维民,等. 我国O型Mya-98口蹄疫病毒流行情况与毒株分析[J].中国动物检疫,2014(5):45-51.
[14] Reid S M,Mioulet V,Knowles N J,et al. Development of tailored real-time RT-PCR assays for the detection and differentiation of serotype O,A and Asia-1 foot-and-mouth disease virus lineages circulating in the Middle East [J]. Journal of Virological Methods,2014,207:146-153.
[15] Knowles N J,Nazem Shirazi M H,Wadsworth J,et al. Recent spread of a new strain(A-Iran-05)of foot-and-mouth disease virus type A in the Middle East [J]. Transbound Emerg Dis,2009,56(5):157-169.
[16] Jamal S M,Ferrari G,Ahmed S,et al. Genetic diversity of foot-and-mouth disease virus serotype O in Pakistan and Afghanistan,1997-2009 [J]. Infect Genet Evol,2011,11(6):1229-1238.
[17] Jamal S M,Ferrari G,Ahmed S,et al. Molecular characterization of serotype Asia-1 foot-and-mouth disease viruses in Pakistan and Afghanistan;emergence of a new genetic Group and evidence for a novel recombinant virus [J]. Infect Genet Evol,2011,11(8):2049-2062.
[18] Schumann K R,Knowles N J,Davies P R,et al. Genetic characterization and molecular epidemiology of footand-mouth disease viruses isolated from Afghanistan in 2003-2005 [J]. Virus Genes,2008,36(2):401-413.
[19] Subramaniam S,Mohapatra J K,Das B,et al. Genetic and antigenic analysis of foot-and-mouth disease virus serotype O responsible for outbreaks in India during 2013 [J]. Infection,Genetics and Evolution,2015,30(0):59-64.
[20] Subramaniam S,Mohapatra J K,Sharma G K,et al. Phylogeny and genetic diversity of foot and mouth disease virus serotype Asia1 in India during 1964-2012 [J]. Vet Microbiol,2013,167(3/4):280-288.
[21] Mohapatra J K,Pawar S S,Tosh C,et al. Genetic characterization of vaccine and field strains of serotype A footand-mouth disease virus from India [J]. Acta Virol,2011,55(4):349-352.
Current Situation and Prevention Suggestion on Foot-and-Mouth Disease in China
He Jijun,Guo Jianhong,Liu Xiangtao
(State Key Laboratory of Veterinary Etiological Biology/National Foot and Mouth Disease Reference Laboratory,Lanzhou Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Lanzhou,Gansu 730046)
Based on the situation of foot and mouth disease(FMD)in China during 2005 to 2014,the statistical results from the epidemic surveillances,and active surveillances carried out by China National FMD Reference Laboratory,current situation of FMD in China was summarized. The disease was characterized by sporadic distribution with multiplex strains but overall steady epidemic situation in China. Molecular epidemiological analysis of FMD showed that the dominant FMDV strains in China were O/Mya-98 and A/Sea-97,which caused wide spread and serious damage and were all from Southeast Asian countries. Hence,it will be the focus of the future work to prevent the threatening strains from foreign countries,strengthen their reserve studies and enhance immunization and immune monitoring.
China;foot and mouth disease;epidemiology;prevention and control
S851.3
B
1005-944X(2015)06-0010-05
科技基础性工作专项“畜禽重要疫病流行病学调查(2012FY111000)”,科技基础性工作专项“动物及动物产品质量安全检测标准物质研制(2013FY113300)”
刘湘涛

