重组人血管内皮抑制素联合化疗治疗晚期胃癌的临床观察
洪国标 肖建军 徐建锋 李志安
重组人血管内皮抑制素联合化疗治疗晚期胃癌的临床观察
洪国标 肖建军 徐建锋 李志安
目的 观察重组人血管内皮抑制素(恩度)联合sox方案(替吉奥+奥沙利铂)治疗晚期胃癌的疗效和安全性。方法 将50例晚期胃癌患者随机分为两组。观察组应用恩度联合SOX方案化疗,对照组单纯化疗。2个疗程后评价疗效、生活质量及毒性反应。结果 观察组有效率68%,对照组有效率36%,两组差异有统计学意义(P<0.05)。观察组疾病进展时间(TTP)及中位生存期(MST)为7.3个月和12.8个月,对照组为6.2个月和10.1个月,两组差异无统计学意义(P>0.05)。治疗后观察组KPS评分较对照组明显改善(P<0.05)。观察组毒副反应发生率与对照组比较差异无统计学意义(P>0.05)。 结论 重组人血管内皮抑制素联合sox方案治疗晚期胃癌提高了临床疗效,改善了患者的生活质量,未见毒副反应增加。
重组人血管内皮抑制素 胃癌 联合化疗
胃癌是常见的恶性肿瘤之一,治疗以手术切除为主。由于胃癌早期缺乏特异征象,大部分患者确诊时已是晚期,手术切除率约50%~53%[1],术后复发或已有转移的晚期胃癌患者主要治疗手段是化疗。多项研究结果显示目前晚期胃癌的生存期在9~11个月左右, 很少>1年[2~4]。作者应用重组人血管内皮抑制素联合SOX方案治疗晚期胃癌50例,取得较好疗效。现报告如下。
1 临床资料
1.1 一般资料 2011年6月至2013年1月本院收治的晚期胃癌患者50例,随机分为观察组25例和对照组25例。其中男29例,女21例;年龄33~72岁,中位年龄53岁。所有患者均经病理检查确诊,KPS评分≥60分,过去6个月体重下降≤10%,预计生存期>3个月,至少有一处可测量的病灶,所有患者在治疗前<1个月未进行过放化疗,血常规、肝肾功能、心电图等检查正常,无其它化疗禁忌证。入组前患者签署知情同意书。
1.2 方法 观察组应用恩度联合SOX方案化疗,对照组单纯化疗。治疗方案:恩度7.5mg/m2,加入0.9%氯化钠注射液500ml静脉滴注4h,14d为1个疗程。替吉奥胶囊80mg/(m2·d),分2次,餐后口服,14d为1个疗程;奥沙利铂130mg/m2,静脉滴注2h,21d为1个疗程,2个疗程后评价疗效。对于病情稳定或有效者继续应用原方案治疗4~6 个疗程。两组患者化疗中应用止吐和支持治疗,预防毒副反应。
1.3 评价标准 客观疗效评价按照RECIST标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。以(CR+PR)为有效率(RR),以(CR+PR+SD)为临床受益率(CBR)。疾病进展时间(TTP)、中位生存时间(MST)、化疗前后生存质量评分采用KPS评分。药物毒性按NCICTC3.0标准分为0~4级。
1.4 统计学方法 采用SPSS 12.0软件。计数资料用χ2检验或四格表确切概率法;Kaplan-Meier生存率曲线计算患者的TTP及MST,用Log-Rank显著性检验分析两组生存期差异,评价远期疗效。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗后疗效比较 见表1。

表1 两组患者治疗后疗效比较
2.2 两组患者治疗前后KPS评分比较 见表2。

表2 两组患者KPS评分比较(n)
2.3 两组毒副反应比较 见表3。
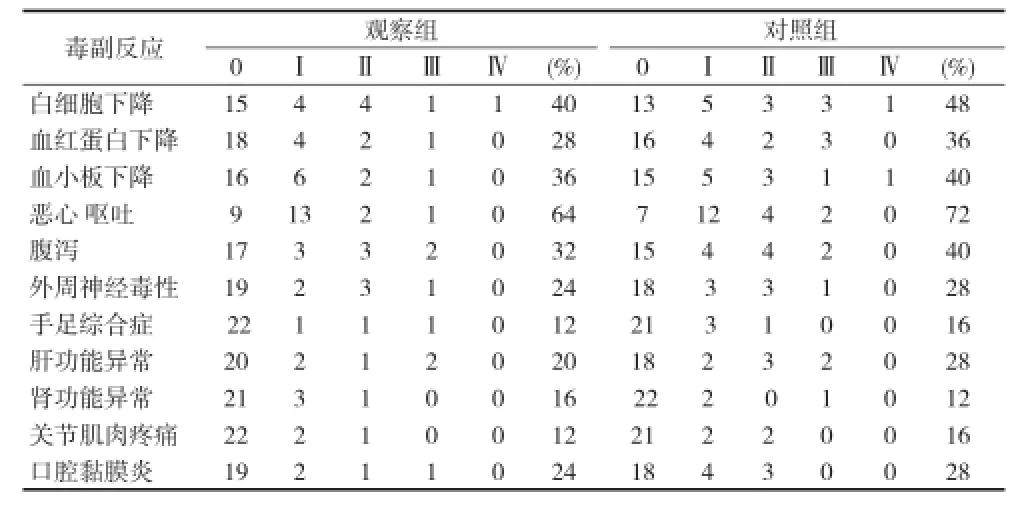
表3 两组患者毒副反应比较(n)
3 讨论
血管内皮抑制素(Endostatin)是一种内源性血管生成抑制剂,作用于肿瘤微血管内皮细胞,通过抑制血管生成因子(如VEGF或碱性成纤维细胞生长因子等)诱导的内皮细胞迁移和增生,抑制肿瘤新生血管形成,达到抑制肿瘤细胞增殖或转移的目的。恩度是我国生产的在Endostatin结构基础上改进的重组人血管内皮抑制素,它在Endostatin氨基酸侧链的N端添加9个氨基酸残基,使其抗肿瘤活性高于Endostatin。胃癌是肿瘤血管比较丰富的恶性肿瘤之一。有研究提示胃癌VEGF阳性表达、血管内皮抑素水平及组织微血管密度与患者的生存期相关[5~7],动物实验[8]显示恩度联合氟尿嘧啶抑制裸鼠移植胃癌生长、减少微血管密度比单独使用恩度或者氟尿嘧啶更佳。而恩度联合化疗治疗多种恶性肿瘤已显示了较好的疗效[9],但目前尚无恩度联合化疗治疗晚期胃癌的大规模临床研究资料。
5-氟尿嘧啶(5-FU)联合奥沙利铂化疗是国内治疗胃癌最常用的方案之一,5- FU极易被正常器官和肿瘤组织产生的二氢嘧啶脱氢酶降解>85%而失活[10]。替吉奥胶囊是替加氟、吉美嘧啶和奥替拉西钾的复方制剂,组成摩尔比为1∶0.4∶1。其中替加氟为5-FU衍生物,口服吸收后经肝药酶作用转化为5-FU发挥作用[11]。吉美嘧啶为二氢嘧啶脱氢酶的强效抑制剂,其可延长血液和肿瘤组织中的5-FU的药效时间,奥替拉西钾口服吸收后可在胃肠道内选择性地作用于乳清酸磷酸核糖基转移酶,阻断5-FU磷酸化,减轻5-FU引起的胃肠道毒副作用[12]。替加氟在吉美嘧啶和奥替拉西钾共同作用下,增强其抗癌作用,降低毒副作用。国外治疗晚期胃癌的临床研究表明替吉奥单药有效率44.6% ,治疗大肠癌的有效率35.5% ,且受试者安全性较好,主要毒副作用为骨髓抑制和消化道反应[13]。在日本替吉奥已成为晚期胃肠道恶性肿瘤的一线化疗药。奥沙利铂与CBP、DDP无交叉耐药,且其抗瘤谱广、活性高,在大肠癌的治疗中已取得了较好的疗效。现将奥沙利铂联合氟尿嘧啶组成的方案用于晚期胃癌的治疗,有临床研究显示疗效优于顺铂联合氟尿嘧啶方案, 提示在胃癌治疗中奥沙利铂优于顺铂[14]。而且奥沙利铂的毒副反应总体较顺铂轻,可以取代顺铂用于胃癌的化疗。
因此,重组人血管内皮抑制素与SOX方案联合治疗晚期胃癌疗效较好,与替吉奥、奥沙利铂具有协同抗肿瘤作用,化疗毒副反应轻,多为消化道反应和骨髓抑制,联合恩度未见明显毒性增加,且显著提高了患者生活质量,是治疗晚期胃癌安全有效的治疗方案,值得临床推广使用。
1 Persiani R,D'Ugo D,Rausei S,et al. Prognostic indicators in locally advanced gastric cancer ( LAGC) treated with preoperative chemotherapy and D2-gastrectomy.J Surg Oncol,2005,89( 4) : 227 ~236.
2 Cutsem EV, Moiseyenko VM, Tjulandin S, et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group.Clin Oncol, 2007, 25(17) : 2490~ 2491.
3 Fukumura D, Jain RK. Tumor microvasculature and microenvironment: targets for antiangiogenesis and normalization.Icro vasc Res, 2007, 74 (223) : 72~84.
4 Li J, Dong X, Xu Z, et al. Endostatin gene therapy enhances the efficacy of paclitaxel to suppress breast cancers and metastases in mice .Biomed Sci, 2008, 15 (1) : 99~109.
5 Woo IS, Kim KA, Jeon HM, et al. Pretreatment serum endostatin as a prognostic indicator in metastatic gastric carcinoma Int .Int J Cancer, 2006, 119 (12) : 2901~2906.
6 王天宝,董文广,李兆亭.重组人内皮抑素联合应用5-氟尿嘧啶对胃癌裸鼠移植瘤的影响 .中华普通外科杂志, 2005,20 (5) : 307~309.
7 Boehm T, udah Folkman J, Browder T, et al. Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance.Nature, 1997, 390 (6658) : 404~407.
8 张婧, 高青. 血管生成拟态在消化道肿瘤中的研究进展.世界华人消化杂志, 2007, 15 (7) : 725~728
9 Zhao HC, Qin R, Chen XX, et al. Microvessel density is a prognostic marker of human gastric cancer .World J Gastroen terol, 2006, 12(47): 7598~7603.
10 Malet-MartinoM, Martino R. Clinical studies of three oral prodrugs of 5 - fluorouracil ( capecitabine, UFT, S - 1) : a review .Oncologist, 2002, 7 (4) : 288~323.
11 Tanaka F, Fukuse T,Wada H, et al. The history, mechanism and clinical use of oral 5 - fluorouracil derivative chemotherapeutic agents .Curr Pharm Biotechnol, 2000 , 1(2) : 137~164.
12 Shirasaka T, Shimamato Y, Ohshimo H, et al. Development of a novel form of an oral 5 - fluorouracil derivative ( S - 1) directed to the potentiation of the tumor selective cytotoxicity of 5 - fluorouracil by two biochemical modulators .Anticancer Drugs, 1996, 7 (5) : 548~557.
13 Shirasaka T, TsukudaM, Inuyama Y, et al. New oral anti cancer drug, TS - 1 ( S - 1) - from bench to clinic .Gan To Kagaku Ryoho, 2001, 28 (6) : 855~ 864.
14 De VitaF, OrdituraM, Matano E, et al. A phase study of biweekly oxaliplatin plus infusional 5-fluorouracil and folinicacid ( FOLFOX-4) as firstline treatment of advanced gastric cancer patients. Br J Cancer, 2005, 92 ( 9 ):1644.
312000 浙江省绍兴第二医院肿瘤内科

