羟基铁柱撑蒙脱土-δ-M nO2复合体Fenton催化降解亚甲基蓝
石中亮 王兴星 姚淑华
(沈阳化工大学应用化学学院,沈阳110142)
羟基铁柱撑蒙脱土-δ-M nO2复合体Fenton催化降解亚甲基蓝
石中亮 王兴星 姚淑华*
(沈阳化工大学应用化学学院,沈阳110142)
制备了一系列羟基铁柱撑蒙脱土-δ-MnO2复合材料,采用X射线粉末衍射(XRD)、比表面积(SBET)及扫描电子显微镜(SEM)研究其结构特征。结果显示:钙基蒙脱土的层间距为1.47 nm,经过柱撑之后,羟基铁撑蒙脱土的层间距增大到1.51 nm,羟基铁柱撑蒙脱土-δ-MnO2复合体为1.55 nm左右,并且比表面积较原土也有明显的增大。以亚甲基蓝为目标污染物,研究了其作为异相催化剂的催化性能,考察了溶液H2O2加入量、δ-MnO2含量及pH值等对亚甲基蓝降解性能的影响。结果表明,在实验条件下,催化剂的催化活性随H2O2浓度的增加而升高,当nFe/nMn=0.241时,催化活性最好,且有较大的pH适用范围。亚甲基蓝的异相催化降解过程符合准一级动力学方程。催化剂循环使用3次,仍然具有良好的活性。
铁柱撑蒙脱土-δ-MnO2复合体;异相催化;亚甲基蓝
0 引言
高级氧化技术(advanced oxidation processes,AOPs)以其适用范围广、氧化处理迅速彻底等特点而被广泛应用于处理有机废水,尤其是用于对生物有较大毒性或难以生化降解的废水治理[1]。其中Fe2+与H2O2形成的Fenton体系在处理有机废水时具有较广泛的前景,可以将染料降解为易生化降解的小分子有机物,甚至彻底矿化为二氧化碳和水[2]。但传统的均相Fenton技术只能在较小的pH值(pH<4)范围内使用,并且会产生铁离子而造成二次污染。针对Fenton技术的这些缺点,已有不少关于异相类Fenton催化剂处理有机污染物的报道,如分子筛固定铁催化剂[3]、粘土固定铁催化剂[4]等。蒙脱土作为粘土的一种,近来用铁柱撑蒙脱土与H2O2形成的异相Fenton体系已得到较多的关注,另外,当有UV照射存在时,由于会加速催化剂与废水之间的电子传递,所以用铁柱撑蒙脱土作异相photo-Fenton体系的光催化剂降解有机物出现了大量报道,如Li等利用铁柱撑蒙脱土作异相photo-Fenton体系的光催化剂降解偶氮染料[5],De León等用Fe-Mt/H2O2/UV体系光降解亚基蓝[6]。
由于Fenton体系中存在的电子转移过程,所以拥有多种氧化态的催化剂在Fenton体系中会有良好的催化性能。锰氧化物是土壤与海洋、湖泊及河流沉积物中广泛存在的一类活性氧化物,它既是植物锰素的重要来源,又影响和决定着许多其它营养元素、重金属元素及有机污染物的行为和归趋[7]。锰元素有多种氧化态,锰氧化物(α-MnO2、β-MnO2、γ-MnO2和δ-MnO2)在许多领域都有广泛的应用。目前已有不少关于锰氧化物-H2O2体系产生活性自由基的报道,如Mn3O4/SBA-15体系生成OH·[8],β-MnO2/H2O2体系生成O2·-和HO2·[9],软锰矿-H2O2体系生成O2·-/ HO2·[10],层状水钠锰矿-H2O2生成O2·-和·OH[11]。
目前用单独的铁柱撑蒙脱土或锰氧化物做Fenton体系催化剂催化H2O2降解有机物的报道已很多,但将2种催化剂复合到一起作为催化剂却未见报道。鉴于此,本实验以辽宁某地的钙基蒙脱土为原料,首先制得聚合羟基铁柱撑蒙脱土,再将用氧化还原法制得的δ-MnO2覆盖于羟基铁柱撑蒙脱土的表面,形成羟基铁柱撑蒙脱土-δ-MnO2复合体,采用X射线衍射分析、扫描电子显微镜等对其进行表征,并以亚甲基蓝模拟废水作为处理对象,考察羟基铁柱撑蒙脱土-δ-MnO2复合体异相Fenton法催化性能。
1 实验部分
1.1 实验材料
原料取自辽宁产的钙基蒙脱土,H2O2(30%)、Na2CO3、Fe(NO3)3·9H2O、MnSO4·H2O、KMnO4、NaOH、KNO3、AgNO3、对苯醌、叔丁醇等所用试剂均为分析纯,实验用水为去离子水。
1.2 羟基铁柱撑蒙脱土的制备
羟基铁柱撑蒙脱土的制备:室温、通N2搅拌条件下,将Na2CO3分批加入到Fe(NO3)3·9H2O溶液中,控制铁离子与钠离子的物质的量之比为1∶1,陈化24 h得到红褐色透明羟基铁柱撑液。在搅拌的状态下,将铁柱撑液与蒙脱土(MTT)相混合,并控制铁离子浓度与蒙脱土的比例为10 mmol·L-1·g-1,60℃温度下搅拌铁柱撑液6 h,静置过夜,洗涤、离心后在105℃烘干,研磨过120目筛,制得暗黄色聚合羟基铁柱撑蒙脱土(Hydroxyl-pillared bentonite,H-Fe-PE)。
1.3 δ-MnO2和羟基铁柱撑蒙脱土-δ-MnO2复合体的制备
δ-MnO2和羟基铁柱撑蒙脱土-δ-MnO2复合体的制备均采用改进的Murray曾使用的方法[12]:搅拌条件下,在6.9 mmol·L-1的MnSO4溶液中,滴加入等体积的4.6 mmol·L-1的KMnO4和6.9 mmol·L-1的NaOH混合溶液。洗涤、离心,然后将样品浸泡于1.5 mmol·L-1KNO3溶液中,再用去离子水洗涤、离心,冷冻干燥。研磨,过120目筛,得到δ-MnO2;搅拌条件下,将一定量的羟基铁柱撑蒙脱土加入到6.9 mmol·L-1的MnSO4溶液中,(使H-Fe-P-E浓度分别为48.00、36.00、18.00、9.00和4.50g·L-1),搅拌30 min,滴加入等体积4.6 mmol·L-1的KMnO4和6.9 mmol·L-1的NaOH混合溶液,陈化、洗涤、离心,然后将样品浸泡于1.5mmol·L-1KNO3溶液中,再用去离子水洗涤、离心,冷冻干燥。研磨,过120目筛,得到羟基铁柱撑蒙脱土-δ-MnO2复合体(H-Fe-P-E-M)。
注:在以下的实验当中,主要以H-Fe-P-E浓度为9.00g·L-1时的复合体为研究对象。
1.4 样品表征
催化剂的晶相结构在D8 Advance型(德国Bruker公司)X射线粉末衍射(XRD)仪上测定,Cu Kα (λ=0.154 06 nm),电压40 kV,电流40 mA,步进扫描,步长为0.02°,扫描速度为1°·min-1。
催化剂比表面积测定在SSA全自动比表面和孔径分布分析仪上进行(Quantachrome Autosorb-1,JEDL-6390/LV)。称取矿物粉末0.100 0~0.200 0 g,在110℃脱气3 h,采用N2吸附法,测定比表面积。样品扫描电镜(field emission scanning electron microscopy)分析在JEOL场发射扫描电子显微镜(JSM6700F,Japan)上进行。
1.5 实验过程及分析
催化反应过程在恒温气浴振荡器内进行,实验过程中温度控制在25℃。将10 mg的样品粉末加入到100 mL预先用稀HCl和NaOH调节好pH值的50 mg·L-1的MB溶液中,以150 r·min-1的速率搅拌60 min建立吸附/解吸平衡,用此时反应液的浓度作为反应的初始浓度。然后在此悬浮液中加入一定量的H2O2,在设定的时间间隔取样,用UV-Vis分光光度计(UV-2550,日本岛津)于亚甲基蓝的最大吸收波长(λmax=664 nm)处测MB吸光度。每组实验平行进行3次。
催化剂中铁含量用菲咯啉显色法测定,锰含量用火焰原子吸收分光光度法测定。
2 结果与讨论
2.1 结构表征
图1为MTT、H-Fe-P-E、H-Fe-P-E-M和δ-MnO2在0°~80°的XRD衍射图。从图1可以看出羟基铁柱撑蒙脱土和柱撑蒙脱土-δ-MnO2复合体的谱线特征没有明显的区别,说明二者的基本成分和结构没有发生明显改变。羟基铁柱撑蒙脱土-δ-MnO2复合体并未出现δ-MnO2晶相在37.58°处的特征衍射峰,这可能是因为羟基铁柱撑蒙脱土阻碍了δ-MnO2结晶,增加了其无定形的程度,使其不是以晶相形式存在,而是以高分散的形式存在于柱撑蒙脱土上,这种高分散的状态使催化剂具有更高的催化活性。
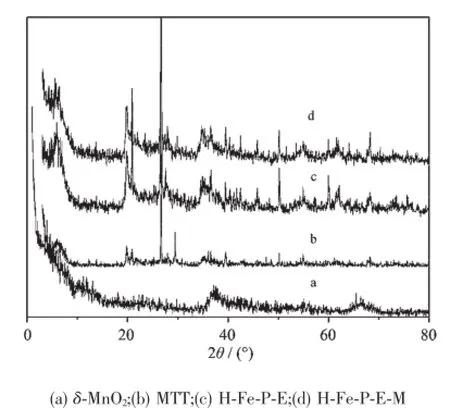
图1 不同物料的X射线衍射图Fig.1 X-ray diffraction patterns of different samples
(001)峰是蒙脱土的特征峰,反映了蒙脱土层间结构的大小。由表1知,蒙脱土原土的底面间距(d001)为1.47 nm,柱撑后的蒙脱土的底面间距增加到了1.51 nm,表明羟基铁被成功的交换到了蒙脱土层间。羟基铁柱撑蒙脱土-δ-MnO2复合体的底面间距增加到1.55 nm。另由表1知,羟基铁柱撑蒙脱土-δ-MnO2复合体的比表面积增加到原土的近3倍,且大于单一的羟基铁柱撑蒙脱土。说明δ-MnO2被吸附固定在蒙脱土边缘的硅氧烷表面,形成了纳米级的锰氧化物,增加了其外表面积,提高了催化活性。
图2(a)为蒙脱土的SEM图,它呈片状及沟壑状结构;图2(b)为铁柱撑蒙脱土的SEM图,阳离子柱撑进入蒙脱土层间后,出现一些相对较大的孔隙,表明柱撑成功。颗粒形状无规则,微细颗粒相互堆积,大小不均;图2(c)为羟基铁柱撑蒙脱土-δ-MnO2复合体的SEM图,可看出有分布不均匀的颗粒状突起和褶皱,且孔隙相对柱撑蒙脱土变小。
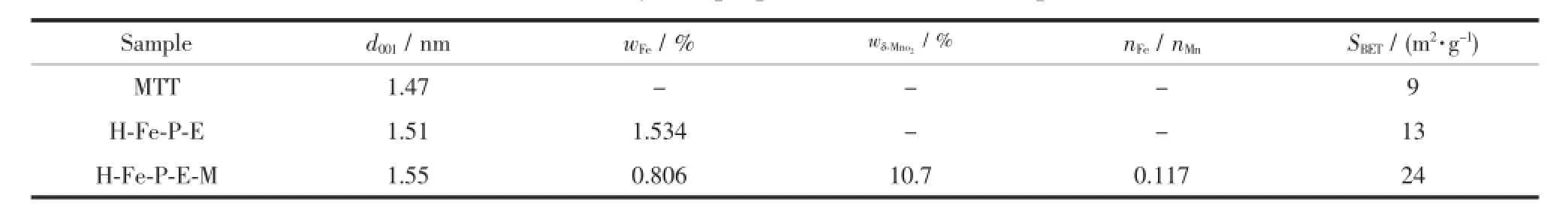
表1 不同材料的物性Table1 Physical p roper ties of different sam p les
2.2 不同反应体系的催化性能比较
为了评估羟基铁柱撑蒙脱土-δ-MnO2复合体对亚甲基蓝的催化降解性能,比较进行了不同催化剂催化H2O2降解亚甲基蓝的实验,结果如图3所示。

图2 不同材料的扫描电镜Fig.2 SEM m icrographs of different materials
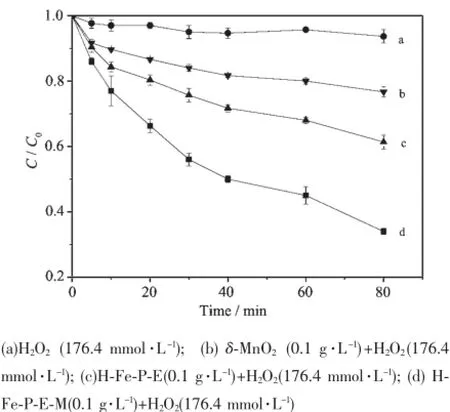
图3不同反应体系下亚甲基蓝的降解效果图Fig.3 Degradation of MB under different conditions
图3 可知,不同体系对亚甲基蓝的降解能力不同。反应80 min,当仅加入176.4 mmol·L-1H2O2时,亚甲基蓝几乎没有降解。相反,当加入176.4 mmol· L-1H2O2的同时加入0.1 g·L-1的δ-MnO2、H-Fe-P-E和H-Fe-P-E-M,降解率分别达到23.3%、38.7%和66.0%。这说明单纯的H2O2作为氧化剂降解亚甲基蓝的能力极其有限,经δ-MnO2复合后的羟基铁柱撑蒙脱土对亚甲基蓝的催化降解性能明显优于单纯的羟基铁柱撑蒙脱土和δ-MnO2。
2.3 催化降解实验结果
2.3.1 H2O2初始浓度对催化效果的影响
作为氧化剂的H2O2在催化亚甲基蓝的过程中,由于会产生氧化性很强的自由基,因此是极为重要的一个影响因素。实验研究了不同H2O2初始浓度对50 mg·L-1的亚甲基蓝的催化性能(见图4),并进行了准一级反应动力学方程拟合,拟合结果见图5和表2。
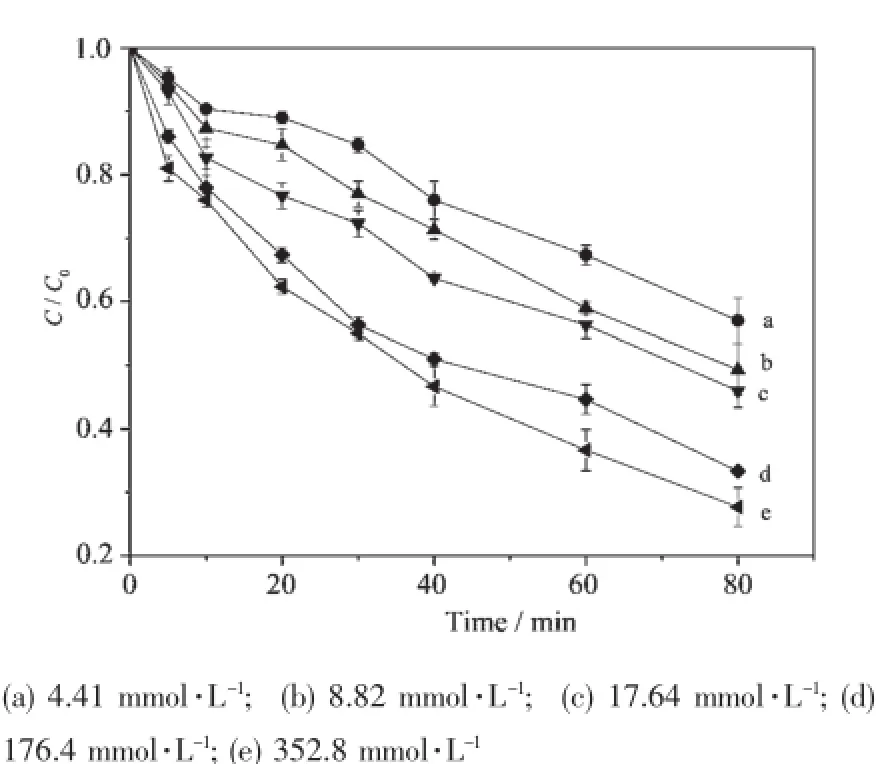
图4 H2O2初始浓度对亚甲基蓝降解的影响Fig.4 Effect of initial concentration of H2O2on degradation ofMB in H-Fe-P-E-M suspensions
由图4可知,当H2O2浓度从4.41 mmol·L-1增加到352.8 mmol·L-1时,亚甲基蓝的降解率随之增加。这是因为在一定的浓度范围内,随H2O2浓度增加,体系通过反应能产生更多的O2·-、·OH,从而可以有效的提高染料的降解率。
应用动力学模型对图4中亚甲基蓝降解数据的平均值进行拟合,发现不同H2O2浓度下亚甲基蓝的催化降解过程均符合准一级动力学方程,得到的拟合相关系数均在0.96以上。据此,建立亚甲基蓝的催化降解反应动力学方程如下:

式中r为反应速率,t为反应时间,Ct为t时刻亚甲基蓝的浓度。k为反应的表观动力学常数。将式(1)积分,得到式(2):

由拟合结果可知(表2),当H2O2浓度分别为4.41、8.82、17.64、176.4和326.8 mmol·L-1时,亚甲基蓝降解的准一级动力学常数分别为0.006 75、0.008 56、0.008 79、0.012 80、0.015 14 min-1,这表明随H2O2浓度的增加亚甲基蓝的降解率升高,与前述实验结果相同。
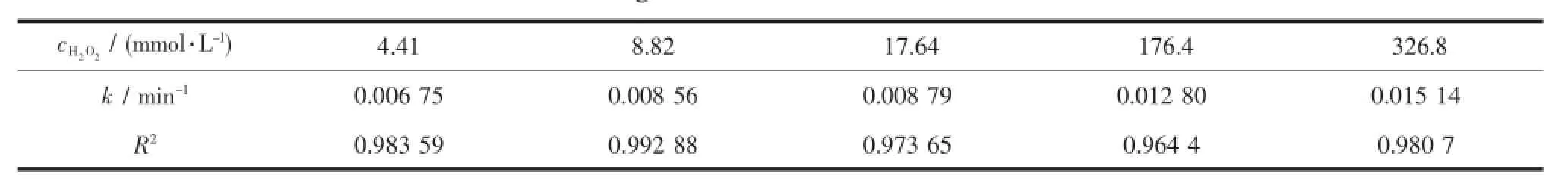
表2 不同实验条件下羟基铁柱撑蒙脱土-δ-M nO2复合体异相催化降解亚甲基蓝的动力学线性回归拟合Table2 Plot of degradation of M B under different conditions
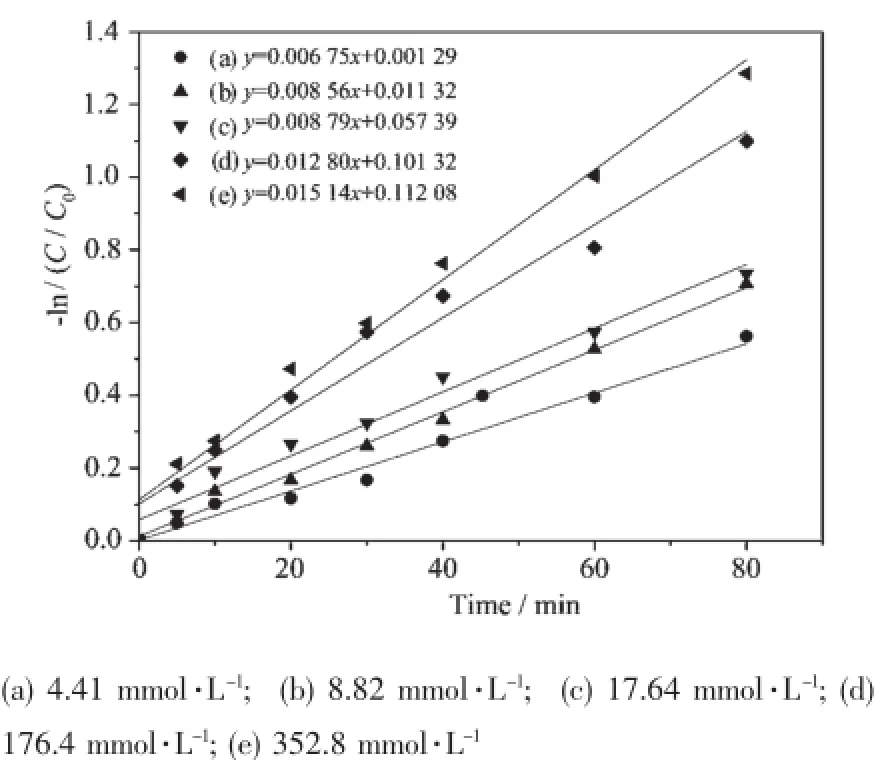
图5 不同H2O2初始浓度时亚甲基蓝降解动力学线性拟合Fig.5 Kinetics fitting of MB degradation reaction at different initial concentration of H2O2
2.3.2 不同δ-MnO2含量复合体对催化效果的影响
搅拌条件下,将一定量的羟基铁柱撑蒙脱土加入6.9 mmol·L-1的MnSO4溶液中(使H-Fe-P-E浓度分别为48.00、36.00、18.00、9.00和4.50g·L-1),搅拌30 min,滴加入等体积4.6 mmol·L-1的KMnO4和6.9 mmol·L-1的NaOH混合溶液,制备了5种不同δ-MnO2含量的羟基铁柱撑蒙脱土-MnO2复合体(H-Fe-P-E-M),分别记为H-Fe-P-E-M-1、H-Fe-P-E-M-2、HFe-P-E-M-3、H-Fe-P-E-M-4、H-Fe-P-E-M-5。不同δ-MnO2含量复合体催化剂的物性如表3,图6为不同催化剂的催化降解结果。
由图6知,反应80 min后,H-Fe-P-E-M-1、H-Fe-P-E-M-2、H-Fe-P-E-M-3、H-Fe-P-E-M-4和H-Fe-P-EM-5对亚甲基蓝的催化降解率则分别为61.0%、67.3%、68.3%、66.0%、57.3%,降解率随δ-MnO2含量的增加呈现先增后减的趋势,当δ-MnO2含量为4.715%(nFe/nMn=0.241)时,催化性能最好。这可能是因为在一定质量的H-Fe-P-E-M中,当δ-MnO2含量较低时,δ-MnO2相对柱撑蒙脱土较少,使其可以更好的以高分散形态负载于蒙脱土上,具有较高的催化活性。而当δ-MnO2含量较高时,δ-MnO2相对柱撑蒙脱土较多,δ-MnO2之间容易发生团聚,不利于在蒙脱土上的分散,催化活性降低。
2.3.3 初始pH值对催化效果的影响
不同pH值条件下羟基铁柱撑蒙脱土-δ-MnO2复合体对亚甲基蓝的催化降解结果见图7。
由图7可知,降解率随pH值升高(2.4~6.5)而降低。反应80 min,初始pH值分别为6.5、4.5、2.4的条件下降解率分别为47.3%、53.3%、66.00%。前人的研究已经表明,当溶液的pH≥4时,由于铁离子的沉淀及一些自由基清除剂(如CO32-/HCO3-)的浓度较高,使H2O2分解[13],均相Fenton或photo-Fenton体系的pH值适宜范围仅为2~4,而该催化剂在pH值为6.5时对反应仍有较高的催化性能,扩大了Fenton反应的适用范围。至于在酸性条件下,催化效果更好,可作如下解释:在较低pH值时(2.4左右),能够有效活化H2O2产生高活性的氧化物种,使得催化剂氧化电势增大,催化剂有更强的氧化能力,增强了其催化活性。

表3 不同δ-MnO2含量复合体催化剂的物性Table3 Physical properties of the catalysts contained different δ-M nO2
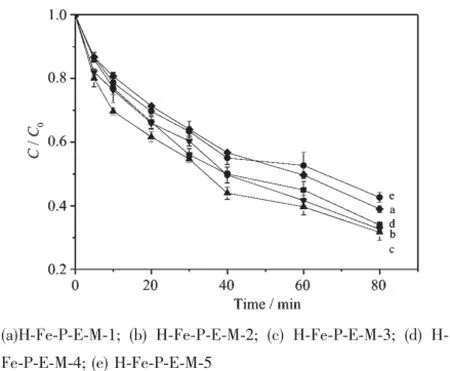
图6 不同δ-MnO2含量对亚甲基蓝降解的影响Fig.6 Effect of different δ-MnO2contents on degradation of MB in H-Fe-P-E-M suspensions
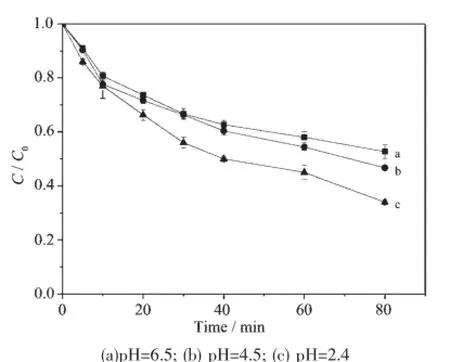
图7 不同pH值条件下亚甲基蓝降解情况Fig.7 Effect of different pH values on degradation of MB in H-Fe-P-E-M suspensions
2.3.4 催化剂的循环使用对催化剂的影响
为了验证H-Fe-P-E-M催化剂的稳定性,进行催化降解MB的循环利用实验(图8)。做每一个循环之前将上一循环的反应物通过高速离心机以4 500 r· min-1将H-Fe-P-E-M催化剂与溶液分离,并置于冷冻干燥机中干燥后过筛。按照前面的实验步骤,将回收的H-Fe-P-E-M加入50 mg·L-1MB溶液中,进行下一个循环的反应。从图8可知,反应80 min后,3次循环反应的催化降解率分别为65.7%、63.7%、58.7%,催化效果并未出现较大的下降,说明H-Fe-P-E-M对MB具有较稳定的催化降解性能,H-Fe-PE-M可重复使用。
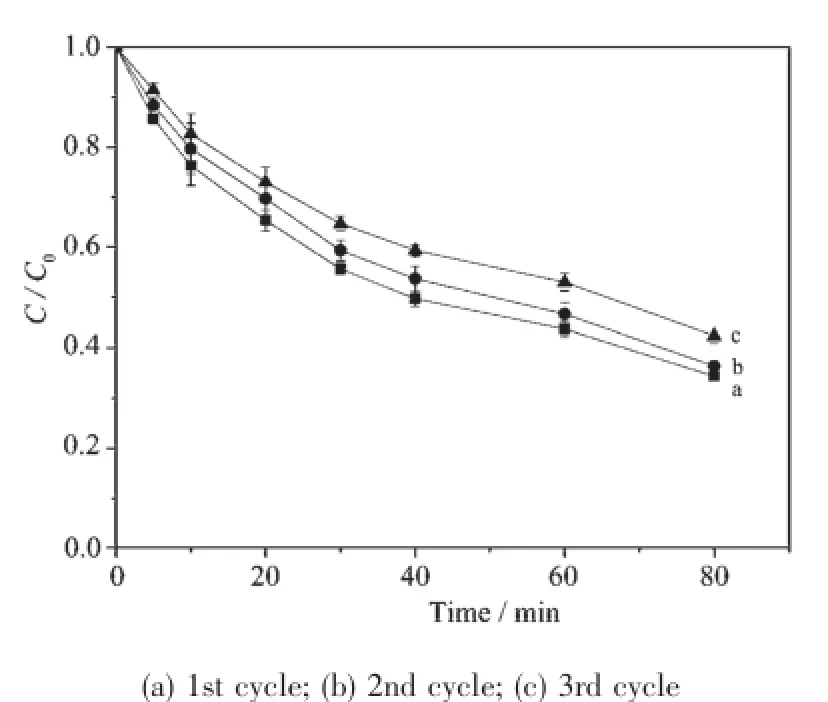
图8 催化剂的循环利用对亚甲基蓝降解的影响Fig.8 Effect of cyclic usage of catalyst on the degradation of MB
2.4 反应机理初探

图9 加入不同捕获剂对亚甲基蓝降解的影响Fig.9 Degradation of MB(50 mg·L-1)in the presence of different scavenger
为了确定反应中到底是何种物质起主要作用,加入一定量的对苯醌、叔丁醇和AgNO3,分别作为O2·-、·OH和电子的自由基捕收剂。实验结果如图9所示,由图9可知,相对于不加捕获剂时,对苯醌和AgNO3的加入对亚甲基蓝的降解有较大的抑制作用,而叔丁醇的加入对亚甲基蓝降解的抑制作用相对较小,反应80 min后,不加捕获剂时的催化降解率为65.7%,对苯醌、叔丁醇和AgNO3的加入使降解率分别降为47.6%、46.0%和59.1%,这说明在催化反应中O2·-和·OH自由基均起到了作用。另外,Chen和Pignatello已经验证了对苯醌作为电子转移体可以加速Fe向Fe的转化[15],则对苯醌的加入会促进Fe对反应的催化进行,但实验结果证明对苯醌的加入会抑制反应进行,这是由于催化剂中wFe=0.806%、wδ-MnO2=10.7%,且δ-MnO2以高分散的形式覆盖于铁柱蒙脱土表面,使对苯醌对δ-MnO2-H2O2体系产生的O2·-的捕获作用大于对Fe-H2O2体系产生的·OH的促进产生作用,致使整个催化反应仍为抑制状态。这说明反应中起主要作用的是锰氧化物和H2O2会产生O2·-自由基。
3 结论
合成了羟基铁柱撑蒙脱土-δ-MnO2复合催化材料,表征结果表明δ-MnO2是以高分散的形式存在羟基铁柱撑蒙脱土上。催化降解实验结果表明,在实验条件范围内,亚甲基蓝的脱色率随双氧水浓度的增加而增大,且异相催化降解过程服从准一级动力学方程。当H-Fe-P-E-M中δ-MnO2含量为4.715%(nFe/ nMn=0.241)时,催化剂的催化活性最佳,且在酸性条件下(pH=2.4左右)有较好的催化活性。加入不同的捕获剂后验证了反应中其主要作用的是锰氧化物和H2O2会产生O2·-自由基。
[1]YUAN Bao-Ling(苑宝玲),CHEN Yi-Ping(陈一萍),LI Yan-Bo(李艳波),et al.Acta Sci.Circumst.(环境科学学报), 2005,25:925-929
[2]Lucas M S,Peres J A.Dyes Pigm.,2006,71(3):235-243
[3]Kasiri M B,Aleboyeh H,Aleboyeh A.Appl.Catal.B:Environ., 2008,84:9-15
[4]Chen Q,Wu P,Li Y,et al.J.Hazard.Mater.,2009,168:901-908
[5]Li Y M,Lu Y Q,Zhu X L.J.Hazard.Mater.,2006,132(2): 196-201
[6]De León M A,Castiglioni J,Bussi J.et al.Catal.Today, 2008,133-135:600-605
[7]Vodyanitskii Y.Eurasian Soil Sci.,2009,42(10):1170-1178
[8]Han Y F,Chen F X,Ramesh K.et al.Appl.Catal.B:Environ., 2007,76:227-234
[9]Watts R J,Sarasa J,Loge F J,et al.J.Environ.Eng., 2005,131:158-164
[10]Do S H,Batchelor B,Lee H K,et al.Chemosphere,2009, 75:8-12
[11]Zhang L L,Nie Y L,Hu C,et al.J.Hazard.Mater.,2011, 190:780-785
[12]Murray J W.J.Colloid Interface Sci.,1974,46(3):357-371
[13]Zhang H,Fu H,Zhang D B.J.Hazard.Mater.,2009,172: 654-660
[14]Furman O,Laine D F,Blumenfeld A,et al.J.Environ.Sci. Technol.,2009,43:1528-1533
[15]Chen R,Pignatello J.J.Environ.Sci.Technol.,1997,31: 2399-2406
Heterogeneous Fenton Degradation of Methylene Blue by δ-MnO2-Coated Fe-Pillared Bentonite
SHI Zhong-Liang WANG Xing-Xing YAO Shu-Hua*
(School of Applied Chemistry,Shenyang University of Chemical Technology,Shenyang 110142,China)
A series of δ-MnO2-coated Fe-pillared bentonite composite materials were synthesized and the samples were used as catalysts for the heterogeneous Fenton degradation of methylene blue.The microstructure of the catalysts was characterized by X-ray diffraction(XRD),specific surface area measurements(SBET),scanning electron microscopy(SEM).The results showed that the pillaring process increased the basal spacing(d001)from 1.47 nm for bentonite(MTT)to 1.51 nm for the Hydroxyl-pillared bentonite(H-Fe-P-E)and 1.55 nm for the δ-MnO2-coated Fe-pillared bentonite(H-Fe-P-E-M).The SBETvalues of the samples were increased after pillaring compared with bentonite.The catalytic activity of different samples was estimated by measuring the degradation rate of methylene blue(MB)in aqueous solution at MB concentration=50 mg·L-1,catalyst dosage=0.1 g·L-1,T=25℃,and the effects of various experimental parameters such as initial H2O2concentration,δ-MnO2content and initial solution pH value on MB degradation were studied.The results showed that the catalytic activity of δ-MnO2-coated Fepillared bentonite increased with H2O2concentration and reached a optimal catalytic result when the molar ratio of nFe/nMn=0.241.The kinetics of degradation reaction can be expressed by the first-order reaction kinetic model.In addition,the recyclability of the prepared catalyst is also confirmed.The catalyst retains high activity after being used three times.
δ-MnO2-coated Fe-pillared bentonite;Heterogeneous catalysis;Methylene blue
O643
A
1001-4861(2015)04-0696-07
10.11862/CJIC2015.112
2014-09-24。收修改稿日期:2014-12-23。
国家自然科学基金(No.41373127),辽宁省自然科学基金项目(No.2013020121)资助。*

