二氢卟吩e6光动力对人结肠癌SW620细胞周期和凋亡的影响*
康玲,徐隽,张杰,马艳
(1.新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室,新疆 乌鲁木齐 830011;2.新疆医科大学第一附属医院牙周黏膜科,新疆 乌鲁木齐 830011)
·论著·
二氢卟吩e6光动力对人结肠癌SW620细胞周期和凋亡的影响*
康玲1,徐隽2,张杰1,马艳1
(1.新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室,新疆 乌鲁木齐 830011;2.新疆医科大学第一附属医院牙周黏膜科,新疆 乌鲁木齐 830011)
目的研究二氢卟吩e6光动力疗法(Ce6-PDT)对人结肠癌SW620细胞周期和凋亡的影响,为阐明Ce6-PDT杀伤结肠癌细胞的机制提供资料。方法激光共聚焦显微镜观察Ce6在SW620细胞中的亚定位。不同浓度Ce6-PDT(0、0.125、0.25、0.5、1.0、2.0、4.0及8.0μg/ml)处理SW620细胞后,荧光显微镜观察活性氧的产生,流式细胞术检测细胞周期和凋亡,Western blot检测细胞Caspase-3、Bcl-2、Beclin 1及LC3B蛋白表达。结果Ce6主要定位于内质网中,其次位于线粒体中,细胞核和溶酶体中几乎无分布。Ce6-PDT可诱导活性氧的产生。随着Ce6浓度的增加,Ce6-PDT能引起细胞G0/G1期阻滞、S期细胞比例减少和细胞凋亡率增加(P<0.05)。Western blot结果显示,不同浓度Ce6-PDT处理细胞后,Caspase-3和Bcl-2蛋白表达各组差异有统计学意义(P<0.05)。LC3B蛋白表达随着Ce6浓度的增加先下调后上调(P<0.05)。结论Ce6-PDT通过诱导细胞周期阻滞和凋亡抑制SW620细胞增殖、引起细胞死亡,Caspase-3、Bcl-2及LC3B可能参与了其光动力杀伤细胞的过程。
结直肠肿瘤;二氢卟吩e6;光动力疗法;凋亡;自噬
结直肠癌是全球常见的恶性肿瘤之一,据流行病学调查资料显示,无论从新发病例还是估计死亡病例而言,结直肠癌在欧美仍旧是第2或第3位常见恶性肿瘤[1-2]。我国结直肠癌发病率呈逐年上升趋势,预计我国结直肠癌新发病例仍将逐年增多[3]。传统放化疗治疗对晚期转移性结直肠癌的疗效并不理想,而且也会给患者带来许多难以耐受的副作用。我们的前期研究发现二氢卟吩e6光动力治疗(Chlorin e6 photodynamic therapy,Ce6-PDT)在体外能够杀伤转移潜能结肠癌细胞SW620、抑制细胞增殖,但其抑制细胞增殖、杀伤细胞引起细胞死亡的机制仍不清楚[4]。PDT可以通过直接杀死细胞导致细胞死亡(如诱导细胞凋亡、自噬或坏死引起细胞死亡),也可通过破坏肿瘤血管或激活抗肿瘤免疫反应引起肿瘤细胞死亡[5]。本实验旨在前期研究基础之上探讨Ce6-PDT直接杀伤SW620细胞的可能机制,为Ce6-PDT应用于结肠癌治疗提供理论依据。
1 材料和方法
1.1 试剂与仪器
二氢卟吩e6(美国Frontier Scientifici公司),Leibovitz’s L-15培养基及胎牛血清(美国Gibco公司)。碘化丙啶PI及RNase(美国Sigma公司),细胞器荧光探针ER-TrackerTMGreen、LysoTracker Deep Red及MitoTracker Green FM(美国Life Technologies公司),RIPA细胞裂解液(美国Thermo Scientific公司),兔抗人Beclin 1及LC3B多克隆抗体(英国Abcam公司),兔抗人Bcl-2及Caspase-3多克隆抗体(美国Cell Signaling公司),兔抗人β-Actin多克隆抗体(美国Santa Cruz公司),凋亡检测试剂盒(瑞士Roche公司),活性氧检测试剂盒(中国碧云天公司),人SW620结肠癌细胞购自南京凯基生物科技发展有限公司(自ATCC引入),900 FORMA恒温二氧化碳CO2培养箱(美国Thermo Scientific公司),荧光倒置显微镜(日本Olympus公司),流式细胞仪(美国BD公司),激光扫描共聚焦显微镜(德国Leica公司),半导体激光仪(西北大学光电子技术重点实验室)。
1.2 方法
1.2.1 光敏剂准备和光照处理将Ce6在避光避声条件下溶解于PBS(pH=7.4)中,质量浓度为2 mg/ml,过滤除菌-20℃避光保存备用。光照各组细胞加不同浓度Ce6进行孵育,使用半导体激光仪垂直照射,光照波长650 nm,输出功率32 mW,照射剂量6 J/cm2。然后继续培养至实验结束时进行检测。
1.2.2 细胞培养及实验分组SW620细胞用含10%胎牛血清、2 mmol/L谷氨酰胺的Leibovitz’s L-15培养基培养,置于37℃、湿度100%、5%CO2恒温培养箱中,2~3 d传代1次,取对数生长期细胞用于实验。研究分实验组和对照组,对照组设空白对照和单纯光敏剂组。实验组加入不同浓度的Ce6培养基孵育后进行光照。各实验实施中均避光进行,实验重复3次。
1.2.3 共聚焦显微镜观察Ce6的亚细胞定位取对数生长期细胞,胰酶消化后调整细胞密度为1× 105个/ml,取2 ml细胞悬液接种至激光共聚焦皿中,置培养箱中培养24 h。吸弃培养基,PBS冲洗3次,将含0.5μg/ml Ce6的培养基1 ml加入激光共聚焦皿中孵育4 h,吸弃培养基,PBS冲洗3次,各皿分别加入浓度为1μmol/L、50 nmol/L、100 nmol/L的内质网ER-TrackerTMGreen探针、溶酶体LysoTracker Deep Red探针、线粒体MitoTracker Green FM探针各1 ml,37℃避光孵育30 min,PBS冲洗细胞3次,共聚焦显微镜下观察Ce6在细胞中的亚定位。
1.2.4 荧光显微镜观察活性氧取2 ml密度为1× 105个/ml的SW620细胞悬液接种于6孔板中,培养24 h后,吸弃培养基,PBS冲洗3次后分别加入不同浓度的Ce6(0,0.125,0.25及0.5μg/ml),避光孵育4 h,吸弃培养基,PBS冲洗3次后进行光照。激光照射后加入新鲜培养基继续培养1 h,吸弃培养基,PBS冲洗3次,每孔加入无血清培养基稀释的2',7'-二氯荧光黄双乙酸盐(2',7'-dichlorofluorescin diacetate,DCFH-DA,1∶1 000)1 ml,阳性对照加入活性氧诱导剂,37℃细胞培养箱内孵育20 min。无血清培养基洗涤细胞3次,荧光倒置显微镜下观察荧光。Image J软件分析荧光强度。
1.2.5 流式细胞术检测细胞周期与细胞凋亡SW620细胞按4×105个/ml的密度接种于6孔板中,培养24 h后,吸弃培养基,PBS冲洗3次后分别加入含0、0.125、0.25、0.5、1.0、2.0、4.0及8.0μg/ml Ce6的培养基,避光孵育4 h,吸弃培养基,PBS冲洗3次后进行光照。激光照射后加入新鲜培养基继续培养24 h,离心收集各组细胞。测定细胞周期的各组细胞加入70%冰乙醇4℃固定过夜,冷PBS洗去固定液,加入RNase(50μg/ml)轻轻混匀后37℃反应30 min,加入PI(50μg/ml)4℃避光染色30 min。测定细胞凋亡的各组细胞加入AnnexinⅤ和PI各20μl,轻轻混匀后避光染色20 min。流式细胞仪检测细胞周期和凋亡。
1.2.6 Western blot检测细胞Caspase-3、Bcl-2、Beclin 1及LC3B蛋白表达分组和干预同前。收集细胞后用RIPA细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。上样量50μg总蛋白,10% SDS-PAGE胶电泳,电泳后转至NC膜,用含5%脱脂奶粉的TTBS室温封闭NC膜2 h,TTBS洗膜3次,每次10 min,加入一抗Caspase-3(1∶1 000)、Bcl-2(1∶1 000)、Beclin 1(1∶2 000)、LC3B(1∶3 000)及β-Actin(1∶3 000),完全浸润NC膜,室温孵育1 h后,放于4℃过夜,次日TTBS洗膜3次,每次10 min,加入辣根过氧化物酶标记的二抗(1∶10 000),室温孵育45 min,TTBS洗膜3次后ECL试剂曝光、显影和定影。Image J软件分析条带灰度。
1.3 统计学方法
实验数据用SPSS 19.0软件进行统计分析,实验数据以均数±标准差(±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ce6在SW620细胞内的定位
Ce6与SW620细胞孵育后,分别加入内质网探针ER-TrackerTMGreen、溶酶体探针LysoTracker Deep Red、线粒体探针MitoTracker Green FM,共聚焦显微镜观察Ce6主要定位于内质网中,其次位于线粒体中,细胞核和溶酶体中几乎无分布(见图1)。
2.2 Ce6-PDT后SW620细胞内产生的活性氧
如图2所示,通过荧光显微镜观察,随着Ce6浓度的增加,细胞内活性氧绿色荧光强度逐渐增强。不同Ce6浓度组荧光强度差异有统计学意义(F= 85.201,P<0.05)。0 ug/ml Ce6-PDT组与Ce6对照组比较荧光强度无差异(P>0.05),其余各组与Ce6对照组比较荧光强度有差异(P<0.05),见表1。
表1 Ce6-PDT后SW620细胞内产生活性氧荧光强度比较(n=3±s)
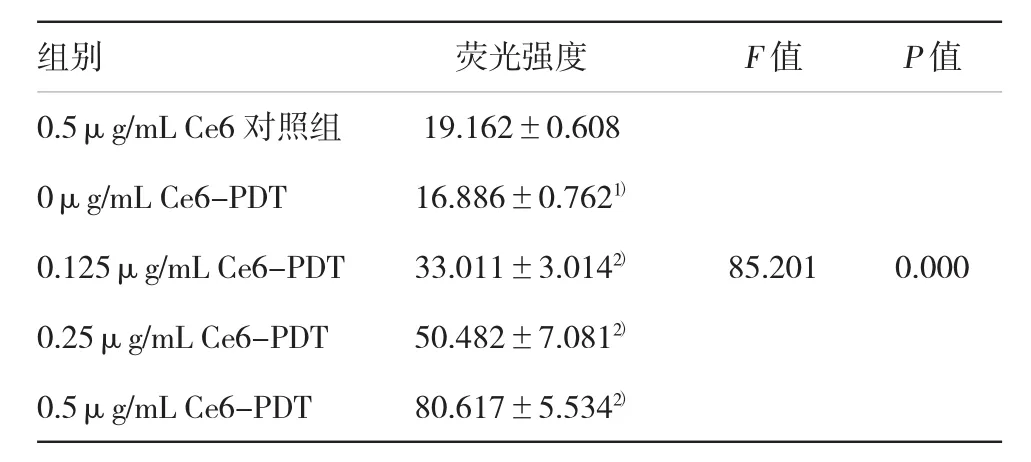
表1 Ce6-PDT后SW620细胞内产生活性氧荧光强度比较(n=3±s)
注:1)与Ce6对照组相比,P>0.05;2)与Ce6对照组相比,P<0.05
组别荧光强度F值P值0.5μg/mL Ce6对照组19.162±0.608 0μg/mL Ce6-PDT16.886±0.7621)0.125μg/mL Ce6-PDT33.011±3.0142)85.2010.000 0.25μg/mL Ce6-PDT50.482±7.0812)0.5μg/mL Ce6-PDT80.617±5.5342)
表2 Ce6-PDT对SW620细胞周期的影响(n=3±s)
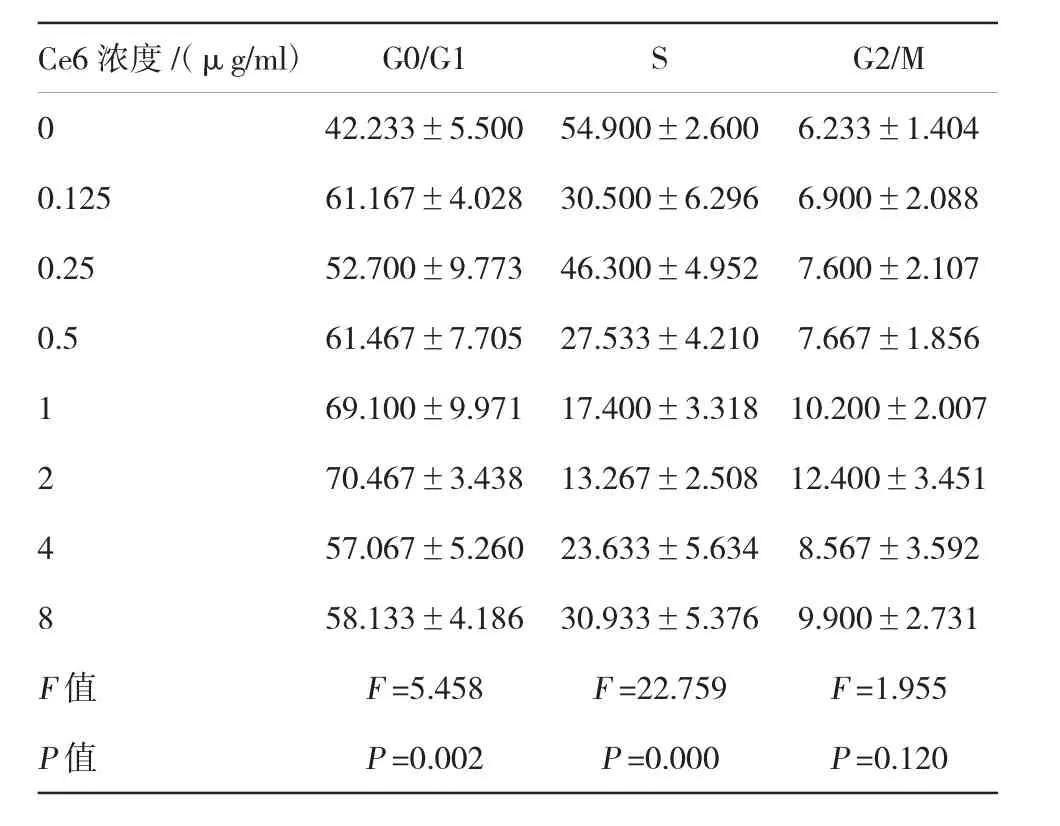
表2 Ce6-PDT对SW620细胞周期的影响(n=3±s)
Ce6浓度/(μg/ml)0 0.125 0.25 0.5 1 2 4 8 G0/G1SG2/M 42.233±5.50054.900±2.6006.233±1.404 61.167±4.02830.500±6.2966.900±2.088 52.700±9.77346.300±4.9527.600±2.107 61.467±7.70527.533±4.2107.667±1.856 69.100±9.97117.400±3.31810.200±2.007 70.467±3.43813.267±2.50812.400±3.451 57.067±5.26023.633±5.6348.567±3.592 58.133±4.18630.933±5.3769.900±2.731 F值P值F=5.458 P=0.002 F=22.759 P=0.000 F=1.955 P=0.120
2.3 Ce6-PDT对SW620细胞周期的影响
流式细胞术检测了Ce6-PDT对SW620细胞周期的影响,统计学分析结果表明,Ce6-PDT可使G0/G1期细胞比例增加(F=5.458,P<0.05),S期细胞比例减少(F=22.759,P<0.05),G2/M期细胞比例变化差异无统计学意义(F=1.955,P>0.05),提示Ce6-PDT能引起G0/G1期阻滞。
2.4 Ce6-PDT对SW620细胞凋亡的影响
由图3可以看出,当Ce6浓度小于等于1.0μg/ml时,光动力组与无光照组相比细胞凋亡率差异无统计学意义(P>0.05),Ce6浓度高于1.0μg/ml时,光动力组细胞凋亡率高于无光照组,差异有统计学意义(P<0.05)。无光照组各浓度细胞凋亡率差异无统计学意义(F=1.364,P>0.05),光动力组各浓度细胞凋亡率差异有统计学意义(F=55.085,P<0.05)。细胞凋亡图如图4所示。
2.5 Ce6-PDT对SW620细胞凋亡、自噬相关蛋白表达的影响
Western blot结果显示,不同浓度Ce6-PDT处理细胞后,Caspase-3蛋白表达上调、Bcl-2蛋白表达下调,各浓度相对灰度值差异有统计学意义(F= 66.530,P<0.05;F=51.433,P<0.05)。LC3B蛋白表达随着Ce6浓度的增加先下调后上调(F=21.254,P<0.05)。Beclin 1蛋白表达各浓度组无明显改变(F=1.757,P>0.05)。
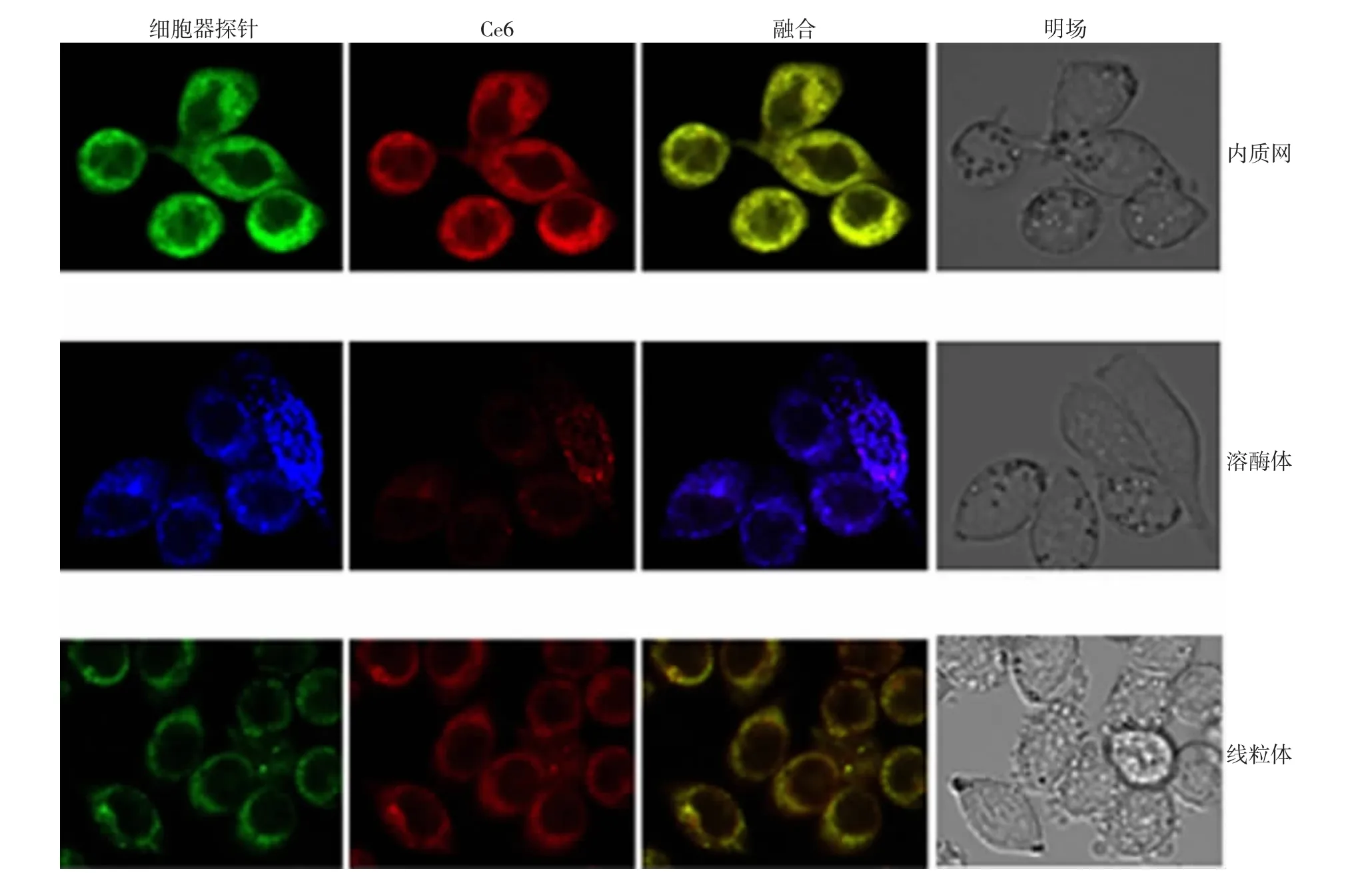
图1 Ce6在SW620细胞内的亚定位
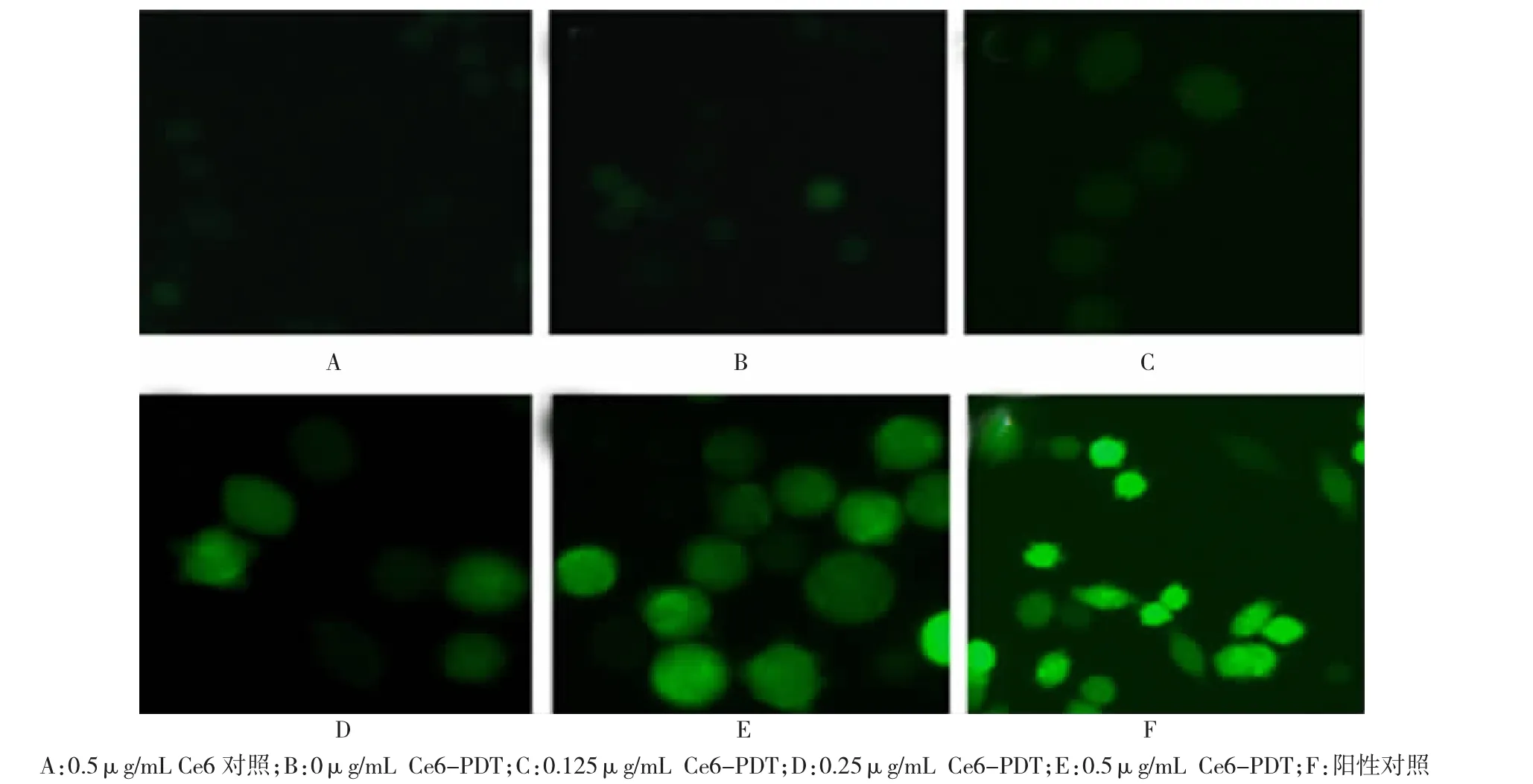
图2 Ce6-PDT后SW620细胞内产生活性氧荧光图
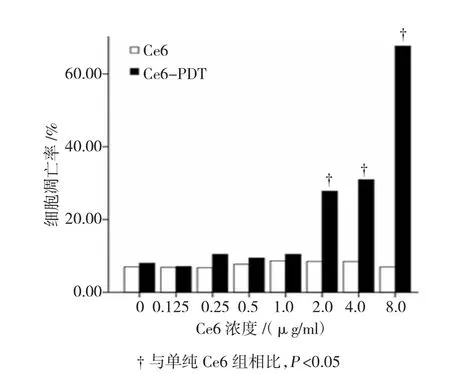
图3 Ce6-PDT对SW620细胞凋亡的影响
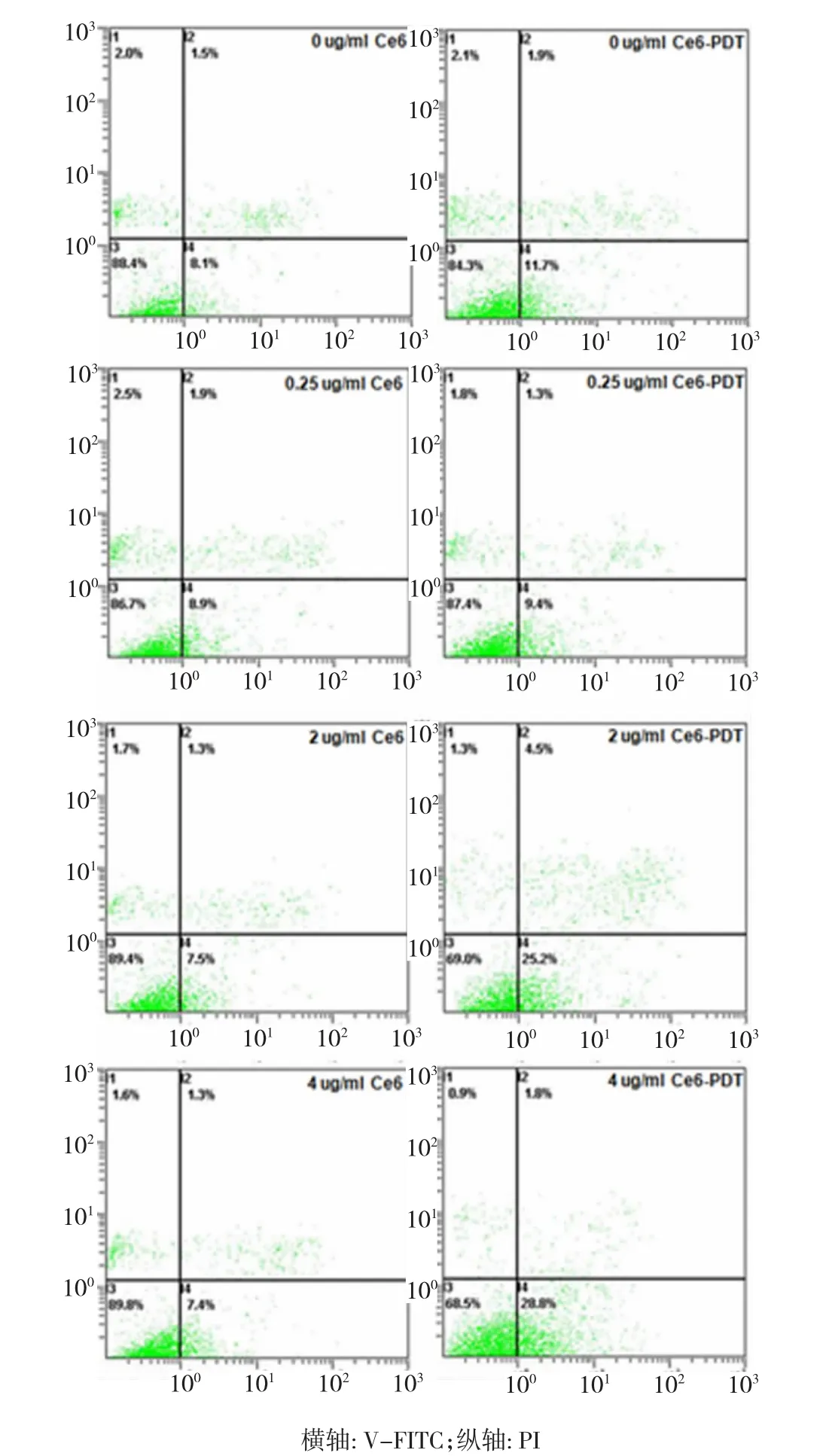
图4 Ce6-PDT诱导SW620细胞凋亡流式细胞图
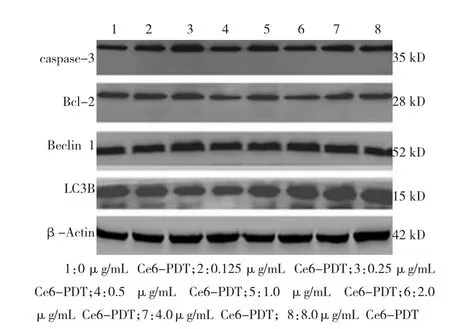
图5 Ce6-PDT对SW620细胞凋亡、自噬相关蛋白表达的影响
3 讨论
PDT的历史可追溯到20世纪初,但直到20世纪70年代,在有“光动力疗法之父”称誉的DOUGHERTY[6]的努力下,该法才得到广泛应用。PDT在加拿大、美国、德国及荷兰等许多国家已成为治疗体表及体内肿瘤的一种新方法。该方法利用光敏剂特异结合肿瘤细胞的性质,加之适当波长光激活光敏剂产生具有杀伤作用的活性氧,从而达到治疗肿瘤的目的[7]。为了探讨Ce6-PDT直接杀伤SW620细胞的可能机制,笔者首先研究了Ce6在细胞中的亚定位及其Ce6-PDT后产生的活性氧。光敏剂与细胞没有直接特异性的结合受体,对于任何一种类型的光敏剂没有一种固定的结构和细胞内定位有关,而光敏剂在细胞中亚定位不同可能会诱导不同的细胞死亡通路[8-9],所以有必要观察Ce6在SW620细胞中的亚定位。研究文献报道的光敏剂亚细胞定位有内质网、溶酶体、线粒体、高尔基体或定位于细胞膜[10-12]。本文应用激光扫描共聚焦显微成像技术观察发现Ce6在SW620细胞中主要位于内质网中,其次位于线粒体中,细胞核和溶酶体中几乎无分布。同样是Ce6在人成纤维细胞中主要定位于溶酶体[13],这也提示笔者即使是相同的光敏剂在不同的细胞中其定位也可能有所不同,引起细胞死亡的途径可能存在差异。荧光显微镜观察发现,Ce6-PDT后SW620细胞内的ROS荧光强度随着Ce6浓度的增加逐渐增强,这与随着光敏剂浓度的增加Ce6-PDT对细胞杀伤作用越强相一致。
有研究资料表明PDT可对细胞周期产生影响。光敏剂金丝桃素使人结肠癌HT-29细胞G0/G1期阻滞,同时伴随G0/G1检验点分子Cyclin E表达增加和Cyclin A表达降低[14]。四间羟基苯二氢卟吩[5,10,15,20-meta-tetra(hydroxyphenyl)chlorin,m-THPC] -PDT可使人A-431鳞状癌细胞及二羧甲氨基对乙酰氨基三苯基卟吩[5-(4'-(2''-dicarboxymethylamino)acetamidophenyl)-10,15,20-triphenylporphyrin,DTPP]-PDT可使人肺癌A-549细胞发生S期阻滞[15-16]。本研究表明随着Ce6浓度的增加,Ce6-PDT可引起细胞G0/G1期阻滞,S期细胞比例逐渐减少,这可能是笔者前期发现随着剂量的增加,Ce6-PDT使细胞增殖逐渐受抑制的原因之一,但本文尚未涉及细胞周期阻滞机制的探讨。m-THPC-PDT使A-431细胞周期阻滞与p21 mRNA和蛋白表达增加有关[15],Ce6-PDT引起SW620细胞周期阻滞是否与上述周期调控关键分子有关有待后续进一步研究。
PDT可以通过诱导细胞凋亡、自噬或坏死引起细胞死亡,这些死亡方式可能会同时发生。参与凋亡性细胞死亡的信号通路常常包括Bcl-2、Caspase家族蛋白。当PDT无法诱导凋亡性细胞死亡通路激活时,PDT可能会诱发自噬性或坏死性细胞死亡。这些死亡机制的诱导与光敏剂本身特性、光敏剂剂量及细胞种类均有关[9,17-19]。无论高剂量或低剂量,定位于线粒体的m-THPC均可引起细胞自噬和凋亡[15]。Ce6及其衍生物可引起人血管平滑肌细胞凋亡及肺腺癌ASTC-a-1细胞粒体途径细胞凋亡[20-21]。本研究发现高剂量Ce6-PDT可引起SW620细胞凋亡率升高,Caspase-3蛋白表达上调,Bcl-2蛋白表达下调,提示Ce6-PDT可引起凋亡性细胞死亡。LC3B蛋白表达随着Ce6浓度的增加先下调后上调,推测可能在低剂量光动力时自噬起到保护细胞作用,在高剂量时和凋亡共同引起细胞死亡。这也是自噬在光动力治疗肿瘤中的双刃剑作用的体现[22]。接下来笔者打算探讨Ce6-PDT光动力杀伤结肠癌细胞中自噬和凋亡的关系及其对诱导细胞死亡的影响,为进一步提高疗效寻找更合适的光动力治疗方案提供依据。
[1]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2]FERLAY J,STELIAROVA-FOUCHER E,LORTET-TIEULENT J,et al.Cancer incidence and mortality patterns in Europe:estimates for 40 countries in 2012[J].Eur J Cancer,2013,49(6): 1374-1403.
[3]代珍,郑荣寿,邹小农,等.中国结直肠癌发病趋势分析和预测[J].中华预防医学杂志,2012,46(7):598-603.
[4]康玲,刘全宏,崔连新,等.二氢卟吩e6光动力对人结肠癌细胞SW620生物学行为的影响[J].肿瘤防治研究,2012,39(11):1301-1305.
[5]MROZ P,YAROSLAVSKY A,KHARKWAL GB,et al.Cell death pathways in photodynamic therapy of cancer[J].Cancers (Basel),2011,3(2):2516-2539.
[6]DOUGHERTY TJ.A brief history of clinical photodynamic therapy development at roswell park cancer institute[J].J Clin Laser Med Surg,1996,14(5):219-221.
[7]ALLISON RR,BAGNATO VS,SIBATA CH.Future of oncologic photodynamic therapy[J].Future Oncol,2010,6(6):929-940.
[8]GALANOU MC,THEODOSSIOU TA,TSIOURVAS D,et al.Interactive transport,subcellular relocation and enhanced phototoxicity of hypericin encapsulated in guanidinylated liposomes via molecular recognition[J].Photochem Photobiol,2008,84(5):1073-1083.
[9]JO.YOO,KS HA.New insights into the mechanisms for photodynamic therapy-induced cancer cell death[J].Int Rev Cell Mol Biol,2012(295):139-174.
[10]BUYTAERT E,CALLEWAERT G,HENDRICKX N,et al.Role of endoplasmic reticulum depletion and multidomain proapoptotic BAX and BAK proteins in shaping cell death after hypericin-mediated photodynamic therapy[J].FASEB J,2006,20(6): 756-758.
[11]KESSEL D,LUO Y,DENG Y,et al.The role of subcellular localization in initiation of apoptosis by photodynamic therapy[J]. Photochem Photobiol,1997,65(3):422-426.
[12]AGOSTINIS P,BERG K,CENGEL KA,et al.Photodynamic therapy of cancer:an update[J].CA Cancer J Clin,2011,61(4): 250-281.
[13]MOJZISOVA H,BONNEAU S,VEVER-BIZET C,et al.Cellular uptake and subcellular distribution of chlorin e6 as functions of pH and interactions with membranes and lipoproteins[J]. Biochim Biophys Acta,2007,1768(11):2748-2756.
[14]KLEBAN J,MIKES J,HORVÁTH V,et al.Mechanisms involvedinthecellcycleandapoptosisofHT-29cells pre-treated with MK-886 prior to photodynamic therapy with hypericin[J].J Photochem Photobiol B,2008,93(2):108-118.
[15]SASNAUSKIENE A,KADZIAUSKAS J,VEZELYTE N,et al. Apoptosis,autophagy and cell cycle arrest following photodamage to mitochondrial interior[J].Apoptosis,2009,14(3):276-286.
[16]WANG H,ZHANG HM,YIN HJ,et al.Combination of a novel photosensitizer DTPP with 650 nm laser results in efficient apoptosis,arresting cell cycle and cytoskeleton protein changes in lung cancer A549 cells[J].Lasers Med Sci,2015,30(1): 77-82.
[17]PANZARINI E,INGUSCIO V,DINI L.Timing the multiple cell death pathways initiated by rose bengal acetate photodynamic therapy[J].Cell Death Dis,2011,2(6):e169.
[18]SPARSA A,BELLATON S,NAVES T,et al.Photodynamic treatment induces cell death by apoptosis or autophagy depending on the melanin content in two B16 melanoma cell lines[J]. Oncol Rep,2013,29(3):1196-1200.
[19]KESSEL D.Subcellular targets for photodynamic therapy:implications for initiation of apoptosis and autophagy[J].J Natl Compr Canc Netw,2012(Suppl 2):S56-S59.
[20]LIU L,ZHANG Z,XING D.Cell death via mitochondrial apoptotic pathway due to activation of bax by lysosomal photodamage[J].Free Radic Biol Med,2011,51(1):53-68.
[21]WAWRZYNSKA M,KALAS W,BIALY D,et al.In vitro photodynamic therapy with chlorin e6 leads to apoptosis of human vascularsmoothmusclecells[J].ArchImmunolTherExp (Warsz),2010,58(1):67-75.
[22]INGUSCIO V,PANZARINI E,DINI L.Autophagy contributes to the death/survival balance in cancer photodynamic therapy[J]. Cells,2012,1(3):464-491.
Photodynamic effects of chlorin e6 on cell cycle and apoptosis of human colon cancer SW620 cells*
Ling KANG1,Jun XU2,Jie ZHANG1,Yan MA1
(1.Department of Occupational and Environmental Health,College of Public Health,Xinjiang Medical University,Urumqi,Xinjiang 830011,P.R.China;2.Department of Periodontics and Oral Medicine,the First Affiliated Hospital of Xinjiang Medical University, Urumqi,Xinjiang 830011,P.R.China)
【Objective】To investigate the effects of chlorin e6-photodynamic therapy(Ce6-PDT)on cell cycle and apoptosis of human colon cancer SW620 cells,and to explore the mechanism of Ce6-PDT in killing colorectal cancer cell.【Methods】Intracellular distribution of Ce6 in SW620 cells was monitored by using Leica confocal laser scanning microscope(LSCM).Generation of reactive oxygen species(ROS)caused by Ce6-PDT(0,0.125,0.25,0.5, 1.0,2.0,4.0 and 8.0 μg/ml)was observed with fluorescence microscope.Cell cycle and apoptosis were analyzed by flow cytometry.Western blot was employed to analyze the expression of Caspase-3,Bcl-2,Beclin 1 and LC3B.【Results】LSCM showed that Ce6 was mainly distributed within the endoplasmic reticulum and mitochondria,with nearly no distribution in the nucleus and lysosome in SW620 cells.Exposure to Ce6-PDT induced ROS production in SW620.Flow cytometry results indicated that SW620 cells presented G0/G1 phase arrest,obvious decrease of S phase ratio,and higher rate of apoptosis,in a dose-dependent manner(P<0.05).Relative gray value of caspase-3 and Bcl-2 protein expression has changed in cells treated with Ce6-PDT,and each group difference was statisticallysignificant(P<0.05).Expression of LC3B protein down-regulated firstly and up-regulated then with the increase of concentration of Ce6(P<0.05).【Conclusion】Induction of cell cycle arrest and apoptosis may be involved in Ce6-PDT in inhibiting cell proliferation and killing SW620 cells,and caspase-3,Bcl-2 and LC3B may participate in killing SW620 cells of Ce6-PDT.
colorectal cancer;chlorin e6;photodynamic therapy;apoptosis;autophagy
R730.57
A
1005-8982(2015)31-0010-07
2015-05-07
新疆维吾尔自治区自然科学基金-医学联合基金项目(No:2014211C003)

