脑性瘫痪患儿全麻苏醒延迟的影响因素①
韩长河,王增春,王强
脑性瘫痪患儿全麻苏醒延迟的影响因素①
韩长河1,王增春2,3,王强2,3
目的探讨导致脑瘫患儿全麻苏醒延迟的因素。方法回顾从2009年7月~2014年8月在全麻下接受下肢矫形术的脑瘫患儿293例的临床资料并对相关因素进行分析。结果37例(12.6%)患儿存在全麻苏醒延迟,单因素分析(χ2检验)显示与体重、ASA分级、静脉通路建立方式、出血量、辅助硬膜外麻醉、术中吸入麻醉药、发生不良事件有关(P<0.05);多因素非条件Logistic分析显示,ASA分级(B=1.490)、发生不良事件(B=2.159)和辅助硬膜外麻醉(B=-1.487)对全麻苏醒延迟产生影响(P<0.05)。结论全麻苏醒延迟可能是多种因素的综合结果,全麻辅助硬膜外麻醉有助于脑瘫全麻患儿的苏醒。
脑性瘫痪;全身麻醉;苏醒延迟
[本文著录格式]韩长河,王增春,王强.脑性瘫痪患儿全麻苏醒延迟的影响因素[J].中国康复理论与实践,2015,21(6): 701-705.
CITED AS:Han CH,Wang ZC,Wang Q.Factors related with prolonged anesthesia recovery in patients with cerebral palsy after general anesthesia[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(6):701-705.
由于麻醉药物及全麻技术手段的进步,目前接受全麻手术的患儿一般应该在停止使用麻醉药后30 min左右苏醒,否则会被认为是麻醉苏醒延迟(prolonged anesthesia recovery,PAR)。患儿发生PAR后,它的危害不仅在于增加患儿在手术室的停留时间、加大护理及监护成本,而且有可能诱发一些严重并发症如误吸[1]或是干扰医生对某些疾病的判断[2-3]。因此,了解可能影响PAR的因素将有助于患儿在麻醉恢复期的观察与治疗,为接受进一步的康复治疗打下基础。本研究拟通过回顾全麻下接受下肢矫形术脑瘫患儿的临床资料,探讨可能导致PAR的因素,为提高病情判断准确性及制定合理的干预措施提供理论依据。
1 资料与方法
1.1 一般资料
2009年7月~2014年8月收入北京市社会福利医院骨科并在全麻下接受下肢矫形术的脑瘫患儿293例,
其中男性197例,女性96例;年龄1~15岁,平均(7.28±3.428)岁;体重7~50 kg,平均(17.45±7.185) kg;单纯痉挛型214例,混合型以痉挛为主79例。依据美国麻醉医师协会(American Association of Anesthesiologists,ASA)的身体状态分级[4]分为Ⅰ~Ⅳ级。手术类型为跟腱延长术、腘绳肌延长术、内收肌切断术、股薄肌切断术、胫后肌延长、足关节囊松解术、截骨术。其中单纯跟腱延长术24例、胫后肌延长21例、多种混合术式248例。
1.2 术前准备
患儿术前禁食6~8 h,禁饮4 h。进入手术室后监测无创血压(non-invasive blood pressure,NIBP)、脉搏血氧饱和度(pulse blood oxygen saturation,SPO2)和心电图(electrocardiogram,ECG)。选择患儿上肢血管建立静脉通道;若哭闹不配合,分别进行氯胺酮肌肉注射(5 mg/kg)、面罩吸入异氟醚(3%)或七氟醚(6%)复合6 L/min纯氧下建立静脉通路。
1.3 麻醉方案
面罩吸氧去氮。麻醉诱导采用静脉注射咪达唑仑0.025 mg/kg、丙泊酚2 mg/kg、维库溴铵0.1 mg/kg、芬太尼2.5 μg/kg或瑞芬太尼1 μg/kg。插入气管插管或喉罩后连接呼吸机行机械通气,设定潮气量6 ml/ kg,呼吸频率12~16次/min,保持呼气末二氧化碳分压(end-tidal carbon dioxide partial pressure,ETCO2)为35~40 mmHg。麻醉维持采用丙泊酚6 mg/(kg·h)和瑞芬太尼0.2 μg/(kg·min)静脉输注,部分患儿辅以异氟醚或七氟醚吸入维持麻醉。部分患儿实施硬膜外穿刺并辅助硬膜外麻醉。部分患儿实施“多模式镇痛(multimodal analgesia,MA)”,即手术开始前15 min内,予氯胺酮0.25 mg/kg静脉注射;切皮前应用0.25%盐酸罗哌卡因≤2 mg/kg对手术切口进行局部浸润麻醉;术中与瑞芬太尼同时静脉输注舒芬太尼0.05 μg/(kg· h)。依靠静脉追加芬太尼、瑞芬太尼或加大异氟醚或七氟醚吸入浓度加深麻醉。缝皮完成后停止使用所有麻醉药。部分患儿连接一次性100 ml恒速(2 ml/h)静脉镇痛泵(内有舒芬太尼2.5 μg/kg及恩丹西酮注射液2~4 mg)。
1.4 麻醉标准
患儿恢复自主呼吸且肌力正常后拔除气管导管或喉罩。能睁眼且生命体征平稳后送回病房。手术时间(operation time,OT)是指切皮开始至缝皮结束,麻醉时间(anesthesia time,AT)是指开始使用麻醉药物至停止使用麻醉药物,麻醉苏醒时间(recovery time,RT)是指停止使用麻醉药物至患儿离开手术室时间。根据本院的实际情况,我们将麻醉苏醒时间在45 min以内的患儿定为正常,否则为PAR。
1.5 观察指标
查阅293份病历,记录所有患儿的一般情况(年龄、性别、体重、脑瘫类型、身体状况分级、麻醉时间、手术时间、出血量)及特殊情况(入室是否哭闹、静脉通路建立方式、麻醉方式、是否采用多模式镇痛、是否使用术后镇痛泵、术中是否使用七氟醚、不良事件)。依据麻醉苏醒时间确定发生PAR的病例。
1.6 统计学分析
采用SPSS 20.0统计软件处理。将各项指标采用χ2检验进行统计学处理,筛选出单因素分析有统计学意义的项目进行非条件性Logistic回归分析。显著性水平α=0.05。
2 结果
2.1 单因素分析
以PAR为目标,对性别、年龄、体重、脑瘫类型、ASA分级、术前哭闹不配合、静脉通路建立方式、麻醉时间、出血量、实施多模式镇痛、辅助硬膜外麻醉、使用术后镇痛泵、术中吸入麻醉药、发生不良事件这些指标进行单因素分析,结果显示,体重、ASA分级、静脉通路建立方式、出血量、辅助硬膜外麻醉、术中吸入麻醉药、发生不良事件与PAR具有相关性(P<0.05)。见表1。
2.2 Logistic回归分析
将“Y(PAR)”调入因变量,单因素分析有显著性差异的“X1(体重)、X2(ASA分级)、X3(发生不良事件)、X4(出血量)、X5(术中吸入麻醉药)、X6(辅助硬膜外麻醉)、X7(静脉通路建立方式)”调入协变量进行Logistic回归分析,进入水准取0.05,删除水准0.10。所得回归方程是:
Logit P=-4.740+1.490X2+2.159X3-1.487X6
P为发生PAR的概率。该方程反映两个危险因素(ASA分级和发生不良事件)和一个保护因素(辅助硬膜外麻醉)对P/(1-P)(PAR的发生概率对不发生概率的比数)的作用。其中ASA分级每增加一个等级时发生PAR的比数比是1.490,有不良事件对没有不良事件时发生PAR的比数比是2.159,没有实施辅助硬膜外麻醉对实施辅助硬膜外麻醉时发生PAR的比数比是1.487。见表2。
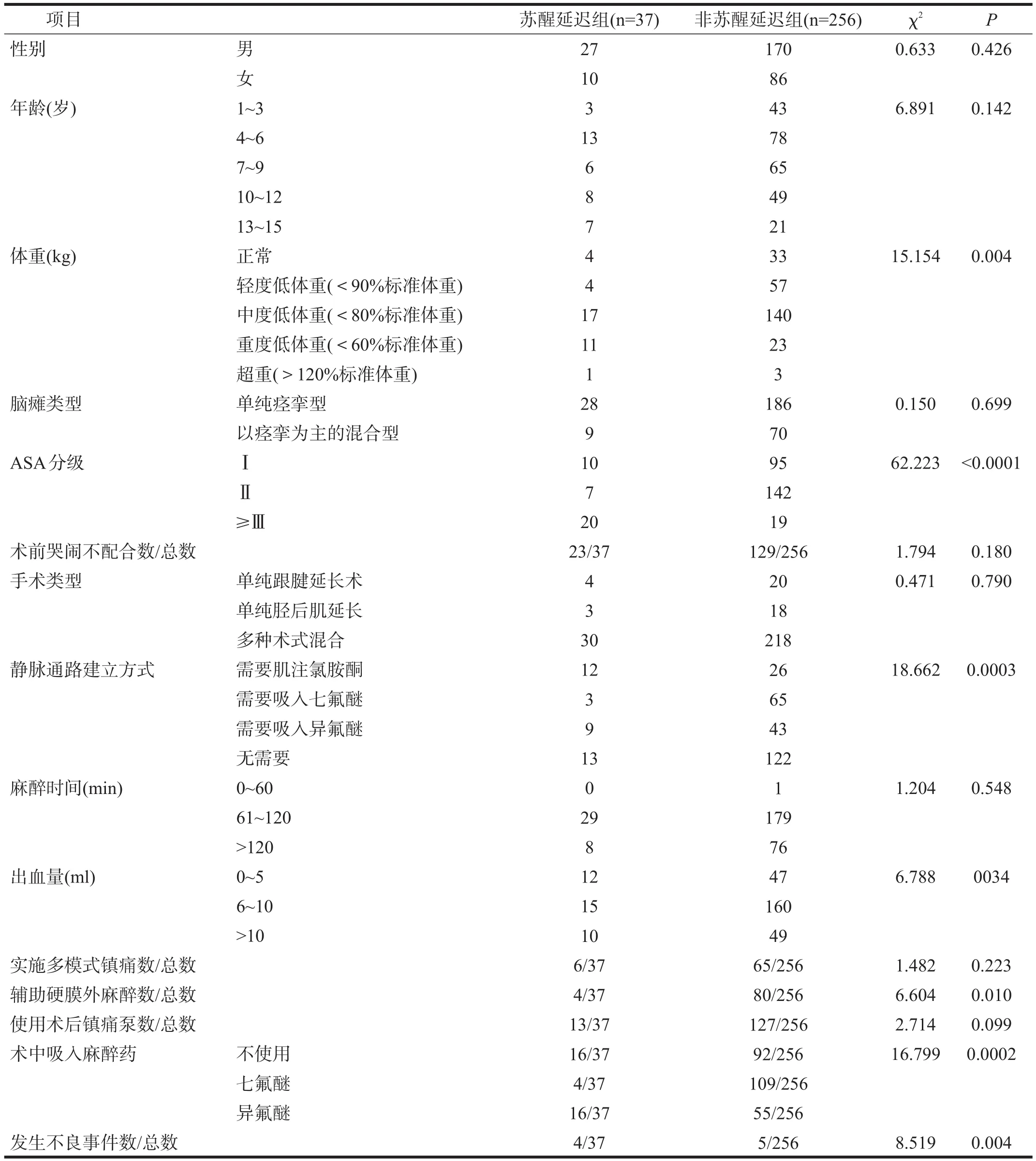
表1 患儿PAR的单因素分析(n)
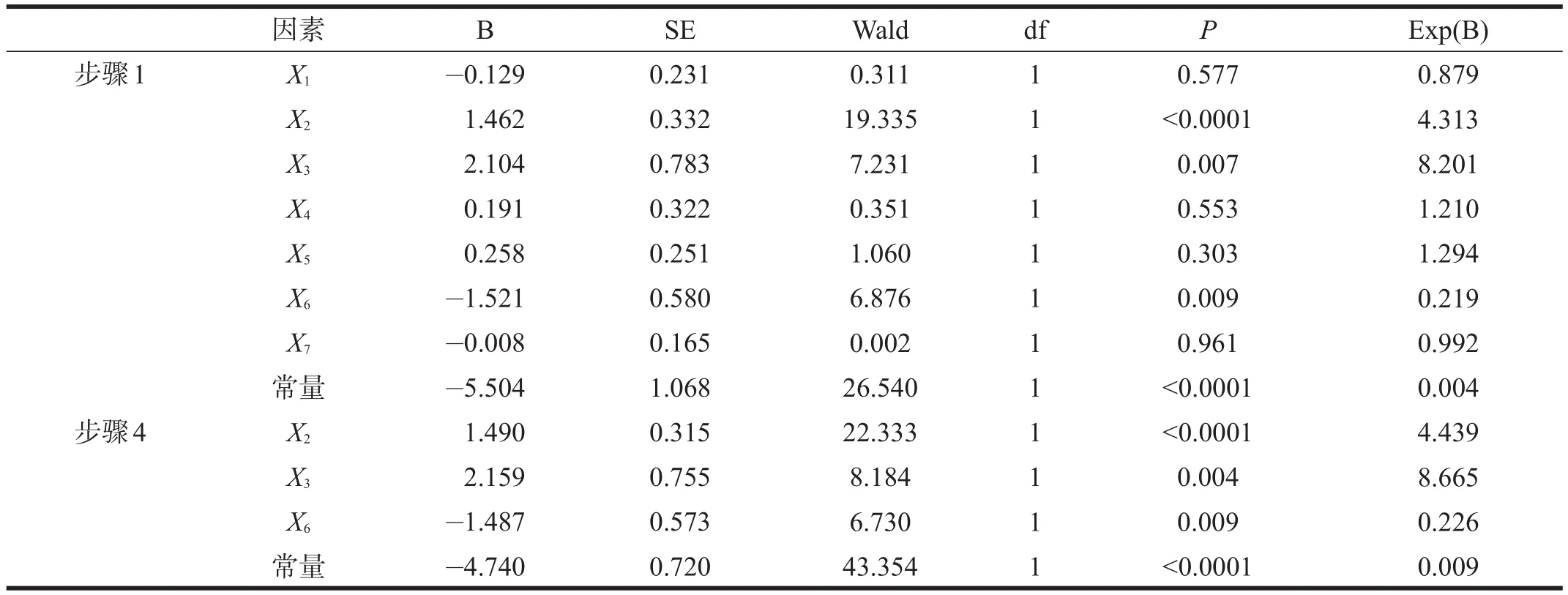
表2 Logistic回归分析
3 讨论
由于影响PAR的因素较多,因此我们先通过单因素分析找到可能影响PAR的因素。在得到的结果中,体重、ASA分级、静脉通路建立方式、失血量、辅助硬膜外麻醉、术中使用吸入麻醉药、发生不良事件是可能的影响因素。对这些因素进行非条件性Logistic分析,确定了3个独立的影响因素,其中ASA分级和发生不良事件是危险因素,而辅助硬膜外麻醉是保护因素。
在本院接受手术的患儿,一般身体状况较差,常伴有低体重、低蛋白血症、肝肾功能障碍以及心肺疾患。在所回顾的293例患儿中,有39例(13%)患儿身体状况分级在ASAⅢ级或以上。这些患儿由于脏器功能受损,必然会使得全麻药物的降解及排出能力降低,最终影响患儿的苏醒,我们的回顾性研究也支持这一点。关于ASA分级与麻醉并发症是否存在必然联系的报道并不一致。有研究显示术前低蛋白血症是患者麻醉恢复期转归变差的危险因素[5];也有报道显示麻醉并发症仅与麻醉深度相关,而与ASA分级之间无联系[6]。但是由于PAR并没有作为它的观察对象,因此还不能证明ASA分级与麻醉并发症之间无联系。
七氟醚和异氟醚是两种应用较广的吸入性麻醉药,前者诱导及苏醒迅速,但是价格较高[7],而且它与全麻后患儿的躁动密切相关[8-10];后者镇痛强,但苏醒时间较长。与本结果一致。此外,有报道显示接受异氟醚麻醉的患儿较接受其他吸入性麻醉药麻醉的患儿有更长的住院时间,这也许与它的麻醉恢复时间较长有关[11]。
所回顾的293例患儿中有9例(3%)患儿发生严重不良事件,其中低体温2例,低血糖2例,过敏性休克1例,低钙血症1例,严重躁动3例。这些患儿中出现低体温和低血糖的患儿均发生苏醒延迟。由于麻醉药可以抑制患儿的体温调节功能[12],因此低体温是围手术期最易发生的不良事件之一,它与PAR直接相关[13]。多种因素可以导致围术期血糖升高,由于它会使患儿的预后变差,因此如何避免高血糖症一直是人们关注的焦点[14-16]。但是,由于患儿术前及术中长时间禁食,因此低血糖症同样是麻醉医生不容忽视的一个问题[17-18]。由于低血糖症会使患儿的意识受到影响[19],因此有可能使麻醉苏醒时间延长。目前各种临床观察所显示的围手术期血糖结果并不相同,因此有必要对术中的血糖进行监测以保障患儿的安全[20-21]。
在PAR的3个影响因素中,“全麻联合硬膜外麻醉”是一个保护因素,说明选择“全麻联合硬膜外麻醉”的方式比仅使用全麻有助于患儿苏醒,这可能与所联合的硬膜外麻醉能够满足患儿的镇痛需求从而减少全麻药物使用量有关。
多种因素可以影响全麻的苏醒时间[22-25],麻醉医生应该全面对患者的病情进行评估,选择恰当的麻醉方式以保证患儿的安全。
[1]Hodzovic I.Airway management disasters—lessons from the United Kingdom[J].Acta Clin Croat,2012,51(3):525-527.
[2]Yamashita S,Fukuda T,Shimizu T,et al.Intracranial hemorrhage from undiagnosed metastatic brain tumor during general anesthesia[J].J ClinAnesth,2011,23(7):562-564.
[3]Greaney D,Vaughan P.Delayed recovery post anesthesia:an atypical presentation of familial hemiplegic migraine[J].Can J Anaesth,2014,61(3):278-279.
[4]Aplin S,Baines D,DE Lima J.Use of the ASA Physical Status Grading System in pediatric practice[J].Paediatr Anaesth, 2007,17(3):216-222.
[5]Rujirojindakul P,Geater AF,McNeil EB,et al.Risk factors for reintubation in the post-anaesthetic care unit:a case-control study[J].Br JAnaesth,2012,109(4):636-642.
[6]Dawson N,Dewar A,Gray A,et al.Association between ASA grade and complication rate in patients receiving procedural sedation for relocation of dislocated hip prostheses in a UK emergency department[J].Emerg Med J,2014,31(3):207-209.
[7]Potdar MP,Kamat LL,Save MP.Cost efficiency of target-controlled inhalational anesthesia[J].J Anaesthesiol Clin Pharmacol,2014,30(2):222-227.
[8]Ayeko M,Mohamed AA.Prevention and treatment of sevoflurane emergence agitation and delirium in children with dexmedetomidine[J].Saudi JAnaesth,2014,8(4):570-571.
[9]KanayaA,Kuratani N,Satoh D,et al.Lower incidence of emergence agitation in children after propofol anesthesia compared with sevoflurane:a meta-analysis of randomized controlled trials[J].JAnesth,2014,28(1):4-11.
[10]Zhang C,Hu J,Liu X,et al.Effects of intravenous dexmedetomidine on emergence agitation in children under sevoflurane anesthesia:a meta-analysis of randomized controlled trials[J]. PLoS One,2014,9(6):e99718.
[11]Kopyeva T,Sessler DI,Weiss S,et al.Effects of volatile anesthetic choice on hospital length-of-stay:a retrospective study and a prospective trial[J].Anesthesiology,2013,119(1):61-70.
[12]Sessler DI.The thermoregulation story[J].Anesthesiology, 2013,118(1):181-186.
[13]Lista F,Doherty CD,Backstein RM,et al.The impact of perioperative warming in an outpatient aesthetic surgery setting[J].Aesthet Surg J,2012,32(5):613-620.
[14]Agos F,Shoda C,Bransford D.Part II:managing perioperative hyperglycemia in total hip and knee replacement surgeries[J].Nurs Clin NorthAm,2014,49(3):299-308.
[15]Bhattacharjee S,Layek A,Maitra S,et al.Perioperative glycemic status of adult traumatic brain injury patients undergoing craniotomy:a prospective observational study[J].J Neurosurg Anesthesiol,2014,26(4):313-319.
[16]Moran Lopez JM,Piedra Leon M,Garcia Unzueta MT,et al. Perioperative nutritional support[J].Cir Esp,2014,92(6): 379-386.
[17]Kalra S,Bajwa SJ,Baruah M,et al.Hypoglycaemia in anesthesiology practice:diagnostic,preventive,and management strategies[J].Saudi JAnaesth,2013,7(4):447-452.
[18]Kadoi Y.Blood glucose control in the perioperative period[J].MinervaAnestesiol,2012,78(5):574-595.
[19]Lagi A,Cencetti S,Lagi F.Incidence of hypoglycaemia associated with transient loss of consciousness.A retrospective cohort study[J].Int J Clin Pract,2014,68(8):1029-1033.
[20]Adenekan AT.Perioperative blood glucose in a paediatric daycase facility:effects of fasting and maintenance fluid[J].Afr J Paediatr Surg,2014,11(4):317-322.
[21]王增春,王强,刘海泉,等.脑瘫患儿腰骶段选择性后根神经切断术中血糖的变化[J].中国康复理论与实践,2005,11(1): 62-63.
[22]Pawar ST,Nath SS,Ansari F.Hyperglycaemia and ketosis in a non-diabetic patient-an unusual cause of delayed recovery[J].Anaesthesiol Intensive Ther,2014,46(3):171-174.
[23]Bansal T,Hooda S,Jaiswal R,et al.Delayed recovery from anaesthesia due to acute phenytoin therapy[J].Indian J Anaesth,2014,58(6):783-785.
[24]Frost EA.Differential diagnosis of delayed awakening from general anesthesia:a review[J].Middle East J Anaesthesiol, 2014,22(6):537-548.
[25]More P,Laheri VV,Waigankar T,et al.Delayed recovery from anaesthesia in a patient with optimised hypothyroidism and incidental hypokalemia[J].J Clin Diagn Res,2015,9(1): UD06-UD07.
Factors Related with ProlongedAnesthesia Recovery in Patients with Cerebral Palsy after GeneralAnesthesia
HAN Chang-he1,WANG Zeng-chun2,3,WANG Qiang2,3
1.Department of Anesthesiology,Beijing Social Welfare Hospital,Beijing 100085,China;2.Capital Medical University School of Rehabilitation,Beijing 100068,China;3.Department of Anesthesiology,Beijing Bo'ai Hospital,China Rehabilitation Research Center,Beijing 100068,China
Objective To explore the factors related with prolonged anesthesia recovery(PAR)in patients with cerebral palsy after general anesthesia.Methods 293 patients with cerebral palsy who received lower limbs orthopedics(LLO)under general anesthesia during July, 2009 to August,2014 were retrospected and the factors related to PAR were analyzed.Results 37 patients(12.6%)suffered from PAR. There was significant difference in factors including body-weight,grade of physical status for anesthesia according to American Association of Anesthesiologists(ASA),the style to set a venous channel,blood loss,general anesthesia combined with epidural anesthesia(GAEA),intra-operative inhalation anesthetics,and serious adverse events(SAE)between patients with or without PAR,according to single factor analysis with chi-square test.It was significant that the factors of ASA grade(B=1.490),SAE(B=2.159)and GAEA(B=-1.487)according to non-conditional logistic analysis.Conclusion PAR is related to several factors and GAEA combined with general anesthesia contributes to the recovery of patients with cerebral palsy.
cerebral palsy;general anesthesia;prolonged anesthesia recovery
10.3969/j.issn.1006-9771.2015.06.014
R742.3
A
1006-9771(2015)06-0701-05
2015-01-23
2015-03-31)
1.北京市社会福利医院麻醉科,北京市100085;2.首都医科大学康复医学院,北京市100068;3.中国康复研究中心北京博爱医院麻醉科,北京市100068。作者简介:韩长河(1966-),男,汉族,北京市人,主治医师,主要研究方向:临床麻醉与疼痛。通讯作者:王强。E-mail: 13801032889@163.com。

