披针叶黄华碱对细胞免疫功能的影响
李 勇 (宁夏职业技术学院生命科学技术系 宁夏 银川 750021) 张玉玲 (宁夏动物疾病预防控制中心 宁夏 银川) 魏彦明 (甘肃农业大学动物医学院 甘肃 兰州)
试验研究
披针叶黄华碱对细胞免疫功能的影响
李 勇 (宁夏职业技术学院生命科学技术系 宁夏 银川 750021) 张玉玲 (宁夏动物疾病预防控制中心 宁夏 银川) 魏彦明 (甘肃农业大学动物医学院 甘肃 兰州)
为研究披针叶黄华碱对小鼠细胞免疫功能的影响。取80只小鼠,按灌服剂量为6、13、25mg/kg,共分 3个试验组和1个蒸馏水对照组(0.5ml/d),连续给药20d,观察披针叶黄华碱对小鼠体重、脏器质量、脏器指数、巨噬细胞吞噬能力及T淋巴细胞数量的影响。结果表明,与对照组相比,灌服3个不同浓度披针叶黄华碱后小鼠体重、脏器质量、脏器指数、巨噬细胞的吞噬能力及T淋巴细胞数量均有所降低。在本试验条件下,中高浓度的披针叶黄华碱对小鼠的免疫功能有抑制作用。
披针叶黄华碱 小鼠 细胞免疫功能
1 材料与方法
1.1 材料 (1)设备仪器:ARll40/C型电子分析天平,奥毫斯国际贸易(上海)有限公司;HWlA型电热恒温水温箱,北京医疗设备厂;H-600型透射电子显微镜,日本日立产;冰箱、微量移液器、小鼠灌胃器、小动物解剖器械等其他设备与器材,均由宁夏职业技术学院兽医微生物实验室提供。(2)主要药品与试剂:浓盐酸、亚硝酸钠、甲醛、(西安蓝翔化工有限公司生产);甲基绿(上海化学试剂厂生产);副品红(天津市天新精细化工开发中心生产);披针叶黄华碱由宁夏职业技术学院兽医微生物实验室提供;醋酸-A萘酯(国药集团化学试剂有限公司生产);乙二醇单甲醚(上海凌锋化学试剂有限公司生产)。
1.2 方法 (1)分组及给药。20日龄ICR小鼠,体重18~22g,雌雄各半,共80只;体重2kg左右的公鸡2只。以上试验动物均购于宁夏医科大学实验动物中心。将小鼠随机分成4组,每组10只。试验前测得所用披针叶黄华碱的LD50=127.04 mg/kg,按照LD50的1/20、1/10、1/5设低剂量组、中剂量组和高剂量组,每组给药量分别为6、13、25mg/kg,并设饲喂蒸馏水为对照组(0.5ml/d)[4]。每天按以上剂量灌胃给药,连续20d。饲喂期间各组给予充足的饲料和饮水。(2)披针叶黄华碱对小鼠体重和主要脏器指数的影响。小鼠末次灌胃2h后,称量体重,摘除眼球放血,颈椎脱臼处死,剪取实质性脏器,分别称重,按以下公式计算各脏器指数:脏器指数(%)=(器官重量/体重)×100%。(3)披针叶黄华碱对小鼠巨噬细胞吞噬机能的影响。每只小鼠腹腔注射10%淀粉肉汤0.5ml后轻揉腹部。5d后每只小鼠再腹腔注射1%鸡红细胞悬浊液0.5ml后轻揉腹腔。60min后,适量抽取小鼠腹腔液,并制成推片,在37℃恒温箱内干燥,用瑞氏染色液染色后,在油镜下观察计数每100个巨噬细胞中吞噬鸡红细胞的巨噬细胞数和每个巨噬细胞吞噬的鸡红细胞数,按照下列公式计算吞噬百分率和吞噬指数[5-7]。吞噬百分率(%)=(100个巨噬细胞中吞噬鸡红细胞的巨噬细胞数/100个巨噬细胞)×100%。吞噬指数=100个巨噬细胞中被吞噬的鸡红细胞总数/100个巨噬细胞。(4)披针叶黄华碱对小鼠血液中T淋巴细胞数量的影响。采用酸性α-醋酸萘酯酶(ANAE)染色法标记小鼠外周血液中T淋巴细胞并计数[8]。摘除小鼠眼球后,取眶静脉血液制成血涂片。将血涂片在4℃甲醛-丙酮缓冲固定液中固定10min,蒸馏水冲洗3次;放入孵育液中,37℃恒温箱中孵育3h;用蒸馏水冲洗3次;放入2%甲基绿水溶液复染细胞核5min;用各级丙酮迅速脱水,二甲苯透明,最后用树胶封片[9]。酯酶染色阳性细胞即T淋巴细胞形态为圆形、胞质少,胞核为绿色、圆形,胞质边缘及其他部位有1到多个粗大的红色或棕红色颗粒。酯酶染色阴性细胞(其他的淋巴细胞)形态也
如上述,但胞质里无着色的颗粒[10]。显微镜观察并记数100个淋巴细胞中ANAE阳性细胞的数量,按下式计算T淋巴细胞百分比:T淋巴细胞百分比=(ANAE阳性细胞/100个淋巴细胞) ×100%。
1.3 数据分析 数据用DPS3.01统计软件进行方差分析和Duncan新复极差法多重比较,数据用±SD表示。
2 结果与分析
2.1 披针叶黄华碱对小鼠质量以及主要脏器指数的影响(1)由表1可知,灌服不同剂量的披针叶黄华碱20d后,各组小鼠的平均体重均有所下降,呈现出随灌服剂量增加而下降的趋势。与对照组相比较,低剂量组小鼠体重下降不明显(P>0.05),而中剂量组和高剂量组小鼠体重明显下降(P<0.05)。(2)表2、3可知,灌服不同剂量的披针叶黄华碱20d后,均可使小鼠的心、肝、脾、肺、肾、胸腺各主要脏器重量和脏器指数降低。中剂量组和高剂量组小鼠的器官重量比对照组明显降低(P<0. 05),中剂量组和高剂量组的脏器指数也比对照组明显降低(P<0. 05);随着灌服剂量的增加,小鼠的心、肝、脾、肺、肾、胸腺各主要脏器重量及脏器指数均呈现下降趋势。

表1 不同浓度披针叶黄华碱对小鼠体重的影响 (g)
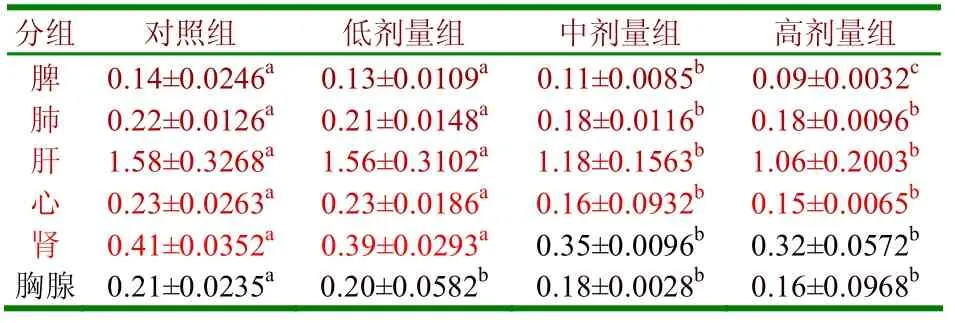
表2 不同浓度披针叶黄华碱对小鼠主要脏器重量的影响

表3 不同浓度披针叶黄华碱对小鼠主要脏器指数的影响
2.2 披针叶黄华碱对小鼠腹腔巨噬细胞吞噬机能的影响表4可知,在低剂量组中,小鼠腹腔中的巨噬细胞的吞噬百分比明显高于对照组(P<0.05),吞噬指数却低于对照组(P<0.05);在中剂量组和高剂量组中,小鼠腹腔巨噬细胞吞噬百分比和吞噬指数都明显低于对照组(P<0.05);随着给药剂量的增加,吞噬百分比和吞噬指数都呈降低趋势。

表4 披针叶黄华碱对小鼠腹腔内巨噬细胞吞噬鸡红细胞功能的影响
2.3 披针叶黄华碱对小鼠外周血液中T淋巴细胞数量的影响 表5可知,在高剂量组中,小鼠外周血液中的T淋巴细胞的数量与对照组、低剂量组和中剂量组相比,明显减少(P<0.05),但对照组、低剂量组和中剂量组之间差异不显著(P>0.05)。

表5 披针叶黄华碱对小鼠血液中T淋巴细胞数量的影响
3 讨论
3.1 披针叶黄华碱对小鼠体重和主要脏器指数的影响通过灌服不同剂量的披针叶黄华碱20d后,每个试验小组中小鼠的平均体重都有下降,随着生物碱浓度的增加,抑制体重的作用不断增强。在同一试验条件下,小鼠的心、肝、脾、肺、肾、胸腺各内脏器官的重量也有所下降,同时其脏器指数也降低,并且呈现出随着灌服剂量的增加,小鼠各内脏器官重量指数也下降的趋势。脾脏和胸腺是主要的免疫器官,对机体的免疫力有着重要的影响。在以上试验条件下,披针叶黄华碱对小鼠脾脏和胸腺的发育有一定的抑制作用,则说明此类生物碱对动物机体的免疫力有抑制作用。
3.2 披针叶黄华碱对小鼠腹腔巨噬细胞吞噬机能的影响
本试验中给小鼠灌服不同浓度的披针叶黄华碱后发现,除了低剂量组的小鼠外,中等剂量组和高剂量组小鼠腹腔中巨噬细胞的吞噬机能随灌服的生物碱浓度增加而降低(P<0.05)。而低剂量的生物碱能提高小鼠腹腔中巨噬细胞的吞噬百分比(P<0.05),但其吞噬指数却低于对照组(P<0.05),说明此浓度的披针叶黄华碱能够刺激更多的巨噬细胞参与吞噬过程,但同时却抑制了单个巨噬细胞的吞噬能力。分布于全身大多数器官组织的巨噬细胞是单核吞噬细胞系统中的重要成员,其吞噬能力在一定程度上可以反映机体的免疫状态[11-12]。从整体来看,披针叶黄华碱对小鼠腹腔内的巨噬细胞吞噬能力起到了一定的抑制作用。低浓度的披针叶黄华碱产生的药理作用提示我们,随着不断降低披针叶黄华碱的浓度,其是否既能增加参与吞噬作用的巨噬细胞的数量,又能提高单个巨噬细胞吞噬的能力,还有待于进一步研究。
3.3 披针叶黄华碱对小鼠外周血液中T淋巴细胞数量的影响 本试验中,高剂量组中由于给小鼠灌服的披针叶黄华碱含量大,使得进入小鼠体内的生物碱对外周血液中的T淋巴细胞的数量有显著的降低作用(P<0.05),因而对小鼠细胞免疫功能起到抑制作用。低剂量组和中剂量组却影响不大(P>0.05)。T淋巴细胞主要介导机体的细胞免疫。T淋巴细胞内含有ANAE,而区别血液中T细胞和其他淋巴细胞的方法之一就是ANAE试验,是一种区分人类和其他哺乳动物成熟T细胞的测定方法[13-14]。通常情况下,动物体内脾脏和胸腺的增重意味着机体淋巴细胞的增殖,淋巴细胞的增殖直接体现免疫应答的强弱。试验中一定浓度的披针叶黄华碱对小鼠脾脏和胸腺的增重有抑制作用,同时也能抑制其外周血液中T淋巴细胞的数量。因此,可以推测由于披针叶黄华碱能够抑制T淋巴细
胞的增殖分化和成熟,所以抑制了胸腺和脾脏的生长,最终抑制了细胞免疫的功能。
综上所述,在本试验的条件下,中高浓度的披针叶黄华碱对小鼠的细胞免疫功能没有促进作用,反而有一定的抑制作用。
[1] 马毓泉主编. 内蒙古植物志[M]. 呼和浩特:内蒙古人民出版社. 1985, 358-365.
[2] 周云风, 朱忠柯, 赵宝玉. 披针叶黄华的营养成分及生物碱成分分析[J[. 动物医学进展, 2001, 415. 18.
[3] 文润玲, 戴寿芝, 裴秀英等. 老瓜头总碱对小鼠免疫功能的影响[J]. 宁夏医学杂志, 1990, 12(2): 75-77.
[4] 国家食品药品监督管理局.药物研究技术指导原则(2005)[M]. 北京:中国医药科技出版社, 2006: 94-103.
[5] 郑丽艳. 猪附红细胞体病诊断方法的研究[D]. 泰安: 山东农业大学, 2006.
[6] 王月英. 新生大鼠免疫系统功能的建立与其影响因素的相关性研究[D]. 石家庄: 河北医科大学, 2004.
[7] 杨汉民. 细胞生物学实验[M].2版.北京: 高等教育出版社, 1993: 166-167.
[8] 宋宁. 五种云南石拼多糖的提取、筛选及免疫调节作用的研究[D].昆明: 昆明医学院, 2006.
[9] 袁伯伦, 于载乐. 淋巴细胞酸性非特异性酯酶染色方法及其意义的初步探讨[J]. 北京医学院学报, 1982, 14(4): 345.
[10] 朱辛为. 血液酸性a-醋酸萘酯酶染色方法改进[J]. 第四军医大学吉林军医学院学报, 1995, 17(3): 203.
[11] 王世若, 王兴龙. 现代动物免疫学[M].2版. 吉林: 吉林科学技术出版社, 2001: 530-531.
[12] 宋宁. 五种云南石拼多糖的提取、筛选及免疫调节作用的研究[D]. 昆明: 昆明医学院, 2006.
[13] 杨汉春. 动物免疫学[M].2版. 北京: 中国农业大学出版社, 2003: 370.
[14] JIN XW, HUANG S, WU X B. Immunohistochemical location of sixkinds ofendocrine cell from digestive tractofmisgurnus anguillicaudatus [J]. AgriculturalScience&Technology, 2009, 10(1):135-139.15832.
S853.75
A
1007-1733(2015)09-0001-03披针叶黄华(Thermopsisl anceolate)异名牧马豆、土马豆或野决明,属豆科野决明属植物,耐旱性强,广泛分布于我国干旱和半干旱以及沙漠地区[1]。据资料记载本种为有毒植物,动物采食其种子和全草可引起中毒,中毒严重的引起死亡,从而对畜牧业产生危害。该植物也是有名的药用植物,具有兴奋呼吸,抗辐射、祛痰止咳、抗癌等功效[2]。其所含的生物碱成分还具有一定的增强机体体液免疫力的作用[3]。但目前未见关于披针叶黄华碱对动物机体细胞免疫功能是否具有促进作用的研究报道。本研究针对披针叶黄华碱是否对小鼠细胞免疫功能产生影响展开研究,为进一步开发利用披针叶黄华资源提供相关试验依据。
2015–05–27)

