Cd胁迫对水稻生长及内源激素含量的影响
游来勇,王昌全*,罗娟,,李冰,曾建
1. 四川农业大学资源环境学院,四川 成都 611130;2. 四川省江油市林业局,四川 绵阳 621700
Cd胁迫对水稻生长及内源激素含量的影响
游来勇1,王昌全1*,罗娟1,2,李冰1,曾建1
1. 四川农业大学资源环境学院,四川 成都 611130;2. 四川省江油市林业局,四川 绵阳 621700
镉(Cd)是水稻(Oryza sativa L.)生长非必需且有毒的元素,其对水稻生长发育和生理代谢过程有重要影响,而内源激素平衡对水稻生长发育起着重要的调节作用。因此,研究Cd胁迫下水稻生长和内源激素的变化对认知Cd对水稻毒害的生理过程有重要的意义。以水稻亲本蜀恢498、Ⅱ-32A和杂交稻Ⅱ优498为试验材料,通过不同Cd质量浓度条件(0、0.5、1、3 mg·L-1)下的水培试验,探究Cd胁迫对水稻生长和内源激素的影响。研究结果表明:相比对照处理,中Cd(1 mg·L-1)和高Cd处理(3 mg·L-1)显著降低水稻株高、地上部和根生物量;水稻中Cd质量分数和累积量均随Cd处理质量浓度的增加而增加,在1.0~3.0 mg·L-1Cd质量浓度胁迫下,水稻地上部Cd含量和累积量表现为蜀恢498>Ⅱ-32A>Ⅱ优498;当处理浓度1.0~3.0 mg·L-1时,水稻IAA和GA3含量显著降低,而ABA则显著增加,品种间总体表现为Ⅱ优498的IAA含量显著高于亲本,ABA则显著低于亲本,GA3差异较小;随Cd质量浓度的升高(0~3 mg·L-1),水稻IAA/ABA比值先升后降,而GA3/ABA则逐渐降低,Ⅱ优498变幅明显低于亲本;Cd对杂交稻内源激素的影响明显轻于亲本。由此可见,Cd胁迫破坏水稻体内正常的激素调节平衡,影响水稻的正常生长;杂交稻Cd的耐受能力强于亲本材料。
Cd胁迫;水稻;生长;内源激素
镉(Cd)是重金属中的有毒金属之一。近年来,矿业开采、工业“三废”排放和污水灌溉等人为活动,使得农田土壤Cd过度累积(Jiao等,2012;Chaney等,2004;Ueno等,2011)。而且我国农田长期不合理化肥施用,导致土壤酸化以及有机质含量降低,引起农田土壤中Cd的活性显著增强(Zhou等,2014;Ardestani等,2013;Zeng等,2011),危害农作物的正常生长、产量及品质。作为主要的粮食作物水稻(Oryza sativa L.),对Cd亲和能力极强,并对Cd毒害耐受性存在明显的基因型差异(朱智伟等,2014)。研究表明,Cd对水稻毒害主要表现为氧化损伤,影响植物的抗氧化系统和光合作用、呼吸作用等生理代谢过程(Srivastava等,2014;Clemens等,2013;Gallego等,2012)。植物内源激素是植物体自身代谢产生的痕量信号分子,对于植物的生长发育过程以及环境应答具有重要意义(许智宏等,2006;Sakamoto T,2006)。目前已知的植物激素主要包括生长素(IAA)、脱落酸(ABA)、赤霉素(GA)、细胞分裂素(CTK)。已有研究表明,内源激素变化显著影响植物抗渗透和抗盐胁迫特性等(Liu等,2011;Peleg等,2011),添加外源激素ABA可以提高作物对重金属Cd胁迫的耐受性(Piotrowsk等,2013)。但Cd胁迫下对水稻内源激素的影响机制尚不明确。本试验以杂交稻Ⅱ优498及其亲本蜀恢498、Ⅱ-32A为研究材料,研究不同Cd质量浓度胁迫对水稻生长、Cd的吸收累积以及内源激素含量的影响,探讨内源激素缓解重金属Cd胁迫的生理反应。
1 材料与方法
1.1 试验设计与处理
试验于2010年5月至6月在四川农业大学雅安校区农场温室进行。供试材料蜀恢498(恢复系)、Ⅱ-32A(不育系)和Ⅱ优498(杂交稻),由四川农业大学水稻研究所提供。选择颗粒饱满的种子,用1.5% NaClO溶液消毒10 min,然后用去离子水洗净后放入恒温培养箱(30 ℃)中催芽,出芽后转移到石英砂盘上,用1/4浓度的国际水稻研究所推荐配方营养液培养(李冰等,2014)。
试验设置4个Cd质量浓度(mg·L-1)0(对照)、0.5(低Cd)、1.0(中 Cd)、3.0(高 Cd),每个处理重复4次。待三叶一心时,选取长势一致的幼苗移栽至黑色塑料桶(3 L)中,每桶6株,培养于完全营养液中。幼苗先在营养液中预培养 7 d,然后添加不同浓度的Cd处理,Cd以CdCl2·2.5H2O形式加入营养液中,每3~5 d更换一次营养液,pH控制在5.5~6.0。
1.2 样品采集与处理
在水稻幼苗经Cd处理14 d、28 d后进行样品采集,每个处理每次采样2株,各重复3次,具体操作步骤为:先用自来水清洗水稻幼苗表面残留的Cd,再用EDTA溶液浸泡水稻根系30 min,其后用去离子水洗净根系表面的Cd和EDTA。首先分别测定水稻株高、根系形态、鲜重。然后将部分幼苗,在105 ℃杀青15~20 min,再在80 ℃下烘干至恒重,粉碎、研磨过 60目尼龙筛。剩余部分幼苗用吸水纸将表面的水吸干后,分地上部和地下部,样品保存在-70 ℃的超低温冰箱,用于水稻幼苗内源激素的测定。
1.3 指标的测定与分析
1.3.1 水稻Cd含量分析
Cd含量采用 HNO3-HCIO4消煮,原子吸收分光光度计(AAnalyst800,Perkin Elmer, USA)测定(陈同斌,2006)。
1.3.2 水稻叶片内源激素提取及测定
内源激素的提取参照王若仲(2002)的方法,即:准确称取冻干样品0.5 g左右,分4次加人预冷的80%甲醇溶液11 mL(5 mL,2 mL,2 mL和2 mL),在弱光下冰浴中研磨成匀浆,于4 ℃冷藏箱中浸提15 h,并不断搅拌。于4 ℃下5000 r·min-1离心10 min,重复两次,合并上清液,用旋转蒸发仪在 40 ℃浓缩至一半,转移至分液漏斗中,然后在分液漏斗中加入10 mL石油醚,震荡后静置分层,弃去上层绿色液体(重复 3次),将剩余液体用旋转蒸发仪浓缩至5 mL,用0.1 mol·L-1HCl调节pH为 2.8,在分液漏斗中用等体积的乙酸乙酯萃取两次,合并乙酸乙酯相,将其蒸干,用2 mL色谱甲醇溶解洗净后,过微孔滤膜后上机测试。
水稻内源激素采用高效液相色谱(HPLC)测定。色谱条件参照谢君(1997):色谱柱─Spherisorb C18(ID4×250 mm,5 μm);预柱─C18(ID4×30 mm);柱温─40 ℃;流动相─乙腈-甲醇-0.6%乙酸(5∶50∶45),0.8 mL·min-1恒流洗脱;检测波长─UV-254 nm。标准品包括IAA、ABA、GA3(均购置于sigma,用甲醇溶解)。
1.4 数据处理与分析
实验数据用Excel 2010进行分析,用DPS11.0软件进行统计分析以及用Origin8.0作图分析。
2 结果与分析
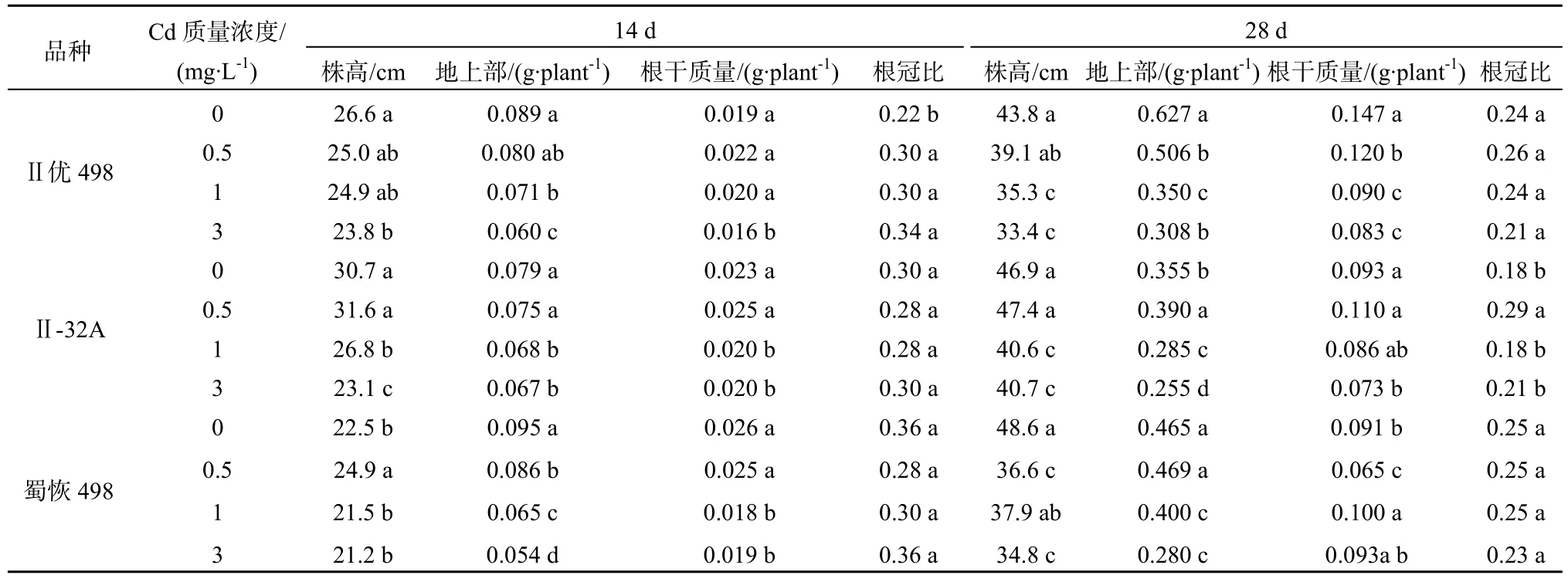
表1 Cd胁迫对杂交水稻及亲本生长的影响Table 1 Effect of Cd stress on growth of the hybrid rice and its parents
2.1 Cd胁迫对杂交水稻及亲本生长的影响
Cd处理14 d后,不同Cd质量浓度处理下对水稻的株高、地上部生物量及地下部生物量的影响显著(表1),对根冠比影响较小,其中Ⅱ优498的株高表现为对照处理最大,且随着Cd质量浓度(0~3 mg·L-1)的增加,株高有降低的趋势,而Ⅱ-32A和蜀恢 498株高均表现为在中 Cd质量浓度(0.5 mg·L-1)处理时最大,其中高Cd质量浓度(3 mg·L-1)水稻株高显著低于低Cd(0.5 mg·L-1)处理;从生物量的累积来看,不同水稻材料间地上部的生物量均表现为对照处理最大,各个材料在高 Cd(3 mg·L-1)处理较对照(0 mg·L-1)均显著降低了地上部和根的生物量(P<0.05),不同材料间的变化趋势不一致,Ⅱ优498和Ⅱ-32A均在0.5 mg·L-1处理时,均提高了根的生物量,相比对照而言差异不显著;Cd处理显著提高了Ⅱ优498的根冠比(P<0.05),而对Ⅱ-32A和蜀恢498影响不显著。
处理28 d时,中Cd(1 mg·L-1)和高Cd(3 mg·L-1)均显著降低了水稻材料的株高(P<0.05),相比对照处理,高Cd(3 mg·L-1)处理明显抑制了各个水稻品种地上部的生物量(P<0.05);从根的生物量来看,添加Cd处理较对照均显著降低Ⅱ优498根系生物量(P<0.05)。蜀恢498和Ⅱ-32A均在0.5 mg·L-1最大,但与对照差异不显著;添加 Cd处理对Ⅱ优498和蜀恢498根冠比影响不显著。随着Cd质量浓度处理增加,Ⅱ-32A根冠比有增加的趋势。
2.2 Cd胁迫对杂交水稻及亲本地上部Cd吸收的影响
从实验结果看出(表2),在添加Cd处理14 d后,随着Cd质量浓度的增加,各个水稻材料的Cd质量分数和Cd的累积量均呈显著增加(P<0.05),均在高Cd(3 mg·L-1)处理达到最高含量,总体上来看,Ⅱ优498地上部Cd浓度在添加Cd的各个质量浓度处理条件,均显著低于其亲本Ⅱ-32A和蜀恢498,在各个相同Cd质量浓度处理下,Ⅱ优498地上部Cd,显著低于亲本Ⅱ-32A,与蜀恢498无显著差异。在添加Cd处理28 d后,随着生物量的不断累积,各个材料在相同Cd浓度处理下,地上部镉浓度均有所降低,但Cd的累积量呈增加趋势。高Cd质量浓度处理(3 mg·L-1)条件下,地上部的Cd质量分数和 Cd累积量均显著高于其余处理(P<0.05);从材料间来看,相同Cd质量浓度处理下,整体表现为Ⅱ优498地上部Cd浓度较低。

表2 Cd胁迫下水稻材料及品种地上部Cd含量Table 2 The content of Cd of Materials and hybrids of rice under Cd stress
2.3 Cd胁迫水稻材料内源激素含量的影响
随着处理Cd质量浓度(0~3 mg·L-1)的不断增加,各个材料的IAA含量均呈下降趋势(表3)。在Cd处理14 d后,相比对照,中质量浓度和高质量浓度Cd处理,各个材料及品种均显著低于对照(P<0.05),而低Cd处理,其中蜀恢498的生长素(IAA)含量略有下降外,其余均表现出升高的趋势,但二者的差异不显著;但在相同Cd质量浓度处理条件下,Ⅱ优498的生长素(IAA)含量均高于Ⅱ-32A和蜀恢498,但品种间的差异均未达显著水平。在处理28 d后,相比对照,Cd处理显著降低了水稻生长素的含量,中Cd和高Cd处理显著降低水稻生长素含量(P<0.05)。相同Cd质量浓度条件下,除空白对照外,Ⅱ优498的生长素(IAA)含量显著高于亲本Ⅱ-32A和蜀恢498(P<0.05)。
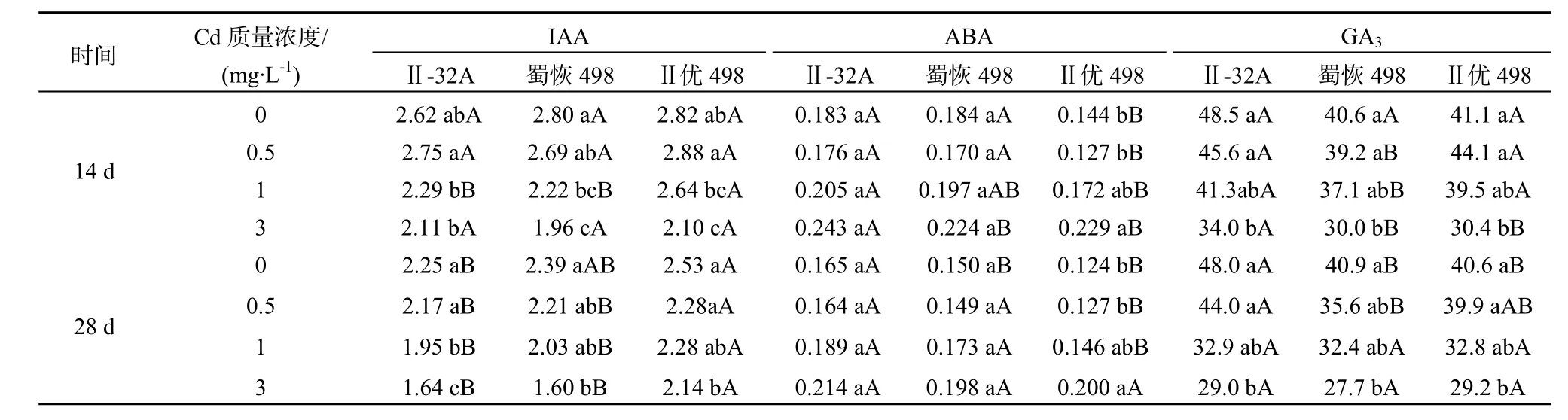
表3 Cd胁迫下杂交水稻及亲本内源激素含量的影响Table 3 Effect of Cd stress on the endogenous hormone content of the hybrid rice and its parents μg·kg-1FW
Cd胁迫明显造成了ABA的累积,添加Cd处理14 d后,各个材料的脱落酸(ABA)含量均呈先降低后升高的趋势。在低质量浓度Cd处理下脱落酸(ABA)积累为0.1274(μg·kg-1·FW)最低,但随处理质量浓度的增加(0~3 mg·L-1),则表现出显著降低的趋势(P<0.05),在添加Cd处理28 d后各个材料品种。各个材料在同一Cd质量浓度处理条件下,Ⅱ优498的ABA含量均比其亲本材料低,但在各个采样时期的分析结果表明,同一 Cd质量浓度处理间没有显著差异。
在添加Cd质量浓度处理14 d后,Ⅱ-32A、Ⅱ优 498,其中赤霉素(GA3)含量均表现出先升高后降低的趋势,在低Cd质量浓度处理下,相比对照增加量不显著,而蜀恢498的对照处理为最大,在中Cd质量浓度1 mg·L-1处理表现为降低,但相比对照及低Cd质量浓度处理3个材料及品种下降均不显著,随着各添加Cd处理的时间不断推进,在28 d时,各个处理间较14 d,总体表现出增加趋势。在同一采样时期,其中Ⅱ优498赤霉素含量随着Cd质量浓度的处理变化不显著。Ⅱ-32A、Ⅱ优498的变化与14 d时表现一致。
从图 1可知,处理 14 d后,3个水稻材料GA3/ABA的值均随 Cd处理质量浓度的增加而降低,在低浓度0.5 mg·L-1处理的时与对照差异均不显著,1.0和3 mg·L-1均显著降低GA3/ABA值,从各个材料来看Ⅱ优498降低的幅度小于亲本Ⅱ-32A和蜀恢498,因此可以看出Ⅱ优498的耐Cd能力要强于Ⅱ-32A和蜀恢498;处理28 d后,3个水稻材料GA3/ABA的值均随Cd质量浓度表现与14 d一致,但从相同材料和低质量浓度(0.5 mg·L-1)来看,GA3/ABA值明显增加(P<0.05),而在高质量浓度(3 mg·L-1)GA3/ABA值变化不明显。则表明在植物耐受浓度范围内,随着植株的不断生长,其抵御Cd毒害能力明显增强,当外界Cd浓度超过了水稻的耐受范围,其生长明显受到抑制,防御机制也难以建立。

图1 Cd胁迫下3个水稻材料及品种IAA/ABA、GA3/ABA值Fig. 1 Effect of Cd stress on endogenousIAA/ABA and GA3/ABA values of Materials of rice
3种材料IAA/ABA值均随着Cd质量浓度的不断提高而显著降低(P<0.05),3个材料在低浓度(0.5 mg·L-1)处理均没有对IAA/ABA值产生显著影响,中Cd质量浓度(1 mg·L-1)和高Cd质量浓度(3 mg·L-1)则显著降低IAA/ABA值;从3种材料IAA/ABA值变化趋势来看,Ⅱ优498在中质量浓度(1 mg·L-1)和高质量浓度(3 mg·L-1)降低幅度均小于亲本Ⅱ-32A和蜀恢498,因此Ⅱ优498的耐Cd能力要强于Ⅱ-32A和蜀恢498;处理28 d后,同一材料在相同Cd浓度处理下IAA/ABA值明显低于12 d,在高质量浓度Cd(3 mg·L-1)表现更加明显,说明随着Cd处理时间增加,植物内源IAA合成明显受到抑制,影响到植株的正常生长。
3 讨论
Cd胁迫条件下,作物的根系生长(何俊瑜等,2010)、光合作用(Srivastava等,2014)、养分吸收(Clemen等,2013)等生理过程明显受到抑制,进而表现出生物量的下降;本研究表明,Cd胁迫对水稻幼苗的生长有明显毒害作用,表现为株高、地上部和地下部的生物累积量减少,而在低Cd质量浓度0.5 mg·L-1时,杂交稻及亲本生长未受到明显影响,当Cd质量浓度到3 mg·L-1,杂交稻及亲本生长受到明显抑制。随着Cd处理时间延长,植物对Cd产生抗性(Chaca等,2014);本研究表明,处理28 d比14 d,中低Cd处理时,株高和生物量的降幅更小。水稻地上部的Cd含量与营养基质中Cd浓度呈极显著正相关(龙小林,2014);本研究表明,随着Cd质量浓度增加,杂交稻地上部Cd浓度和Cd累积量均增加,随处理时间延长,杂交稻地上部Cd浓度降低,但Cd累积量呈增加趋势。且不同材料间Cd累积量存在明显差异。
Cd胁迫可明显改变植物内源激素水平,打破其平衡,进而影响植物正常生长发育;当植物在低浓度Cd处理时,会激活植物的抗氧化系统,在高浓度Cd时候,产生过多的活性氧自由基(ROS),使植物表现出氧化损伤(Wang等,2012),本研究表明,低Cd质量浓度0.5 mg·L-1处理增加杂交水稻及亲本材料IAA含量,高质量浓度则降低了亲本材料IAA含量,可能是由于低质量浓度Cd处理激活了水稻的抗氧化系统,使得IAA的合成前体吲哚乙醛不易氧化,而增加其合成前体;而在高质量浓度Cd处理时,膜脂过氧化,使IAAO(吲哚乙酸氧化酶)活性增强,则加快IAA分解(吴坤等,2011)。很多研究表明,在重金属胁迫下,植物ABA的含量显著增加(Chaca等,2014)。本研究表明,Cd胁迫显著增加ABA在地上部的含量,且随着胁迫时间的延长呈降低的趋势;Sharma(2002)认为通过ABA的增加,使气孔关闭而维持植物体内的水分平衡和减少根系对Cd的直接吸收,进而达到降低体内的Cd浓度,从而减轻毒害。GA3是对植物生长发育必须的一类激素,其对于促进茎的生长有重要作用(黄先忠等,2006)。本研究表明,Cd胁迫降低了水稻材料地上部 GA3的含量,Atici等(2005)在用 Pb处理鹰嘴豆幼苗也降低了地上部GA3含量;Zhu(2012)认为GA可以减少内源NO的含量,抑制 Cd转运蛋白的合成,从而降低 Cd的吸收,降低Cd毒害。内源IAA、ABA、GA3可能是水稻响应Cd胁迫的信号分子,目前其深层次的机理尚不明确,有待进一步研究。
4 结论
(1)随着Cd质量浓度的增加,水稻株高、地上部生物量和根干重显著降低;地上部Cd的质量分数和累积量均显著增加,处理时间延长则表现为地上部Cd的质量分数降低而Cd的累积量增加;在1.0~3.0 mg·L-1Cd质量浓度胁迫下,水稻地上部Cd质量分数和累积量表现为蜀恢 498>Ⅱ-32A>Ⅱ优498,因此Cd胁迫显著抑制水稻的生长。
(2)当处理浓度1.0~3.0 mg·L-1时,水稻IAA和GA3含量显著降低,而ABA则显著增加,品种间总体表现为Ⅱ优498的IAA含量显著高于亲本,ABA则显著低于亲本,GA3差异较小;随Cd质量浓度的升高(0~3 mg·L-1),水稻IAA/ABA比值先升后降,而GA3/ABA则逐渐降低,Ⅱ优498变幅明显低于亲本;Cd对杂交稻内源激素的影响明显轻于亲本。Cd胁迫破坏水稻体内正常的激素调节平衡;杂交稻Cd的耐受能力强于亲本材料。
ALICJA P N, BAJGUZ A, ZAMBRZYCKA E, et al. 2012. Phytohormones as regulators of heavy metal biosorption and toxicity in green alga Chlorella vulgaris (Chlorophyceae) [J]. Plant Physiology and Biochemistry, 52: 52-65.
ARDESTANI M M, VAN GESTEL C A. 2013. Using a toxicokinetics approach to explain the effect of soil pH on cadmium bioavailability to Folsomia candida [J]. Environmental Pollution, 180: 122-130.
ATICI Ö, AĞAR G, BATTAL P. 2005. Changes in phytohormone contents in chickpea seeds germinating under lead or zinc stress [J]. BiologiaPlantarum, 49(2): 215-222.
CHACA M V P, VIGLIOCCO A, REINOSO H, et al. 2014. Effects of cadmium stress on growth, anatomy and hormone contents in Glycine max (L.) Merr [J]. ActaPhysiologiaePlantarum, 36(10): 2815-2826.
CHANEY R L, REEVES P G, RYAN J A, et al. 2004. An improved understanding of soil Cd risk to humans and low cost methods to phytoextract Cd from contaminated soils to prevent soil Cd risks [J]. BioMetals, 17(5): 549-553.
CLEMENS S, AARTS M G M, THOMINE S, et al. 2013. Plant science: the key to preventing slow cadmium poisoning [J]. Trends in plant science, 18(2): 92-99.
GALLEGOS M, PENA L B, BARCIA R A, et al. 2012. Unravelling cadmium toxicity and tolerance in plants: insight into regulatory mechanisms [J]. Environmental and Experimental Botany, 83: 33-46.
JIAO W T, CHEN W P, et al. 2012. Environmental risks of trace elements associated with long-term phosphate fertilizers applications: A review[J]. Environmental Pollution, 168(1): 44-53.
LIU Y, DING Y F, WANG Q S, et al. 2011.Effect of Plant Growth Regulators on Growth of Rice Tiller Bud and Changes of Endogenous Hormones [J]. Acta Agronomica Sinica , 37(4): 670-676.
PELEG Z, BLUMWALD E. 2011.Hormone balance and abiotic stresstolerance in crop plants [J]. Current Opinion in Plant Biology, 14(3): 290-295.
SAKAMOTO T. 2006. Phytohormones and rice crop yield: strategies and opportunities for genetic improvement [J]. Transgenic Research, 15(4): 399-404.
SHARMA S S, KUMAR V. 2002. Responses of wild type and abscisic acid mutants of Arabidopsis thaliana to cadmium [J]. Journal of Plant Physiology, 159(12): 1323-1327.
SRIVASTAVA R K, PANDEY P, RAJPOOT R, et al. 2014. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings [J]. Protoplasma, 251(5): 10417-1065.
UENO D, KOYAMA E, YAMAJI N, et al. 2011. Physiological, genetic, and molecular characterization of a high-Cd-accumulating rice cultivar, Jarjan [J]. Journal of Experimental Botany, 62(7): 2265-2272.
WANG C, LUO X, TIAN Y, et al. 2012. Biphasic effects of lanthanum on Viciafaba L. seedlings under cadmium stress, implicating finite antioxidation and potential ecological risk [J]. Chemosphere, 86(5): 530-537.
ZENG F, ALI S, ZHANG H, et al. 2011. The influence of pH and orGA3nic matter content in paddy soil on heavy metal availability and their uptake by rice plants [J]. Environmental Pollution, 159(1): 84-91.
ZHOU J, XIA F, LIU X, et al. 2014. Effects of nitrogen fertilizer on the acidification of two typical acid soils in South China [J]. Journal of Soils and Sediments, 14(2): 415-282.
ZHU X F, JIANG T, WANG Z W, et al. 2012. Gibberellic acid alleviates cadmium toxicity by reducing nitric oxide accumulation and expression of IRT1 in Arabidopsis thaliana [J]. Journal of Hazardous Materials, 15(239-240): 302-307.
陈同斌, 宋波, 郑袁明, 等. 2006. 北京市菜地土壤和蔬菜铅含量及其健康风险评估[J]. 中国农业科学, 39(8): 1589-1597.
何俊瑜, 任艳芳, 严玉萍, 等. 2010. 镉胁迫对水稻幼苗生长和根尖细胞分裂的影响[J]. 土壤学报, 47(1): 138-144.
黄先忠, 蒋才富, 廖立力, 等. 2006. 赤霉素作用机理的分子基础与调控模式研究进展[J]. 植物学报, 23(5): 499-510.
李冰, 王昌全, 李枝, 等. 2014. Cd胁迫下杂交水稻对Cd的吸收及其动态变化[J]. 生态环境学报, 23(2): 312-316.
龙小林, 向珣朝, 徐艳芳, 等. 2014. 镉胁迫下籼稻和粳稻对镉的吸收、转移和分配研究[J]. 中国水稻科学, 28(2): 177-184.
王若仲, 萧浪涛, 蔺万煌, 等. 2002. 亚种间杂交稻内源激素的高效液相色谱测定法[J]. 色谱, 20(2): 148-150.
吴坤, 吴中红, 邰付菊, 等. 2011. 镉胁迫对烟草叶激素水平, 光合特性,荧光特性的影响[J]. 生态学报, 31(16): 4517-4524.
谢君. 1997. 高效液相色谱测定多种植物内源激素方法研究[J]. 四川农业大学学报, 15(3): 297-299.
许智宏, 李家洋. 2006. 中国植物激素研究:过去, 现在和未来[J]. 植物学通报, 23(5): 433-428.
朱智伟, 陈铭学, 牟仁祥, 等. 2014. 水稻镉代谢与控制研究进展[J]. 中国农业科学, 47(18): 3633-3640.
Effect of Cd Stress on Growth and Content of Endogenous Hormones in Rice
YOU Laiyong1, WANG Changquan1*, LUO Juan2, LI Bing1, ZENG Jian1
1. College of Resource and Environment, Sichuan Agricultural University, Chengdu 611130, China; 2. Jiangyou Forestry Bureau of Sichuan province, Mianyang 621170, China
Cadmium (Cd) is non-essential but toxic elements for rice, which has an important effect on the development and physiological metabolism in rice. The balance of endogenous hormones plays an important regulatory role on rice growth and development. Therefore, the investigation on growth and endogenous hormones changes in rice under Cd stress would help to understand the physiological process and mechanism. In the present study, rice (Shuhui498, II-32A and hybrid rice IIyou498) was chosen as the experimental material to investigate the growth and content of endogenous hormones in rice under various concentrations of Cd stress (0, 0.5, 1, 3 mg·L-1). This study showed the following results: Compared to controls, high and intermediate concentration Cd significantly reduced the plant height, shoot biomass and root biomass of rice seedlings. With the increasing of Cd concentration, the Cd content in rice showed growing tendency. Under the Cd stress, the Cd content in aboveground of rice showed the trend of shuhui498 > II-32A > II you498. When the Cd concentration reached at 1.0~3.0 mg·L-1, the content of IAA and GA3in rice was significantly reduced, whereas the ABA content of rice was significantly increased, compared to the controls. With the increasing of Cd concentration, the IAA/ABA ratio of rice firstly increased and then decreased, while GA3/ABA gradually decreased. The amplitude of the IAA/ABA ratio in IIyou498 was significantly lower than that of the parent. The parents had more sensitive to Cd stress than did hybrid rice. These results suggested that Cd stress disturbed the balance of endogenous hormones and caused the decrease of the growth of rice. The hybrid rice had stronger resistance to Cd than did its parent.
cadmium stress; rice; growth; endogenous hormones
10.16258/j.cnki.1674-5906.2015.05.021
X171.5
A
1674-5906(2015)05-0860-06
游来勇,王昌全,罗娟,李冰,曾建. Cd胁迫对水稻生长及内源激素含量的影响[J]. 生态环境学报, 2015, 24(5): 860-865.
YOU Laiyong, WANG Changquan, LUO Juan, LI Bing, ZENG Jian. Effect of Cd Stress on Growth and Content of Endogenous Hormones in Rice [J]. Ecology and Environmental Sciences, 2015, 24(5): 860-865.
国家科技支撑计划项目(2012BAD14B18-02)
游来勇(1990年生),男,硕士研究生,主要从事土壤环境质量研究。E-mail:youlaiyong@126.com *通信作者:王昌全(1962年生),男,教授,主要从事土壤环境与可持续研究。E-mail:w.changquan@163.com
2015-02-27

