外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响
史静,潘根兴
1. 云南农业大学资源与环境学院,云南 昆明 650201;2. 南京农业大学农业资源与生态环境研究所,江苏 南京 210095
外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响
史静1*,潘根兴2
1. 云南农业大学资源与环境学院,云南 昆明 650201;2. 南京农业大学农业资源与生态环境研究所,江苏 南京 210095
研究不同水稻(Oryza sativa)品种外加Cd处理下镉吸收特征、PCs(主要是非蛋白巯基)的解毒机制及从微观水平探寻亚细胞镉的分布状况,对了解不同水稻基因型的耐Cd机理有重要意义。通过盆栽实验研究了不同外加Cd处理对水稻体内Cd的吸收累积、亚细胞分布及非蛋白巯基含量的影响。结果表明,外加Cd胁迫显著诱导根合成NPT-SH,外加Cd及品种差异对水稻体内Cd的吸收具有不同程度的影响,两品种相比,不加Cd处理下,品种J196地上部Cd含量/根系Cd含量的比值高于中浙优1号;当外加Cd浓度达到5 mg·kg-1时,品种A根系向地上部转移的Cd远高于品种C,分为25.7%和7.4%;但在外加Cd处理达到25 mg·kg-1时,两品种间无显著差异。根中NPT-SH的诱导量与水稻根系内Cd的含量变化一致。外加Cd处理下,品种J196根系内NPT-SH含量均高于中浙优1号,从细胞水平上表明中浙优1号可能具有从根系向茎叶的高镉转运能力。同时以差速离心法探究Cd在两杂交水稻品种不同器官的亚细胞分布为根系细胞的Cd大部分存在于细胞壁中,占52.6%~83.2%,少部分存在于细胞可溶部分(细胞质),其镉含量分布的百分率为3.0%~10.1%,且根系细胞壁中J196的分布率高于中浙优1号;表明J196的根系细胞壁的具有较强的固Cd能力;和对照相比,外加Cd促使中浙优1号根系细胞内可溶物向地上部移动,且高Cd处理下,Cd在中浙优1号细胞内溶物的分配率大于J196,从而在亚细胞水平上推测了品种中浙优1号为高转运品种的可能机制。
水稻;镉;非蛋白巯基;亚细胞分布
镉污染及其生物毒性问题已得到全世界关注。关于植物对Cd的吸收转运过程和耐性机制受到很大重视。同时,这些植物也能在一定程度上表现出对镉胁迫的适应性机制。其中一个重要的适应性机制是植物螯合肽解毒机制。植物体内的谷胱甘肽(GSH)、非蛋白巯基(NPT)、植物螯合态(PC)和半胱氨酸(Cys)等可能是植物消除重金属镉胁迫的主要成分(Cobbett,2000;孙琴等,2005),有研究报道GSH和Cys在非超积累植物对重金属的耐性中起着重要的作用(高可辉等,2011)。自1985年Grill发现一组镉结合多肽,并命名为植物络合素(Phytochelatins,PCs)以来,PCs的生理功能已受到国际上众多学者的广泛关注。PCs是一种富含半胱氨酸的多肽物质,其主要生理功能是络合金属(植物微量营养和非必需重金属)元素,从而减轻或避免过量金属离子对植物体的伤害。多种金属和非金属均能诱导PCs产生,其中Cd是最强的体内诱导因子(Rauser,1995),镉在植物体内可能主要是以PC-Cd络合物或者是Cd-GSHx络合物的形式运输(Guo和Marschner,1995)。也有研究表明Cd与细胞质内PC相结合形成低分子量复合物,然后经液泡膜上的转运蛋白运输至液泡,进而形成对植物毒性很低的富含硫的高分子量复合物贮存于液泡是植物对 Cd的主要解毒机制(Clemens,2006)。因此,PCs作为金属胁迫下细胞内一项反应敏感的指标受到国际上众多学者的关注,同时Keltjens和Beusichem(1998)则将PCs的激增作为植物遭受重金属胁迫的早期预警指标。因此研究不同水稻(Oryza sativa)品种外加Cd处理下的非蛋白巯基的变化,对了解不同水稻基因型的耐Cd机理有重要意义。
与此同时植物总是尽量避免Cd及其它重金属元素损伤其相对重要的组织、细胞和细胞器,从而表现出选择性分布。植物从土壤中吸收重金属后,一般主要集中在根系,再通过根系向植物的各个器官进行转运分配,但植物根系吸收的Cd比Pb、As等重金属更易向地上部及子实中转移。因此,植物根系中Cd的分配可能会影响到其在植物体内的移动性。而开展水稻微观水平的研究有助于更深入地了解水稻不同品种间对Cd耐性、吸收和累积机理。本研究正是从上述超微结构的观察入手,采用差速离心分析技术分离水稻各器官各部分细胞器,比较子粒镉积累不同类型的水稻镉的亚细胞分布特征,从微观层次揭示低Cd与高Cd基因型在亚细胞水平上差异的机理,以探讨不同水稻品种耐Cd的机制和特点。基于此,本试验采用土培试验的培养方法研究了不同外Cd处理下两个水稻品种体内Cd、巯基蛋白总量以及在亚细胞分布的变化特征,以期研究两个子粒Cd积累能力相差很大的水稻品种在Cd吸收的第一高峰期苗期对Cd的耐性差异及根系向地上部转运的差异。
1 材料与方法
1.1 供试土壤
红沙泥田,属红壤性水稻土,为典型简育湿润老成土(Typical Hapludults),采自中国科学院鹰潭红壤生态实验站(116°55′E, 28°5′N),第四纪红黏土母质所发育。该土壤于2007年4月采集,运回实验室后经风干,磨碎,过5 mm孔径筛,混匀备用,用于盆栽实验。另取部分磨碎过1和0.149 mm尼龙筛供基本性质测定。供试土壤的基本理化性质分析结果见表1。

表1 供试土壤的基本性质Table 1 Basic properties of soil
1.2 供试作物
通过前期对我国南方110个栽种杂交水稻品种的筛选研究(Shi等,2009),选取子粒含Cd量差异较大的2个杂交水稻品系:中浙优一号(品种A,子粒高Cd含量品种)和J196(品种C,子粒低Cd含量品种)两品种的生育期为(150±20) d。
1.3 试验设计
水稻苗期盆栽试验于2007年5月中旬─7月中旬在南京农业大学牌楼温室中进行,采用20 cm×20 cm的塑料钵,每盆装土3.0 kg,设置3个不同Cd质量浓度处理,分别为0(Cd0)、2.5(Cd1)、5(Cd2)、10(Cd3)、25(Cd4)mg·kg-1(以纯 Cd计)。将CdCl2·2.5H2O与去离子水配成母液,逐级稀释成处理浓度后与过5 mm筛的土壤反复混合均匀,再加入底肥N(0.1 g·kg-1)、P2O5(0.2 g·kg-1)和K2O(0.2 g·kg-1)加水搅成匀浆混匀之后室温下平衡30 d。水稻于2007年6月17日挑选优质饱满种子用“浸种灵”按一定比例和温水混匀成溶液,浸种催芽48 h至种子露白,6月19日取优质露芽种子直接播种,土壤保持湿润状态,待幼苗2叶1心时间苗,每盆保留3株,保持淹水层(水层3 cm)。试验按完全随机设计,3次重复。7月25日采集植株样品,分根系和地上部采集,收获的植物样品先用自来水多次冲洗,然后用蒸馏水冲洗,吸水纸吸干样品表面水分,将样品剪碎混合,分成两部分,一部分样品放入烘箱105 ℃杀青30 min,60~70 ℃烘干至恒质量,测定各器官Cd含量;一部分样品直接分析非蛋白质巯基含量以及测定亚细胞镉含量。
1.4 测定方法
1.4.1 非蛋白巯基的测定(Keltjens和Beusichem,1998;Rama和Prasad,1998)
称取水稻鲜样1.00 g,加2.0 mL 5%(V/V)的SSA(5-磺基水杨酸)(内含6.3 Mmdtpa,pH<1),再加入少许洗净的石英砂,冰浴研磨混匀,低温离心(8000 g, 4 ℃)15 min。上清夜冷藏用于TNP-SH的测定。取上清液300 μL放入10 mL玻璃试管中,加630 μL 0.5 mol·L-1的K2HPO4(pH7.5)和25 μL 6.3mmol·L-1的 5, 5′双二硫(2-硝基苯甲酸)(DTNB),室温下放置20 min,然后在分光光度计412 nm波长下用分光光度计比色测定。以等量的未加DTNB的溶液作空白调零点,用GSH作标准。
1.4.2 Cd在水稻植株各器官的亚细胞分布
采用差速分级离心技术分离出各器官不同细胞组分(图1),具体方法如下:植物材料10 g加入 10 mmol·L-1Tris-HCl缓冲液(pH=7.4, 2.5% AsA),冰浴研磨,将匀浆液按图程序冷冻离心分离出各细胞组分,每步离心前用缓冲液补充至同一体积,所得残渣和沉淀供分析测定(周卫等,1999;李德明等,2004)。
1.4.3 残渣及沉淀消煮、测定分析
细胞壁及未破碎残渣用去离子水洗涤,定量滤纸过滤后60 ℃烘干,加10 mL HNO3-HClO4(4∶1,V/V)混合液,过夜后在200 ℃条件下消煮至澄清,用去离子水定容至25 mL,滤液用原子吸收分光光度计测定Cd含量;细胞器各沉淀用去离子水转入小烧杯中,在电热板上蒸干,再加2 mL浓硝酸砂浴消煮至澄清,用去离子水定容至10 mL后测定Cd含量;上清液(细胞内可溶物)主要为提取液,经酸化后直接测定其中的Cd含量。
1.4.4 重金属Cd的测定
烘干粉碎植株样品用 4∶1硝酸-高氯酸消化后,用原子吸收分光光谱仪测定。
1.5 统计分析
分析结果进行平均值和标准差统计,统计检验采用SPSS for Windows 11.5软件,显著性差异水平为P≤0.05。

图1 差速离心法分离水稻茎叶和根的亚细胞组分Fig. 1 Separation of subcellular fractions of stem and root in rice with differential centrifugation
2 结果与分析
2.1 外加Cd对水稻体内含Cd量的影响
从植株含Cd量的结果来看,不管何种外加Cd条件下,植物吸收的Cd绝大部分积累在根部,根系Cd含量变化于1~63 mg·kg-1范围内,约是茎叶含Cd量的3~15倍。各处理间差异显著,随着外加Cd处理浓度的提高,根中Cd含量显著增加,两品种间根系含Cd量差异显著,中浙优1号变化于6~35 mg·kg-1范围内,J196变化于25~63mg·kg-1,且中浙优1号在外加Cd处理达到10 mg·kg-1(Cd3)时达到最高含量值。这表明外加Cd处理下,不同的水稻品种对镉的吸收能力是不同的。当外加Cd浓度过高,如本实验外加Cd的最高水平(25 mg·kg-1)时,可能抑制了中浙优1号对Cd的吸收,或者是促进了根部Cd向地上部的转运。而J196却随着外加Cd的升高根系含Cd量也显著增加。两品种水稻幼苗茎叶中含Cd量的变化,可以看出随着外加Cd浓度的增加,两品种水稻幼苗茎叶中镉含量也表现为和根系Cd含量变化相似的增加趋势。

表2 不同Cd水平水稻体内根及地上部Cd含量Table 2 Cd contents in shoots and roots of rice
从表2中可看出两品种相比,不加Cd处理下,J196地上部Cd含量与根系Cd含量的比值高于中浙优1号;当外加Cd浓度达到5 mg·kg-1时,中浙优1号根系向地上部转移的Cd远高于J196,两者地上部与根系Cd含量之比分为25.7%和7.4%;但在外加Cd处理达到25 mg·kg-1时,两品种间差异不大。这说明在此生育期,在不加Cd处理下,J196根系向地上部转运的Cd高于中浙优1号,但当外加Cd在一定浓度范围内提高时,中浙优1号由于自身的高转运特性,向地上部的转运Cd的能力超过J196。
2.2 外加Cd对水稻体内非蛋白巯基含量的影响
植物体内的非蛋白巯基(Non-protein thiol, NPT)包括植物螯合多肽(PCs)、谷光甘肽(GSH)等物质。这些物质与重金属胁迫有密切关系。从图2中可看出,外加Cd处理显著增加了水稻植株根系NPT的含量。且J196根系NPT含量显著高于中浙优1号。和不加Cd处理相比,外加Cd处理下的水稻根中NPT含量约是不加Cd处理的1~2倍左右。茎叶中NPT含量显著低于根系中NPT的量,约为根中NPT的20%~30%左右。对于J196而言,外加Cd同样也显著提高了茎叶中NPT含量,而中浙优1号茎叶NPT含量在不同外加Cd处理下没有明显规律可循。但总体而言,除了不加Cd处理,中浙优1号茎叶NPT高于J196外,其余外加Cd处理下,J196茎叶NPT也高于中浙优1号。

图2 不同浓度Cd对两品种水稻植株不同部位NPT含量(鲜质量)变化的影响Fig. 2 Effect of Cd on NPT in different part of two rice at seeding period
2.3 不同Cd处理下水稻体内Cd亚细胞分布
2.3.1 不同Cd处理下水稻地上部Cd亚细胞分布
从表3可以看出,两品种地上部各细胞器组分中的Cd含量随着外加Cd浓度提高没有显著变化。两品种比较,不加Cd处理下中浙优1号细胞器含量高于J196,细胞壁和细胞内可溶物之间没有显著差异。当外加Cd处理达到25 mg·kg-1时,J196细胞壁 Cd含量高于中浙优 1号,细胞内可溶物中
Cd含量却低于J196。从各细胞器组分分配率上看,任意Cd浓度处理下,Cd主要分布在两个品种的细胞壁中,占到各细胞组分的 31.2%~51.5%,不加Cd处理和加Cd 25mg·kg-1下,中浙优1号的Cd在细胞壁中分配率小于 J196。而在加 Cd 5 mg·kg-1下,中浙优1号的Cd在细胞壁中分配率高于J196。
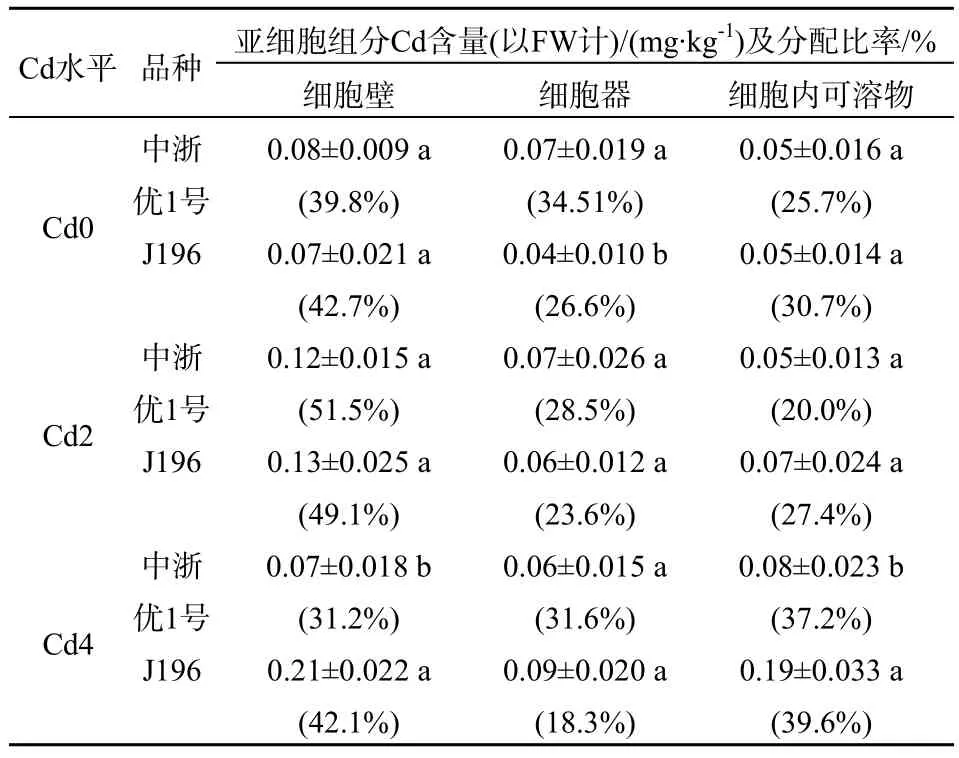
表3 水稻地上部各亚细胞组分Cd含量及分配率Table 3 Cd contents and distributions of subcellular fractions in shoots of rice

表4 水稻根系各亚细胞组分Cd含量及分配率Table 4 Cd contents and distributions of subcellular fractions in roots of rice
2.3.2 不同Cd处理下水稻根系Cd亚细胞分布
根系各亚细胞组分中的Cd含量水平随品种、外加Cd处理不同而变化。从表4可以看出,两品种根系各亚细胞组分中的Cd含量随着外加Cd浓度的升高而显著增加。两品种间各亚细胞组分在不同外加 Cd处理下表现不同。不加 Cd处理时,J196细胞壁内Cd含量显著高于中浙优1号,但细胞器和细胞内溶物中Cd含量在两品种间无显著差异。当外加Cd为5 mg·kg-1时,J196细胞壁和细胞器中Cd含量显著高于中浙优1号,细胞内溶物中的Cd则在两品种间无显著差异。从各亚细胞组分组分分配率上看,任意Cd浓度下,Cd主要分布在两品种的细胞壁上,且加Cd处理下的Cd分配比例高于不加Cd处理。其次是细胞器中的Cd含量,而细胞内溶物的Cd含量最少。任意Cd处理下,各亚细胞组分的分配率均表现为,中浙优1号Cd在细胞壁中分配率小于J196,而细胞器和细胞内溶物中Cd的分配率大于J196。
3 讨论
3.1 外加镉对水稻非蛋白巯基的影响
植株体内NTP含量的产生与金属的浓度有关,其合成水平的高低与细胞内胁迫金属的数量存在显著的正相关关系,认为胞内PCs的诱导量可反映金属的实际毒性(Sneller等,1999)。本实验中不同外加Cd处理下两品种水稻植株体内(根系、茎叶)Cd含量差异明显,但Cd主要集中在根系。对于两品种而言,J196根系Cd含量远高于中浙优1号;茎叶Cd含量除了不加Cd处理下二者无显著差异外,其他处理下J196均显著高于中浙优1号。而此时,水稻植株体内的NPT含量则表现出:两品种NPT含量主要集中在根系,且外加Cd下,根中NPT含量约是不加Cd处理的1~2倍左右。说明Cd对NPT的诱导能力与水稻Cd的含量变化存在一定的响应关系,尤其表现在根系。外加Cd处理下,J196根系内NPT-SH含量均高于中浙优1号,这可能有助于前者体内的镉从根向地上部运输,这正从细胞水平上表明 J196可能具有从根系向茎叶的高转运能力。细胞水平上NPT-SH的诱导程度与Cd积累量相比可能是两品种Cd耐性差异机制之一。
类似结果也出现在玉米(Keltjens和Beusichem,1998)和小麦(孙琴等,2004;孙琴等,2005)等多种植物体内。可见,细胞水平上PCs的诱导程度可以更好反映Cd的生物毒性。Guo和Marschner(1995)报道,镉在植物体内可能主要是以PC-Cd络合物或者是Cd-GSHs络合物的形式运输,镉胁迫时,许多植物如大豆、烟草、番茄、土豆及玉米,其γ-谷氨酰半胱氨酸合成酶活性明显增强,这些NPT物质与镉络合形成络合物数量增加,从而促进Cd从根系向地上部的转运。Hsu和Kao报道(2003),用10~50 μmol·L-1镉处理水稻幼苗6 d后,耐性强的水稻品种TNG67其叶绿素和蛋白质含量没有明显的变化,而镉敏感品种TN1其叶绿素和蛋白质含量都出现显著的下降。因此植物体内高PC或高GSH含量可能有助于镉从根向地上部的转运。因此,植物体内高TNP-SH含量可能有助于镉从根向地上部的转运。
对于同种作物的不同品种而言,Florijn和Van Beusichem(1993)发现高Cd玉米根中PC的浓度远高于低Cd玉米,因而前者地上部的Cd含量远高于后者。王芳等(2010)采用镉(Cd)耐性不同的水稻品种N07-6和N07-63,通过室内水培试验,比较了50 μmol·L-1Cd胁迫下水稻的非蛋白巯基(NPT)的差异。结果表明,Cd胁迫诱导了两个品种NPT含量的增加,N07-63的增幅显著高于N07-6。高可辉等(2011)结果表明:Cd胁迫明显抑制了水稻生长,显著诱导了巯基物质[非蛋白巯基(NPT)、谷胱甘肽(GSH)、植物螯合肽(PC)]的合成,在一定程度上减轻了Cd的毒性效应。原海燕等(2013)采用溶液培养研究Pb胁迫以及Pb胁迫下添加外源谷胱甘肽(GSH)和丁胱亚磺酰胺(BSO)对马蔺根和叶非蛋白巯基总肽(NPT)含量的影响。结果表明Pb胁迫下添加BSO后马蔺生物量的下降可能与非蛋白巯基化合物合成受抑降低有关。
3.2 外加镉条件下对镉在水稻亚细胞分布的影响
进行Cd亚细胞分布的研究有利于从细胞水平上深入研究Cd对植物的毒害和耐受机制。而目前对Cd在植物体内的细胞行为还不十分清楚,但细胞壁沉积和液泡区室化作用是植物对重金属解毒的重要途径(Wang等,2008)。李德明等(2004)研究发现在小白菜的亚细胞结构中,Cd主要分布在细胞可溶性成分、细胞壁和叶绿体中,细胞核、线粒体和核糖体中Cd分布量较少。Hall(2002)认为,Cd在植物细胞内除由细胞壁部分吸附外,大部分的Cd积累于液泡,使植物细胞免除毒害。在各亚细胞组分中,Cd都随着溶液中 Cd浓度的增加而增加(Ramos等,2002)。万敏等(2003)对小麦的两个不同品种的研究表明,在其根和叶片细胞中,Cd大部分存在于细胞可溶部分(细胞质部分),占总量的58.5%~66.8%,少部分存在于细胞不溶部分(细胞器和细胞壁部分)。杨居荣等(1993)在对小黑麦、玉米、大豆和黄瓜4种盆栽试验的结果也表明,Cd在 4种作物根细胞中的分布均以可溶性组分所占比例最高,可达 58%~70%。冉文静等(2010)指出复合投加gallic acid和SDS可以增强黑麦草对Cd的区室化作用和细胞壁沉积作用。潘秀等(2012)也通过盆栽实验分析了Cd、Zn在互花米草中的亚细胞分布,细胞壁是主要分布部位。这些结果上的差异,可能是因为试验中不同的Cd浓度及试验作物耐Cd性的不同而致。
试验结果表明,Cd处理下,2水稻品种的根系细胞的 Cd大部分存在于细胞壁中,占 52.6%~83.2%,少部分存在于细胞可溶部分(细胞质),其镉含量分布的百分率为 3.0%~10.1%,且根系细胞壁中J196的分布率高于中浙优1号。说明J196的根系细胞壁的固Cd能力较强。可能的原因是和中浙优1号相比,J196的根细胞壁具有大量的阳离子配位基团并且含有大量的能吸附Cd离子的非可溶性物质。随着Cd处理升高,二者的差异减小,外加Cd使更多的Cd积累在根系,中浙优1号细胞壁的固镉能力提高。根细胞中镉的亚细胞分布会影响镉在植物体内的移动性,这一假设已经在对不同作物的研究中得到验证。对于细胞内可溶物中的Cd而言,和不加Cd处理下J196根系的细胞内可溶物占根中总Cd的分布百分率高于中浙优1号相比,这一点很好的解释了J196地上部Cd含量高于中浙优1号的事实。随着外加Cd升高,中浙优1号表现出高于J196的趋势,在此情况下的中浙优1号细胞质中较高Cd含量及其占根中各亚细胞组分较高,增加了Cd从根系由木质部向地上部移动的可能性,这一点正好说明中浙优1号加Cd下地上部与根系Cd含量的比值升高这一事实。
两水稻品种地上部细胞壁Cd分配率随着外加Cd浓度升高而出现先升高后降低,说明外加Cd处理,两品种吸收的C在细胞壁上累积较多,这因为细胞壁是Cd进入植物的第一层屏障,体现了细胞壁保护原生质体免受 Cd伤害的功能。当外加 Cd到一定程度时,各品种自身就开始表现出不同的耐Cd差异,如在本试验中当外加Cd达到25 mg·kg-1时,J196的细胞壁及细胞内溶物组分Cd含量均显著高于中浙优1号,在细胞器中两品种没有显著差异,说明在此外加Cd浓度下有更多的Cd进入中浙优1号的细胞壁和细胞内溶物内。在此外加Cd浓度下,和不加Cd、低Cd浓度相比,Cd在中浙优1号细胞内溶物的分配率增高11.5%~17.2%,J196只增高8.9%~12.2%,表明外加Cd处理下会促使中浙优1号中Cd在叶片中细胞内溶物的分配百分率,这样则增加了中浙优1号叶片中Cd由韧皮部运往子粒的可能性,也从亚细胞水平上说明了中浙优 1号为高转运品种的可能机制。因此根系、地上部Cd的积累量并不能作为判断一个品种是否耐Cd的标志,Cd在亚细胞组分中的分配比例似乎更重要,不同亚细胞组分对Cd的固定可能才是品种自身的耐Cd机制所在。
4 结论
(1)外加Cd对水稻体内非蛋白巯基(NPT-SH)的诱导量与水稻体内Cd的含量变化存在一定的响应关系,尤其表现在根系。两品种根系NPT-SH含量的差异响应了二者体内Cd从根系向茎叶运输能力的差异。
(2)外加Cd影响到不同品种水稻体内Cd在根系、叶片内细胞壁、细胞内溶物中含量及分配率变化。Cd胁迫下超级稻品种根系、叶片中细胞内溶物分配百分率升高的现象从亚细胞水平上解释了该品种为籽粒高转运、分配品种的可能机制。
CLEMENS S. 2006. Toxic metal accumulation responses to exposure and mechanisms of tolerance in plants [J]. Biochimie, 88(11): 1707-1719.
COBBETT C S. 2000. Phytochelatins and their roles in heavy metal detoxification [J]. Plant Physiology, 123(3): 825-832.
FLORIJN P J, VAN Beusichem M L. 1993. Uptake and distribution of cadmium in maize inbred lines [J]. Plant and Soil, 150(1): 25-32.
GUO Y T, MARSCHNER H. 1995. Uptake, distribution and binding of cadmium and nickel in different plant species [J]. Journal of Plant Nutrition, 18(12): 2691-2706.
HALL J L. 2002. Cellular mechanisms for heavy metal detoxification and tolerance [J]. Journal of Experimental Botany, 53(366): 1-11.
HSU Y T Y, KAO C H. 2003. Changes in protein and amino acid contents in two cultivars of rice seedings with different apparent tolerance to cadmium [J]. Plant Growth Regulation, 40(2): 147-155.
KELTJENS W G, BEUSICHEM M L. 1998. Phytochelatins as biomarker for heavy metal stress in maize (Zea mays L.) and wheat (Triticum aestiv um L.): Combined effects of copper and cadmium [J]. Plant Soil, 203(1): 119-126.
RAMA DEVI S,PRASAD M N V. 1998. Copper toxicity in Ceratophyllum demersum L. a free floating macrophyte: Response of antioxidant enzymes and antioxidants [J]. Plant Science, 138(2): 157-165.
RAMOS L, ESTEBAN E, LUCENA J J, et al. 2002. Cadmium uptake and subcellular distribution in plants of Lactuca sp. Cd-Mn interaction [J]. Plant Science, 162(5): 761-767.
RAUSER W E. 1995. Phytochelatins and related pep tides [J]. Plant Physiology, 109(4): 1141-1149.
SHI J, PAN G X, LI L Q. 2009. Variation of Cd and Zn concentrations in rice grain of 110 hybrid rice cultivars grown in a low-Cd paddy soil from South China [J]. Journal of Environmental Sciences, 21(2): 168-172.
SNELLER F E C, NOORDOVER E C M, TEN BOOKUM W M, et al. 1999. Quantitative relationship between phytochelatin accumulation and growth inhibition during prolonged exposure to cadmium in S ilene vulgaris [J]. Ecotoxicology, 8(3): 167-175.
WANG X, LIU Y, ZENG G, et a1. 2008. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea(L.) Gaud. [J]. Environmental and Experimental Botany, 62(3): 389-395.
高可辉, 葛滢, 张春华. 2011. 缺硫对镉胁迫下水稻幼苗非蛋白巯基物质含量和谷胱甘肽硫转移酶活性的影响[J]. 应用生态学报, 22(7): 1796-1802.
李德明, 朱祝军. 2004. 镉在不同品种小白菜中的亚细胞分布[J]. 科技通报, 20(4): 278-282.
潘秀, 石福臣, 刘立民, 等. 2012. Cd、Zn及其交互作用对互花米草中重金属的积累、亚细胞分布及化学形态的影响[J]. 植物研究, 32(6): 717-723.
冉文静, 傅大放. 2010. Gallic acid 和SDS对黑麦草体内重金属亚细胞及形态分布的影响[J]. 环境科学学报, 30(11): 2264-2269.
孙琴, 王晓蓉, 袁信芳, 等. 2004. 有机酸存在下小麦体内Cd的生物毒性和植物络合素(PCs)合成的关系[J]. 生态学报, 24(12): 2804-2809.
孙琴, 袁信芳, 王晓蓉. 2005. 环境因子对小麦体内镉的生物毒性和植物络合素合成的影响[J]. 应用生态学报, 16(7): 1360-1365.
万敏, 周卫, 林葆. 2003. 镉积累不同类型的小麦细胞镉的亚细胞和分子分布[J]. 中国农业科学, 36(6): 671-675.
王芳, 丁杉, 张春华, 等. 2010. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 29(4): 625-629.
杨居荣, 鲍子平, 张素芹. 1993. Cd、Pb在植物细胞内的分布及其可溶性结合形态[J]. 中国环境科学, 13(4): 263-268.
原海燕, 郭智, 佟海英, 等. 2013. Pb胁迫下外源GSH对马蔺体内Pb积累和非蛋白巯基化合物含量的影响[J]. 水土保持学报, 27(4): 212-216.
周卫, 汪洪, 林葆. 1999. 钙对胁迫下玉米镉的亚细胞分布及叶绿体超微结构与光合作用酶活性的影响[J]. 植物营养与肥料学报, 5(4): 335-340.
Effects of Cd-spiking Treatment on Cd Accumulation, Subcellular Distribution and Content of Nonprotein Thiols in Rice
SHI Jing1*, PAN Genxing2
1. College of resources and environment of Yunnan Agricultural University, Kunming 650201, China; 2. Institute of Resources, Ecosystem and Environment of Agriculture, NanjingAgricultural University, Nanjing 210095, China
In China, Cd concentration in croplands and subsequent accumulation in crops has been increased as a result of soil polltuion due to human activities such as mining, emission from industry and application of sewage sludges, which is posing potential public health risk for human through dietary intake. Among the major staple crops, rice (Oryza sativa L.) is the particular food crop with high Cd uptake and accumulation in grains. There had been much evidences of differences in Cd accumulation in plants and plant tolerance to between rice species and genotypes. Meanwhile, Cd tolerance and low Cd accumulation in grains may be used as a strategy for low Cd rice production. However, the mechanisms involved in Cd tolerance and grain accumulation has been not clearly demonstrated. Studying cadmium absorption characteristics under different rice varieties with Cd contaminated soil, the detoxification mechanism of PCs (mainly Non-protein thiol) and from micro level explore the distribution of cadmium subcellular. Its has huge significance to understand the resistance mechanism of Cd in different rice genotypes. In an effort to understand the biological process of Cd bioaccumulation, a pot experiments with subcelluar fractionation were carried out to investigate the subcelluar distribution of Cd in roots and leaves of rice. Two rice cultivars, Zhongzheyou-1, a high grain Cd accumulation cultivar, and J196, a low Cd accumulating cultivar, were grown in red soils. The experiment was conducted to study the effect of Cd-spiking treatment on Cd content, nonprotein thiols (NPT) production and its subcellular distribution in rice. The results showed that Cd stress had significant inhibitory effects on NPT overproduction. The Cd uptake of rice was affected by the Cd-spiking treatment and the genotypes. Furthermore, the Cd content was enhanced with increasing Cd supply, coinciding with the enhancement of NPT level in root. Compared the two varieties, when soil without Cd. The ratio of J196 aboveground Cd content/root Cd content is higher than Zhong-Zhe Optimal number 1; when the soil Cd content was 5 mg·kg-1, the amount of root A transform Cd to aboveground is far more than C, respectively 25.7% and 7.4%; but when the soil Cd content was 25 mg·kg-1, there was no significant difference between the two varieties. Root NPT contents of J196 was more than those of Zhongzheyou-1, suggested that Zhongzheyou-1 has the higher Cd transfer level from root to stem compared to J196. At the same time, there was a genotypic difference of Cd concentrations among two cultivars. Cd concentrations in different plant parts followed the rank of root>leaf. Cd was mainly distributed in the cell wall, about 52.6%~83.2%, and less distributed in the fractions of cell soluble component with distribution rate of 3.0%~10.1%. The phenomenon of J196 Cd cell wall distribution rate was higher than Zhongzheyou-1 showed that the cell wall compartmentation of J196 is stronger contract to Zhongzheyou-1; in the condition of Cd-spiking, it promoted root cell soluble component of Zhongzheyou-1 transferring to shoot via xylem. Under high Cd supply, Zhongzheyou-1 possessing the increase degree of Cd distribution in cell soluble component compared to J196, which possibly resulted in lower in stem and more Cd traslocation from shoot to grain via phloem.
rice; Cd; NPT; subcelluar distribution
10.16258/j.cnki.1674-5906.2015.05.020
X171.5
A
1674-5906(2015)05-0853-07
史静,潘根兴. 外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响[J]. 生态环境学报, 2015, 24(5): 853-859.
SHI Jing, PAN Genxing. Effects of Cd-spiking Treatment on Cd Accumulation, Subcellular Distribution and Content of Nonprotein Thiols in Rice [J]. Ecology and Environmental Sciences, 2015, 24(5): 853-859.
云南省应用基础研究计划项目(2013FB043);国家自然科学基金项目(41301349)
史静(1980年生),女,副教授,硕士生导师,主要从事土壤-作物镉迁移与防控研究。E-mail:383110966@qq.com *通信作者。
2014-10-27

