基于实时荧光定量PCR技术对不同盐碱程度土壤甲烷氧化菌比活性的研究
杨铭德,焦燕,李新,温慧洋
内蒙古师范大学化学与环境科学学院,内蒙古 呼和浩特 010022
基于实时荧光定量PCR技术对不同盐碱程度土壤甲烷氧化菌比活性的研究
杨铭德,焦燕*,李新,温慧洋
内蒙古师范大学化学与环境科学学院,内蒙古 呼和浩特 010022
为了探究不同盐碱程度土壤甲烷氧化菌比活性与甲烷吸收速率的关系,通过室内 CH4培养实验,采用实时荧光定量PCR技术,研究3种不同盐碱程度土壤,即:轻度盐化土壤(SA)、强度盐化土壤(SB)、盐土(SC)CH4吸收速率和甲烷氧化菌比活性。以含有甲烷氧化菌功能基因pmoA片段的重组质粒为标准品,测得标准曲线的相关系数r2为0.9977,扩增效率为 86%,溶解曲线峰值均一。结果表明:轻度盐化土壤(SA)、强度盐化土壤(SB)、盐土(SC)CH4吸收速率分别为28.4、20.6、17.7 ng·kg-1·h-1,表现为轻度盐化土壤(SA)>强度盐化土壤(SB)>盐土(SC)。土壤CH4吸收速率与土壤甲烷氧化菌比活性显著正相关,Person相关系数r=0.788(P=0.012,n=9)。由Monte Carlo法检验后表明:pH、土壤浸提液电导率 EC与土壤甲烷氧化菌比活性显著负相关,相关系数分别为-0.943(P=0.000 1,n=9)和-0.895(P=0.001,n=9),而容重ρb、总磷TP、总氮TN、有机碳OC与土壤甲烷氧化菌比活性无显著相关性(P>0.05)。较高pH和EC的盐碱土壤,土壤甲烷氧化菌比活性低,CH4吸收速率低。
盐碱土壤;PCR;甲烷氧化菌;吸收速率;比活性
CH4是重要的温室气体,每年大约有 470 Tg CH4在大气中被吸收,其导致气候变暖的效能是等量 CO2的 20~30倍(Cicerone和 Oremland,1988)。好气性的旱地土壤是目前唯一已知的由生物氧化CH4的汇,消耗全球大气CH4的10%(张玉铭等,2011)。甲烷氧化菌在大气中 CH4的氧化方面起着重要的作用。土壤中甲烷氧化菌细胞以CH4为唯一的碳源和能源,其内的甲烷单氧酶(MMO)在分子氧的作用下,依靠甲醇脱氢酶(MDH)、甲醛脱氢酶(FADH)和甲酸脱氢酶(FDH)的途径氧化成CO2和H2O。由于传统检测甲烷氧化菌含量的方法存在诸多问题,如培养法操作繁琐,劳动强度大,费时费力,难以满足大批量样品快速检测要求等。陈中云等(2001)利用传统的滚管法技术需要制备甲烷氧化菌固体培养基分装于厌氧试管中,大批量样品耗时长。Amann(1995)等证实传统的依赖于培养的方法已无法充分描述微生物的多样性,可能会错失 99%以上的微生物种类。因此,选用实时荧光定量 PCR快速检测甲烷氧化菌的新方法,具有灵敏度高、特异性强、自动化程度高等特点。仝川和佘晨兴(2011)利用 PCR-DGGE技术分析了自然湿地微生物群落多样性。几乎所有好氧甲烷氧化菌都含有 MMO,因此,利用颗粒性甲烷单加氧酶(pMMO)的pmoA基因片段作为生物标记物进行好氧甲烷氧化菌生态学研究已被广泛应用(贠娟莉,2013)。许科伟等(2013)通过建立基于功能基因pmoA的定量 PCR技术,对油气田土壤样品中不同种类甲烷氧化菌丰度进行测定;HenckeL和 Jackel(2000)通过标记甲烷氧化菌MMO的pmoA基因,采用PCR技术解释了 CH4氧化的活性高低。单个甲烷氧化菌的活性可以用比活性的大小表征,土壤甲烷氧化菌的比活性由测得的 CH4吸收速率和甲烷氧化菌丰度值决定的(Kolb等,2005)。高的甲烷氧化菌丰度或是较高的甲烷氧化菌比活性是决定土壤吸收 CH4的先决条件(Conrad,1984)。Menyailo等(2008)发现土壤甲烷氧化菌比活性在俄罗斯草原种植人工林后土壤CH4吸收速率变化中扮演重要角色。杨芊葆等(2010)通过对旱地农田土壤的研究发现比活性越大,CH4吸收速率越大。
目前,CH4研究主要集中在草地(Unteregelsbacher等,2013;Wei等,2014)、农田(张雪松等,2006;Jacinthe和 Lal,2005)、森林(Zhang等,2014;Xu等,2014)等不同利用方式的土壤。据统计,全球盐碱土壤面积已达1.0×109hm2,占全球土壤总面积的30%(Gao等,2011)。但对于盐碱土壤甲烷氧化菌的比活性研究仍较少,盐碱土壤影响 CH4吸收研究的相关报道也较少。零星研究表明,土壤盐含量增加抑制CH4吸收(Whalen,2000)。因此本文通过室内模拟实验,实时荧光定量 PCR技术探讨不同盐碱程度土壤甲烷氧化菌比活性,为野外盐渍化土壤 CH4吸收速率的研究提供理论依据。
1 材料与方法
1.1 研究区概况
供试土壤采于内蒙古巴彦淖尔市乌拉特前旗,地处黄河北岸,河套平原东端,该地属温带大陆性气候,冬寒而长,夏热而短,干旱少雨,春季风沙较大,最高气温为 39.7 ℃,最低气温是-30.7 ℃,年平均气温为 7.7 ℃。年平均日照时间是 3212.5 h,无霜期共 167 d。降水集中于 7─9月,年平均降水量为 213.5 mm,最大降水量为 8月,极端日降水量可达109.6 mm。
1.2 样品采集
为避免地形等因素影响,研究样区选择地势平坦的地方,并按照邻近原则布置样点。试验于2014年 5月(土壤未种植作物),选取样本S1~S9,距离地表0~20 cm取样,依据土壤盐化含量分级标准(表1),选取3种不同盐碱程度土壤(表 2),将小区土壤(S1、S2、S3)划分为 SA(轻度盐化土),小区土壤S4~S6划分为SB(强度盐化土),小区土壤 S7~S9土壤划分为 SC(盐土)。1份土壤风干磨碎过2 mm筛用于理化性质测定和 CH4培养实验;另 1份迅速运回实验室,分装于若干无菌离心管中,于-8 ℃保存。
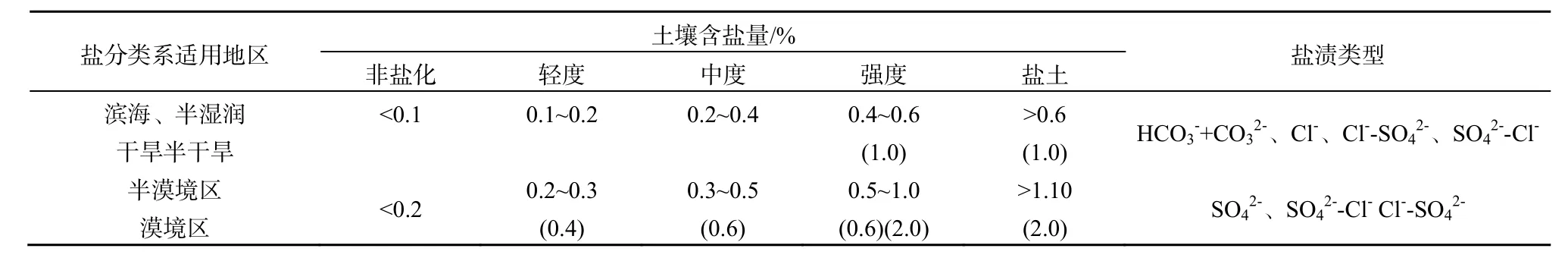
表1 土壤盐化分级指标(王遵亲,1993)Table 1 Soil salinization classification
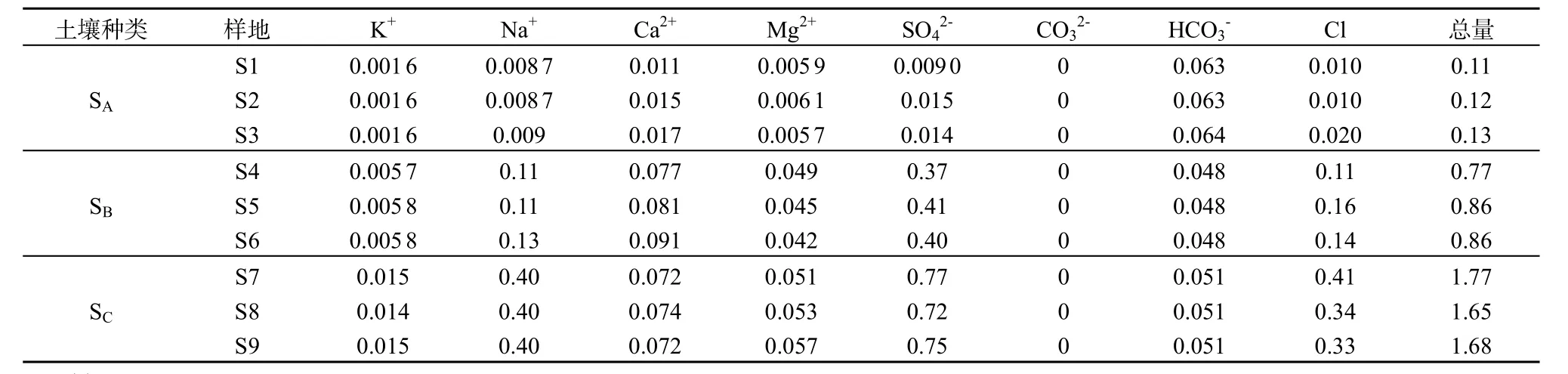
表2 试验土壤盐分含量Table 2 Salinity of different soil samples %
1.3 土壤基本理化性质
土壤基本理化测定方法(鲍士旦,2000)如下:pH以1∶2.5的土水比,复合电极法测定;EC以 1∶5的土水比,复合电极法测定;土壤容重用环刀法测定;土壤质地用比重计速测法测定;土壤OC选用重铬酸钾容量-外加热法;土壤 TP用HClO4-H2SO4测定;土壤TN用凯氏定氮仪测定。土壤 CO32-、HCO3-测定:电位滴定法。Cl-测定:硝酸银滴定法。SO42-测定:EDTA容量法。Ca2+和Mg2+测定:EDTA容量法。K+、Na+测定:火焰光度法。土壤基本理化性质如表3所示。
1.4 总DNA提取
DNA提取采用CTAB/SDS方法提取。取土壤样品 0.5 g,液氮研磨后置于 10 mL无菌离心管中,加入4 mL DNA抽提缓冲液(1% CTAB;100mM Tris-HCl,pH8.0;20 mM EDTA,pH8.0;700 mM NaCl pH8.0)和 200 μL蛋白酶 K,充分混匀。在 37 ℃放置 30 min,每隔 10 min混匀 1次。加入800 μL 10% SDS,充分混匀。在65 ℃水浴1 h,每隔15 min混匀1次。在室温下于12000 r·min-1转速离心10 min,将上清转移至一批新的2 mL无菌离心管中。1份加入等体积 V(氯仿)∶V(异戊醇)=24∶1,1份加入等体积氯仿/异戊醇,1份加入 0.6倍体积预冷的异丙醇。每份充分混匀,在-20 ℃放置20 min。弃上清,加入1 mL 75%乙醇洗涤DNA沉淀。离心,风干,加40 μL TE缓冲液溶解DNA沉淀。取2 μL DNA样品,琼脂糖电泳检测。将DNA溶液于-20 ℃冰箱保存。

表3 试验土壤基本理化性质Table 3 Physico-chemical properties of soil samples
1.5 PCR质粒标准品的制备
1.5.1 目的基因的扩增
pmoA基因广泛运用于环境样品中甲烷氧化菌的检测与定量化,在pmoA定量过程中,所采用的引物(Adrian等,2011)为A189f(5’-GGN GAC TGG GAC TTC TGC-3’)和A682r(5’-GAA SGC NGA GAA GAA SGC-3’),利用2对特异性引物分别扩增样品 DNA中细菌数目的 DNA序列。qPCR反应所需体系为:PCR扩增体系(25 μL)为 10×PCR buffer 2.5 μL;dNTP(2.5 mM)1.6 μL;primers F(5P)1 μL;primers R (5P)1 μL;Taq(5 U·μL-1) 0.125 μL;模板DNA 50 ng;补H2O 16.775 μL。PCR扩增程序为:95 ℃预变性4 min;95 ℃变性30 s,60 ℃复性30 s,72 ℃延伸30 s,30个循环;最终72 ℃延伸10 min。
1.5.2 重组质粒的构建、测序与浓度测定
PCR产物采用 AXYGEN公司 DNA Gel Extraction Kit进行纯化。纯化连接到pEASY-T载体上,并转化至DH5α感受态细胞中,筛选阳性克隆,对插入的细菌 DNA片段进行序列测定。依据测序结果验证标准品是否构建合格。序列正确的阳性克隆子利用试剂盒提取质粒作为标准品,超微量紫外分光光度计测定浓度,置于-20 ℃备用。根据测定的核酸浓度,计算质粒标准品中甲烷氧化菌pmoA基因片段拷贝数。PCR仪为 Biometra公司生产的 T-gradient,凝胶成像仪为 Bio-Rad公司的Gel-Doc2000凝胶成像系统。
1.5.3 标准曲线的建立
将制备好的质粒标准品10倍梯度质量浓度稀释,得到 4个稀释度的标准模板。每个稀释度模板质量浓度取 3个平行样,记录结果,取平均值,绘制溶解性曲线。以 qPCR反应的循环数为横坐标,以不同模板拷贝数的对数为纵坐标,绘制标准曲线。
1.6 CH4室内培养实验
称取过筛的 S1~S9土壤样品 50 g(相当于烘干土质量),装入 250 mL规格的培养瓶(Glasgeratebau OCHS GmbH),加入灭菌去离子水5 mL,预培养7 d,激活土壤微生物,7 d后取出培养瓶,调节培养体系中土壤质量含水率为体积分数25%,T型硅胶塞封口。于25 ℃下恒温培养箱避光培养360 h。每个处理均设置3次重复。为了保持瓶内压力恒定,在向瓶内注射纯 CH4之前用注射器从瓶内抽出相同体积的空气,前 12次每隔12 h抽取培养瓶中混合气体,之后每24 h抽1次,CH4质量浓度用改进后的气相色谱仪(Agilent 6820,Agilent Technologies)测定。仪器配备:FID 检测器和不锈钢的 Porapak Q(80/100 mesh),工作条件设定:柱温、进样口和检测器的温度分别设为 55、130、250 ℃,载气(氮气)、FID氢气和 FID空气的流速分别设为 30、30和 400 mL·min-1,CH4的吸收速率用 ng·kg-1·h-1表示。
1.7 数据分析方法
甲烷氧化菌丰度(copies)=总体积×摩尔数×样品中检测目标的质量浓度/(pEASY-T碱基数×脱氧核糖核苷酸平均分子量) (1)
式中:总体积表示提取到的 DNA的总体积,µL;摩尔数:DNA的物质的量,个·mol-1;样品中检测目标的质量浓度:根据标准品,用荧光定量得到的数据换算出样品中目的片段的质量浓度,ng·µL-1;pEASY-T碱基数:由pEASY-T载体构建标准品碱基对的数量,个;脱氧核糖核苷酸平均分子量,607.4 g·mol-1。
CH4吸 收 速 率 : P=(dc/dt)×(Vh/Ws)× (MW/Vm)×(Tst/Tst+T) (2)
式中:P为 CH4吸收速率,ng·kg-1·h-1;dc/dt为单位时间培养瓶内 CH4质量浓度的变化量;Vh指培养瓶内部空间的体积,mL;Ws为土样的质量,g;MW表示CH4的分子量,16.04;Vm为标准状态下 1 mol气体的体积,22.4 L;T为培养温度,℃;Tst为标准温度。
土壤氧化菌比活性=单位土壤甲烷吸收速率(2)/该土壤pmoA基因丰度值(1) (3)
采用OriginPro8和Excel2010软件进行数据处理和制图,SPSS22.0软件进行单因素方差分析(AVNOA)。
2 结果与分析
2.1 土壤甲烷氧化菌实时荧光定量PCR检测体系的建立
经凝胶电泳检测,土壤样品细菌基因组 DNA能提取较高的质量,纯度较高,可直接用于 PCR扩增(图1)。

图1 土壤细菌基因组DNA提取聚丙烯酰胺凝胶电泳Fig. 1 The polyacrylamide gel electrophoresis of the bacteria DNA in soil
利用核酸定量仪测定质粒质量浓度,计算得到甲烷氧化菌 pmoA基因片段的质量浓度为 776 ng·μL-1,将质粒提取液10倍系列稀释得到 4个稀释度的标准模板,各取 2 μL稀释标准品作为荧光定量PCR的模板进行扩增,在荧光定量PCR扩增指数期,画一条阀值线,本研究设定阀值等于0.020208(图2)。依据该阀值线,确定在PCR过程中,各样品扩增产物的荧光信号达到设定的阈值时,所经过的扩增循环数 Ct。根据标准品 4个浓度梯度的模板 Ct值,计算并绘制反应的标准曲线:y=-0.2694x(Ct)+3.2796,该标准曲线的斜率为-0.2694,相关系数 r2=0.9977,扩增效率 E=86%(图3)。根据未知样品Ct值,在标准曲线上得到未知样品初始模板量,即3种不同盐碱程度土壤的pmoA基因数。绘制各浓度稀释后的标准品在实时荧光定量过程中的熔点曲线。其中,实时荧光定量PCR体系的熔点曲线具有单一特异性的峰,扩增产物溶解温度 Tm值均一,为(90.4±1.1) ℃。结果表明,标准物质和扩增反应产物特异性良好且无引物二聚体影响(图4)。

图2 荧光定量PCR特异性评价的扩增曲线Fig. 2 Amplification curve for fluorescence qPCR specificity evaluation

图3 实时荧光定量PCR标准曲线Fig. 3 Standard curve of the Real-Time qPCR
2.2 土壤CH4吸收速率
由单因素AVNOA方差分析可以发现,不同盐碱程度土壤之间 CH4吸收速率具有明显的差异性(t=18.027,P=0.0001)(图 5)。经计算可知SA、SB、SC土壤 CH4吸收速率数值大小依次为28.4、20.6、17.7 ng·kg-1·h-1,即SA>SB>SC,随着土壤盐碱程度的增加,CH4吸收速率呈现递减变化趋势。相比较盐土,轻度盐化土壤 CH4吸收速率增加了60.5%,表现了较高的CH4吸收潜力。

图4 实时荧光定量PCR熔点曲线Fig. 4 Melting curve of the Real-Time qPCR

图5 不同盐碱程度土壤CH4吸收速率Fig. 5 CH4uptake rates of different saline soils
2.3 土壤甲烷氧化菌丰度和比活性分析
单因素AVNOA方差分析表明,不同盐碱程度土壤之间的甲烷氧化菌丰度(t=11.684,P= 0.0001)和比活性(t=9.227,P=0.0001)具有明显的差异性(图 6、7)。由公式(1)得出土壤甲烷氧化菌丰度值分别为 13.25×103、19.90×103、40.18×103copies,表现为SA

图6 不同盐碱程度土壤氧化菌比活性Fig. 6 Methanotrophs specific activity in different saline soils

图7 不同盐碱程度土壤氧化菌丰度Fig. 7 Methanotrophs abundance in different saline soils
2.4 土壤 CH4吸收速率与甲烷氧化菌丰度、甲烷氧化菌比活性以及与环境因子的冗余分析
利用Canoco 4.5 for windows软件的除趋势对应分析(Detrended correspondence,DCA),采用线性拟合模型,选择冗余分析法。由图8表明,以CH4吸收速率的矢量箭头为轴可将样本分为3种不同盐碱程度土壤 SA(S1~S3)、SB(S4~S6)、SC(S7~S9),土壤 S1~S9指代野外小区土壤。分类结果与土壤盐化分级结果一致。土壤 CH4吸收速率与甲烷氧化菌比活性的投影在第一主成分轴的正方向,甲烷氧化菌比活性越大,CH4吸收速率越大,r=0.788(P=0.012,n=9),土壤 CH4吸收速率与土壤甲烷氧化菌丰度投影在 X轴的方向相反,不具有显著相关性 r=-0.099(P=-0.099,n=9)。第一主成分轴(X轴)和第二主成分轴(Y轴),2个主成分轴共解释环境变量的 97.0%,由Monte Carlo法检验后表明:pH、EC与土壤甲烷氧化菌比活性负相关,Person相关系数依次为r为-0.943(P=0.0001,n=9)和-0.895(P=0.001,n=9),容重ρb、总磷TP、总氮TN、有机碳OC与土壤甲烷氧化菌比活性无显著相关性(P>0.05)。表明 pH、EC越高的土壤,甲烷氧化菌比活性越低,CH4吸收速率越低。

图8 甲烷与环境因子的冗余分析Fig. 8 Redundancy analysis of soil properties and environmental factors
3 讨论
不同盐碱程度土壤SA、SB、SC的CH4吸收速率表现为轻度盐化土壤(SA)>强度盐化土壤(SB)>盐土(SC),随着土壤盐碱程度的增加,pH与盐含量高的土壤,CH4吸收速率低。ZHANG等(2011)发现在相同的质地状况下,不同盐渍化土壤,轻度盐化土壤有较好的 CH4吸收潜力。Whalen(2000)发现高原冻土(5~15 cm)添加的氯化钠质量浓度增加 20倍,CH4吸收速率降低75%。因此,盐含量高的土壤CH4吸收速率较低可能是盐土中过高的氯离子抑制了甲烷氧化菌的活性,导致土壤 CH4吸收速率降低(Zhang等,2011)。
本研究发现3种不同盐碱程度土壤盐土具有较高的甲烷氧化菌丰度。Tsubota等(2005)表明,温泉底泥土壤中性嗜温型甲烷氧化菌能忍受质量浓度为 3%的 NaCl,Dimitry等(2000)分离出来的5种高盐底泥样品中,得到一种新的Ⅰ型甲烷氧化菌,其能够在 pH=10的碱性条件和钠离子质量浓度为 1 M 的环境下生存。3种不同盐碱程度土壤中,盐土同时也具有较低的甲烷氧化菌比活性。邓永翠和崔骁男(2013)研究表明,丰度最高的Methylocella甲烷氧化菌,其氧化 CH4活性低。盐含量高的盐碱土壤,甲烷氧化菌比活性低,这可能的原因是甲烷氧化菌种群的另外一种 pMMO酶在盐碱程度高的土壤停止表达(邓永翠和崔骁男,2013)。
本研究表明,CH4吸收速率与甲烷氧化菌比活性正相关(r=0.788,P=0.012),盐碱程度高的土壤,甲烷氧化菌比活性低,CH4吸收速率低。杨芊葆等(2010)的研究也表明,暗棕土壤甲烷氧化菌的比活性与 CH4吸收速率具有正相关关系。Menyailo等(2008)发现,对于改造后的俄罗斯草原土壤甲烷氧化菌比活性影响土壤 CH4吸收速率。当今国际刊物大多直接用土壤浸提液电导率(EC)来表示土壤盐渍化程度(邓丽娟,2011)。土壤性质(如 pH和 EC)是调控细菌多样性和群落结构的关键因子(Catherine和Rob,2007)。本研究Monte Carlo检验后表明:土壤pH、EC与土壤甲烷氧化菌比活性显著负相关。因此,pH和EC含量高的盐碱土壤,土壤甲烷氧化菌比活性低,土壤CH4吸收潜力低。
4 结论
(1)不同盐碱程度土壤 CH4吸收速率表现为轻度盐化土壤(SA)>强度盐化土壤(SB)>盐土(SC),即随土壤 pH和土壤浸提液电导率(EC)的增加,CH4吸收速率降低。
(2)不同盐碱程度土壤甲烷氧化菌比活性越低,CH4吸收速率越低。pH和 EC越高的盐碱土壤,甲烷氧化菌比活性越低,CH4吸收速率越低。土壤甲烷氧化菌比活性与土壤容重 ρb、总磷 TP、总氮TN、有机碳OC无显著相关性。
ADRIAN H, CLAUDIA L, PETER F. 2011. Recovery of methanotrophs from disturbance: population dynamics, evenness and functioning [J]. The ISME Journal, 5(4): 750-758.
AMANN R I, LUDWIG W, SCHLEIFER K H. 1995. Phylogenetic identification and in situ detection of individual microbial cells without cultivation [J]. Microbiological Reviews, 59(1): 143-169.
CATHERINE A L, ROB K. 2007. Global patterns in bacterial diversity [J]. Proceedings of the National Academy of Sciences, 104(27): 11436-11440.
CICERONE R J, OREMLAND R S. 1988. Biogeochemical aspects of atmospheric methane [J]. Global Biogeochemical Cycles, 2(4): 299-327.
CONRAD R. 1984. Capacity of aerobic microorganisms to utilize and grow on atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO) [J]. American society for microbiology, 60(4): 461-467.
DIMITRY Y, SOROKIN B E, JONES J, et al. 2000. An obligate methylotrophic, methane-oxidizing methylomicrobium species from a highly alkaline environment [J]. Extremophiles, 4(3): 145-155.
GAO F, HUANG Q, SUN X Y, et al. 2011. Study on dynamic changes of the soil salinization in the upper stream of the tarim river based on RS and GIS [J]. Procedia Environmental Sciences, 11(C): 1135-1141.
HENCKEL T, JACKEL U. 2000. Molecular analyses of novel methanotrophic communities in forest soil that oxidize atmospheric [J]. Applied and Environmental Microbiology, 66(5): 1801-1808.
JACINTHE P A, LAL R. 2005. Labile carbon and methane uptake as affected by tillage intensity in a Mollisol [J]. Soil and Tillage Research, 80(1-2): 35-45.
KOLB S, KNIEF C, DUNFIELD P F, et al. 2005. Abundance and activity of uncultured methanotrophic bacteria involved in the consumption of atmospheric methane in two forest soils [J]. Environ Microbiol, 7(8): 1150-1161.
MENYAILO O V, HUNGATE B A, ABRAHAM W R, et al. 2008. Changing land use reduces soil CH4uptake by altering biomass and activity but not composition of high-affinity methanotrophs [J]. Global Change Biology, 14(10): 2405-2419.
TSUBOTA J, ESHINIMAEY B T, KHMELENINA V N, et al. 2005. Methylothermus thermalis gen. nov., sp. nov., a novel moderately thermophilic obligate methanotroph from a hot spring in Japan [J]. International Journal of Systematic and Evolutionary Microbiology, 55(5): 1877-1884.
UNTEREGELSBACHER S, GASCHE R, LIPP L, et al. 2013. Increased methane uptake but unchanged nitrous oxide flux in montane grasslands under simulated climate change conditions [J]. European Journal of Soil Science, 64(5): 586-596.
WEI D, XU R, TENZIN T, et al. 2014. Fluxes of methane, carbon dioxide and nitrous oxide in an alpine wetland and an alpine grassland of the Tianshan Mountains, China [J]. Journal of Arid Land, 6(6): 717-724.
WHALEN S C. 2000. Influence of N and non-N salts on atmospheric methane oxidation by upland boreal forest and tundra soils [J]. Biology and Fertility of Soils, 31(3-4): 279-287.
XU M J, CHENG S L, FANG H J, et al. 2014. Low-Level Nitrogen Addition Promotes Net Methane Uptake in a Boreal Forest across the Great Xing'an Mountain Region, China [J]. Forest Science, 60(5): 973-981.
ZHANG J F, LI Z J, NING T Y, et al. 2011. Methane uptake in salt-affected soils shows low sensitivity to salt addition [J]. Soil Biology and Biochemistry, 43(7): 1434-1439.
ZHANG W, WANG K, LUO Y, et al. 2014. Methane uptake in forest soils along an urban-to-rural gradient in Pearl River Delta, South China [J]. Scientific Rep, 4:5120.
鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社.
陈中云, 闵航, 陈美慈, 等. 2001. 不同水稻土甲烷氧化菌和产甲烷菌数量与甲烷排放量之间相关性的研究[J]. 生态学报, 21(9): 1499-1505.
邓丽娟. 2011. 土壤浸提液电导率与盐分关系的通径分析[J]. 地下水, 33(6): 20-21.
邓永翠, 崔骁男. 2013. 青藏高原湿地好氧甲烷氧化菌的群落多样性及活性研究[D]. 北京: 中国科学院: 130.
仝川, 佘晨兴. 2011. 自然湿地土壤产甲烷菌和甲烷氧化菌多样性的分子检测[J]. 生态学报, 31(14): 4126-4135.
王遵亲. 1993. 中国盐渍土[M]. 北京: 科学出版社.
许科伟, 邵明瑞, 汤玉平, 等. 2013. 三种油气指示菌定量PCR方法的建立及其在油气田土壤中的初步应用[J]. 生物技术通报, 4(4): 172-178.
杨芊葆, 范分良, 王万雄, 等. 2010. 长期不同施肥对暗棕壤甲烷氧化菌群落特征与功能的影响[J]. 环境科学, 31(11): 2756-2762.
贠娟莉. 2013. 好氧甲烷氧化菌生态学研究进展[J]. 生态学报, 33(21): 6774-6785.
张雪松, 申双和, 李俊, 等. 2006. 华北平原冬麦田土壤CH4的吸收特征研究[J]. 南京气象学院学报, 29(2): 181-188.
张玉铭, 胡春胜, 张佳宝, 等. 2011. 农田土壤主要温室气体(CO2、CH4、N2O)的源/汇强度及其温室效应研究进展[J]. 中国生态农业学报, 19(4): 966-975.
Specific Activity of Methanotrophs in Saline-Alkaline Soils Retrieved from A Fluorescent Quantitative Real-time PCR Technique
YANG Mingde, JIAO Yan*, LI Xin, WEN Huiyang
Chemistry & Environment Science College, Inner Mongolia Normal University, Hohhot 010022, China
In order to explore the relationship between Specific Activity of methanotrophs and methane uptake rate in different levels of saline-alkaline soils, most studies on CH4uptake potential in saline-alkaline soils are limited to confined field trials. In methanotrophs culture experiments, we used fluorescent quantitative real-time PCR technique to investigate CH4 uptake rate and methanotrophs specific activity in three saline-alkaline soils: slightly saline soil (SA), severely saline soil (SB), saline soil (SC). The recombinant plasmid containing pmoA gene was used as standards to optimize the experimental conditions and generate a standard curve. The correlation coefficient (r2) of the standard curve was 0.997 7 and the amplification efficiency was 86%. The dissocition curves of the real time qPCR demonstrated uniform peaks. The results showed that CH4uptake rates of SA, SBand SCwere negatively related to soil salinity, i.e., SA>SB>SC. Soil CH4uptake rate increased with the growth of specific activity, showing a significant positive correlation (r=0.788, P=0.012, n=9). Monte Carlo test showed that methanotrophs specific activity was significantly negatively correlated with pH (r=-0.943, P=0.0001) and EC (r=-0.895, P=0.001), while correlations between methanotrophs specific activity and bulk density(ρb), total phosphorus(TP), total nitrogen(TN) and organic carbon(OC) were insignificant (P>0.05). Salinealkaline soils of high pH and EC appeared to have lower methanotrophs specific activity and CH4uptake rates.
saline-alkaline soils; PCR; methanotrophs; methane uptake rate; specific activity
10.16258/j.cnki.1674-5906.2015.05.012
X171.3;S154
A
1674-5906(2015)05-0797-07
杨铭德,焦燕,李新,温慧洋. 基于实时荧光定量 PCR技术对不同盐碱程度土壤甲烷氧化菌比活性的研究[J].生态环境学报, 2015, 24(5): 797-803.
YANG Mingde, JIAO Yan, LI Xin, WEN Huiyang. Specific Activity of Methanotrophs in Saline-Alkaline Soils Retrieved from A Fluorescent Quantitative Real-time PCR Technique [J]. Ecology and Environmental Sciences, 2015, 24(5): 797-803.
国家自然科学基金项目(41165010;41375144);2013内蒙古高等学校“青年科技英才”支持计划资助(NJYT-13-B06);内蒙古师范大学研究生科研创新基金项目(CXJJS14060)
杨铭德(1990年生),男,硕士研究生。E-mail:279314135@qq.com *通信作者:焦燕(1977年生),女,教授,博士,主要从事碳循环与全球变化研究。E-mail:jiaoyan@imnu.edu.cn
2015-02-26

