1-乙基-3-甲基咪唑丙氨酸离子液体热力学性质的研究
郑 玲 樊本汉 卜晓雪 潘 懿 董家新 关 伟,*
(1辽宁大学化学院, 沈阳 110036; 2广西师范大学化学化工学院, 广西 桂林 541004)
1-乙基-3-甲基咪唑丙氨酸离子液体热力学性质的研究
郑 玲1樊本汉1卜晓雪1潘 懿1董家新2关 伟1,*
(1辽宁大学化学院, 沈阳 110036;2广西师范大学化学化工学院, 广西 桂林 541004)
用中和法合成了氨基酸离子液体1-乙基-3-甲基咪唑丙氨酸([C2mim][Ala]), 并利用恒温环境的溶解反应热量计, 在(288.15 ± 0.01) K―(308.15 ± 0.01) K温度范围内每隔5 K, 测定不同质量摩尔浓度离子液体在水中的溶解焓(ΔsolHm). 根据Archer的方法, 通过线性拟合得到了该离子液体的标准摩尔溶解焓并计算了其相对表观摩尔溶解焓(ΦL). 在298.15 K下, 根据Glasser经验方法得到了格子能UPOT= 566 kJmol–1, 并计算了其阴阳离子水化焓值(ΔH++ ΔH–) = –620 kJmol–1及阴离子水化焓ΔH–([Ala]–) = –387 kJmol–1. 此外, 估算了[C2mim][Ala]水溶液的热容(Cp(sol))和表观摩尔热容(ΦCp).
离子液体; 溶解焓; 热容; 水化焓; 格子能
1 引 言
自19世纪80年代以来, 室温离子液体(RTILs)作为理想的反应溶剂、萃取溶剂、电解质材料等得到科研工作者的高度关注. 而氨基酸因具有低成本、生物降解性、无毒性等优点, Fukumoto等1在探索新的RTILs过程中首次合成了以氨基酸为阴离子,咪唑衍生物为阳离子的氨基酸离子液体(AAILs). AAILs具有许多独特的性质: 即可用作手性溶剂, 能够溶解多种生命物质, 吸附CO2气体, 具有较强的氢键网状结构等.2–6无论在生命科学、药物化学、环境化学、还是化学工业等领域都具有广泛的应用前景.7,8AAILs已经得到了科研工作者的高度关注和广泛研究.9–11
AAILs种类虽不断增加, 但其热化学数据,如标准摩尔溶解热、标准摩尔反应热、标准摩尔生成热、标准摩尔燃烧热及水化热等还很少, 而这些却是离子液体工业化过程中不论设备选型还是工艺参数选定的重要基础物理化学数据. 为此, 本文在前期研究12–15的基础上, 做了如下工作: (1)通过中和法合成了1-乙基-3-甲基咪唑丙氨酸离子液体, 采用型号为SRC 100的溶解-反应量热仪在(288.15 ± 0.01)―(308.15 ± 0.01) K温度范围内每间隔5 K测定了水中不同质量摩尔浓度的溶解焓(ΔsolHm); (2)计算各个温度下离子液体的标准摩尔溶解焓不同温度不同质量摩尔浓度的相对表观摩尔溶解焓(ΦL); (3)在298.15 K下, 计算了[C2mim][Ala]的格子能UPOT和阴阳离子水化焓及阴离子水化焓ΔH–([Ala]–), 同时也估算离子液体摩尔热容(Cp(IL)), 离子液体水溶液的的热容(Cp(sol))和表观摩尔热容(ΦCp).
2 实验部分
2.1 实验材料
离子交换树脂(717型, > 95%), 用常规方法活化;溴代乙烷, 丙氨酸(> 98.5%)用标准方法精制; N-甲基咪唑(购于浙江双港化工厂), 使用前氮气保护减压蒸馏; 氯化钾(> 99.99%)、3-羟甲基胺基甲烷(THAM, GR, > 99%), 使用前真空干燥; 甲醇(> 99.8%)、乙酸乙酯(> 99.5%)、乙腈(> 99.5%)、卡尔费休试剂, 均为AR试剂(购于国药集团化学试剂有限公司); 高纯水由去离子水蒸馏得到; 离子液体[C2mim][Ala] (> 99%).
2.2 离子液体[C2mim][Ala]的合成
基于中和法16制备丙氨酸离子液体(见图1), 首先根据文献17合成了1-乙基-3-甲基咪唑溴盐([C2mim]Br). 将N-甲基咪唑粗产品在一定温度下提纯, 再加入适量溴代正乙烷, 恒温(50–70 °C)回流48h, 将产物冷藏12 h后得到[C2mim]Br白色晶体. 然后,将其水溶液通过阴离子交换柱, 得到1-乙基-3-甲基咪唑氢氧化物([C2mim]OH)溶液. 最后, 将[C2mim]OH与过量的丙氨酸水溶液反应48 h, 依次经减压蒸馏、过滤、干燥, 最终得到淡黄色离子液体[C2mim][Ala]. 经核磁共振氢谱(1H NMR)确定是目标产物, 且差式扫描量热(DSC)分析表明该离子液体无熔点(见Supporting Information中的图S1、S2). 为减小样品中微量水的影响, 本文采用卡尔费休水分测定仪(ZSD-2 type)对目标产物中含水量进行测定, 其结果显示目标产物中含水量小于0.5% (w), 硝酸银试剂检测产物无沉淀, 因此, 综合上述检测结果可知产物纯度高于99%.
2.3 溶解焓的测定
本文采用SRC 100型溶解反应量热仪18–20测定离子液体[C2mim][Ala]溶解焓. 在使用仪器前选用氯化钾和3-羟甲基胺基甲烷(THAM)在298.15 K下对仪器进行校正, 将干燥过的氯化钾(约0.3650 g)和THAM(约0.5000 g)分别溶于高纯水和浓度为0.1moldm–3的稀盐酸溶液中, 并分别测定两种样品的摩尔溶解焓. 测试结果表明氯化钾的摩尔溶解焓ΔsolHm= (17.542 ± 0.031) kJmol–1, THAM的摩尔溶解焓ΔsolHm= (– 29.794 ± 0.028) kJmol–1, 二者与文献值(17.549和– 29.754 kJmol–1)21,22较为接近, 实验误差分别为0.04%和0.14%, 说明该溶解反应热量计达到了实验要求. 然后, 用标定后的溶解反应热量计分别测定了(288.15 ± 0.01)―(308.15 ± 0.01) K温度范围内每间隔5 K不同质量摩尔浓度离子液体[C2mim][Ala]的摩尔溶解焓.
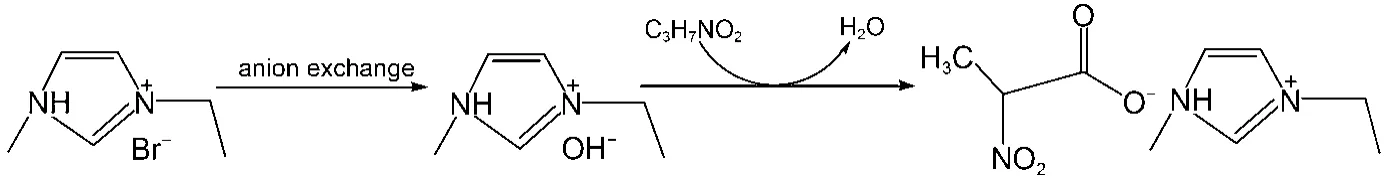
图1 中和方法制备[C2mim][Ala]离子液体的过程Fig.1 Synthesized process of ionic liquid (IL) [C2mim][Ala] by the neutralization method
3 结果与讨论
3.1 离子液体的摩尔溶解焓
本文在(288.15 ± 0.01)―(308.15 ± 0.01) K温度范围内每间隔5 K测定了不同质量摩尔浓度[C2mim] [Ala]的ΔsolHm, 其中标准不确定度u(T) = ± 0.01 K, u(m) = ± 0.0002 g, u(ΔT ) = ± 0.0001 K. 相关结果列于表1–5.
从表中数据可以看出离子液体[C2mim][Ala]溶于水是一个典型的放热过程, 且在同一温度下, 其释放的热量随其质量摩尔浓度的增大而减小, 这与我们曾报道的相关结果15,23较好的一致.
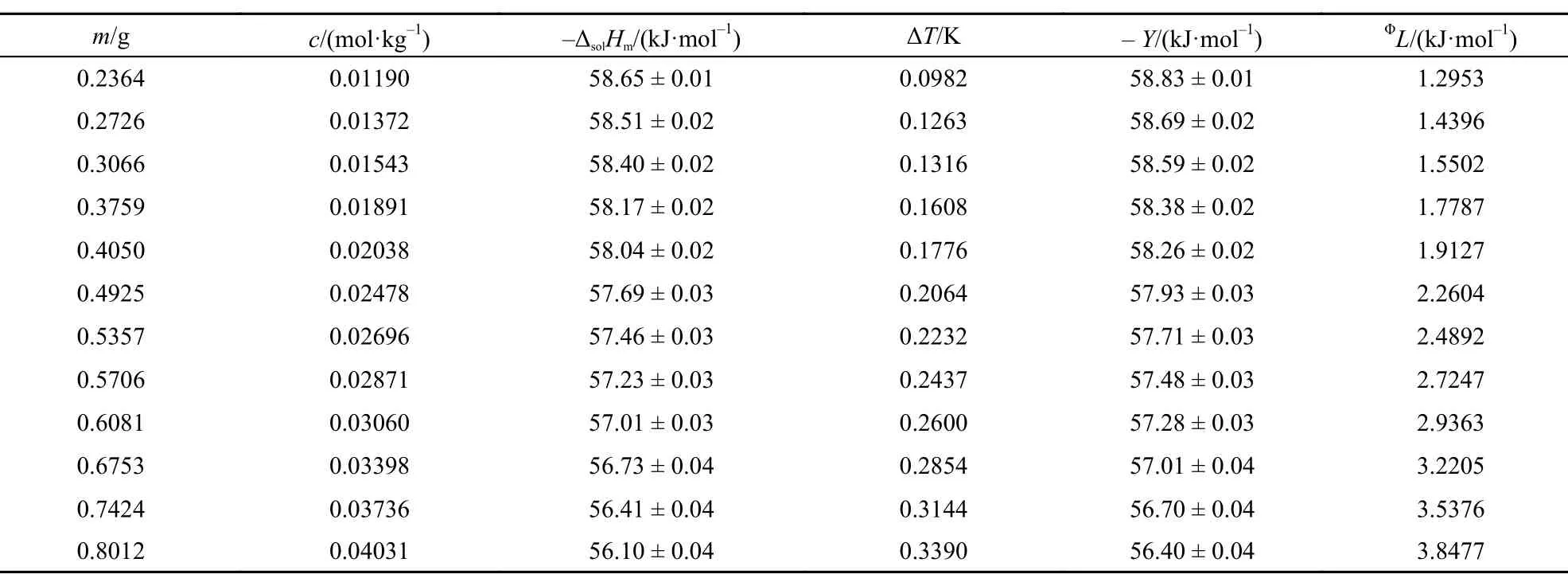
表1 288.15 K时离子液体[C2mim][Ala]的摩尔溶解焓(ΔsolHm),外推函数(Y)和相对表观摩尔溶解焓(ΦL) 值Table1 Values of the molar enthalpies of solution (ΔsolHm), the extrapolation function (Y), and the apparent relative molar enthalpy (ΦL) for [C2mim][Ala] at 288.15 K
参考Archer等24的方法, 根据Debye-Hückel极限方程, [C2mim][Ala]在不同温度下的标准摩尔溶解焓可由下式得到:
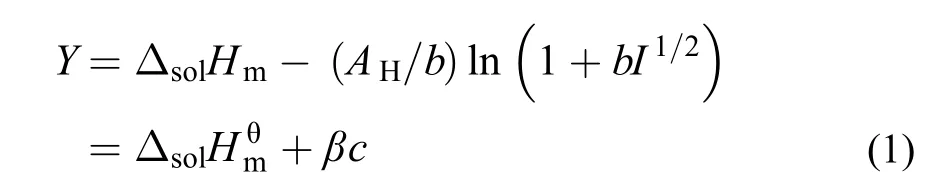
式(1)中: Y为外推函数, 可由实验数据计算得到, AH为Debye-Hückel参数,25b为常数, b = 1.2,25c为质量摩尔浓度, I为离子液体强度(当电解质溶液按照1 : 1电解时, I = c), β为经验常数. 将外推函数Y对质量摩尔浓度c作图, 可得一系列直线(见图2), 从直线的截距和斜率可得到和β的值, 相关数据被列于表6中. 通过表中数据可以看出标准摩尔溶解焓随温度的升高而减小. 在298.15 K下, [C2mim][Ala]的标准摩尔溶解焓值小于[C4mim][Ala]的值随着咪唑烷基碳链(-CH2-)的增加标准摩尔溶解焓增大, 这与我们实验过程中观察到的[C2mim][Ala]在溶解过程中放热较小是一致的.
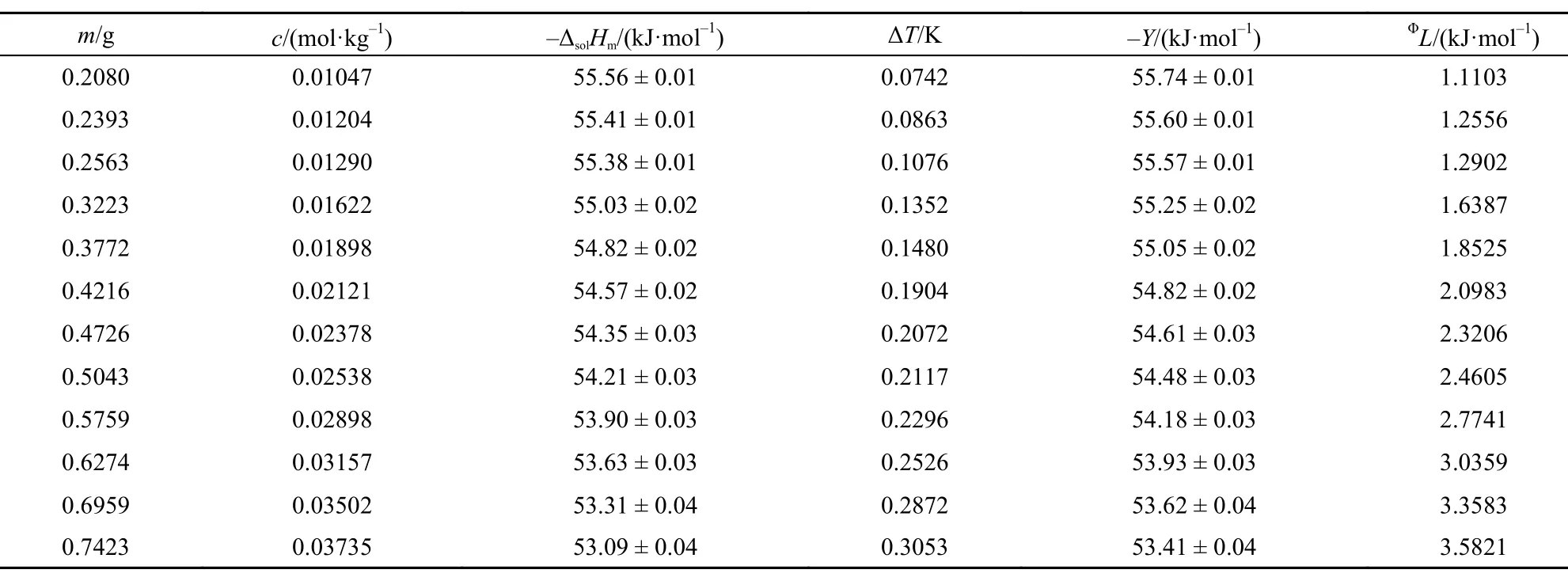
表2 293.15 K时离子液体[C2mim][Ala]的ΔsolHm, Y和ΦL值Table2 Values of ΔsolHm, Y, andΦL for [C2mim][Ala] at 293.15 K
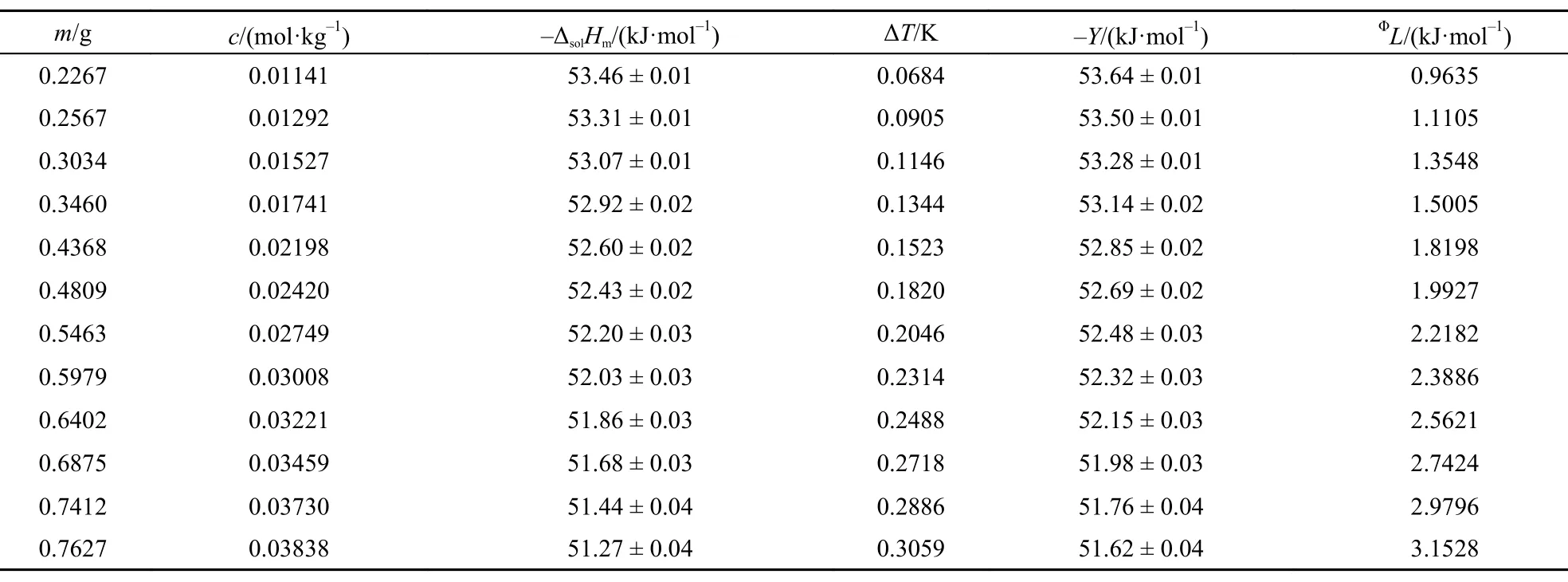
表3 298.15 K时离子液体[C2mim][Ala]的ΔsolHm, Y和ΦL值Table3 Values of theΔsolHm, Y, andΦL for [C2mim][Ala] at 298.15 K
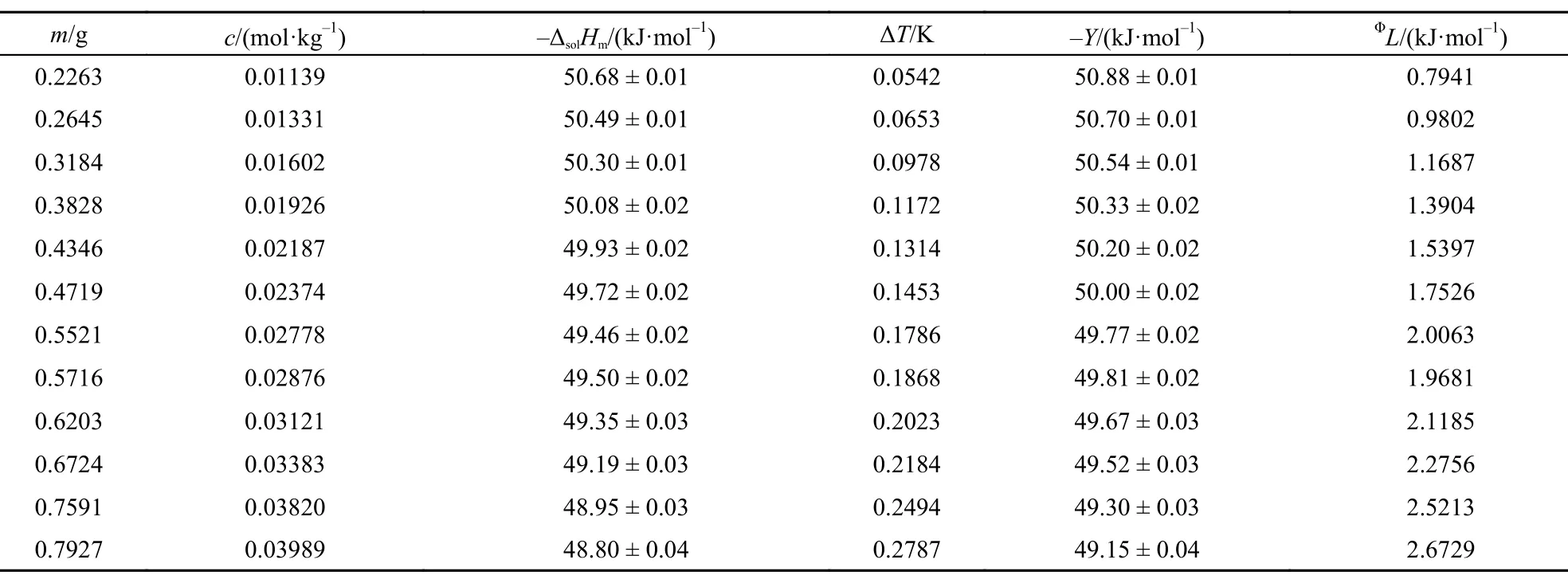
表4 303.15 K时离子液体[C2mim][Ala]的ΔsolHm, Y和L值Table4 Values of theΔsolHm, Y, andΦL for [C2mim][Ala] at 298.15 K
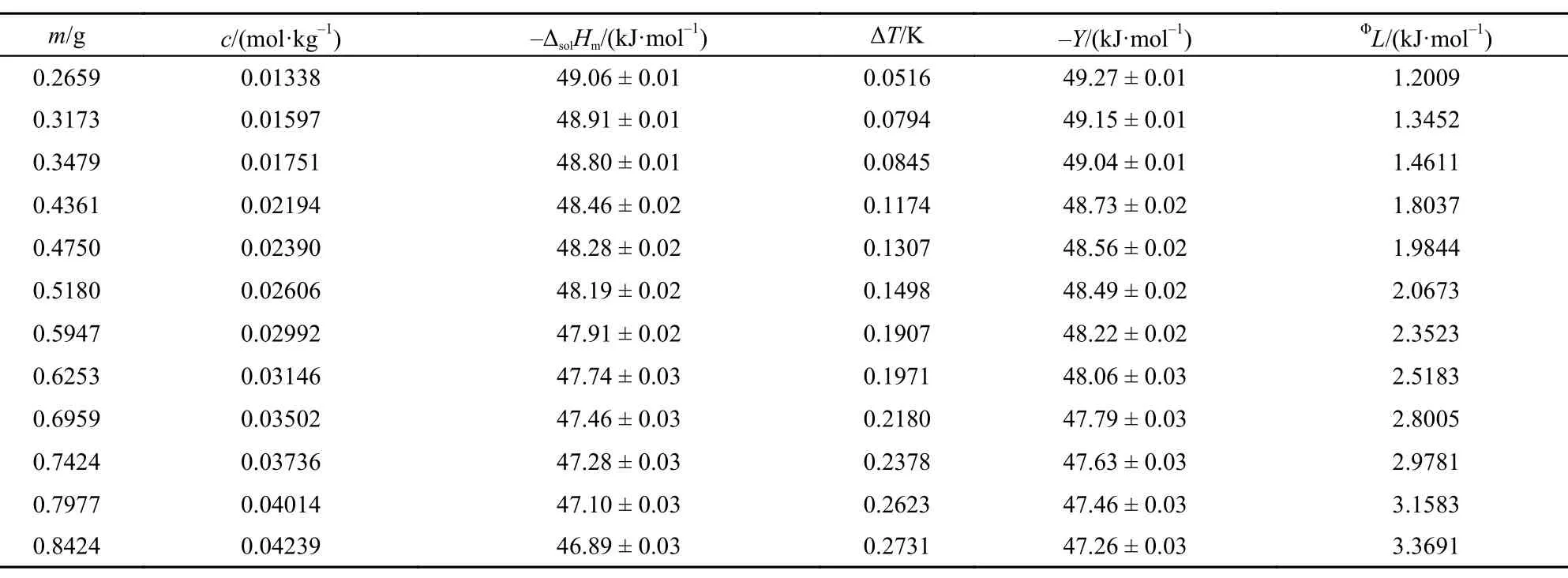
表5 308.15 K时离子液体[C2mim][Ala]的ΔsolHm, Y和ΦL值Table5 Values of theΔsolHm, Y, andΦL for [C2mim][Ala] at 298.15 K
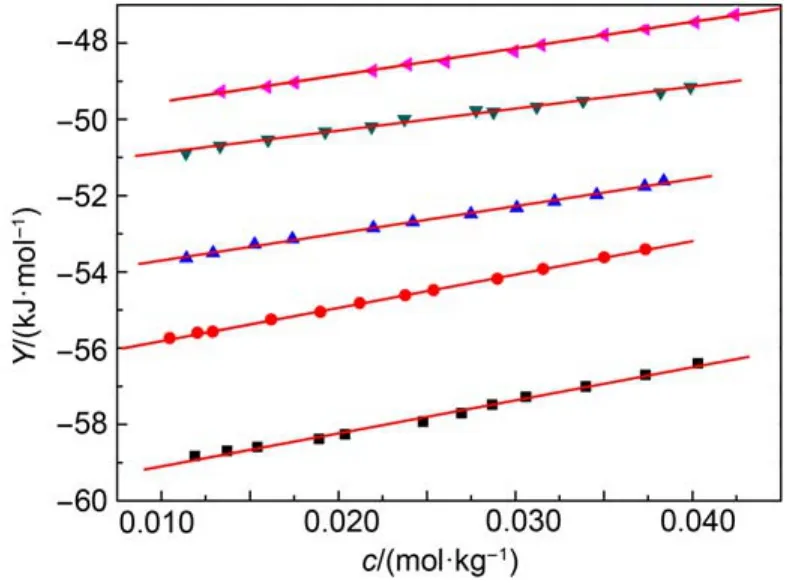
图2 288.15–308.15 K温区内离子液体[C2mim][Ala]的Y对c的拟合图Fig.2 Plots of the extrapolation function Y against c for IL [C2mim][Ala] in temperature range of 288.15 to 308.15 K
离子液体[C2mim][Ala]的相对表观摩尔焓(ΦL)可由方程(2)计算得到, 计算的结果见表1–5.
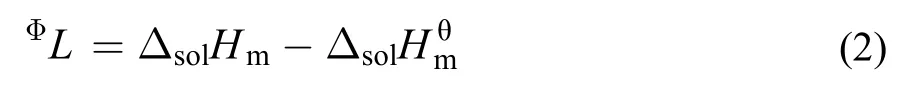
3.3 离子液体的阴阳离子水化焓的估算
通过设计热力学循环, 如图3所示, 离子液体阴阳离子水化焓值可由下式计算得到:
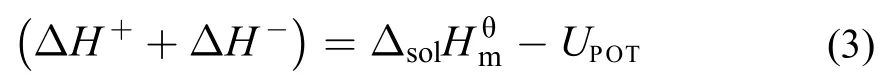
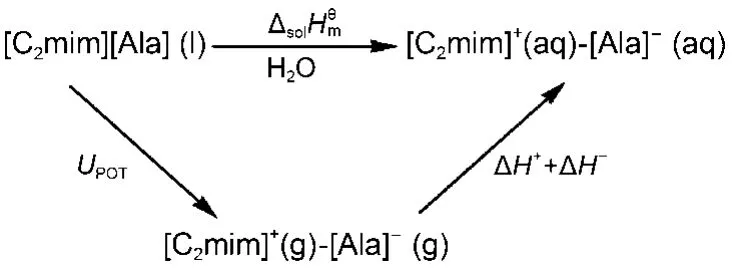
图3 离子液体[C2mim][Ala]水化焓的热力学循环图Fig.3 Thermodynamic cycle for estimation the values of the hydration enthalpy of IL [C2mim][Ala]
Table6 Values of standard molar solution enthalpyfor [Cmim][Ala] in temperature range of 288.15–308.15 K2
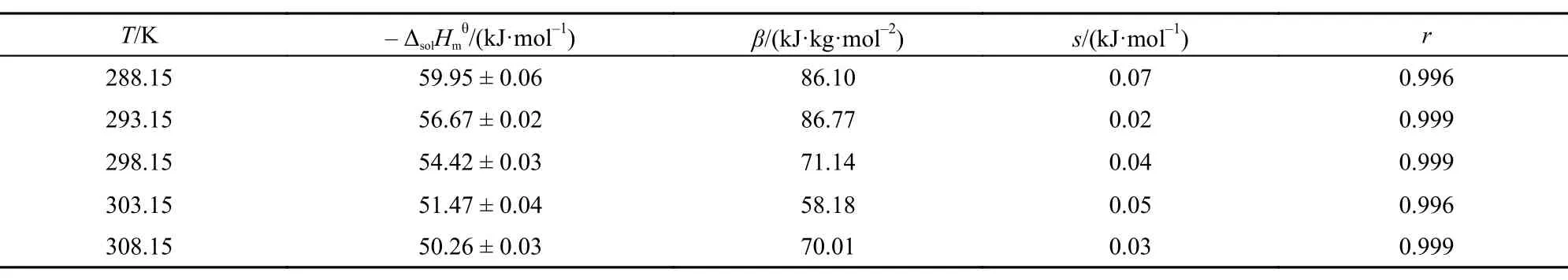
表6 288.15–308.15 K温度范围离子液体[C2mim][Ala]的标准摩尔溶解焓
利用Glasser27,28经验方程可计算离子液体的格子能:
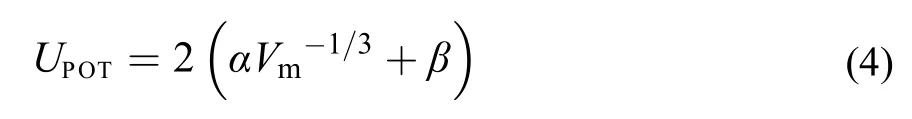
式中: α和β是常数,29α = 83.3 nmkJmol–1, β = 157.3 kJmol–1, Vm为[C2mim][Ala]的分子体积. 在298.15 K下, Vm= 0.2914 nm3,30得到UPOT= 566 kJmol–1.
根据方程(3),计算[C2mim][Ala]的阴、阳离子水化焓由于其中阳离子水化焓–233kJmol–1,31因此,
3.4 离子液体表观摩尔热容(ΦCp)
离子液体[C2mim][Ala]的表观摩尔热容ΦCp由方程(5)计算得到:
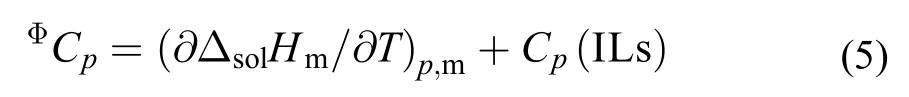
根据Archer等24的方法, 计算了[C2mim][Ala]在一定质量摩尔浓度下的摩尔溶解焓ΔsolHm, 并将ΔsolHm对T作线性拟合图, 所得直线的斜率即为(∂ΔsolHm/∂T)p,m, 这些结果均被列于表7中. 此外, 离子液体的摩尔热容Cp(ILs)可根据Paulechka等32提出得经验方程进行估算:
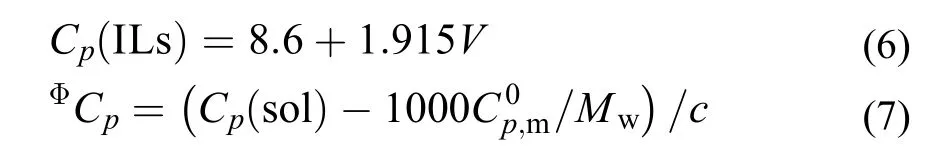
其中: V为[C2mim][Ala]的摩尔体积, V = 175.4 cm3,为纯水的摩尔热容, Mw为水的摩尔质量. 根据方程(6), 离子液体[C2mim][Ala]的摩尔热容Cp(ILs) = 344.49 JK–1mol–1, 将结果带入方程(5), 得到了不同质量摩尔浓度下的ΦCp. 将上述ΦCp及其相对应的c值代入方程(7)可计算出溶液的热容Cp(sol), 上述计算的结果均被列于表7中.
4 结 论
在288.15 K至308.15 K温度范围内每隔5 K, 测定了离子液体的摩尔溶解焓ΔsolHm, 并计算了标准摩尔溶解焓和相对表观摩尔溶解焓ΦL, 且通过数据得出标准摩尔溶解焓值随温度的升高而减小,通过对[C2mim][Ala]和[C4mim][Ala]标准摩尔溶解焓值的对比发现随着咪唑烷基碳链(-CH2-)的增加标准摩尔溶解焓逐渐增大; 计算了298.15 K下[C2mim][Ala]的阴阳离子水化焓(ΔH++ ΔH–)和阴离子水化焓ΔH–([Ala]–); 此外, 估算了离子液体水溶液的热容和不同质量摩尔浓度的表观摩尔热容.
Supporting Information: available free of charge via the internet at http://www.whxb.pku.edn.cn
(1)Fukumoto, K.; Yoshizawa, M.; Ohno, H. J. Am. Chem. Soc. 2005, 127, 2398. doi: 10.1021/ja043451i
(2)Ohira, K.; Yoshida, K.; Hayase, S.; Itoh, T. Chemistry Letters 2012, 41, 987. doi: 10.1246/cl.2012.987
(3)Rauta, D. G.; Sundman, O.; Su, W.; Virtanen, P.; Sugano, Y.; Kordasd, K.; Mikkola, J. P. Carbohydrate Polymer 2015, 130, 18. doi: 10.1016/j.carbpol.2015.04.032
(4)Pemberton, W. J.; Droessler, J. E.; Kinyanjui, J. M.; Czerwinski, K. R.; Hatchett, D. W. Electrochimica Acta 2013, 93, 264. doi: 10.1016/j.electacta.2013.01.044
(5)Pinto, A. M.; Rodríguez, H.; Arce, A.; Soto, A. Journal of Chemical Thermodynamics 2014, 77, 197. doi: 10.1016/j.jct.2013.10.023
(6)Christodoulou, C. P. K.; Stavrou, I. J.; Mavroudi, M. C. Journal of Chromatography A 2014, 1363, 2. doi: 10.1016/j.chroma.2014.05.059
(7)Kasahara, S.; Kamio, E.; Matsuyama, H. J. Membrane Science 2014, 454, 155. doi: 10.1016/j.memsci.2013.12.009
(8)Li, X. H.; Jiang, Y. B.; Zhang, L.; Li, R. Acta Phys. -Chim. Sin. 2006, 22, 747. [李雪辉, 江燕斌, 张 磊, 李 榕. 物理化学学报, 2006, 22, 747.] doi: 10.3866/PKU.WHXB20060620
(9)Primerano, P.; Milazzo, M. F.; Risitano, F.; Matarazzo, A. Journal of Chemical Technology and Biotechnology 2015, doi: 10.1002/jctb.4717
(10)Liu, Y.; Tian, A.; Wang, X.; Qi, J.; Wang, F.; Ma, Y.; Ito, Y.; Wei, Y. Journal of Chromatography A 2015, 1400, 40. doi: 10.1016/j.chroma.2015.04.045
(11)Bi, Y. H.; Duan, Z. Q.; Li, X. Q.; Wang, Z. Y.; Zhao, X. R. Journal of Agricultural and Food Chemistry 2015, 63, 558. doi: 10.1021/jf505296k
(12)Wei, J.; Ma, T. Y.; Ma, X. X.; Guan, W.; Liu, Q. S.; Yang, J. Z. RSC Adv. 2014, 4, 30725. doi: 10.1039/C4RA04391J
(13)Guan, W.; Yang, J. Z.; Li, L.; Wang, H.; Zhang, Q. G. Fluid Phase Equilibria 2006, 239, 161. doi: 10.1016/j.fluid. 2005.11.015
(14)Ma, X. X.; Wei, J.; Zhang, Q. B.; Tian, F.; Feng, Y. Y.; Guan, W. Ind. Eng. Chem. Res. 2013, 52, 9490. doi: 10.1021/ie401130d
(15)Wei, J.; Zhang, Q. B.; Tian, F.; Zheng, L.; Guan, W.; Yang, J. Z. Fluid Phase Equilibria 2014, 371, 1. doi: 10.1016/ j.fluid.2014.03.011
(16)Fukumoto, K.; Yoshizawa, M.; Ohno, H. J. Am. Chem. Soc. 2005, 127, 2398. doi: 10.1021/ja043451i
(17)Wilkes, J. S.; Levisky, J. A.; Wilson, R. A.; Hussey, C. L. Inorg. Chem. 1982, 21, 1263. doi: 10.1021/ic00133a078
(18)Di, Y. Y.; Qu, S. S.; Liu, Y.; Wen, D. C.; Tang, H.; Li, L. W. Thermochim Acta 2002, 387, 115. doi: 10.1016/S0040-6031 (01)00831-0
(19)Liu, J. G.; Xue, W. F.; Qin, Y.; Yan, C. W. J. Chem. Eng. Data 2009, 54, 1938. doi: 10.1021/je8009557
(20)Ji, M.; Liu, M. Y.; Gao, S. L.; Shi, Q. Z. Instrum. Sci. Technol. 2001, 29, 53. doi: 10.1081/CI-100001408
(21)Rychly, R.; Pekarek, V. J. Chem. Thermodyn. 1977, 9, 391. doi: 10.1016/0021-9614(77)90060-X
(22)Montgomery, R. L.; Melaugh, R. A.; Lau, C. C.; Meier, G. H.; Chan, H. H.; Rossini, F. D. J. Chem. Thermodyn. 1977, 9, 915. doi: 10.1016/0021-9614(77)90214-2
(23)Ma, X. X.; Li, L.; Wei, J.; Duan, W. B.; Guan, W.; Yang, J. Z. J. Chem. Eng. Data 2012, 57, 3171. doi: 10.1021/je300768j
(24)Archer, D. G.; Widegren, J. A.; Kirklin, D. R.; Magee, J. W. J. Chem. Eng. Data 2005, 50, 1484. doi: 10.1021/je050136i
(25)Pitzer, K. S. Activity Coefficients in Electrolyte Solutions, Chapter 3; CRC Press: Boca Raton, FL. 1991.
(26)Fang, D. W.; Guan, W.; Tong, J.; Wang, Z. W.; Yang, J. Z. J. Phys. Chem. B 2008, 112, 7499. doi: 10.1021/jp801269u
(27)Glasser, L. Thermochim. Acta 2004, 421, 87. doi: 10.1016/j.tca.2004.03.015
(28)Glasser, L. Jenkins, H. D. B. J. Chem. Eng. Data 2011, 56, 874. doi: 10.1021/je100683u
(29)Gutowski, K. E.; Rogers, R. D.; Dixon, D. A. J. Phys. Chem. B 2007, 111, 4788. doi: 10.1021/jp066420d
(30)Zhang, Q. B. Synthesis and Study on the Physico-Chemical Properties of the Acetic Acid Series and Alanine Series of Ionic Liquids. Master Dissertation, Liaoning University, Shenyang, 2014. [张秋波. 醋酸离子液体和丙氨酸离子液体的合成及物理化学性质的测定[D]. 沈阳: 辽宁大学, 2014.]
(31)Yang, J. Z.; Zhang, Z. H.; Fang, D. W.; Li, J. G.; Guan, W. Fluid Phase Equilibria 2006, 247, 80. doi: 10.1016/j.fluid.2006.06.016
(32)Paulechka, Y. U.; Kabo, A. G.; Blokhin, A. V.; Kabo, G. J.; Shevelyova, M. P. J. Chem. Eng. Data 2010, 55, 2719. doi: 10.1021/je900974u
Study on Thermodynamic Properties of Ionic Liquid 1-Ethyl-3-methylimidazolium Alanine
ZHENG Ling1FAN Ben-Han1BU Xiao-Xue1PAN Yi1DONG Jia-Xin2GUAN Wei1,*
(1College of Chemistry, Liaoning University, Shenyang 110036, P. R. China;2College of Chemistry & Chemical Engineering, Guangxi Normal University, Guilin 541004, Guangxi Province, P. R. China)
We synthesized the alanine-based ionic liquid [C2mim][Ala] (1-ethyl-3-methylimidazolium alanine) by using the neutralization method and characterized it. Using a solution-reaction isoperibol calorimeter, we determined the molar enthalpies of the solution (ΔsolHm) at various molalities in water from (288.15 ± 0.01) to (308.15 ± 0.01) K in intervals of 5 K. Using Archer’s method, we obtained the standard molar enthalpy of solution for [C2mim][Ala]and calculated its apparent relative molar enthalpy (ΦL). Using Glasser’s theory of lattice energy, we obtained the lattice energy, UPOT= 566 kJmol–1, the hydration enthalpy of the cation and anion, (ΔH++ ΔH–) = –620 kJmol–1, and the hydration enthalpy of an anion, ΔH–([Ala]–) = –387 kJmol–1at 298.15 K. Finally, we obtained the heat capacity of aqueous [C2mim][Ala] (Cp(sol)) and its apparent molar heat capacity (ΦCp) at various specific molalities.
Ionic liquid; Enthalpy of solution; Heat capacity; Hydration enthalpy; Lattice energy
O642
10.3866/PKU.WHXB201509111
Received: July 30, 2015; Revised: September 10, 2015; Published on Web: September 11, 2015.
*Corresponding author. Email: guanweiy@sina.com.
The project was supported by the National Natural Science Foundation of China (21173107) and Liaoning Excellent Talents in University, China (2015025).
国家自然科学基金(21173107)和辽宁省高等学校优秀人才支持计划(2015025)资助项目
©Editorial office of Acta Physico-Chimica Sinica

