Ras-GRF1基因敲除小鼠的行为学研究
段巍鹤,郑宏亮,陆美林,万家余,何秀霞
(1.长春理工大学 校医院,长春 130022,2.长春理工大学 生命科学技术学院,长春 130022,3.军事医学科学院 军事兽医研究所,长春 130122)
细胞内信号传递通过中心转换站接收、调节和传递信号。小分子量G蛋白家族构成了对生长、分化、形态发生、囊泡转运和细胞骨架形成极其重要的膜相关转运站。Ras蛋白是一个分子质量为21kD左右的单体GTP酶,参与典型的G蛋白激活和失活循环。Ras突变常见于人类许多癌症中。突变后持续活化的生长信号导致细胞的恶性增殖。并且,Ras蛋白大量存在于神经中枢中。因此,Ras蛋白在细胞的生长分化、细胞的癌变、信号的的传递等方面扮演着重要的作用,其在癌症的预防、诊断、治疗方面的研究越来越深入,而在学习记忆功能方面的研究同样受到了国内外的关注[1,2]。为此,对Ras基因和蛋白的细致研究可以产生巨大经济价值和医疗价值,将会对人类肿瘤的治疗和学习记忆功能的发展带来突破性的进展[3-7]。
本实验利用敲除Ras-GRF1基因的雌性小鼠(Ras-GRF10/0)进行自主活动实验以检测机体运动状态;通过莫里斯水迷宫实验评估转基因和敲除小鼠学习与记忆能力[8-12];通过避暗穿梭实验、跳台实验等判断小鼠学习和记忆功能是否受到影响[13]。
1 材料与方法
1.1 材料
1.1.1 实验小鼠
Ras-GRF10/0基因敲除小鼠由美国公司构建,野生型老鼠由军事医学科学院兽医研究所提供。各品系老鼠均有十四只。
1.1.2 实验仪器
伯乐高电压电泳仪Biorad Powerpac HV 164-5056,伯乐小型电泳槽,伯乐C1000 PCR仪均为伯乐公司生产;Morris水迷宫视频分析系统,避暗穿梭测试仪XR-YLS-17B,自主活动箱,跳台实验设备均为北京众实迪创科技发展有限公司生产。
1.2 实验方法
1.2.1 Ras-GRF10/0纯合敲除鼠的扩繁
将成年(大于6周龄)首建的杂合敲除鼠按每笼3只雌鼠1只雄鼠合笼,养殖房需要温度可控(22℃),采取等昼夜长,水和食物可以供小鼠自由食用的方式来饲养。待母鼠产的子代小鼠长到5周大的时候,打耳号区分每一只鼠。
1.2.2 Ras-GRF10/0基因敲除小鼠的鉴定
利用Axygen公司提供的AxyPrep基因组DNA小量试剂盒提取小鼠的基因组。将提取DNA进行PCR以鉴定所用Ras-GRF10/0老鼠是否为纯合老鼠。
1.2.3 自主活动箱
自主活动箱由长方体不透光的封闭空间组成。内壁含有4个光电管,可以测定小鼠的自主活动次数。将小鼠轻轻放进自主活动箱,然后将盖子盖上。以5min为测试时间,连续五天。第一次实验时需给予小鼠3min适应实验。
1.2.4 Morris水迷宫
连续进行7天定位航行试验;第八天撤去隐藏平台,即空间搜索实验。将小鼠轻轻地放置在隐藏的平台,小鼠在随后会逃离平台,允许小鼠在池内游泳,以适应环境,然后用手,引导小鼠慢慢游向隐藏平台,并保证小鼠在平台上至少停留15s。在水迷宫分析系统中人为地将水池分为4个象限,分后随机在4个象限中选取入水点。入水时,小鼠面向水池壁,防止其观察到隐藏平台,然后让小鼠在四个象限中自由游泳,时间规定为120s。若在120s内小鼠找到隐藏平台并在平台停留至少5s,则结束实验,时间即为该小鼠的逃避潜伏期;若没有找到,则需要人为地诱导小鼠寻找隐藏平台,然后让其停留至少15s,逃避潜伏期记作120s。同时记录每次小鼠的游泳轨迹。第八天进行空间搜索实验,在没有隐藏平台的情况下,记录小鼠第一次穿越平台的时间,游泳轨迹以及在120s内穿越平台的次数。
1.2.5 避暗穿梭
实验设备是由长宽各为20cm,高为15cm的四个不透光的封闭空间组成,分为A、B、C、D四个区域,A和C作为一组测量仪器,B与D作为一组。其底部均由可通电的电栅组成。每个空间内有均有自动传感器可以测量小数的活动。实验时,将小鼠轻轻的放进A、B两室中,然后将盖子盖上,通电后,A、B两室将闪烁灯光,C、D两室会以限压30V,限流0.5mA的电流持续通电。以5min为测试时间,连续三天。同样第一次实验时需给小鼠3min的适应时间。
1.2.6 跳台实验
将小鼠放置到实验设备的圆柱体平台中,将盖子盖上。将会有限压30V,限流0.5mA的电流通过底部的电栅。以5分钟为测试时间,连续两天。在第一天的实验中,给予小鼠三分钟的适应时间。
每批小鼠在完成上述实验后,都要及时的用清水清理实验仪器,防止有气味等因素干扰小鼠的判断。实验前后保持安静,温度为21℃恒定。
2 实验结果
2.1 Ras-GRF10/0纯合老鼠的鉴定
为了得到足够数量的纯合Ras-GRF10/0小鼠,进行种内自交,在F1代群体中,通过PCR技术鉴定杂合型和纯合型后代。通过图1PCR的鉴定结果可以看出,杂合型小鼠电泳结果中有两条电泳条带如5、7、8、9、10、11、12泳道,有清晰单一条带的为Ras-GRF10/0纯合小鼠如3、4泳道,2、6泳道则为野生型小鼠。以PCR检测为纯合的小鼠进行后续实验。

图1 Ras-GRF10/0PCR鉴定结果
图1中,1为DL2000 Marker;2和6:野生型小鼠PCR结果;3和4:Ras-GRF10/0纯合小鼠的PCR结果;5,7,8,9,10,11,12:为Ras-GRF10/0杂合小鼠的鉴定结果.
2.2 自主活动实验结果
在自主活动的实验中,野生型小鼠和Ras-GRF10/0小鼠在活动性上随着时间的推移均有所下降,但下降的幅度不大,且Ras-GRF10/0小鼠活动次数整体少于野生型小鼠。但是没有显著性差异。实验数据见表1。

表1 野生型小鼠和Ras-GRF10/0型小鼠自主活动次数(单位:次)

表2 野生型小鼠与Ras-GRF10/0型小鼠逃避潜伏期(单位:秒)
2.3 水迷宫实验结果
2.3.1 定位航行试验结果
由Morris水迷宫得出两种小鼠的平均逃避潜伏期见表2,野生型小鼠逃避潜伏期有逐渐降低的趋势,实验的5~7天逃避潜伏期有平稳的趋势。而Ras-GRF10/0小鼠的逃避潜伏期在实验的前两天几乎没有变化,从实验的第三天开始,有逐渐降低的趋势。对比野生型小鼠和Ras-GRF10/0小鼠,可以明确发现两者在逃避潜伏期的第1天没有显著差异,第2天则表现差异显著(P<0.05),第3~7天则差异极显著(P<0.01)。从游泳轨迹(见图2)也证实了这一点,即随着时间的延长,野生鼠目的性更强,游泳轨迹更直接。
2.3.2 空间探索实验
实验的第八天,撤去水下的隐藏平台。通过对比野生型小鼠和Ras-GRF10/0小鼠在120s内穿越平台的平均次数,可以发现野生型平均穿越次数为6.1要大于Ras-GRF1基因敲除小鼠的5次穿越次数。虽然在统计学上没有显著差异,但从两者空间探索轨迹可以看出野生鼠的探索次数多于Ras-GRF10/0小鼠,搜索性更强(图3)。
2.4 避暗穿梭实验结果
从表3避暗实验结果显示,5min内两种小鼠被电击次数在第一天有显著差异,之后则没有表现出差异,但Ras-GRF10/0型小鼠被电击次数多于野生型小鼠。对比野生型小鼠和Ras-GRF10/0型小鼠主动回避潜伏时间可以看出(如表4)在实验的第一天潜伏期都很短,但Ras-GRF10/0型小鼠第一天和第二天的潜伏期均远远低于野生型小鼠,在实验的第三天,即最后一天中,这两种小鼠的差异变得很小。
2.5 跳台实验结果
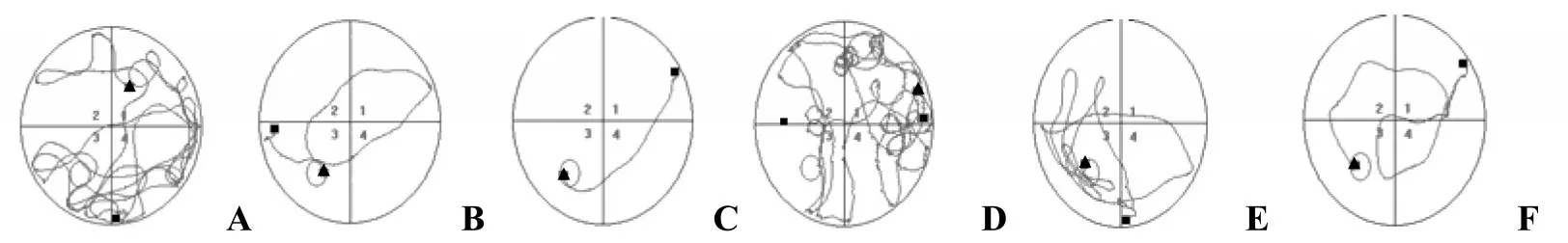
图2 野生型小鼠与Ras-GRF10/0型小鼠游泳轨迹

图3 野生型小鼠和Ras-GRF1小鼠空间探索轨迹
通过分析对比跳台实验结果(图4)可以看出两者在跳下平台的时间没有显著差异,但Ras-GRF10/0型小鼠的潜伏期小于野生型小鼠。在第一天的实验中,Ras-GRF10/0型小鼠跳台次数大于野生型小鼠差异显著。在第二天的实验中两种小鼠的跳台次数略有差距(见图5)。

表3 野生型小鼠和Ras-GRF10/0小鼠5min被电击次数(单位:次)

表4 野生型小鼠和Ras-GRF10/0小鼠主动回避潜伏时间(单位:秒)
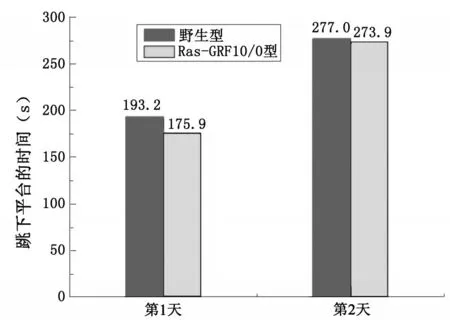
图4 野生型小鼠和Ras-GRF10/0小鼠第一次跳下平台的时间
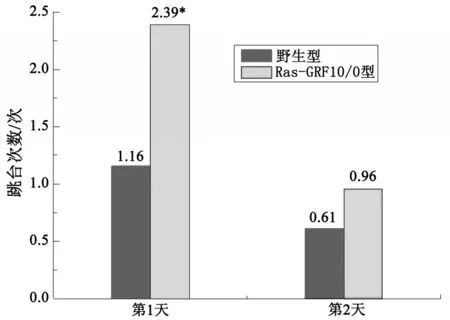
图5 野生型小鼠和Ras-GRF10/0小鼠5min内跳台次数
3 讨论
自主活动实验结果说明,在自主活动能力上、在体力上,野生型小鼠与Ras-GRF10/0型小鼠没有较大的区别。跳台试验说明Ras-GRF10/0型小鼠的平均潜伏期与野生型大致相同,但跳台次数Ras-GRF10/0型小鼠多于野生型。Morris水迷宫的空间探索实验结果说明Ras-GRF10/0型小鼠对平台所在位置并没有显著的记忆。避暗穿梭实验进一步说明Ras-GRF10/0型小鼠的学习记忆能力不如野生型小鼠。
[1]郭瑞珍,胡成久.20例皮肤瘢痕癌中Ras蛋白表达及意义[J].临床与实验病理学杂志,2011,27(11):1237-1239.
[2]张玉,谢丙炎,冯东昕,等.Ras蛋白信号途径及其对线虫生长发育的调控作用[J].生物技术通报,2009,8(1):32-37.
[3]Karl Peter Giese,Eugenia Friedman,Nikolai B.Fedorov,etal.Hippocampus-dependentlearningand memory is impaired in mice lacking the Ras-guanine-nucleotide releasing factor 1(Ras-GRF1)[J].Neuropharmacology,2001,6(41):791-800.
[4]Zhuravliova E,Barbakadze T,Narman N,et al.Hypoinsulinemia alleviates the Grf1/Ras/Akt anti-apoptotic pathway and induces alterations of mitochondrial ras trafficking in neuronal cells[J].Neurochem,2009(34):1076-1082.
[5]Jaime Font de Mora,Luis Miguel Esteban,Deborah J Burks,et al.Ras-GRF1 signaling is required for normalβ-cell development and glucose homeostasis[J].The EMBO Journal,2003,22(12):3039-3049.
[6]Huibin Yang,Raymond R Mattingly.The ras-GRF1 exchange factor coordinates activation ofH-Ras and rac1 to control neuronal morphology[J].Molecular Biology of the Cell,2006(17):2177–2189.
[7]Rachel J Buchsbaum,Beth A Connolly,Larry A Feig,et al.Interaction of rac exchange factors tiam1 and Ras-GRF1 with a scaffold for the p38 mitogen-activated protein kinase cascade[J].Molecular and cellular biology,2002(6):4073-4085.
[8]薛丹,徐淑萍,刘进修,等.水迷宫实验中三种品系小鼠学习记忆能力的比较[J].中国实验动物学,2010,l8(2):149-152.
[9]封敏,卢圣锋,张承舜,等.国内大鼠Morris水迷宫实验现状与分析[J].辽宁中医杂志,2011,38(11):2170-2172.
[10]刘艳霞,胡晋红,朱全刚,等.水迷宫水域调节方法的改良[J].实验动物与比较医学,2008,28(4):243-245.
[11]武文芳,吴兵.水迷宫实验动物游动的图像轨迹采集分析系统设计[J].医疗设备信息,2002(6):24-25.
[12]王维刚,周嘉斌,朱明莉,等.小鼠动物实验方法系列专题(一)Morri水迷宫实验在小鼠表型分析中的应用[J].中国细胞生物学学报,2011,33(1):8-14.
[13]袁力勇,戴体俊,苏珍,等.跳台实验训练后小鼠自然遗忘时间的观察[J].徐州医学院学报,2007,27(2):84-85.

