MR扩散加权成像对子宫腺肌病高强度聚焦超声治疗后早期疗效的评价价值
丁 立,王 薇,康 敏,代倩苓,王世琦,陈 瑞
(1.四川省妇幼保健院放射科,四川 成都 610045;2.成都市妇女儿童中心医院妇科,四川 成都 610091)
MR扩散加权成像对子宫腺肌病高强度聚焦超声治疗后早期疗效的评价价值
丁立1,王薇2,康敏1,代倩苓2,王世琦1,陈瑞1
(1.四川省妇幼保健院放射科,四川 成都610045;2.成都市妇女儿童中心医院妇科,四川 成都610091)
目的:评估MR扩散加权成像(DWI)对子宫腺肌病高强度聚焦超声(HIFU)治疗后早期疗效评价的价值。方法:55例患者依据病灶范围,分为局灶性44例,弥漫性11例。在HIFU术前及消融后5 d内行DWI、CE-MRI检查,分析病灶的DWI信号特征,并计算不同区域表观弥散系数(ADC)差异。结果:55例DWI均能明确残留病灶及消融灶范围;HIFU术前病灶平均ADC值为(1.36±0.21)×10-2mm2/s,术后5 d残留灶平均ADC值为(1.49±0.23)×10-2mm2/s,较术前升高,两者经t检验,t=3.10,P= 0.003,两者间差异有统计学意义,术后5 d消融灶平均ADC值为(1.22±0.24)×10-2mm2/s,较术前降低,残留灶与消融灶间差异经t检验,t=6.02,P=0.000,两者间差异亦有统计学意义(P<0.005)。结论:DWI及ADC值是评价子宫腺肌病HIFU术后早期消融效果非常有效的方法。
子宫疾病;磁共振成像;超声疗法
子宫腺肌病是妇科常见病,发病率呈升高趋势,多发生于30~50岁经产妇[1]。传统治疗以手术和药物为主,但药物治疗效果差,手术治疗创伤大,高强度聚焦超声(HIFU)作为一项新型无创介入技术[2],通过聚焦超声消融治疗,为子宫腺肌病患者提供了一种保留子宫的治疗途径,具有创伤小、无辐射等优点,更容易被患者所接受。HIFU疗效的评价方式至关重要,而相应评价研究甚少[3],因此本文首先在国内通过MR扩散加权成像(DWI)来评价HIFU治疗子宫腺肌病早期疗效的价值。
1 资料与方法
1.1一般资料
收集2013年1月—2014年8月在成都市妇女儿童中心医院HIFU治疗子宫腺肌病55例,年龄29~48岁,平均40岁,所有患者均有痛经渐进性加重,经量增多,经期延长,其中局限性病灶44例(后壁32例,前壁12例),弥漫性病灶11例,伴发子宫肌瘤15例,所有病例术前、术后1周内均行MR平扫加动态增强及扩散加权成像检查。
1.2方法
1.2.1评价方式
术前、术后均使用GE Signa HDx 1.5T超导型MR仪进行评价,病人仰卧位,检查前均签署知情同意书,采用8通道体部线圈进行扫描。所有患者HIFU治疗前、后均采用相同参数的T1WI、T2WI、DWI及动态对比增强扫描。T1WI参数:TR 360~450ms,TE 8~15ms,层厚4mm,层间距1mm,FOV 260mm× 260mm,T2WI参数:TR 2800ms,TE 68ms,层厚4mm,层间距1mm,FOV 260mm×260mm,DWI参数:采用SE-EPI序列,轴位及矢位成像,TR 6 500ms,TE 70ms,层厚4mm,无间隔,FOV 420mm×420mm,b值为0、800 s/mm2,并将原始数据导入AW4.5图像工作站,ROI选取病灶边缘及病灶中心,面积选取55mm2,用Functool 2软件分别得出ADC值。CEMRI成像参数:采用LAVA的T1W1序列矢状位、轴位成像,TR 3.8ms,TE 1.8ms层厚4mm,无间隔。
1.2.2治疗方案
治疗设备采用JC型聚焦超声肿瘤治疗系统(重庆海扶(HIFU)技术有限公司研制)。患者术前常规禁食4 h,胀尿,采用超声定位,并实施镇静镇痛,在心电监测下行HIFU治疗[4]。
1.3图像分析
由两位主治以上的高年资MRI诊断医师对数据及图像分别分析。图像信号强弱以同平面骨胳肌作为参考。结合CE-MRI图定位,观察术前病灶及术后5 d坏死、残留灶DWI图像信号特点,在DWI图像上准确选择术后残留部分及消融部分作为感兴趣区(ROI),分别测量其平均ADC值。
1.4统计分析
2 结果
2.1HIFU术前、后子宫腺肌病磁共振信号的变化
HIFU术前弥漫型子宫腺肌病11例,在T2WI上表现为子宫均匀性增大,轮廓光滑,结合带弥漫性均匀或不均匀增厚,增厚的结合带与内膜和外层肌之间界限不清(图1);DWI呈均匀或不均匀高信号(图2a);增强扫描有不同程度不均匀强化(图2b)[5]。局限型子宫腺肌病44例,在T2WI上表现为肌层内与结合带信号相近的低信号肿块(图3a)。DWI亦呈局限性不均匀稍高信号(图3b),术后DWI呈更高信号(图3c)。术前ADC伪彩图,病灶大部分呈绿色(图3d),HIFU术后5 d复查,病灶呈现T2WI中央消融灶信号较前减低,周围信号较前不均匀增高 (图3e),增强后消融区无强化,周可见环形强化残留灶(图3f),术后ADC伪彩图病灶边缘呈黄色,中央呈绿色(图3g)。
2.2HIFU术前、后病灶ADC值的变化特点
子宫腺肌病术前平均ADC值为 (1.36±0.21)× 10-2mm2/s;术后5 d残留部分平均ADC值为(1.49± 0.23)×10-2mm2/s,较术前有升高,两者间的配对t检验,差异有统计学意义(P<0.005)。术后5 d消融部分平均ADC值为(1.22±0.24)×10-2mm2/s,低于残留部分,两者差异有统计学意义(P<0.005)。详见表1。

表1 病灶ADC值改变统计表(mm2/s)
3 讨论
3.1子宫腺肌病的病理和发病机制
子宫腺肌病的病理学诊断标准为距子宫内膜基底层以下至少一个低倍视野(大约2.5mm)深处的子宫肌层中出现内膜腺体和间质,呈岛状分布,其周围有增生肥大的平滑肌。子宫腺肌病的病因不清,以子宫内膜损伤学说占主导地位,常出现经量过多,经期延长和逐渐加重的进行性痛经[6]。
3.2HIFU治疗子宫腺肌病的机理
病变细胞致死的临界温度为42.3℃~43.0℃,人体正常细胞可耐受的温度极限在45℃。HIFU利用超声波的组织穿透性和聚焦性将体外低能超声波聚焦于体内深部增生的腺肌组织,在靶区焦点处超声波能转化为热能,ROI内温度于1 s内升至60℃~100℃,使异常增生的腺肌组织发生凝固性坏死,病灶区内微血管亦大量被破坏,坏死组织被机体缓慢溶解吸收或纤维化[7]。HIFU的空化、机械、声化学效应亦能直接损伤增生的腺肌组织。靶区内微血管及毛细血管区的损伤,使靶区血流灌注明显下降,从而加速组织细胞坏死,以增强HIFU的疗效[8]。
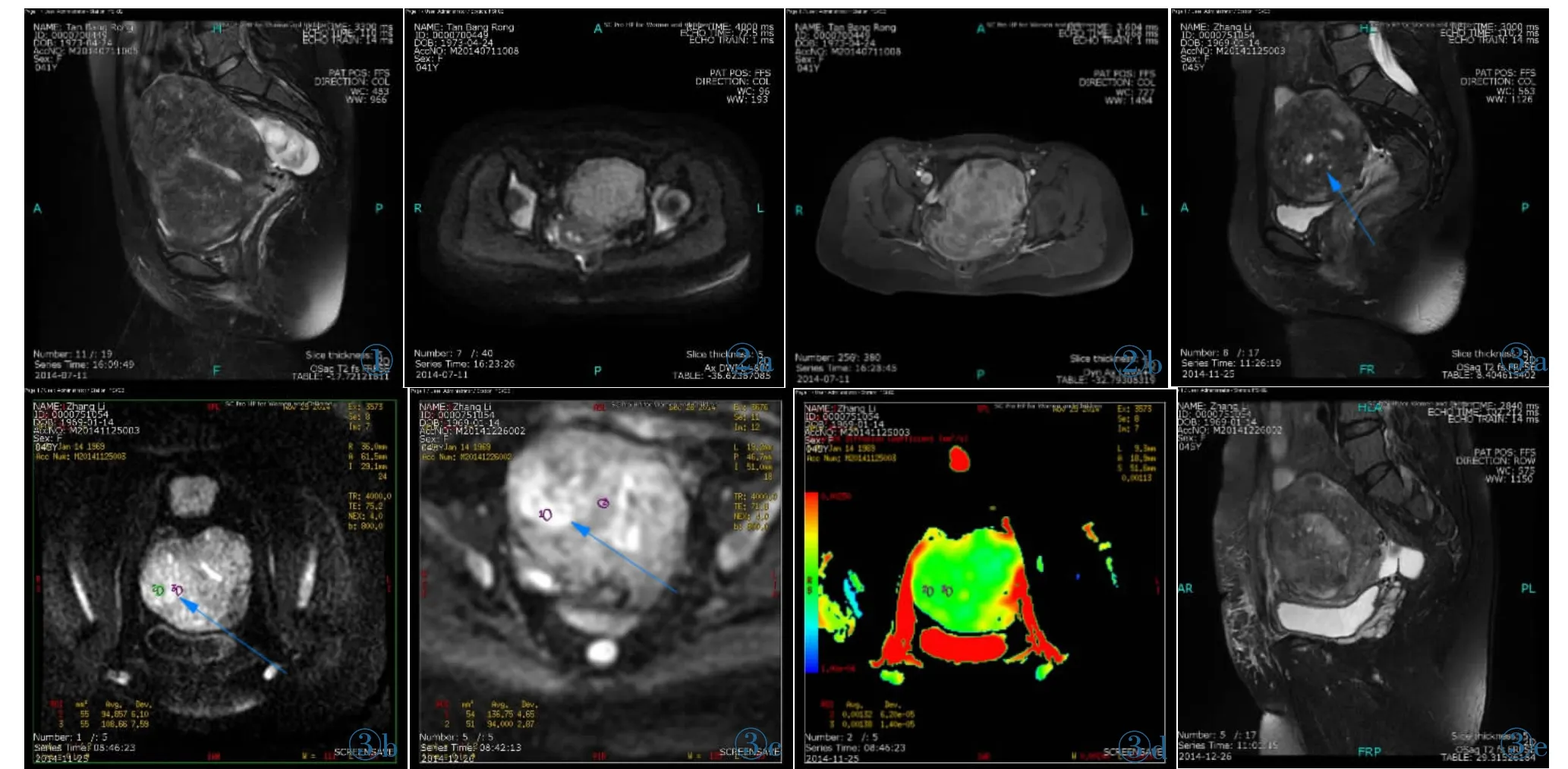

图1 弥漫性腺肌症。 图2a 同一病例DWI。 图2b 同一病例增强检查。 图3a 蓝箭所示局限性腺肌瘤。 图3b 蓝箭所示术前病灶DWI稍高信号。 图3c 蓝箭所示术后病灶DWI更高信号。 图3d 术前ADC伪彩图。 图3e 术后T2WI图像。 图3f 术后增强检查 (蓝箭示消融灶,红箭示残留区)。 图3g 术后ADC伪彩图。Figure 1. Diffuse uterine adenomyosis. Figure 2a. DWI of the same patient.Figure 2b. Contrast enhanced MRI examination of the same patient. Figure 3a. Blue arrow points focal uterine adenomyosis.Figure 3b. Blue arrow points the high signal lesion in DWI of preoperation.Figure 3c. Blue arrow points the higher signal lesion in DWI of post-operation.Figure 3d.The pseudo color map of ADC of pre-operation.Figure 3e.T2WI image of post-operation.Figure 3f.Contrast enhanced MRI examination of post-operation(blue arrow points ablation part,red arrow points residual part).Figure 3g.The pseudo-color ADC map after operation.
3.3DWI在HIFU早期疗效评价价值
常规磁共振平扫加增强检查在子宫腺肌症诊断中的价值已经得到很多人的认可,但通过T1/T2WI 及T1WI增强序列评判HIFU治疗子宫腺肌病早期疗效却有很大的不足[9],这是因为HIFU治疗后我们需要尽快评价消融灶与残留灶范围,从而判断预后,而早期宫内病灶体积并未明显缩小,同时又由于治疗造成的凝固性坏死使残留区与消融灶难以区分,观察消融灶及残留灶就需要一种新的评判方式。通过本研究结果发现DWI能有效地显示病灶改变情况。术后5 d内消融灶ADC值较术前降低,消融灶内的水分子扩散能力明显降低。其生物学机制可能是HIFU的多种生物学效应,主要是热效应有关,引起病灶内细胞蛋白质变性、细胞膜功能异常等病理改变,导致病灶内出现组织凝固性坏死[8],从而使DWI病灶信号较术前明显增高。HIFU术后残留灶ADC值较术前增高,DWI亦见信号增高,表明区域内有血流灌注[10],这种情况说明残留灶发生的是血管源性水肿,其组织内总体水分增加,从而在DWI上表现为稍高信号区域。因而在DWI图像上更高信号的消融灶与高信号残留灶及相对低信号的肌层在图像上分界较清晰,从整体上可勾画出病灶的范围及改变程度,特别是在局限性腺肌瘤术后改变显示上更为清楚。同时ADC值评价术后腺肌病不同区域也有价值,常规影像通过形态学信号改变确定病灶消融情况,而本研究更能定量地客观评判。这可以从两个方面表现:首先,我们的研究中可见术后5 d内残留区的ADC值比消融灶的高,两者间ADC值差异有统计学意义,因此通过测量ADC值有助于鉴别和检出残留灶。这是因为发生血管源性水肿的残留灶的水含量比凝固性坏死的消融区高,从而使ADC值较高。其次局部ADC值下降越明显越提示该部位病灶消融效果好,从而可以判断不同区域病灶被消融的效果[11]。这是因为HIFU是依靠超声聚焦产生的热效应来使病灶细胞坏死,热能越集中的区域对病灶的损伤越明显,当持续给予的能量不够时,病灶消融效果就不好,也就是局部ADC值较高的区域,反之亦然[12]。
3.4DWI研究的不足
当然DWI在研究中也有一定的不足,因例数较少,我们没有对弥漫性和局灶性病灶作严格的分组统计,造成统计上的偏倚有待于以后进一步研究。
总之,DWI及ADC值可有效评判子宫腺肌病HIFU术后病灶早期改变情况,与常规图像相结合,可对病灶的范围、消融程度作出定量评价,为进一步治疗提供客观依据。
[1]夏恩兰,马宁,于丹,等.囊性子宫腺肌病四例报告及文献复习[J].中华临床医师杂志:电子版,2010,4(9):181-183.
[2]崔杰,许永华.高强度聚焦超声治疗子宫腺肌病临床研究进展[J].介入放射学杂志,2015,24(3):268-271.
[3]陈桂清,邹建中.高强度聚焦超声治疗肌壁厚度不足3 cm的子宫腺肌症的临床分析[J].中国超声医学杂志,2015,31(5):467-470.
[4]王丽萍,翁亚娟,王亚金.高强度聚焦超声在子宫腺肌症治疗中的价值[J].陕西医学杂志,2012,41(10):1318-1319.
[5]汪俊萍,白人驹.子宫腺肌症的MRI诊断与鉴别诊断[J].国外医学临床放射学分册,2007,30(4):276-278.
[6]侯金文,程华,李传福.子宫腺肌症的MRI表现及其病理学对照研究[J].中华放射学杂志,2002,36(1):67-71.
[7]吴莺,高悦,王燕,等.高强度聚焦超声单次整体治疗子宫腺肌症的临床研究[J].中国超声医学杂志,2013,29(10):918-922.
[8]卢瑞沾,张俊成,杨振华,等.DWI监测子宫肌瘤HIFU术后早期疗效的价值 [J].中国中西医结合影像学杂志,2013,11(5):466-468.
[9]Fan TY,Zhang L,Chen W.Feasibility of MRI-guided high intensity focused ultrasound treatment for adenomyosis[J].Eur J Radiol,2012,81(11):3624-3630.
[10]张俊成,杨振华,赵相胜,等.MR扩散成像在子宫肌瘤HIFU术后早期疗效评价中的价值[J].放射学实践,2012,27(12):1356-1360.
[11]朱建国,杨亚芳,刘斐,等.CT灌注成像联合磁共振扩散加权成像诊断急性脑梗死 [J].中国医学影像技术,2011,27(4):710-713.
[12]陈敏,李铁军,陈强,等.高强度聚焦超声消融子宫腺肌症的临床剂量学研究[J].重庆医学,2013,42(20):2369-2371.
The value of DW I in the early-term effectiveness of high-intensity focused ultrasound ablation of adenom yosis
DING Li1,WANG Wei2,KANG Min1,DAI Qian-ling2,WANG Shi-qi1,CHEN Rui1
(1.Department of Radiology,Sichuan Province Hospital for Women and Children,Chengdu 610045,China; 2.Department of Maternal Chengdu Women&Children’s Central Hospital,Chengdu 610091,China)
Objective:To retrospectively analyze the early-term value of diffusion weighted imaging(DWI)features of adenomyosis after high intensity focused ultrasound(HIFU)ablation.Methods:Fifty-five patients(44 cases of focal uterine adenomyosis,11 cases of diffuse uterine adenomyosis)underwent HIFU ablation,DWI and CE-MRI was performed one week before and 5 days after HIFU.The feature of DWI signal and ADC value of the residual part of adenomyosis was analyzed,and then calculated the difference of ADC values among different areas.Results:The residual part of adenomyosis was found in DWI.The signal intensity of the residual part of adenomyosis in DWI sequence increased at 5 days after HIFU ablation.The ADC value of the residual part of adenomyosis was(1.49±0.23)×10-2mm2/s at 5 days after HIFU ablation,was higher than the ADC value((1.36±0.21)×10-2mm2/s)before operation,and the t value of T-test was 3.10,the value of P is 0.003,there was significant difference between before and after surgery.And the ADC value of the focal ablation part of adenomyosis was (1.22±0.24)×10-2mm2/s when was HIFU ablation after 5 days,was lower than the ADC value((1.36±0.21)×10-2mm2/s)before operation.The t value of T-test was 6.02,the value of P is 0.000,the significant difference was found between the ADC value of the residual part and focal ablation part(P<0.005).Conclusion:DWI and ADC value are very useful means for monitoring the early term effectiveness of ablation of adenomyosis after HIFU ablation.
Uterine diseases;Magnetic resonance imaging;Ultrasonic therapy
R711.74;R445.1;R445.2
A
1008-1062(2015)11-0804-04
2015-07-22;
2015-09-02
丁立(1981-),男,重庆人,主治医师。

