替米沙坦减轻DOCA-盐型高血压大鼠氧化应激改善血管内皮功能研究
张黎黎,刘爱东,蒲春华,王 芳,周 鹏,李文章,杨 震△
1.成都医学院第一附属医院 神经内科(成都 610500);2.成都医学院第一附属医院 心血管内科(成都 610500)
高血压是脑卒中的重要危险因素,《中国心血管病报告(2013)》指出,目前我国已有超过2.7亿的高血压患者,脑卒中现患人数约为700万,高血压相关的心脑血管疾病的防治形势相当严峻。盐与高血压的关系基本明确,约有50%的高血压为盐敏感性高血压,提示盐敏感性高血压是高血压中的一个重要类型[1]。在遗传与环境因素的交互作用下,高血压对心、脑、肾等靶器官的损害涉及多种机制,氧化应激是关键的共同环节[2]。在高盐环境下,机体氧化应激水平显著升高,长期的高盐暴露,即使血压未明显升高亦可出现显著的血管内皮损害,血管内皮的损伤则是一切心脑血管疾病的基础[3]。因此,理想的降压药物不应只针对血压,还应针对氧化应激及其所介导的血管内皮损害。替米沙坦是血管紧张素Ⅱ受体拮抗剂,近年研究[4-5]发现其不仅具有显著的降压作用,还可通过激活过氧化物酶增殖物激活受体γ(PPARγ),显著改善血管内皮功能,但其对高盐介导的血压和氧化应激水平的升高及血管内皮功能障碍的影响未见有直接的报道。本研究通过复制DOCA-盐型高血压大鼠模型,观察替米沙坦对该模型大鼠血压、氧化应激及血管内皮功能的影响,以期为替米沙坦防治盐敏感性高血压及相关的血管内皮功能障碍提供依据。
1 材料与方法
1.1 实验动物分组及干预方式
健康雄性SD大鼠24只(四川省成都达硕实验动物有限公司提供),体质量(200±8)g,分笼饲养,自由进水、进食,喂食1次/d,隔日换水。动物房为自然昼夜采光,室温22~26℃,湿度维持在50%左右。在造模前先进行适应性饲养1周。
大鼠分假手术组、DOCA-模型组、DOCA-替米沙坦组、DOCA-氨氯地平组,每组各6只。DOCA-替米沙坦组在术后经胃管灌服替米沙坦(10mg/kg)生理盐水混悬液,1次/d;DOCA-氨氯地平组术后经胃管灌服氨氯地平(5mg/kg)生理盐水混悬液,1次/d;假手术组与DOCA-模型组均给予灌服等体积的生理盐水,总干预时间为1月。
1.2 动物模型的建立[6]
[6]方法:大鼠以戊巴比妥钠麻醉后,取俯卧位,统一取脊柱右侧肾区进行备皮,常规消毒后作一长约1~1.5cm的切口,暴露肾脏,紧贴肾门处以手术线结扎后切除肾脏,清洗后逐层缝合,以青霉素肌注预防感染。术后,除假手术组外,其余各组大鼠每周给予皮下注射醋酸去氧皮质酮(DOCA)[120mg/kg,溶于注射用油/乙醇(5/1,v/v)中],并给予高盐(1%NaCl,0.2%KCl)饮水,共1月;假手术组则皮下注射等体积的溶剂,每周1次。
1.3 观察指标及方法
1.3.1 鼠尾无创动脉血压测定[5]采用北京软隆公司生产的鼠尾血压计测定,参考既往方法,每只动物测3次,取平均值,造模前测定基础血压水平,以后每周测量1次。
1.3.2 血管功能的测定 参照文献[5]方法:采用丹麦DMT公司生产的微血管张力测定仪(DMT 620M)测定。实验结束后大鼠以戊巴比妥钠腹腔注射麻醉后先取血液标本,后迅速打开腹腔,取肠袢,固定并浸泡于 Kreb's液中,并通以 CO2/O2(5%/95%)混合气体,于解剖显微镜下迅速分离2~3级肠系膜动脉,截取长约2~3mM的血管条,以40 μM钢丝穿过后悬挂于浴槽中,继续通以CO2/O2混合气体,稳定约30min后调初张力(2mN),稳定约30min后以KCl预激3次,以苯肾上腺素(10-5mol/L)刺激,分别进行乙酰胆碱(10-9~10-5mol/L)诱导的血管内皮依赖性舒张功能和硝酸甘油诱导的非内皮依赖性舒张功能测定(10-9~10-5mol/L)。利用prism 3.0软件描绘拟合曲线,计算最大舒张反应(Emax,%)。
1.3.3 血浆SOD、MDA的测定 取非抗凝血,于3 000r/min低速离心机离心10min后取血清。采用硫代巴比妥酸(TBA)缩合法测定血清中MDA含量;采用黄嘌呤氧化法测定血清中SOD活性,具体操作按试剂盒(购于南京建成生物工程研究所)说明书进行。
1.4 统计学方法
采用SPSS 15.0统计软件进行数据录入及统计分析,以prism 3.0制图。计量资料以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 替米沙坦对DOCA-盐型大鼠鼠尾收缩压的影响
造模前各组大鼠的鼠尾收缩压(SBP)分别为:假手术组(128±11)mm Hg,DOCA-模型组(131±10)mm Hg,DOCA-替米沙坦组(133±12)mm Hg,DOCA-氨氯地平组(129±11)mm Hg,各组比较差异无统计学意义(P>0.05)。造模后第1周开始,DOCA-模型组血压显著高于假手术组,经替米沙坦10mg/(kg·d)或氨氯地平5mg/(kg·d)干预4周后,各组大鼠鼠尾收缩压分别为:DOCA-替米沙坦组(162±13)mm Hg,DOCA-氨氯地平组(157±12)mm Hg,均显著低于DOCA-模型组(190±13)mm Hg,差异有统计学意义(P<0.05)。DOCA-替米沙坦组与DOCA-氨氯地平组比较,差异无统计学意义(P>0.05)(图1)。

图1 替米沙坦对DOCA-盐型大鼠鼠尾血压的影响
2.2 替米沙坦对DOCA-盐型大鼠氧化应激水平的影响
与假手术组比较,DOCA-模型组大鼠血清SOD水平显著下降,血清MDA水平显著上升,差异均有统计学意义(P<0.05);替米沙坦干预可显著升高大鼠SOD水平(156.49±11.02)U/mL,降低 MDA水平(8.34±0.92)nmol/L,与 DOCA-模型组大鼠比较,SOD(120.46±9.24)U/mL,MDA(612.25±1.35)nmol/L,差异均有统计学意义(P<0.05);氨氯地平干预对血清SOD和MDA水平影响比较,差异均无统计学意义,与DOCA-模型组比较,差异均无统计学意义(P>0.05)(图2)。
2.3 替米沙坦对DOCA-盐型大鼠血管功能的影响
DOCA-盐型大鼠乙酰胆碱诱导的血管内皮依赖性舒张功能显著下降[Emax(%),假手术组(86.63±6.07),DOCA-模型组(63.75±6.51)];替米沙坦干预可显著改善血管内皮依赖性舒张功能[Emax(%),(76.70±4.41)],与 DOCA-模型组比较,差异有统计学意义(P<0.05);DOCA-替米沙坦组与DOCA-模型组内皮依赖性舒张功能的差异在预孵一氧化氮合酶的抑制剂L-NAME作用后消失;DOCA-氨 氯 地 平 组 [Emax(%),(68.19±4.96)]有改善血管内皮依赖性舒张功能的趋势,但经统计学比较,差异无统计学意义(P>0.05)。替米沙坦及氨氯地平对硝酸甘油诱导的血管非内皮依赖性舒张功能影响比较,差异均无统计学意义,与DOCA-模型组及假手术组比较,差异均无统计学意义(P>0.05)(图3、图4)。
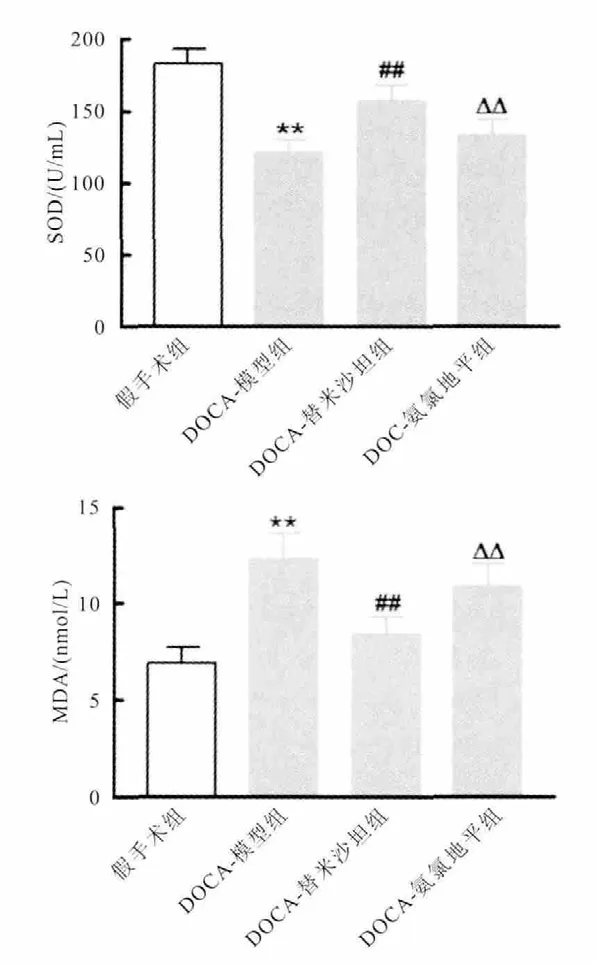
图2 替米沙坦对DOCA-盐型大鼠血清SOD和MDA水平的影响
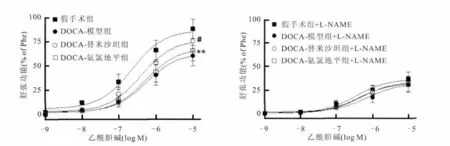
图3 替米沙坦对DOCA-盐型大鼠乙酰胆碱诱导的血管内皮依赖性舒张功能的影响
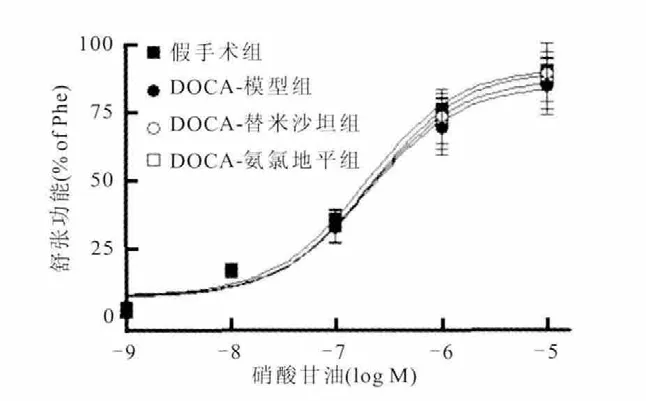
图4 替米沙坦对DOCA-盐型大鼠硝酸甘油诱导的血管内皮依赖性舒张功能的影响
3 讨论
流行病学和基础实验研究均已证实了盐与高血压及相关靶器官损害的关系。DASH(Dietary Approaches to Stop Hypertension)饮食研究[7]表明,每日食盐摄入量在6g以下可减少收缩压2~8 mm Hg,有效降低了卒中的发生率。我国流行病学研究也表明,喜高盐饮食的东北地区高血压与脑卒中的发生率显著高于清淡饮食的华南地区。但另一方面,个体对盐的敏感性存在显著差异,高盐导致血压升高及靶器官损害涉及多种机制[1]。目前普遍认为,氧化应激与众多心血管疾病的发生、发展存在密切联系[8]。同样在盐敏感性高血压中,盐的敏感性与机体氧化应激反应性增强,体内氧化-抗氧化系统失衡导致活性氧簇(Reactive Oxygen Species,ROS)的产生增加有密切的联系[9]。ROS可快速灭活具有保护血管作用的NO,而且ROS与NO结合后可生成具有更强氧化活性的硝基化产物,这些均是导致血管内皮结构与功能损害的重要物质[10]。众所周知,内皮的损害是一切心血管疾病发生的起始环节,它将导致血压升高和靶器官损害。
DOCA-盐型高血压大鼠是盐皮质高血压合并肾功能损害的模型,具有水钠潴留、氧化应激、炎症水平显著升高和靶器官纤维化等特征。与既往的研究[11]一致,本实验复制的DOCA-盐型高血压大鼠模型具有显著的血压升高、氧化应激及血管功能障碍的特征,提示造模成功。
尽管盐敏感性高血压及相关靶器官损害的研究已进入基因、分子水平,但目前对于盐敏感性高血压的确切机制研究、临床患者盐敏感性的判断及针对盐敏感性高血压的干预措施仍不尽人意。近年关于干预心血管剩留风险的观念提醒我们,降压治疗固然功不可没,但仍要关注降压以外的其他心血管保护途径。多项临床研究及大型荟萃分析表明,ARB类药物(替米沙坦)与CCB类药物(氨氯地平)比较,其降压作用相对较弱,但却具有较好改善心脏重构、代谢等降压以外作用的效果。替米沙坦是ARB类药物的一个典型,该药具有降压以外的改善代谢的作用。基础研究[12-14]证实,替米沙坦不但作用于RAAS系统,阻断AT1受体,还可直接激活PPARγ或PPARβ,具有改善糖、脂代谢和血管内皮功能的作用。既往研究[5]表明,替米沙坦通过激活PPARγ可显著改善老龄鼠脑血管内皮依赖性舒张功能;另一项研究[15]表明,PPARγ激动剂通过减轻氧化应激水平,可显著改善老龄鼠脑血管内皮依赖性舒张功能。MDA是自由基引起的脂质过氧化过程中生成的一种醛类物质,能够促进核酸、蛋白质和磷脂的交联,从而破坏生物大分子的功能。SOD可清除过氧化氢和超氧阴离子,从而保护细胞不受毒性氧自由基的损伤,故本研究采用分析大鼠血清中的SOD和MDA水平来评估大鼠体内的氧化应激水平。本研究发现,替米沙坦可显著降低DOCA-盐型大鼠血清中MDA的水平,升高SOD的水平,上述作用均显著优于氨氯地平,为此,笔者推测,替米沙坦对DOCA-盐型高血压大鼠血管内皮功能的改善作用可能与改善其氧化应激水平有关。
但替米沙坦通过何种途径达到改善DOCA-盐型大鼠氧化应激的作用机制尚不明确。有研究[16]分别利用平滑肌PPARγ敲除和血管内皮PPARγ敲除的小鼠观察PPARγ激动剂对DOCA-盐型模型血压和血管功能的影响,结果表明,敲除血管内皮的PPARγ显著减弱了PPARγ激动剂的降压作用。另有研究[17]证实,替米沙坦以PPARγ依赖的方式,显著降低DOCA-盐型大鼠NADPH氧化酶的活性。课题组前期研究[15]证实,激活老龄鼠血管内皮上的PPARγ,通过UCP2依赖的方式,可显著减少血管内皮细胞ROS的水平,增加NO水平,从而改善老龄相关的血管内皮功能障碍。上述研究提示,替米沙坦可能通过激活PPARγ,调控体内氧化应激水平,减少ROS的生成,从而改善血管内皮功能,但确切的机制有待进一步深入研究。
参考文献
[1]蒲春华,王沛坚,周鹏.PPARs与盐敏感性高血压及相关靶器官损害[J].成都医学院学报,2014,9(6):750-753.
[2]蒋毅弘,钟久昌.血管紧张素转换酶2、氧化应激与高血压[J].中华高血压杂志,2011,19(6):518-520.
[3]李伟,周乐,刘新辉,等.盐敏感性高血压发病机制再认识[J].中华高血压杂志,2012,20(10):941-945.
[4]Li H,Lu W,Cai W,et al.Telmisartan Attenuates Monocrotaline-induced Pulmonary Artery Endothelial Dysfunction through a PPARγ-Dependent PI3K/Akt/eNOS Pathway[J].Pulmonary Pharmacology and Therapeutics,2014,28(1):17-24.
[5]张黎黎,杨震,刘爱东,等.替米沙坦激活PPARγ改善衰老大鼠脑血管内皮依赖性舒张功能[J].成都医学院学报,2014,9(4):399-403.
[6]陈启稚,陈静,吴永杰,等.香荚兰乙酮对DOCA盐高血压大鼠血压及大动脉结构的影响[J].中国新药与临床杂志,2011,30(9):684-688.
[7]Sacks FM,Svetkey LP,Vollmer WM,et al.Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension(DASH)diet.DASHSodium Collaborative Research Group[J].N Engl J Med,2001,344(1):3-10.
[8]Prasad K,Dhar I.Oxidative stress as a mechanism of added sugar-induced cardiovascular disease[J].Int J Angiol,2014,23(4):217-226.
[9]Meng S,Cason GW,Gannon AW,et al.Oxidative stress in Dahl salt-sensitive hypertension [J].Hypertension,2003,41(6):1346-1352.
[10]赵宇,王沛坚,蒲云飞,等.膳食辣椒素对醋酸脱氧皮质酮-盐型高血压大鼠肾脏氧化应激损害的保护作用[J].中华高血压杂志,2014,22(2):136-141.
[11]Iyer A,Chan V,Brown L.The DOCA-Salt Hypertensive Rat as a Model of Cardiovascular Oxidative and Inflammatory Stress[J].Curr Cardiol Rev,2011,6(4):291-297.
[12]Rios NB,Esparragon FR,Rodriguez Perez JC.Telmisartaninduced eNOS gene expression is partially independent of its PPAR-gamma agonist property[J].Clin Invest Med,2012,35(2):55-64.
[13]Maejima Y,Okada H,Haraguchi G,et al.Telmisartan,a unique ARB,improves left ventricular remodeling of infarcted heart by activating PPAR gamma[J].Lab Invest,2011,91(6):932-944.
[14]Yamagishi S,Takeuchi M.Telmisartan is a promising cardiometabolic sartan due to its unique PPAR-gammainducing property[J].Med Hypotheses,2005,64(3):476-478.
[15]Wang P,Li B,Cai G,et al.Activation of PPAR-gamma by Pioglitazone Attenuates Oxidative Stress in Aging Rat Cerebral Arteries Through Upregulating UCP2 [J].J Cardiovasc Pharmacol,2014,64(6):497-506.
[16]Hernanz R,Martin A,Perez-Giron JV,et al.Pioglitazone treatment increases COX-2-derived prostacyclin production and reduces oxidative stress in hypertensive rats:role in vascular function [J].Br J Pharmacol,2012,166(4):1303-1319.
[17]Toba H,Wang J,Ohigashi M,et al.Telmisartan protects against vascular dysfunction with peroxisome proliferatoractivated receptor-γ activation in hypertensive 5/6 nephrectomized rats[J].Pharmacol,2013,92(5-6):265-275.

