基于锁核苷酸(LNA)增敏的植烟土壤中烟草黑胫病菌定量PCR检测方法
刘 芳,宋纪真,范艺宽,牟文君,奚家勤*,胡利伟*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
2.中国烟草总公司河南省公司,郑州市政七街7号 450008
基于锁核苷酸(LNA)增敏的植烟土壤中烟草黑胫病菌定量PCR检测方法
刘 芳1,宋纪真1,范艺宽2,牟文君1,奚家勤*1,胡利伟*1
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
2.中国烟草总公司河南省公司,郑州市政七街7号 450008
为了快速有效地检测植烟土壤中的烟草黑胫病菌的定殖数量,以一种锁核苷酸(LNA)引物为基础,进行了植烟土壤中烟草黑胫病菌数量的定量PCR检测方法研究。结果表明:①与普通DNA引物相比,LNA引物提高了PCR反应的退火温度,减少了引物二聚体和非特异性产物的形成,提高了烟草黑胫病菌分子检测的灵敏度与特异性;②定量分析检测出14个烟草-大蒜轮作土样中烟草黑胫病菌的定殖数量为2.76×103~5.20×104个/g,且在4~5 h内完成检测,具有较高的灵敏度和检测效率。
植烟土壤;烟草黑胫病菌;锁核苷酸(LNA);荧光定量PCR;分子检测
烟草黑胫病是一种毁灭性的土传真菌病害,由寄生疫霉烟草变种(Phytophthora parasitic var.nicotianae)引起,在我国许多产烟区尤其是北方烟区,如安徽、山东和河南等省发病较重,给烟叶生产造成严重损失[1-3]。由于烟草黑胫病的发病率高、分布范围广、造成的经济损失大,因此对其进行快速有效诊断和检测一直是病害防治工作的重点和前提[4]。植烟土壤中的黑胫病菌定殖量直接影响烟区的烟草黑胫病发病率,所以检测植烟土壤中的黑胫病菌定殖量对预测烟草黑胫病的发生具有重要意义。由于土壤微生态环境复杂,杂菌种类繁多,给检测工作带来了很大的困难,因此需要高灵敏度和高特异性的检测方法对土壤中烟草黑胫病菌的定殖量进行有效检测。近年来,PCR技术尤其是荧光定量PCR技术为快速、准确和灵敏地定量检测微生物数量提供了有效手段[5]。谢勇等[6]合成了一对17 bp的特异性寡聚核苷酸引物,采用普通PCR可对烟草黑胫病菌进行快速检测;Ippolito等[7]和Blaya等[8]曾先后采用Real-time PCR对土壤中的烟草黑胫病菌进行了定性或定量分析,并取得了一定效果。随着分子检测方法的改进,相应PCR引物的设计也引起了人们的重视。一种被命名为锁核苷酸(Locked Nucleic Acid,LNA)[9]的新型寡核苷酸衍生物应运而生,其结构中的β-D-呋喃核糖的2’-O、4’-C位点可通过缩水形成环形结构,如氧亚甲基桥、硫亚甲基桥或胺亚甲基桥等,这种结构能够锁定呋喃糖的N构型,一定程度上降低了核糖结构的柔韧性,增加了核酸链之间杂交的稳定性[9-12]。国外有报道表明,LNA修饰后能够显著增强寡核苷酸与DNA模板的结合能力,与普通DNA引物相比,LNA引物能够提高PCR的特异性和灵敏性[13-14];并且在相对更宽泛的PCR退火温度范围内,LNA引物仍可以保持很高的扩增效率[15]。这种LNA引物已经应用于许多分子检测体系中,但在烟草黑胫病菌的检测和诊断方面则未见报道。为此,通过对比烟草黑胫病菌特异性普通DNA引物及碱基修饰后的LNA引物的反应条件,探讨LNA引物对PCR扩增的影响,并采用荧光定量PCR检测植烟土样中烟草黑胫病菌的定殖数量,旨在建立一种锁核苷酸(LNA)增敏的植烟土壤中烟草黑胫病菌定量PCR检测方法。
1 材料与方法
1.1 试验材料与试剂
供试感病烟株采集于洛阳烟区;供试土样采集于驻马店烟区的烟草-大蒜轮作的田块。
燕麦培养基[16]、含氨苄的LB培养基均在实验室内现用现配;土壤病原菌DNA提取试剂盒购自美国MOBIO公司,PCR试剂购自德国QIAGEN公司;pMD18-T载体、PCR产物纯化试剂盒、DH5α感受态大肠杆菌、质粒小量提取试剂盒、SYBR Green I均购自日本TaKaRa公司;引物合成和测序由美国Invitrogen公司和生工生物工程(上海)股份有限公司完成。
1.2 试验设计
1.2.1 病原菌的分离及培养
将感黑胫病烟株的茎部冲洗干净,用灭菌刀将茎部剖开,从病健交界处取大约3 mm×3 mm的碟片状髓部组织,依次通过NaClO、75%乙醇进行表面消毒,经无菌水漂洗2~3次。将漂洗过的组织用无菌滤纸吸干后接种到燕麦培养基上,放入恒温箱中28℃下对菌落进行纯化培养,并将纯化后的菌株保藏到4℃冰箱中。
1.2.2 菌株和土壤病原菌DNA的提取
采用POWERSOIL DNA提取试剂盒进行土壤黑胫病菌DNA的提取,具体操作参照试剂盒说明书进行。采用CTAB(十三烷基三乙基溴化铵)法提取烟草黑胫病菌菌丝DNA[17]。
1.2.3 引物的设计与筛选
通过查阅文献[18]和相关生物信息学分析[19],获得烟草黑胫病菌独特的5.8S核糖体RNA及其相邻的ITS区域,采用Primer Express 2软件设计引物,见表1。运用常规PCR进行引物特异性检测,总反应体系 25 μL,包括 10×PCR buffer 2.5 μL ;1 U Taq酶、0.2 mmol/L dNTP 混合液;0.2 μmol/L引物;25 ng DNA模板,最后加ddH2O补至25 μL。阴性对照为ddH2O。PCR反应条件:95℃预变性3 min;94 ℃变性 30 s,55 ℃退火30 s,72 ℃延伸1 min,40个循环;72℃延伸10 min。PCR产物采用1%琼脂糖凝胶电泳检测。
LNA引物的设计:引物的LNA修饰对PCR反应的影响主要取决于LNA修饰的位置、数量和引物本身的序列长度,其中以在引物序列中间位置相距大约4~6个碱基的两个碱基位点进行修饰的效果较好[20]。综合考虑引物的设计原则及其特异性,对引物Pn3R/Pn3F两个位置的碱基进行修饰。正向引物:5'-TGAACGCATATTGCACTTCC-3',反向引物:5'-GACAAACCAGTCGCCAATTT-3'(下划线字母为LNA碱基)。

表1 烟草黑胫病检测的相关引物
1.2.4 LNA引物PCR反应体系和条件优化
总反应体系 25 μL:10×buffer 2.5 μL;1 U Taq酶、0.2 mmol/L dNTP混合液;0.2 μmol/L的LNA引物;25 ng黑胫病菌DNA模板,加ddH2O补至25 μL,阴性对照为ddH2O。
反应条件:95℃预变性 3 min;94℃变性 30 s,分别以55.0、55.8、57.4、59.7、62.6、65.0和66.3 ℃的退火温度退火30 s,72℃延伸30 s,40个循环;72℃延伸10 min。PCR产物采用1%琼脂糖凝胶电泳检测。
1.2.5 标准曲线的建立及土壤样品中烟草黑胫病菌定殖数量的检测
烟草黑胫病菌5.8S核糖体RNA及其相邻的ITS区域克隆:使用PCR产物纯化试剂盒对1.2.3节中采用Pn3R/Pn3F进行PCR扩增获得的产物进行纯化,具体操作按照试剂盒说明书进行。然后将4 μL纯化产物与1 μL pMD18-T载体混合,加入5 μL连接溶液I(日本TaKaRa公司),连接体系为10 μL,16 ℃保温12 h。取连接产物10μL与100 μL DH5α感受态大肠杆菌菌液混合均匀,冰浴25 min,42℃热激45 s。接着将菌液涂布到含氨苄青霉素、IPTG和X-gal的 LB平板上,37℃过夜培养,挑取白斑进行PCR鉴定,然后挑取阳性克隆置于含有氨苄青霉素的LB液体培养基中,并于37℃振荡培养箱中200 r/min振荡16 h后,取1.5 mL菌液进行质粒提取。
标准样品的制备:按照试剂盒说明书,使用质粒小量提取试剂盒从过夜培养的菌液中提取质粒,采用紫外分光光度计法测定浓度,然后进行拷贝数换算。将质粒溶液用ddH2O稀释,分别稀释成1×102~1×106个/μL 5个梯度作为模板(稀释时用移液枪吹打15次,振荡10 s,保证溶液充分混匀)。
同时对提取的14个土壤黑胫病菌DNA和不同浓度的质粒标准品一起进行荧光定量PCR反应。荧光定量PCR反应于瑞士罗氏公司的LightCycler®480 Instrument II上进行。荧光定量PCR 反应总体系为 25 μL:2×Taq PCR MasterMix 12.5 μL,引物各0.3 μmol/L,模板1 μL,加ddH2O补到25 μL。每个样品重复3次。PCR反应条件为:95℃预变性3 min;95℃变性10 s,60℃退火15 s,72℃延伸15 s,50个循环;72℃延伸10 min。
2 结果与分析
2.1 引物设计与筛选
对提取的4个不同的土壤黑胫病菌DNA进行扩增反应的结果(图1)表明:3对引物均可以扩增出长度大小不同的特异性条带,但是灵敏度存在差异,引物Pn3R/Pn3F的灵敏度最高,Pn2R/Pn2F次之,Pn1R/Pn1F的灵敏度相对较弱。对扩增效果最好的一对引物Pn3R/Pn3F的PCR产物纯化后进行测序,测序结果见图2。通过NCBI数据库进行BLAST比对,结果表明Pn3R/Pn3F的PCR扩增产物来自黑胫病菌,扩增的烟草黑胫病菌特异性目的条带大小为251 bp。
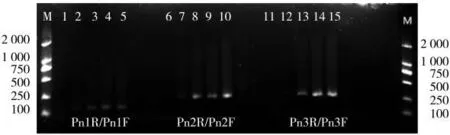
图1 3对引物对黑胫病菌DNA的PCR扩增产物电泳图
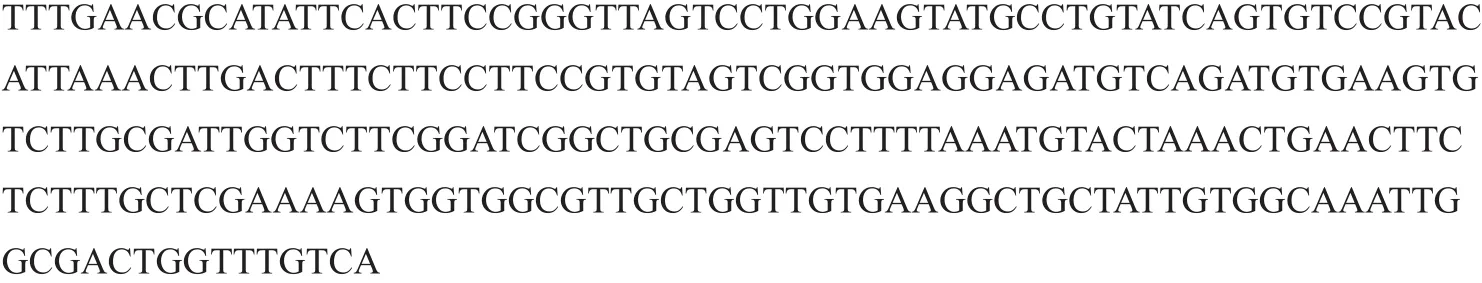
图2 引物Pn3R/Pn3F的PCR扩增产物测序序列
2.2 LNA引物的PCR反应体系和条件的优化
在相同的PCR反应体系及退火温度下对黑胫病菌菌丝DNA进行扩增,并将DNA引物与LNA引物的扩增结果进行比对,结果见图3。从电泳结果可以看出,在55~57℃的退火温度条件下LNA引物的扩增效率稍高,但不显著。当退火温度提高到60℃以上时,普通DNA引物的扩增效率急剧下降且不稳定,甚至在66℃的退火温度下没有特异性条带产生。而在相同的PCR反应条件下,LNA引物的适宜退火温度范围更广,在55~66℃均可以扩增出目的条带,而普通DNA引物的适宜退火温度范围相对较窄。较高的退火温度能够减少引物二聚体和非特异性产物的形成,与DNA引物相比,LNA引物不仅提高了烟草黑胫病菌分子检测的灵敏度,还提高了检测的特异性。
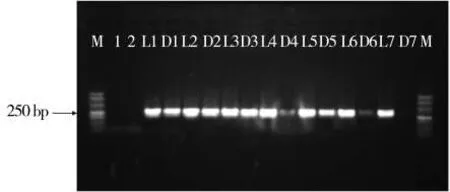
图3 不同退火温度下LNA引物与DNA引物的PCR扩增产物的电泳图
2.3 标准曲线的建立
将提取的含有目的片段的原始质粒悬液的浓度单位换算成个数单位,进行稀释后得到1.0×102~1.0×106个/μL的标准质粒浓度梯度,并以其为模板进行实时荧光定量PCR反应,利用质粒的浓度对数和对应的循环阈值(Ct)生成扩增反应标准曲线和直线回归方程,扩增结果见图4。图4A表明烟草黑胫病菌DNA的10倍稀释液均有明显的扩增产物生成;图4B的熔解曲线只在83~84℃之间出现了一个峰值,验证了本试验中设计的LNA引物具有高度特异性;图4C为本试验中建立的标准曲线,标准曲线的线性方程Y=-3.675 0X+40.876,R2=0.999 6,相关性较好,表明所建立的标准曲线具有可靠性和合理性,反应效率为1.831,可满足定量PCR分析的要求。这些数据表明试验中建立的标准曲线适用于植烟土壤中烟草黑胫病菌定殖数量的分析。
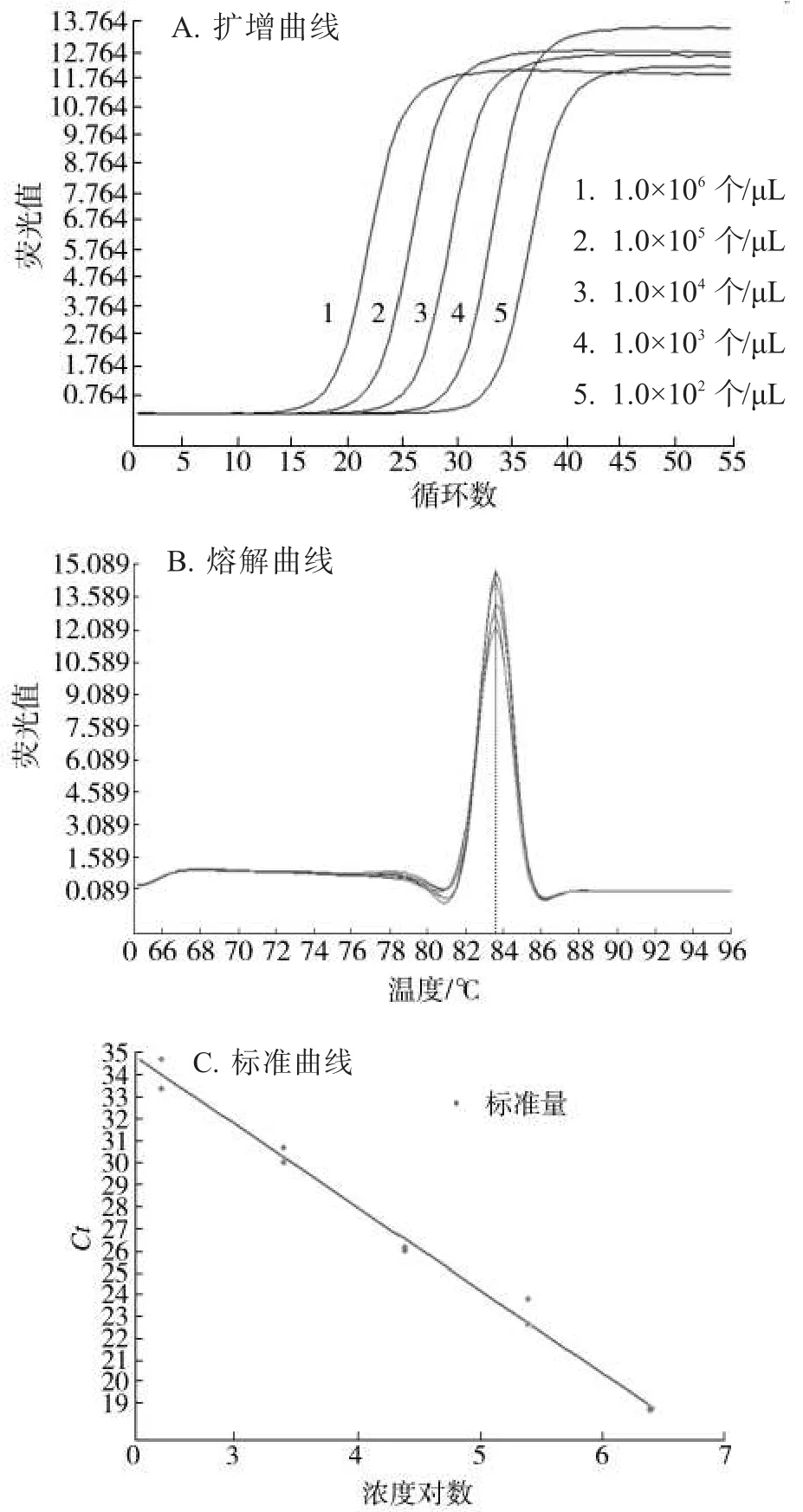
图4 不同浓度梯度的标准质粒悬液的荧光定量PCR扩增结果
2.4 土壤DNA的荧光定量PCR反应
将提取的土壤病原菌DNA同时与不同浓度梯度的质粒悬液同时进行荧光定量PCR分析,待测土样的黑胫病菌定殖数量可以根据其所测得的Ct值从直线回归方程中计算得到。扩增结果(图5)表明:图5A中样本的荧光强度随着PCR循环次数的增加而增加,可以看出所有的土样DNA均有明显的扩增产物生成,不同的土样中黑胫病菌的定殖量存在差异;图5B表明该引物对提取的土壤DNA扩增反应的特异性高,证明了扩增结果的重复性和可靠性。本试验中采用试剂盒对0.25 g土壤进行病原菌DNA提取,获得100 μL DNA溶液,取1 μL进行定量PCR反应,将得到的Ct值代入标准曲线,得到1μL模板中烟草黑胫病菌的数量,计算得出采集的供试土样1g土壤中的烟草黑胫病菌的定殖数量为2.76×103~5.20×104个,见表2。
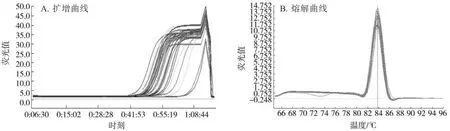
图5 14个植烟土壤黑胫病菌DNA样品的荧光定量PCR扩增结果
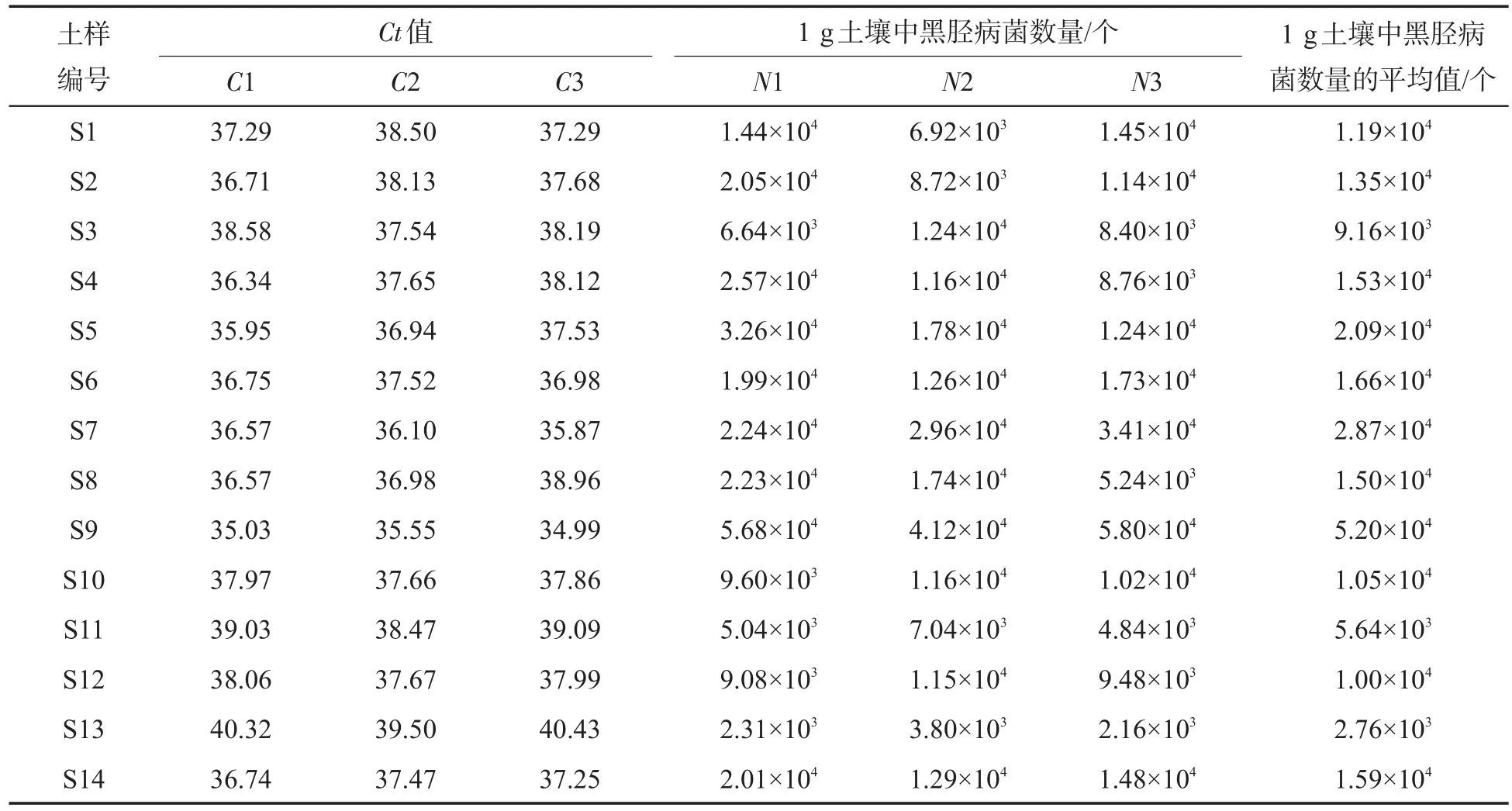
表2 供试土壤中烟草黑胫病菌的定殖数量
3 结论与讨论
将LNA引物运用于烟草黑胫病菌数量的定量PCR检测中,建立了一种LNA增敏的检测植烟土壤中黑胫病菌数量的定量PCR检测方法。该方法以烟草黑胫病菌(Phytophthora parasitica var.nicotianae)中的5.8S核糖体RNA及其相邻的ITS区域片段设计多对DNA引物,选择扩增效率较好的一对引物(Pn3R/Pn3F)对其碱基修饰得到LNA引物,提高了引物的特异性和灵敏度。本试验中的供试土壤为烟草-大蒜轮作地块的土壤,利用设计的LNA引物对14个植烟土样进行荧光定量PCR反应,可以检测到土壤中黑胫病菌的定殖数量,证明在复杂的土壤环境中也可以有效地进行检测,成功构建了一种基于LNA增敏的植烟土壤中黑胫病菌数量的定量PCR检测方法。
该方法适用于复杂土壤中烟草黑胫病菌定殖数量的检测,但本试验中所选择的材料仅来自河南省部分烟区,试验材料尚不充分,而且LNA增敏的荧光定量PCR方法目前只针对植烟土壤中黑胫病菌定殖数量的检测进行了试验。从理论上分析,该方法同样适用于烟草植株、病株残体中黑胫病菌定殖数量的检测,但尚有待进一步试验验证,另外在扩大试验材料范围如供试样品的采集地和病原菌的寄主范围方面也有待进一步研究。
[1] Hickman C J.Presidential address:Phytophthora—plant destroyer[J].Transactions of the British Mycological Society,1958,41(1):2-13.
[2] 马国胜,陈娟.烟草黑胫病研究进展[J].烟草科技,2001(9):44-48.
[3] 王静,孔凡玉.烟草黑胫病综合防治技术[J].烟草科技,2002(8):45-47.
[4] 赵振山.中国烟叶生产实用技术指南[G].中国烟叶生产购销公司,2005.
[5] Hagn A,Wallisch S,Radl V,et al.A new cultivation independent approach to detect and monitor common Trichoderma species in soil[J]. Journal of Microbiological Methods,2007,69(1):86-92.
[6] 谢勇,王云月,陈建斌,等.烟草黑胫病菌分子检测[J].云南农业大学学报,2000,15(2):176.
[7] Ippolito A,Schena L,Nigro F,et al.Real-time detection of Phytophthora nicotianae and P.citrophthorain citrus roots and soil[J].European Journal of Plant Pathology,2004,110(8):833-843.
[8] Blaya J,Lacasa C,Lacasa A,et al.Characterization of Phytophthora nicotianae isolates in southeast Spain and their detection and quantification through a real-time TaqMan PCR[J].Journal of the Science of Food and Agriculture,2015,95(6):1243-1251.
[9] Koshkin A A,Nielsen P,Meldgaard M,et al.LNA(locked nucleic acid):an RNA mimic forming exceedingly stable LNA:LNA duplexes[J].Journal of the American Chemical Society,1998,120(50):13252-13253.
[10] Nielsen C B,Singh S K,Wengel J,et al.The solution structure of a locked nucleic acid(LNA)hybridized to DNA[J]. Journal of Biomolecular Structure and Dynamics,1999,17(2):175-191.
[11]Braasch D A,Corey D R.Locked nucleic acid(LNA):fine-tuning therecognition ofDNA and RNA[J].Chemistry&Biology,2001,8(1):1-7.
[12]Sørensen M D, Kværnø L, Bryld T, et al.α-L-ribo-configured locked nucleic acid(α-L-LNA):synthesis and properties[J].Journal of the American Chemical Society,2002,124(10):2164-2176.
[13]Latorra D,Campbell K,Wolter A,et al.Enhanced allele-specific PCR discrimination in SNP genotyping using 3'locked nucleic acid(LNA)primers[J].Human Mutation,2003,22(1):79-85.
[14] Latorra D,Hopkins D,Campbell K,et al.Multiplex allele-specific PCR with optimized locked nucleic acid primers[J].Biotechniques,2003,34(6):1150-1152.
[15]Crinelli R,Bianchi M,Gentilini L,et al.Design and characterization of decoy oligonucleotides containing locked nucleic acids[J].Nucleic Acids Research,2002,30(11):2435-2443.
[16]李锡坤.湖北省烟草黑胫病病原生理分化研究[D].北京:中国农业科学院,2011.
[17]吴发红,黄东益,黄小龙,等.几种真菌 DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[18]刘冰,褚小静,焦娇,等.皖南烟田三种土传病原物分子检测[J].中国烟草科学,2013,34(5):100-103.
[19]胡德华,张洁,方平.生物信息学数据库调查分析及其利用研究[J].生物信息学,2005,3(1):22-25.
[20] Latorra D,Arar K,Hurley J M.Design considerations and effects of LNA in PCR primers[J].Molecular and Cellular Probes,2003,17(5):253-259.
A Quantitative PCR Method for Detecting Phytophthora parasitica var.nicotianae in Tobacco Planting Soil Based on LNA Sensitization
LIU Fang1,SONG Jizhen1,FAN Yikuan2,MOU Wenjun1,XI Jiaqin*1,and HU Liwei*1
1.Zhengzhou Tobacco Research Institute of CNTC,Zhengzhou 450001,China
2.Henan Province Company of CNTC,Zhengzhou 450008,China
In order to efficiently detect the colonization of Phytophthora parasitica var.nicotianae in tobacco planting soil,a quantitative PCR method was researched based on locked nucleic acid(LNA)primer.The results showed that:1)Comparing with conventional DNA primers,the LNA primer raised PCR reaction annealing temperature,reduced the formation of primer dimers and non-specific products,and improved the sensitivity and specificity of detection.2)LNA quantitative PCR analysis revealed that the concentration of Phytophthora parasitica var.nicotianae in 14 soil samples of tobacco/garlic rotation fields ranged from 2.76×103to 5.20×104per gram.This method is sensitive and efficient,the detection can be completed within 4-5 hours.
Tobacco planting soil;Phytophthora parasitica var.nicotianae;Locked nucleic acid(LNA);Fluorescence quantitative PCR;Molecular detection
S43
A
1002-0861(2015)12-0014-06
10.16135/j.issn1002-0861.20151203
2015-01-19
2015-05-06
中国烟草总公司河南省公司科技项目“烟草黑胫病防控关键技术研发与应用”(122013DS0320)。
刘芳(1992—),女,在读硕士研究生,研究方向:烟草农业。E-mail:qqfliu@163.com;*
奚家勤,E-mail:xijq@ztri.com.cn;胡利伟,E-mail:lwhu2003@hotmail.com
刘芳,宋纪真,范艺宽,等.基于锁核苷酸(LNA)增敏的植烟土壤中烟草黑胫病菌定量PCR检测方法[J].烟草科技,2015,48(12):14-19.LIU Fang,SONG Jizhen,FAN Yikuan,et al.A quantitative PCR method for detecting Phytophthora parasitica var.nicotianae in tobacco planting soil based on LNA sensitization[J].Tobacco Science&Technology,2015,48(12):14-19.
责任编辑 董志坚

