秦巴不同生态区烤烟基因表达谱分析
金保锋,扈 强,叶为民,阮 志,李晓娜,陈富彩,勾 薇,崔志燕,4,张 玲,高 梅,张立新*
1.广东中烟工业有限责任公司技术中心,广州市天河区林和西横路186号 510385
2.西北农林科技大学生命科学学院,陕西省杨凌示范区西农路22号 712100
3.西北农林科技大学资源环境学院,陕西省杨凌示范区邰城路3号 712100
4.商洛市烟草公司镇安县分公司,陕西省商洛市镇安县宏化街17号 715000
秦巴不同生态区烤烟基因表达谱分析
金保锋1,扈 强1,叶为民1,阮 志2,李晓娜3,陈富彩2,勾 薇2,崔志燕2,4,张 玲2,高 梅2,张立新*2
1.广东中烟工业有限责任公司技术中心,广州市天河区林和西横路186号 510385
2.西北农林科技大学生命科学学院,陕西省杨凌示范区西农路22号 712100
3.西北农林科技大学资源环境学院,陕西省杨凌示范区邰城路3号 712100
4.商洛市烟草公司镇安县分公司,陕西省商洛市镇安县宏化街17号 715000
为了揭示不同生态区烤烟风格特色形成的机理,采用Agilent烟草寡聚芯片技术,对商洛市洛南县和宝鸡市陇县(对照)两个生态区烤烟打顶后15 d同一品种(秦烟96)中部叶的基因表达谱进行了初步分析。结果表明:与陇县相比,在44 000个基因中洛南烟区烟叶有2 058个基因差异表达,其中上调基因962个,占46.74%;下调基因1 096个,占53.26%。按功能富集分类,这些差异基因主要富集在代谢、响应外界刺激及生理调控等生物学过程,大部分位于胞外区与细胞内膜系统。其中洛南烟区碳水化合物合成代谢较为活跃,陇县烟区萜类化合物代谢、苯丙烷代谢、芳香族化合物合成代谢较为活跃。基因代谢通路分析表明,细胞信号转导、转录因子及参与植物非生物胁迫相关基因在两个烟草种植区均为高表达。
烤烟;生态区;秦烟96;基因;基因芯片;表达谱
基因芯片技术可用于高通量基因表达平行分析、大规模基因发现及序列分析、基因多态性分析和基因组研究等[1]。目前,基因芯片技术已在水稻、玉米、小麦等[2-4]作物上广泛应用,而以烟草为材料的研究报道较少。杨天旭等[5]发现渗透胁迫48 h后,烟草根系上调表达基因主要是激素响应蛋白基因、钙信号响应蛋白基因及蛋白激酶基因,而下调表达基因则主要是赤霉素响应蛋白类基因和泛素连接酶类基因。利用基因芯片技术研究不同生态区烟草叶片基因表达情况仅有崔红等[6]对烤烟移栽后60 d叶面腺毛表达谱进行过初步分析,而有关不同生态区烤烟打顶后烟叶基因表达谱变化的研究尚未见报道。因此,采用烟草寡聚芯片技术对两个生态区烤烟打顶后烟叶基因表达变化进行试验,旨在从分子水平上揭示生态因子对相同基因型烤烟物质代谢的影响。
1 材料与方法
1.1 试验材料
试验于2013年进行,分别设置在宝鸡市陇县(LX,对照)曹家湾镇流渠村(海拔1 055 m,N 34°53'57.3",E 106°42'46.6")和商洛市洛南县(LN)城关镇樊村(海拔 920 m,N 34°01'58'',E 110°18'05")。供试材料为烤烟品种秦烟96。2013年洛南烟区大田期(5月—9月)平均气温12.51~25.56℃,月降水量为29.80~45.00 mm,大田期光照时数累计值为1 183.14 h;陇县烟区大田期平均温度为13.00~26.37℃,月降水量为65.20~259.40 mm,大田期光照时数累计值为1 220.55 h。两生态烟区烤烟均于5月7日移栽,7月23日打顶。按当地烟叶生产技术规范进行烟田管理。移栽后15 d选择标记长势长相均匀一致的烟株10株,分别在烤烟打顶后15 d(8月6日),用打孔器打下中部叶片第10叶位的叶片样品,置于液氮速冻,带回实验室,置于-80℃冰箱中,保存备用。
1.2 试验方法
1.2.1 总RNA提取及纯化
采用Trizol(美国Gibco BRL公司)提取烟草叶片总RNA,并进一步用RNA去除试剂盒(德国MACHEREY-NAGEL公司)对总RNA进行纯化。
1.2.2 cRNA的合成及荧光标记
以总RNA起始,含有T7噬菌体RNA聚合酶启动子序列的寡聚dT为引物,使用CbcScript酶合成cDNA第一条链。用核糖核酸酶H(RNaseH)将杂合链中的RNA切成随机短片段,DNA聚合酶以RNA短片段作为引物进行延伸,合成与cDNA第一条链互补配对的第二条链,并纯化双链cDNA。以cDNA为模板,利用T7酶混合物合成cRNA,然后用RNA去除试剂盒纯化。取5 μg cRNA,用CbcScriptⅡ酶利用随机引物进行反转录,反转录产物用PCR NucleoSpinExtract II Kit(德 国 MACHEREYNAGEL公司)纯化。取上述反转录产物,以随机引物进行Klenow酶标记,之后用PCR NucleoSpin Extract II Kit纯化经Klenow酶标记的产物,纯化后干燥。用荧光染料Cy5-dCTP和Cy3-dCTP(美国GE Healthcare公司,型号:No.PA 55021/PA53021)分别标记试验样品(一种为洛南样品,另一种为陇县样品)。洛南与陇县两地样品设为一组,组内试验采用荧光正反标的方法进行标记,每个样品进行2组4次独立杂交试验,每组3次生物学重复。
1.2.3 芯片的检测与数据分析
将标记的DNA溶于2×GEx Hyb Buffer+25%甲酰胺的杂交液中,45℃条件下杂交过夜。杂交结束后,在42℃左右含0.2%SDS+2×SSC的液体中漂洗5 min,之后置于25℃下,0.2×SSC中漂洗5 min。玻片干燥后用微阵列扫描仪(G2565CA型,美国Agilent公司)对芯片进行扫描,得到杂交图。
采用Feature Extraction图像分析软件将芯片图像信号转为数字信号。运用批Percentile shift方法,将原始数据导入至GeneSpring GX软件中,对数字信号值进行归一化处理。以绝对差异倍数(Absolute Fold change)大于或等于2、同时用Flag数据标签标记成可检测的标准形式进行差异基因筛选。绝对差异倍数越大,说明两个样品之间的差异越大。
1.2.4 生物信息学分析
查阅NCBI数据库对差异表达基因进行分析。采用AgriGO和WEGO等[7]网站对差异表达基因进行GO注释和富集分析,并运用BLASTN对基因代谢途径进行分析。
2 结果与分析
2.1 RNA提取与芯片杂交结果
经甲醛变性胶电泳检测,RNA样品电泳条带清晰,见图1。28S∶18S rRNA条带亮度大于或接近 2∶1,且 A260/A280≥1.80,RNA 总量≥8 μg(表 1),满足了表达谱芯片实验要求。表明RNA纯度及完整性可满足后续实验要求。
图1RNA电泳图Fig.1 Electrophoretogram of RNA

表1 样品质检结果Tab.1 Quality of samples
烤烟打顶后15 d,在44 000个芯片探针中,检测到的杂交信号有34 080个,检出率为77.45%。说明在两个烟区样品中共检测到34 080个基因的表达量发生了变化。将两组实验的荧光数据校正、整合后制作散点图,见图2。从图2可以看出,多数数据点集中在上下两条斜线之间,说明绝大多数基因在两个生态区中表达差异不大。
2.2 烤烟基因表达差异分析
图3显示,与陇县相比,洛南烟区烟叶表达量差异在2倍以上的有2 058个,其中上调基因有962个,占46.74%;下调基因有1 096个,占53.26%。
2.3 烤烟差异表达基因富集分析
应用AgriGO和WEGO数据库进行基因本体注释和功能富集分析。图4显示,烤烟打顶后15 d,与陇县相比,在洛南烟区烤烟叶片2 058个差异表达基因中有763个(37.07%)基因有功能注释。差异表达基因显著富集在代谢、响应刺激及生理调控等生物学过程中,定位在细胞膜、胞内及细胞器中。同时这些差异表达基因翻译的蛋白质主要具有催化活性、分子转运及转录调控活性。
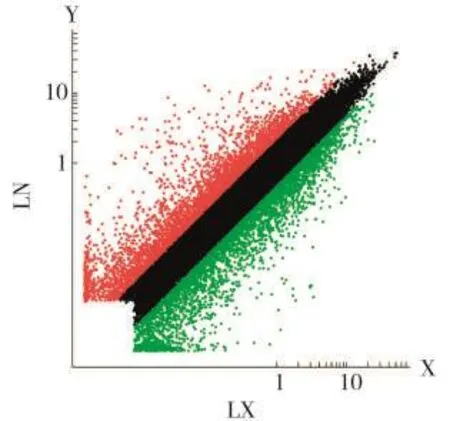
图2 洛南烟区烤烟烟叶差异表达基因散点图Fig.2 Differentially expressed gene scatterplot of flue-cured tobacco leaves from Luonan
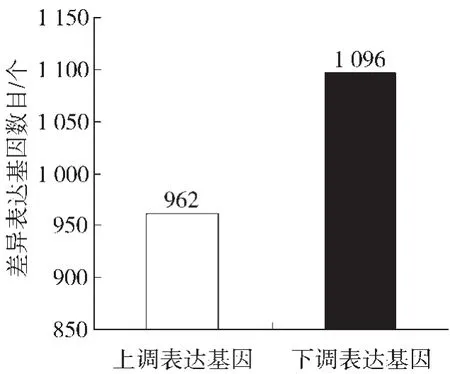
图3 洛南烟区烤烟烟叶差异表达基因Fig.3 Differentially expressed genes of flue-curedtobacco leaves from Luonan
由表2可知,与陇县相比,洛南烟区上调差异表达基因达到显著水平的GO条目有10个[错误发现率(FDR)<0.05],其中生物学过程5个、分子功能4个、细胞组分1个,分别占50%、40%和10%。生物学过程主要为节律过程(GO:0048511,P)、昼夜节律(GO:0007623,P)、响应二糖刺激(GO:0034285,P)、蔗糖刺激(GO:0009744,P)、果糖刺激(GO:0009750,P)。分子功能主要为原叶绿素酸酯还原酶活性(GO:0016630,F)、氧化还原酶活性(GO:0016628、GO:0016627,F)和水解酶活性(GO:0016798,F)。差异表达基因富集的细胞组分主要涉及胞外区(GO:0005576,C)。

图4 洛南烟区烤烟烟叶差异表达基因富集分析Fig.4 Analysis of differentially expressed genes of flue-cured tobacco leaves from Luonan

表2 洛南烟区烤烟烟叶上调差异表达基因GO功能分类Tab.2 GO function classification of differentially expressed up-regulated genes of flue-cured tobacco from Luonan
由表3可知,与陇县相比,洛南烟区下调差异表达基因达到显著水平的GO条目有33个(FDR<0.05),其中生物学过程19个、分子功能13个、细胞组分1个,分别占57.58%、39.39%和3.03%。生物学过程主要为次级代谢(GO:0019748,P)、倍半萜类代谢(GO:0016106、GO:0051762、GO:0051761、GO:0006714,P)、萜烯代谢(GO:0042214,P)、萜类化合物代谢(GO:0016114、GO:0042214,P)、营养生长向生殖生长转变时间调控(GO:0048510,P)、分生组织相变时间调控(GO:0048506,P)、发育调控(GO:0040034,P)、类异戊二烯合成(GO:0008299、GO:0006720,P)、脂类合成(GO:0008610,P)、苯丙烷代谢(GO:0009698,P)、氨基酸衍生物合成(GO:0006575,P)、芳香族化合物合成(GO:0019438,P)过程。分子功能主要为α-蛇麻烯合成酶活性(GO:0080017,F)、反式-E-β-石竹烯合成酶活性(GO:0080016,F)、碳-氧裂解酶活性(GO:0016838、GO:0016835,F)、腺苷酸环化酶活性(GO:0009975,F)、催化活性(GO:0003824,F)、主动跨膜转运蛋白活性(GO:0015291、GO:0022804,F)、裂解酶(GO:0016829,F)、阳离子转运蛋白活性(GO:0015294,F)、转运蛋白活性(GO:0015293,F)及转移酶活性(GO:0016765、GO:0016740,F)。细胞组分主要位于细胞内膜系统(GO:0012505,C)。
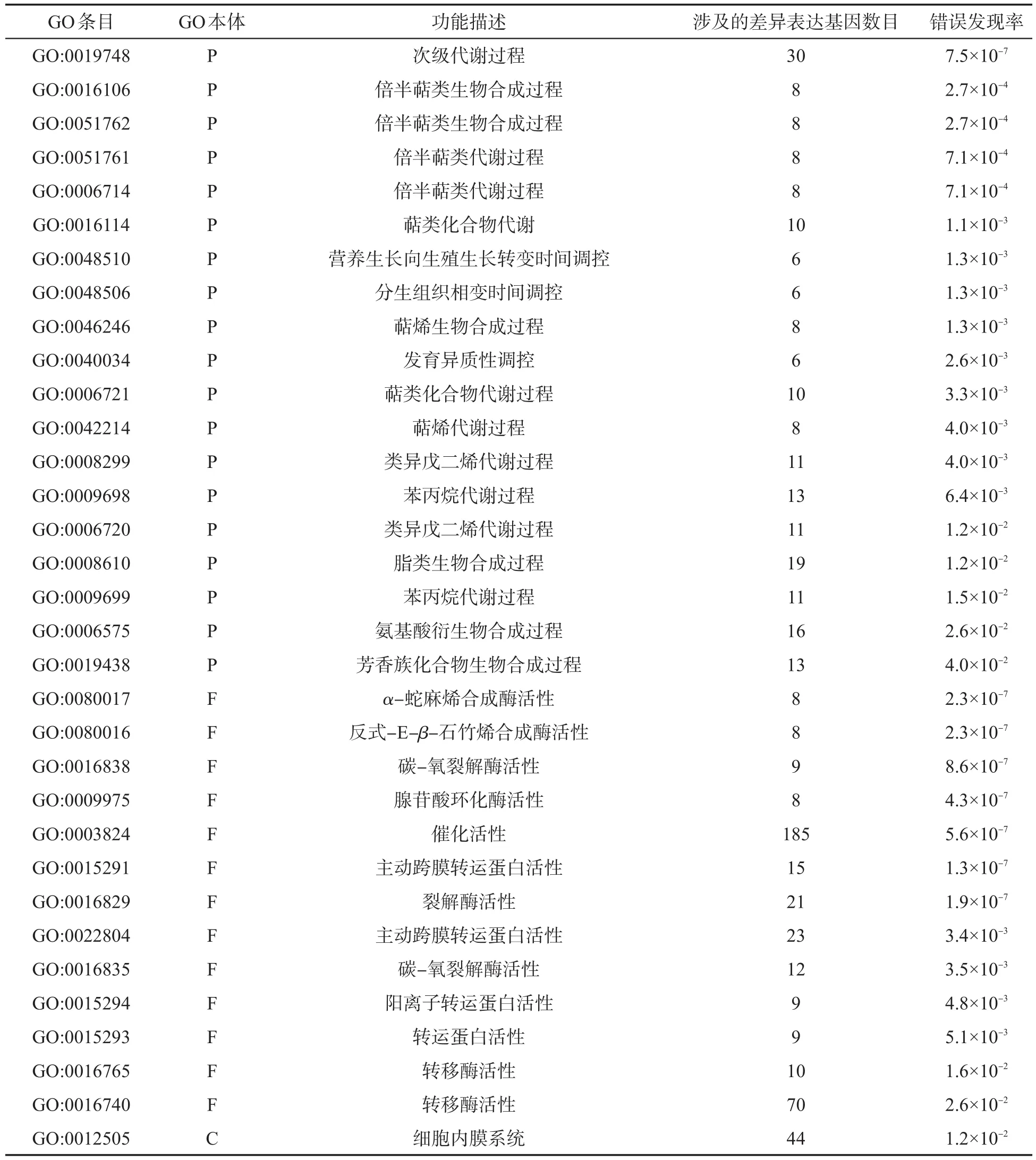
表3 洛南烟区烤烟烟叶下调差异表达基因GO功能分类Tab.3 GO function classification of differentially expressed down-regulated genes of flue-cured tobacco leaves from Luonan
2.4 烤烟差异表达基因代谢途径分析
由表4可知,与陇县相比,在洛南烟区烟草叶片中差异表达20倍以上的上调基因共有152个,有13个基因功能已知,其余均为未知功能蛋白。
已知的上调表达功能基因主要分为4类:①光合色素相关基因。原叶绿素酸酯还原酶在开花植物依赖于光的显绿过程中起重要作用[8]。捕光色素叶绿素a/b结合蛋白为光合系统蛋白,是与色素形成的色素蛋白复合体(LHC),LHC能将捕获的光能迅速传至反应中心并引起光化学反应,在光合作用和对各种环境的适应过程中发挥作用[9]。②细胞结构形成相关基因。果胶甲基酯酶抑制蛋白,果胶甲基酯酶(PME)是一种果胶酶,在细胞壁降解过程中起着重要作用[10]。碱性α-半乳糖苷酶在植物种子、幼苗、叶片及果实中均存在,参与种子萌发、叶片发育、果实成熟及低温耐受等生理过程[11-12]。类萌发素蛋白是存在于植物体中的重要防御酶,既能调控植物特定的生长发育过程,又能在植物响应生物及非生物胁迫中发挥作用[13]。过氧化物酶前体在细胞器过氧化物酶体中被催化生成过氧化物酶,过氧化物酶与植物的抗逆性有关,是植物保护酶系的重要保护酶之一[14]。富含甘氨酸蛋白互作蛋白和富含脯氨酸蛋白(PRP)是一类细胞壁结构蛋白,在细胞壁的形成和细胞的防卫过程中有重要作用,其表达具有组织特异性并受发育阶段特异性及多种环境因素的调控[15]。③细胞信号转导相关基因。丝氨酸/苏氨酸蛋白激酶SAPK8类蛋白是一大类特异性催化蛋白质丝氨酸和苏氨酸残基磷酸化的激酶家族,参与细胞中许多信号转导途径[16]。含NB-ARC结构域蛋白在植物超敏反应中发挥作用[17]。④转录因子类:富含甘氨酸结构域RNA结合蛋白通过与RNA相互作用来调节细胞的功能,从而适应多种逆境条件[18]。Drm3类蛋白、生长素抑制蛋白均参与生长素诱导基因的下调表达调控[19]。

表4 洛南烟区烤烟烟叶差异表达20倍以上的基因功能注释Tab.4 Function of genes differentially expressed more than 20 times of flue-cured tobacco from Luonan
下调差异表达20倍以上的基因有86个,其中有8个基因功能已知,其余均为未知功能蛋白。半胱氨酸蛋白酶参与胁迫响应、组织分化、衰老等过程[20]。MYB类转录因子广泛参与植物的生长发育和代谢调控过程[21]。RNA酶H家族蛋白,该酶具有核酸酶活性,催化DNA-RNA杂合体的RNA部分的核内降解,对细胞的增殖和分化起调控作用[22]。马兜铃烯合成酶是一种萜烯合成酶,能催化不同类异戊二烯中间产物使其环化[23]。肉桂酰辅酶A还原酶(CCR)是木质素特异途径的第一个关键酶,对木质素单体的生物合成起重要作用,而木质素对植物的结构与防御功能都具有重要作用[24-25]。Patatin 类蛋白1(PLP1)为一类酯酰基水解酶,参与植物生物胁迫与非生物胁迫过程[26-27]。生长素类蛋白是一类参与植物生长素产生和降解的重要蛋白[28]。肌醇-3-磷酸合成酶是植酸合成代谢中催化葡糖糖转化为肌醇-3-磷酸的功能蛋白,植酸可以防止植物叶片褐变,提高植物的抗氧化性[29-30]。
3 结论与讨论
在本试验中通过对两生态烟区烤烟品种秦烟96在打顶后15 d烟叶基因表达谱分析显示,洛南生态烟区差异表达基因为2 058个,其中上调差异表达基因为962个,下调差异表达基因为1 096个。这些差异基因主要在植物生长发育、细胞信号转导、物质代谢与运输、抵御逆境等过程中发挥作用。叶绿素合成、碳水化合物代谢与萜类化合物代谢相关基因的差异表达可能是造成两个生态区烟叶风格特色差异的内因。
适宜的温度能满足烤烟生长发育,有利于物质的积累和烟叶充分成熟,同时适宜的光照可以保证碳水化合物的合成积累及烟叶的色泽[31]。叶绿素在高温和强光照下易发生降解,烟叶成熟期温度过高,会破坏叶绿素,影响光合作用,从而使植物新陈代谢失调,明显地影响烟株的生长、成熟和烟叶品质[32-33]。洛南烟区在烤烟打顶后烟叶叶绿素合成相关基因,如光合色素原叶绿素酸酯还原酶、捕光色素叶绿素a/b结合蛋白前体相关基因高度表达。洛南烟区的温度有利于烟叶中叶绿素生物合成,从而促进了光合作用。整个生育期的平均气温与烟叶总糖和还原糖含量密切相关,平均气温适宜时总糖和还原糖含量较高,过高则不利于总糖和还原糖合成[34]。推测洛南烟区烤烟成熟前期温度较为适宜,促进了碳代谢化合物相关基因高表达,提高了碳水化合物累积量,进而为后期次生代谢提供了充足的前体物质和能量,为萜类化合物合成创造了良好的前提条件。不同气候条件如降雨量和降雨分布会影响土壤水分状况与空气湿度,导致烟草叶面腺毛分泌物发生变化,进而对烟叶香气品质产生影响[35]。陇县烟区烟叶萜类化合物、芳香族化合物基因表达量较高,如马兜铃烯合成酶基因。这可能是由于洛南烟区8月上旬平均气温与降雨量要高于陇县烟区所致[36]。可见,生态因子对两个生态烟区叶绿素合成、碳代谢和萜类代谢相关基因表达产生较大影响,导致两地烟叶化学成分的差异。张松涛等[37]研究提出生态条件差异对细胞内核苷酸代谢、激素代谢、DNA复制和修复以及信号转导相关基因的表达有一定影响。在本研究中也有类似发现,两个生态区差异表达基因均涉及细胞结构(细胞壁)的形成、细胞信号转导及参与非生物胁迫等过程。表明不同生态区烟叶风格特色的差异是由多基因参与调控的结果。
生态因子影响着细胞内众多基因的表达,造成这些基因表达差异的原因尚不完全明晰。另外相关数据库中基因的信息及功能注释不太全面,也影响了数据分析的深度。此外,烤烟叶片基因差异表达还需通过荧光定量PCR进一步验证。在差异表达20倍以上的基因中,还有一部分并未进行功能注释,它们的差异表达对于两个生态烟区烤烟风格特色形成的影响尚不清楚,需要进行更深入的研究。
[1] 滕晓坤,肖华胜.基因芯片与高通量DNA测序技术前景分析[J].中国科学(C辑:生命科学),2008,38(10):891-899.
[2] 肖军,杨涛,杨镇,等.应用基因芯片分析植物内生菌醇提取物处理条件下水稻的基因表达图谱[J].生物技术通报,2013,29(1):89-95.
[3] 袁广胜,杜娟,高健,等.玉米穗粒腐病差异表达基因的生物信息学分析[J].玉米科学,2013,21(5):46-51.
[4] 董剑,刘迎团,刘宏伟,等.基因芯片分析杀雄剂SQ-1诱导小麦生理型雄性不育的基因差异表达[J].中国生物化学与分子生物学报,2013,29(10):948-955.
[5] 杨天旭,汪耀富,刘国顺,等.渗透胁迫下烟草叶片基因的差异表达研究[J].作物学报,2007,33(6):914-920.
[6] 崔红,冀浩,杨惠绢,等.不同生态区烟草的叶面腺毛基因表达[J].生态学报,2011,31(11):3143-3149.
[7] Ye J,Fang L,Zheng H,et al.WEGO:a web tool for plotting GO annotations[J].Nucleic Acids Research,2006,34(2):293-297.
[8] Lebedev N,Timko M P.Protochlorophyllide oxidoreductase B-catalyzed protochlorophyllide photoreduction in vitro:insight into the mechanism of chlorophyll formation in light-adapted plants[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(17):9954-9959.
[9] 未丽,徐秉良,雷江丽,等.胡杨叶绿素a/b结合蛋白基因的克隆及序列特性分析[J].中国农业科技导报,2008,10(4):63-69.
[10]董章勇,王振中.香蕉枯萎病菌果胶甲基酯酶基因的克隆与生物信息学分析[J].生物技术通报,2012,28(6):111-115.
[11] Marraccini P,Rogers W J,Caillet V,et al.Biochemical and molecular characterization of alpha-D-galactosidase from coffee beans[J]. Plant Physiology and Biochemistry,2005,43(43):909-920.
[12] PetersS, Mundree S G,Thomson JA,etal.Protection mechanisms in the resurrection plant Xerophyta viscosa(Baker):both sucrose and raffinose family oligosaccharides(RFOs) accumulate in leaves in response to water deficit[J]. Journal of Experimental Botany,2007,58(8):1947-1956.
[13]王沙沙,舒文涛,陈军营,等.麦类作物萌发素及其相关蛋白研究进展[J].河南农业大学学报,2007,41(2):242-246.
[14]蒋选利,李振岐,康振生.过氧化物酶与植物抗病性研究进展[J].西北农林科技大学学报:自然科学版,2001,29(6):124-129.
[15]柴团耀,张玉秀.菜豆富含脯氨酸蛋白质基因在生物和非生物胁迫下的表达[J].植物学报,1999,41(1):111-113.
[16]臧梦维.丝氨酸/苏氨酸蛋白激酶[J].基础医学与临床,1996,16(2):86-95.
[17]王文娟,张飞云.植物抗病分子机制研究进展[J].生物技术通报,2007,23(1):19-23.
[18] Kim Y O,Kim J S,Kang H.Cold-inducible zinc finger-containing glycine-rich RNA-binding protein contributes to the enhancement of freezing tolerance in Arabidopsis thaliana[J].The Plant Journal,2005,42(6):890-900.
[19]Misra P,Pandey A,Tiwari M,et al.Modulation of transcriptome and metabolome of tobacco by Arabidopsistranscription factor,AtMYB12,leads to insect resistance[J].Plant Physiology,2010,152(4):2258-2268.
[20]闫龙凤,杨青川,韩建国,等.植物半胱氨酸蛋白酶研究进展[J].草业学报,2005,14(5):11-19.
[21] Martin C.Multifunctionality and diversity within the plant MYB-gene family[J].Plant Molecular Biology,1999,41(5):577-585.
[22] SchultzS J,Champoux JJ.RNaseH activity:structure, specificity, and function in reverse transcription[J].Virus Research,2008,134(1):86-103.
[23]郝宏蕾,朱旭芬,曾云中.类异戊二烯的生物合成及调控[J].浙江大学学报:农业与生命科学版,2002,8(2):108-114.
[24]李波,梁颖,柴友荣.植物肉桂酰辅酶A还原酶(CCR)基因的研究进展[J].分子植物育种,2006,4(S1):55-65.
[25]章霄云,郭安平,贺立卡,等.木质素生物合成及其基因调控的研究进展[J].分子植物育种,2006,4(3):431-437.
[26]Camera S L,Balagué C,Göbel C,et al.The Arabidopsispatatin-like protein 2 (PLP2) plays an essential role in cell death execution and differentially affects biosynthesis of oxylipins and resistance to pathogens[J]. Molecular Plant-microbe Interactions,2009,22(4):469-481.
[27]Matos A R,D'Arcy-Lameta A.A novel patatin-like gene stimulated by drought stress encodes a galactolipid acyl hydrolase[J].Febs Letters,2001,491(3):188-192.
[28]DreherK A,BrownJ,Saw R E,etal.The Arabidopsis Aux/IAA protein family has diversified in degradation and auxin responsiveness[J].The Plant Cell,2006,18(3):699-714.
[29]袁凤杰,董德坤,李百权,等.两个低植酸大豆突变体中肌醇-3-磷酸合成酶MIPS1基因表达特性的研究[J].核农学报,2013,27(03):286-292.
[30]李伟,高玉珍,刘霞,等.植酸对烟叶破碎后几个生理指标的影响[J].郑州轻工业学院学报:自然科学版,2007,22(4):9-12.
[31]王玉玺,栗珂,韦成才,等.陕南优质烤烟气候条件及区域划分的研究[J].陕西气象,2001,42(5):15-18.
[32]张武昌,王荣.光和温度对叶绿素a和脱镁叶绿酸a降解的影响[J].海洋科学,2000,24(4):50-52.
[33]李琦.烤烟优劣质年的气象条件分析[J].安徽农业科学,1997,25(2):32-35.
[34]韦成才,马英明,艾绥龙,等.陕南烤烟质量与气候关系研究[J].中国烟草科学,2004,25(3):38-41.
[35]杨克伟.生态因子对烟叶香型风格划分的影响[J].北京农业,2013,32(3):19-20.
[36]郭兆夏,贺文丽,李星敏,等.基于GIS的陕西省烤烟气候生态适宜性区划[J].中国烟草学报,2012,18(2):21-24.
[37]张松涛,杨永霞,杨惠娟,等.不同生态区烟草叶片基因表达谱的分析[J].农业生物技术学报,2014,22(10):1251-1260.
Analysis of Gene Expression Profiles of Flue-cured Tobaccos from Different Ecological Zones in Qinba Mountain Area
JIN Baofeng1,HU Qiang1,YE Weimin1,RUAN Zhi2,LI Xiaona3,CHEN Fucai2,GOU Wei2,CUI Zhiyan2,4,ZHANG Ling2,GAO Mei2,and ZHANG Lixin*2
1.Technology Center,China Tobacco Guangdong Industrial Co.,Ltd.,Guangzhou 510385,China
2.College of Life Sciences,Northwest A&F University,Yangling 712100,Shaanxi,China
3.College of Natural Resources&Environment,Northwest A&F University,Yangling 712100,Shaanxi,China
4.Zhen'an County Tobacco Company of Shaanxi Province,Zhen'an 715000,Shaanxi,China
To investigate the formation mechanism of style characteristics of flue-cured tobaccos from different ecological environment conditions,the middle leaves of flue-cured tobacco cv.Qinyan96 grown in two ecological zones,i.e.Luonan County in Shangluo City and Longxian County in Baoji City(the control)were sampled 15 days after topping,and their gene expression profiles were preliminarily analyzed with Agilent tobacco oligo microarray.The results showed that,comparing with those from Longxian,of the 44 000 genes of leaves from Luonan,there were 2 058 differentially expressed genes,including 962(46.74%)up-regulated genes and 1 096(53.26%)down-regulated genes.Categorizing byfunction,those genes mainly involved in biological processes,including metabolism,response to external environment stimulation,physiological regulation;and mostly distributed in extracellular regions and endomembrane systems.Synthesis metabolism of carbohydrate was more active in leaves from Luonan,while that of terpenoid,phenylpropanoid and aromatic compound was active in leaves from Longxian.Metabolic pathway analysis indicated that genes related to cell signal transduction,transcription factor and involved in plant abiotic stress were of higher expression in leaves from both Luonan and Longxian.
Flue-cured tobacco;Ecological zone;Qinyan96;Gene;Microarray;Expression profile
S572.01
A
1002-0861(2015)12-0001-08
10.16135/j.issn1002-0861.20151201
2015-04-17
2015-06-15
广东中烟工业有限责任公司科技计划项目“‘双喜’品牌秦巴生态烟叶关键技术研究与集成推广”[粤烟工05XM-QK(2014)015]。
金保锋(1973—),硕士,高级工程师,主要从事特色烟叶开发与应用研究。E-mail:jinbf@gdzygy.com;*
张立新,E-mail:zhanglixin@nwsuaf.edu.cn
金保锋,扈强,叶为民,等.秦巴不同生态区烤烟基因表达谱分析[J].烟草科技,2015,48(12):1-8.JIN Baofeng,HU Qiang,YE Weimin,et al.Analysis of gene expression profiles of flue-cured tobaccos from different ecological zones in Qinba mountain area[J].Tobacco Science&Technology,2015,48(12):1-8.
责任编辑 董志坚

