海洋动物来源活性物质的研究新进展
李艳青,陆园园,邢莹莹,奚涛
(中国药科大学海洋药学教研室,江苏 南京210009)
海洋动物来源活性物质的研究新进展
李艳青,陆园园,邢莹莹,奚涛*
(中国药科大学海洋药学教研室,江苏 南京210009)
海洋动物因具有产生抗菌物质、抗肿瘤物质、抗病毒物质、免疫调节物质等活性产物的巨大潜力,备受研究人员重视。近年来,各国研究者已从海洋动物中分离出了数千种结构新颖的活性物质,为新药的开发提供了坚实的基础。简要介绍了近六年来海绵、珊瑚、海参、海鞘等海洋动物来源的活性物质研究进展,旨在为海洋药用动物资源的开发利用提供参考。
海洋动物;抗肿瘤;抗菌;抗病毒;抗炎;活性物质
海洋是重要的海洋生命支持系统,也是生物界重要的组成部分。现已知的海洋动物约有23万种,它们形态多样,分布广泛,其生存环境与陆生动物截然不同,使得海洋动物中蕴藏着许多功能特异、结构特殊的活性物质,大多具有抗菌、抗病毒、抗肿瘤、抗炎等活性。近年来,来源于印度-太平洋芋螺的肽类毒素合成类似物Ziconotie、海绵聚醚大环内酯类软海绵素合成类似物E7389等相继被批准上市,更有多种海洋动物来源的活性化合物或其结构类似物正处于临床研究阶段,显示出广阔的研究前景。本文对近6年海绵、珊瑚、海参、海鞘等海洋动物来源活性物质的最新研究进行综述,旨在对海洋天然产物的相关药物研发提供参考。
1 海绵动物来源活性物质
海绵动物分布广泛,长期与海洋微生物共存,富含结构新颖的次生代谢产物,如萜类、生物碱、甾体等,具有抗肿瘤、抗菌、抗病毒、抗原虫等生物活性,为海洋天然活性物质的相关新药研制提供了先导化合物,是创新药物的丰富资源[1]。
1.1 抗肿瘤活性
Bea等[2]从海绵Chondrosia corticata中分离得到5种新型大环内酯类化合物,其中化合物(19Z)-HCA(1)对6种人实体瘤细胞株A549、A549-PA、HCT116、MDA-MB-231、SK-HEP-1、SNU601有显著抑制作用,体外IC50分别为0.024、0.022、0.073、0.04、0.08、0.107 μmol·L-1。进一步研究发现,(19Z)-HCA抑制人肺癌细胞增殖的作用机制是诱导细胞周期阻滞于G2/M期和调控mTOR/AMPK信号通路[3]。
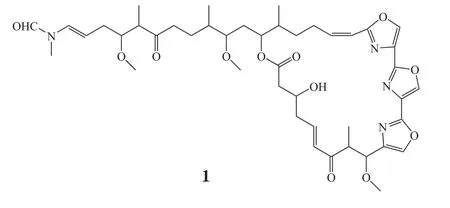
Biegelmeyer等[4]从巴西南海岸线海绵Haliclona
tubifera的乙酸乙酯提取物中分离获得2个鞘氨醇类化合物Halisphingosine A-B(2,3),其对人胶质瘤细胞U87和神经母细胞瘤SH-SY5Y具有较强的细胞毒作用,体外IC50均小于15 mg·L-1;此外还可以增加血浆复钙时间,表现出抗凝活性。
1.2 抗菌活性
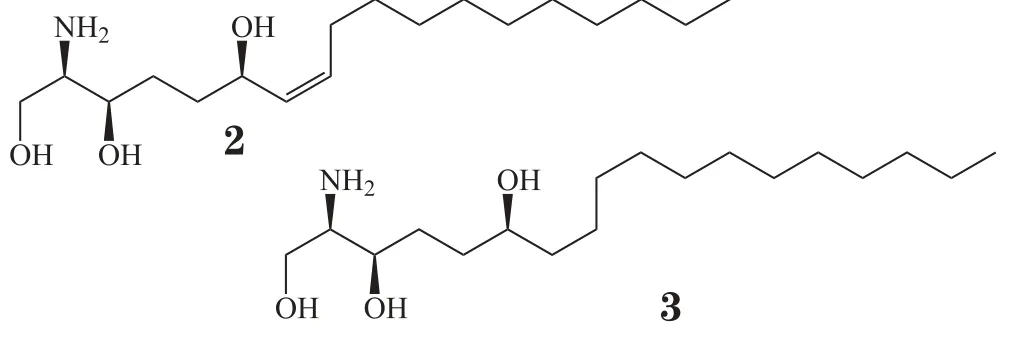
Sun等[5]从海绵Dysidea granulosa中分离出3个多溴联苯醚类化合物(4~6),体外抗菌实验显示,化合物4对蜡样芽孢杆菌(Bacillus cereus)、李斯特菌(Listeria monocytogenes)、耐甲氧西林的金黄色葡萄球菌(MRSA)、沙门菌(Salmonella sp.)、肺炎克雷伯菌(Klebsiella pneumoniae)、淋球菌(Neisseria gonorrhoeae)有良好的抗菌活性,MIC分别为0.1、2.0、0.1、1.0、0.1、2.0 mg·L-1;化合物5对李斯特菌、MRSA的MIC均为0.1 mg·L-1。
1.3 抗病毒活性
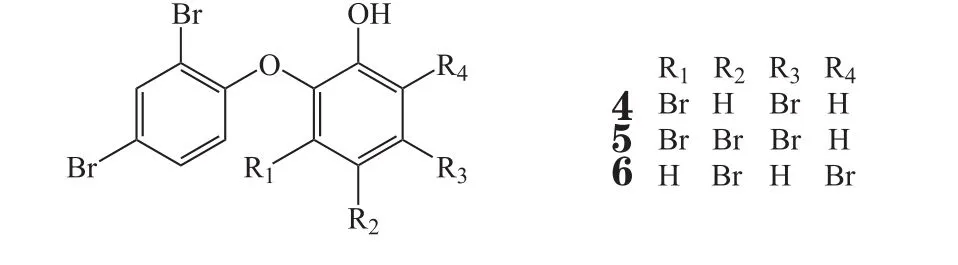
Stelletta属海绵可以生产出结构多样的天然活性物质。2014年,Shin等[6]从此种属海绵中分离出2个结构新颖的缩肽类化合物Stellettapeptins A-B(7,8),实验表明这2个化合物可以抑制HIV感染T细胞中的病毒增殖,EC50值分别为0.023和0.027 mg·L-1。此外,这2个化合物的结构与以往的抗HIV肽有很大不同,且活性显著,具有开发为HIV治疗药物的潜力。

1.4 抗原虫活性
Orhan等[7]分离获得13个来自海绵的萜类化合物,并对其进行体外抗原虫活性实验,结果表明,这13个化合物对4种原虫均表现出较好的活性,化合物9~12活性尤为突出。其中化合物9对罗得西亚锥虫的体外IC50为0.6 mg·L-1,化合物10和12对克氏锥虫的IC50约为4 mg·L-1,化合物12对杜氏利什曼虫的IC50为0.75 mg·L-1,化合物11对恶性疟原虫的IC50值为0.43 mg·L-1。
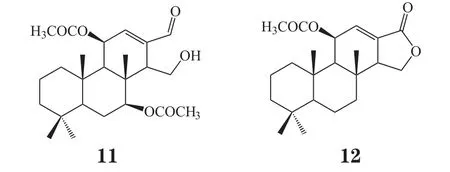
化合物10~12除具有抗原虫活性外,还对哺乳动物细胞有毒性,而其他化合物没有毒性或只有低细胞毒活性。
1.5 酶抑制活性
DYRKs和CLKs是阿尔茨海默病和唐氏综合征发生、发展中的2个重要激酶。分离自海绵Leucetta microraphis的生物碱leucettamine B(13)是DYRKs和CLKs的天然抑制剂,而其结构优化物leucettine L41(14)还可特异性地作用于阿尔茨海默病的次级靶点如CK2、SLK、PIKfyve/Vac14/Fig4通道。进一步研究发现,leucettine L41具有神经保护作用,可抑制谷氨酸诱导的海马神经元HT-22细胞死亡,还能减少淀粉样蛋白前体蛋白诱导的小鼠大脑皮质神经细胞死亡,具有开发为阿尔茨海默病治疗
药物的潜力[8]。
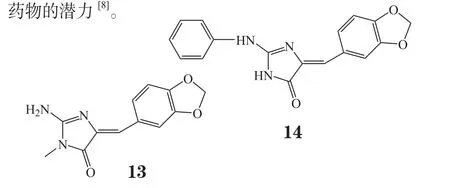
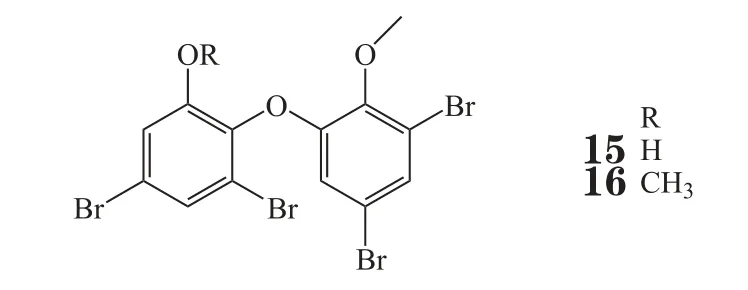
Yamazaki等[9]研究发现印尼海绵Lamellodysidea herbacea乙醇提取物有抑制蛋白酪氨酸磷酸酶1B(PTP1B)的活性,进一步分离得到了2个聚溴二苯醚化合物(15,16),其对PTP1B的体外IC50分别为0.85和1.7 μmol·L-1,与齐墩果酸的抑制活性(IC50为1.1 μmol·L-1)相当。PTP1B是一种胰岛素信号的负性调节因子,可通过引起胰岛素抵抗、瘦素抵抗及影响脂质代谢等方式导致肥胖症和2型糖尿病的发生,抑制PTP1B的作用已成为一种新的治疗胰岛素抵抗、2型糖尿病和肥胖的方法。
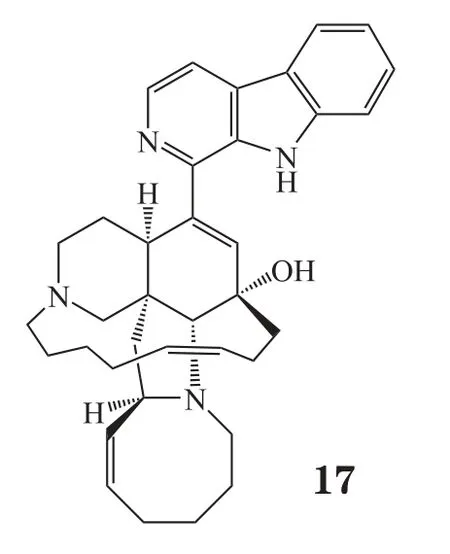
Eguchi等[10]从印度尼西亚海绵Acanthostrongylophora ingens 中分离得到一个生物碱类化合物Manzamine A(17),研究发现此化合物可以抑制巨噬细胞源性泡沫细胞形成,对早期动脉粥样硬化病变有抑制作用;同时可以抑制中华仓鼠卵巢细胞内胆固醇酯再形成。对ApoE基因缺陷小鼠以30 mg·kg-1·d-1的剂量连续口服给药80 d,结果显示,小鼠血清中总胆固醇、游离胆固醇、低密度脂蛋白胆固醇和甘油三酯水平分别降低了40%、20%、40%、50%,主动脉粥样硬化病变的面积也减少了45%。
2 腔肠动物来源活性物质
珊瑚虫纲是腔肠动物中最大的一个纲,也是国际海洋天然产物研究热点之一,许多结构新颖、有显著生物活性的化合物均是从这类海洋动物中发现的。
Ahmed等[11]从采自埃及塞法杰附近红海海域的短指软珊瑚Sinularia sp.中分离得到一个新型甾醇类化合物(18)和3个神经酰胺类化合物(19~21),在禽流感血凝抑制试验中发现,这4个化合物具有抗流感病毒H5N1活性,在1 μg·L-1浓度下,其对H5N1的抑制率分别为55.16%、48.81%、10.43%和15.76%。
Lin等[12]从采自东沙环礁的一种软珊瑚Lobophytum crassum中分离出一个新型西柏烷类化合物(22),体外实验显示该化合物对人肺癌A549细胞的ED50值为3.6 mg·L-1,对小鼠淋巴癌细胞系P388的ED50值为28 mg·L-1,对人结肠癌细胞HT-29的ED50值为10 mg·L-1。
Taira等[13]从采自日本冲绳的一种软珊瑚Cespitularia sp.中分离得到2个双萜类化合物Alcyonolides(23~24),其具有诱导HCT-116细胞凋亡的作用,体外IC50分别为2.5和10 mg·L-1;此外,这2个化合物可以通过抑制iNOS和COX-2基因表达进而抑制NF-kB活性,达到抗炎作用。
时,发现其合成中间体austrasulfone 3(26)不仅对小鼠神经性疼痛、动脉粥样硬化和多发性硬化症有治疗作用,镇痛抗炎活性也较为显著,它可以抑制脂多糖(LPS)诱导的诱导型一氧化氮合酶(iNOS)表达,IC50为(3.6±0.3)μmol·L-1;可抑制环氧化酶-2(COX-2)的积累,IC50是(32.1±8.1)μmol·L-1;对慢性收缩性损伤模型大鼠鞘内注射austrasulfone 3,通过测定大鼠热缩足反射潜伏期(PWL),计算出最大镇痛效应百分率(MPE),结果显示austrasulfone 3镇痛活性的ED50为(0.75±0.05)μg。
海葵体及其触手中含有大量蛋白质和多肽类化合物,有神经毒和细胞毒等生物活性。Zaharenko等[15]从海葵Bunodosoma cangicum中分离出一种酰胺基酸化合物Bunodosine 391(27),研究发现此化合物可以通过调控5-羟色胺受体达到止痛效果。Ramezanpour等[16]研究发现,公主海葵毒液可以通过线粒体途径激活Caspases和降低线粒体膜电位,从而诱导细胞凋亡,表现出较强的细胞毒性。
钵水母纲动物是海洋中一类数量庞大的浮游生物,其触手和刺丝囊含有蛋白质毒素,具有溶血、心脏毒性、神经毒性、肌肉毒性等作用,该类生物是一个潜在的海洋药物资源宝库。Lassen等[17]从发形霞水母刺丝囊毒素中分离到了一个相对分子质量仅8 220的多肽CcNT,实验表明此多肽可通过阻滞Na+电压门控通道显著抑制小鼠神经细胞瘤细胞的生长。Ding等[18]发现,海蜇胶原蛋白肽能明显降低小鼠乳酸含量,增加肝糖原和肌糖原含量,达到抗疲劳的效果;能提高肝组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活力,起到抗氧化作用。
3 棘皮动物来源活性物质
棘皮动物现存7 000多种,主要分布于6个纲,目前对其活性成分的研究主要集中于海参纲和海星纲。
海参中含有氨基酸、硫酸软骨素、黏多糖等特殊活性成分,是棘皮动物中经济价值最大的一纲。Liu等[19]用酶解法从海参Apostichopus japonicus中分离制备了一种平均相对分子质量为36 200的海参多糖(AJP),通过体外实验评估其清除1,1-二苯基-2-三硝基苯肼(DPPH)、羟
基、超氧化物自由基的能力,发现AJP有很好的抗氧化活性;高血脂症Wistar大鼠以400 mg·kg-1·d-1的剂量灌胃给予AJP,28 d后发现,大鼠血清总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL-C)含量显著降低,高密度脂蛋白胆固醇(HDL-C)含量显著增加,表明AJP有抗高血脂活性。
海星中含有蛋白和多肽、糖苷类、甾醇、生物碱、神经酰胺等生物活性物质。Thao等[20]从一种海星Astropecten monacanthus中分离得到4个新型海星皂苷,通过评估LPS刺激小鼠骨髓来源树突状细胞分泌TNF-α、IL-6和IL-12 p40的水平来评价上述海星皂苷的抗炎效果,发现化合物astrosteriosides D有非常好的抗炎活性:抑制TNF-α分泌的体外IC50为1.21 mg·L-1,抑制IL-6分泌的IC50为3.51 mg·L-1,抑制IL-12 p40分泌的IC50为0.60 mg·L-1。Ivanchina等[21]从远东海星Lethasterias fusca中分离出2个新型海星皂苷,其细胞毒性较弱,但有显著抑制肿瘤细胞集落形成的能力。
算法是在TI公司发布的CCStudio v3.3开发环境下编写与调试的,采用的开发板是中国源创力YCL-DSP2812pro配合TDS510-USB2.0的仿真器使用,为了方便DSP之间的程序移植采用了通用的C语言作为程序设计的主要语言,并结合CCStudio v3.3的特点,部分程序嵌入汇编命令,提高程序的运行速度。整个项目程序包括主程序、系统初始化程序、外围设备初始化、中断服务程序和LCD显示程序。限于篇幅原因,在此仅给出主程序和ADC中断服务程序。
4 尾索动物来源活性物质
尾索动物中含有许多重要的生物活性物质,是海洋中的重要药用生物资源。
Wang等[22]从朝鲜尾索动物Pesudodistoma antinboja中分离出6种新型丁烯酸内酯化合物以及3种已知的丁烯酸内酯化合物,体外抗菌实验显示这些化合物有非常强烈的抗革兰阳性菌活性,且在100 mg·L-1浓度下未表现出细胞毒作用,化合物28~32对4株甲氧西林敏感金葡菌和4株甲氧西林耐药金葡菌的体外IC50为0.13~4 mg·L-1,其抗耐药菌活性可媲美万古霉素和利奈唑胺,具有一定的开发潜力。
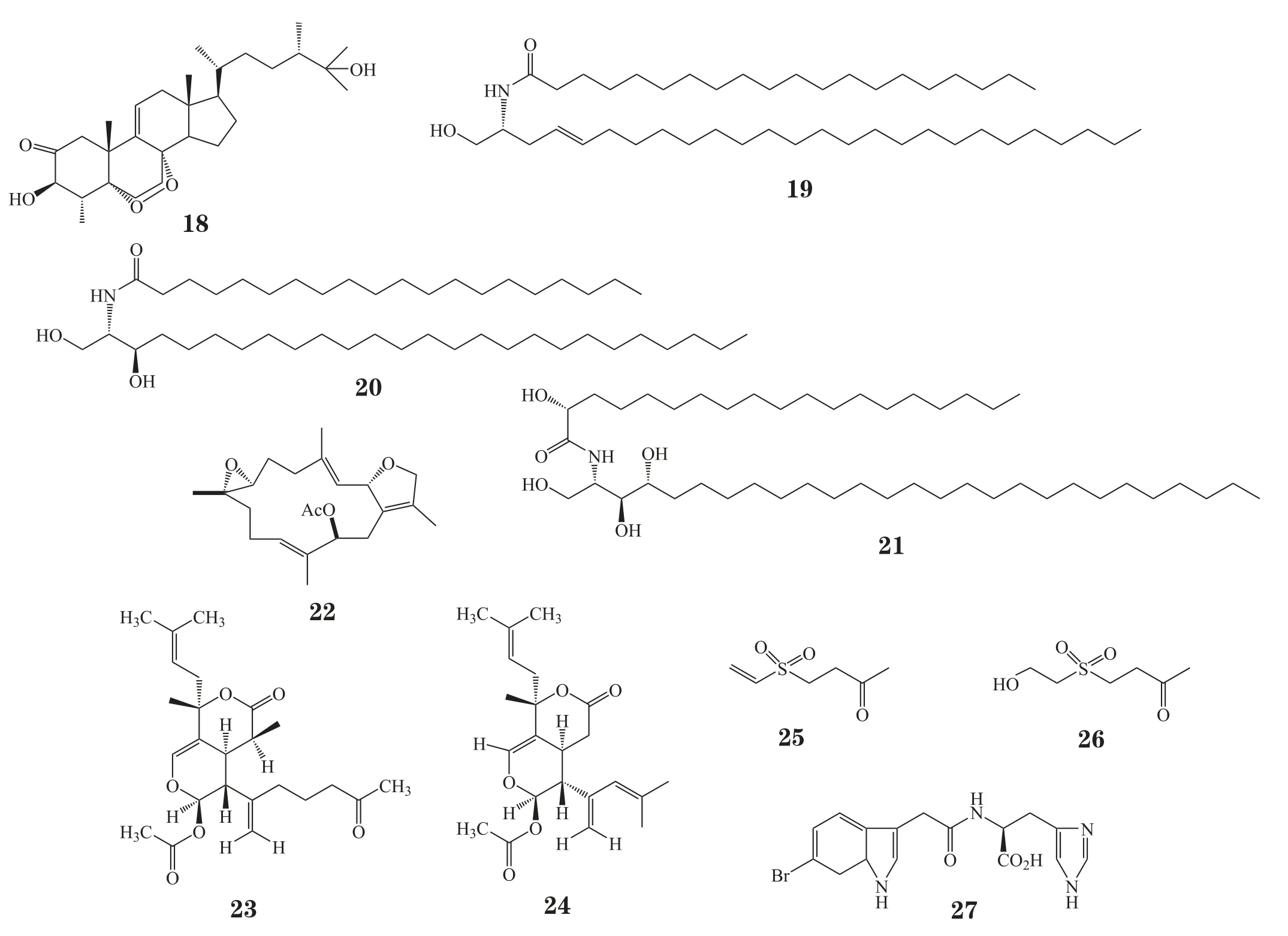
Carroll等[23]从澳大利亚大堡礁海鞘Didemnum albopunctatum分离出一个新型蒽醌类化合物Albopunctatone 1(33),抗疟原虫活性实验显示,该化合物对氯喹耐药型恶性疟原虫的IC50为5.3 mg·L-1,对氯喹敏感型恶性疟原虫的IC50为0.5 mg·L-1。
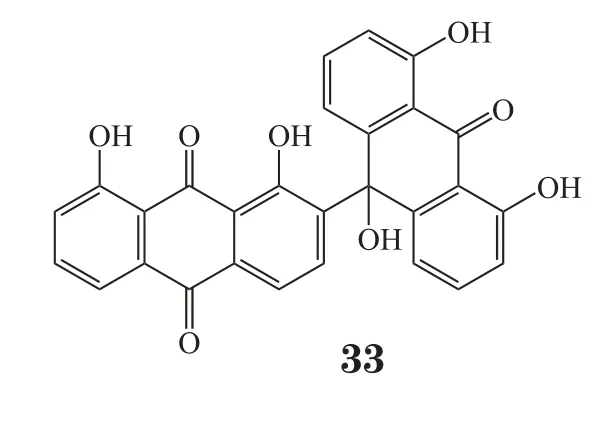
Feng等[24]从一种澳洲海鞘Polysyncraton echinatum中分离得到了一个高活性的生物碱化合物,经检测,其抗锥虫的IC50达到0. 077 μmol·L-1。Trong等[25]从海鞘Ancorina geodides和Cnemidocarpa stolonifera中分离得到2个新型吡啶并吖啶生物碱化合物:ancorine A(34)和cnemidine A(35),研究发现这2个化合物可以高效且选择性抑制人前列腺癌细胞PC 3,IC50分别为17和1.1 μmol·L-1。
5 软体动物来源活性物质
海洋软体动物包括鲍鱼、海兔、乌贼、青蛤、贻贝、扇贝、文蛤、牡蛎等,含有丰富的多糖、蛋白质、多肽和萜类,因具有抗肿瘤、抗衰老、增强机体免疫力和抗氧化等功能,成为研究开发的热点,也是新型的海洋药物和功能型保健食品资源。
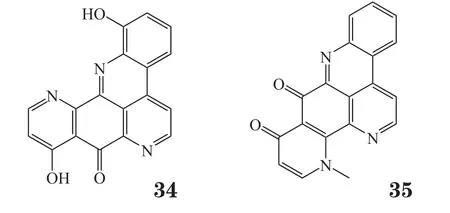
Nuzzo等[26]从印度洋-太平洋海域的一种裸鳃动物Aldisa andersoni中分离得到2个新型phorboxazole同系物(36,37),其对A549、MCF-7、SKMEL-28、Hs683、U373等肿瘤细胞显示中等抑制活性。
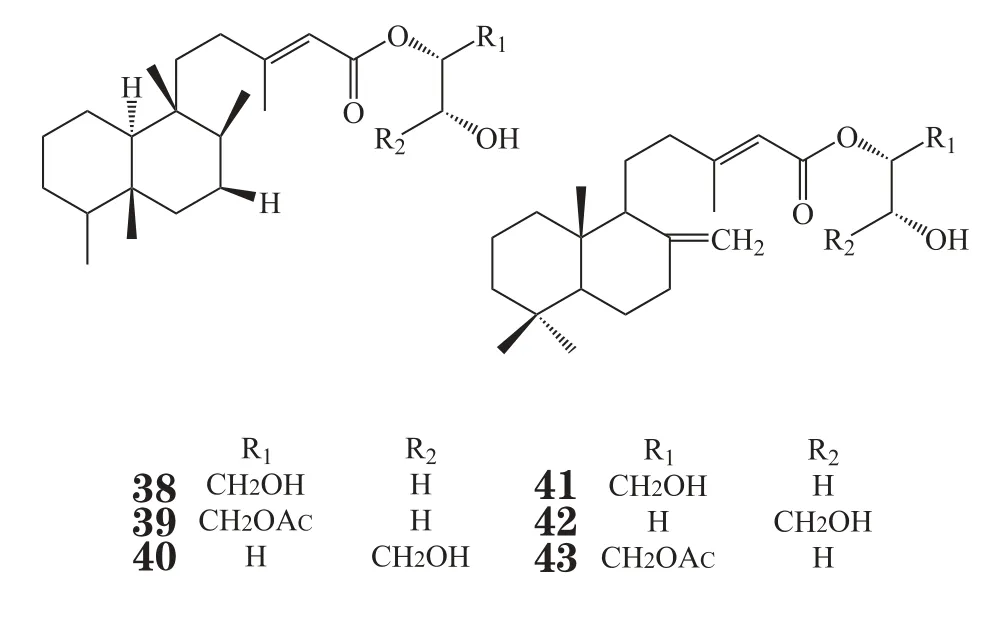
Mascheka等[27]从南极半岛西部的一种裸鳃动物Austrodoris kerguelenensis中分离得到一系列克罗二萜甘油酯,其中化合物Palmadorin A、B、D、M、N和O(38~43)能显著抑制人红白血病HEL细胞增殖,体外IC50分别为8.7、8.3、16.5、4.9、6.3、13.4 μmol·L-1;此外,化合物Palmadorin M可以抑制HEL细胞中Jak2、STAT5、Erk1/2相关信号通路的激活,从而诱导细胞凋亡,IC50值为5.0 μmol·L-1。
Andrianasolo等[28]从大西洋中脊深海热液口的一种软体动物贻贝中分离得到2个神经酰胺衍生物Bathymodiolamides A和B(44,45),其均可诱导肿瘤细胞凋亡。这是首次报道的从海洋深海热液喷口处发现的贻贝次生代谢产物。
6 其他
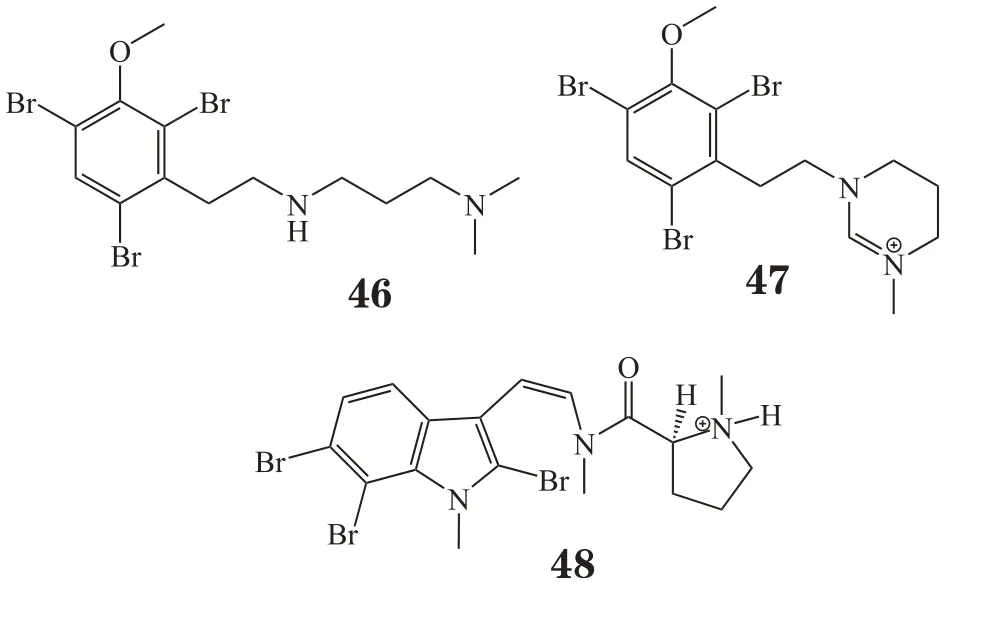
海洋苔藓虫是一类种属很多的海洋低等动物。从加利福尼亚海域的总合草苔虫Bugula nertina中分离出的大环内酯类化合物Bryostatin-1具有抗肿瘤活性和抗阿尔茨海默病活性,现已进入Ⅱ期临床实验。近年来,关于苔藓虫中生物碱成分的报道很多,例如,Davis等[29]从澳大利亚新南威尔士州苔藓虫Amathia tortuosa中分离出2个新型溴代生物碱convolutamines I和J(46,47),其对布氏锥虫有抑制活性,IC50值分别为1.1和13.7 mg·L-1;化合物46对人胚胎肾细胞显示出细胞毒活性。Carroll等[30]从同一种属的苔藓虫中分离出一种新型三溴吲哚生物碱化合物(48),此化合物对氯喹敏感型和氯喹耐药型恶性疟原虫有杀伤作用,而对人类正常细胞则无损害。
7 结语
近年来,人们对海洋资源不断探索和深入研究,为药物开发提供了一条新途径;海洋动物已成为最重要的药用生物资源之一。表1总结了近六年报道的来自海洋动物的具有显著生物活性的新型化合物,还有不少以海洋动物活性化合物为先导物合成的衍生物已进入临床试验,如提取自地中海海鞘Aplidium albican中的抗肿瘤活性天然产物plitidepsin,又名Aplidine,其可与eEF1A2基因特异性结合,最终导致肿瘤细胞凋亡,目前正在进行将其用于治疗复发或难治性多发性骨髓瘤的Ⅲ期临床试验[69];又如Kahalalide F是来源于海洋软体动物Elysia rufescen的肽类物质,可选择性改变肿瘤细胞的溶酶体膜,干扰溶酶体功能,通过非凋亡机制的死亡程序诱导细胞死亡,其合成类似物Elisidepsin被用于治疗晚期实体瘤患者,目前已进入Ⅱ期临床试验[70]。此外,还有7个来源于海洋动物的药物已成功上市(见表2)。由于从海洋动物中分离的活性物质产量很低,且结构极其复杂,难于化学合成,不能满足毒理、药理、临床等研究的需要,海洋药物的研究与开发一度受到限制。但可以相信,随着生物技术的不断发展以及药理学、有机合成、化学生物学、微生物工程、基因/代谢工程等领域的学科交叉融合和不同领域相互合作,海洋动物活性物质的发现、改造设计以及开发成新药的进度将会大大加快,为人类攻克重大疾病作出贡献。
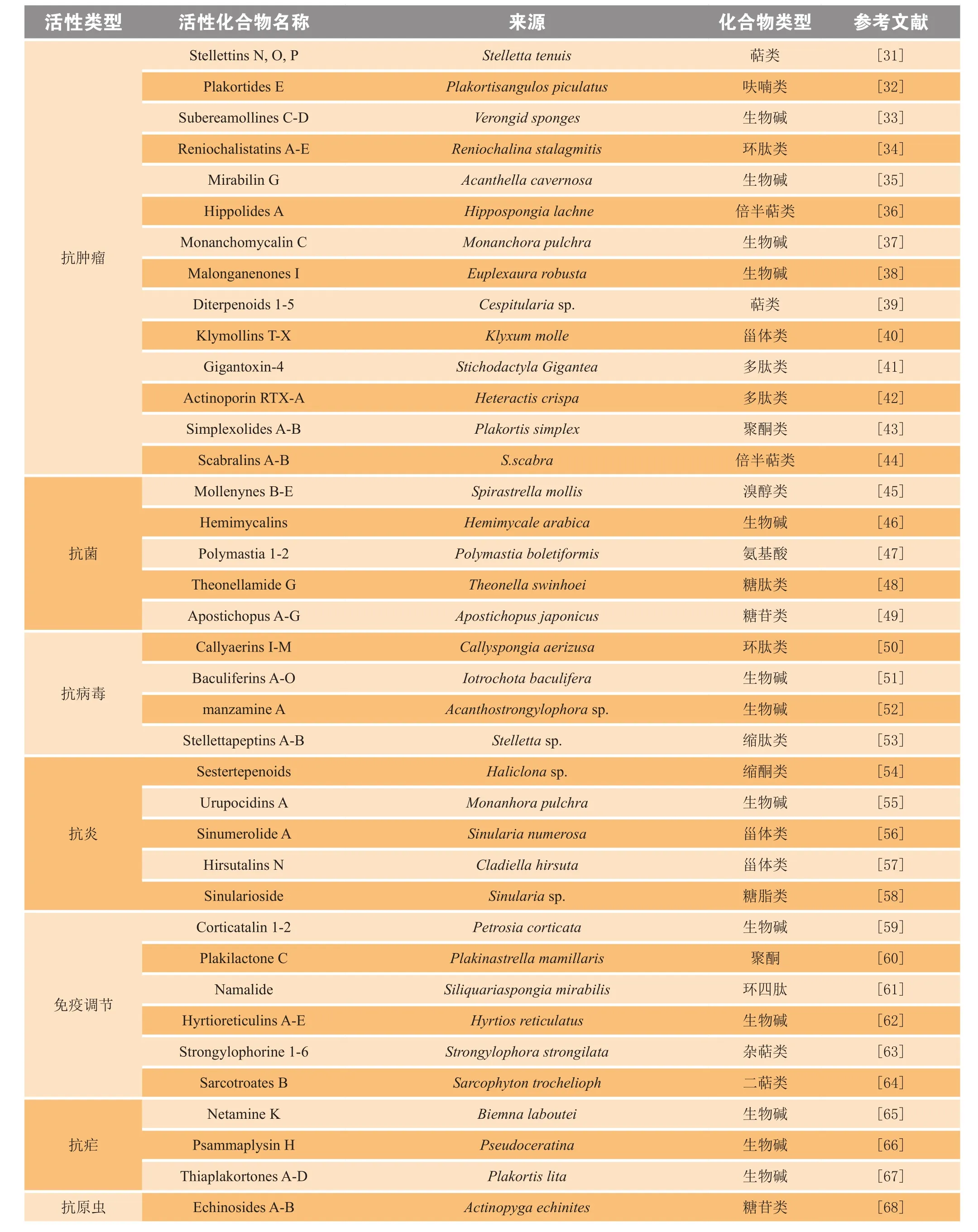
表1 近六年从海洋动物中分离到的活性化合物Table 1 Active compounds isolated from marine animals in the last six years
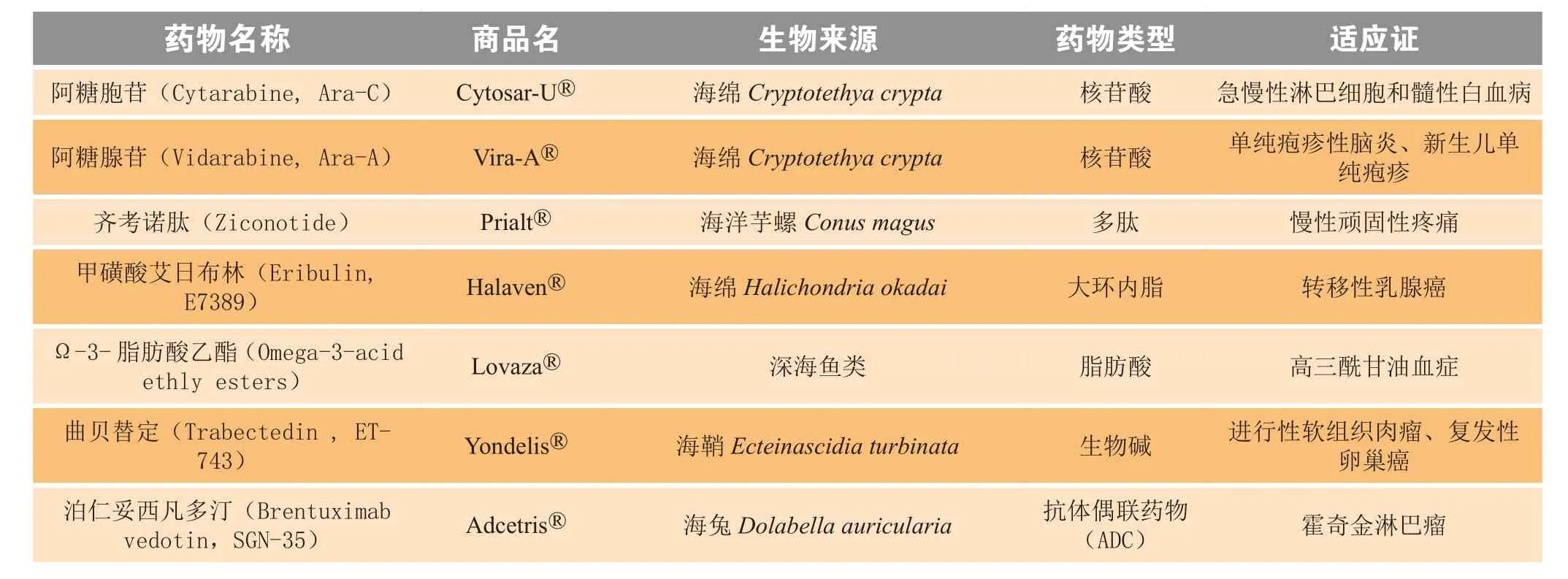
表2 FDA批准上市的海洋动物来源药物Table 2 FDA-approved drugs from marine animals
[1]Joseph B, Sujatha S. Pharmacologically important natural products from marine sponges[J]. J Nat Prod, 2011, 4(1):5-12.
[2]Bae S Y, Kim G D, Jeon J E, et al. Anti-proliferative effect of (19Z)-halichondramide, a novel marine macrolide isolated from the sponge Chondrosia corticata, is associated with G2/M cell cycle arrest and suppression of mTOR signaling in human lung cancer cells [J]. Toxicol in Vitro, 2013, 27 (2): 694-699.
[3]Bae S Y, Song J, Shin Y, et al. Anti-proliferative effect of (19Z)-halichondramide from the sponge Chondrosia corticata via G2/M cell cycle arrest and suppression of mTOR signaling in human lung cancer cells[J]. Cancer Res, 2014,74(19): 4235.
[4]Biegelmeyer R, Schröder R, Rambo D F, et al. Sphingosines derived from marine sponge as potential multi-target drug related to disorders in cancer development[J]. Mar Drugs, 2015, 13 (9): 5552-5563.
[5]Sun S, Canning C B, Bhargava K, et al. Polybrominated diphenyl ethers with potent and broad spectrum antimicrobial activity from the marine sponge Dysidea [J]. Bioorg Med Chem Lett, 2015, 25 (10): 2181-2183.
[6]Shin H J, Rashid M A, Cartner L K, et al. Stellettapeptins A and B, HIV-inhibitory cyclic depsipeptides from the marine sponge Stelletta sp.[J]. Tetrahedron Lett, 2015, 56 (8): 4215-4219.
[7]Orhan I, Sener B, Kaiser M, et al. Inhibitory activity of marine spongederived natural products against parasitic protozoa [J]. Mar Drugs,2010, 8 (1): 47-58.
[8]Tahtouh T, Elkins J M, Filippakopoulos P, et al. Selectivity, cocrystal structures, and neuroprotective properties of leucettines , a family of protein kinase inhibitors derived from the marine sponge alkaloid leucettamine B [J]. J Med Chem, 2012, 55 (21): 9312-9330.
[9]Yamazaki H, Sumilat D A, Kanno S, et al. A polybromodiphenyl ether from an Indonesian marine sponge Lamellodysidea herbacea and its chemical derivatives inhibit tyrosine phosphatase 1B, an important target for diabetes target for diabetes treatment [J]. J Nat Med, 2013, 67: 730-735.
[10]Eguchi K, Fujiwara Y, Hayashida A, et al. Manzamine A, a marinederived alkaloid, inhibits accumulation of cholesterol ester in macrophages and suppresses hyperlipidemia and atherosclerosis in vivo[J]. Bioorg Med Chem, 2013, 21 (13): 3831-3838.
[11]Ahmed S, Ibrahim A, Arafa A S. Anti-H5N1 virus metabolites from the Red Sea soft coral Sinularia candidula [J]. Tetrahedron Lett, 2013, 54(19): 2377-2381.
[12]Lin S T, Wang S K, Duh C Y. Cembranoids from the Dongsha Atoll Soft Coral Lobophytum crassum [J]. Mar Drugs, 2011, 9 (12): 2705-2716.
[13]Taira J, Tsuchida E, Uehara M, et al. Dual biological functions of the apoptotic activity and anti-inflammatory effect by alcyonolide congeners from the Okinawan soft coral, Cespitularia sp.[J]. Bioorg Med Chem Lett, 2015, 25 (20): 4496-4499.
[14]Wen Z H, Chao C H, Wu M H, et al. A neuroprotective sulfone of marine origin and the in vivo anti-inflammatory activity of an analogue[J]. Eur J Med Chem, 2010, 45 (12): 5998-6004.
[15]Zaharenko A J, Picolo G, Ferreira W A, et al. Bunodosine 391: an analgesic acylamino acid from the venom of the sea anemone Bunodosoma cangicum [J]. J Nat Prod, 2011, 74 (3): 378-382.
[16]Ramezanpour M, da Silva K B, Sanderson B J. Venom present in sea anemone (Heteractis magnifica) induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria-mediated pathway [J]. Biotechnol Lett, 2014, 36 (3): 489-495.
[17]Lassen S, Wiebring A, Helmholz H, et al. Isolation of a Nav channel blocking polypeptide from Cyanea capillata medusae-A neurotoxin contained in fishing tentacle isorhizas [J]. Toxicon, 2012, 59 (6): 610-611.
[18]Ding J F, Li Y Y, Xu J J, et al. Study on effect of jellyfish collagen
hydrolysate on anti-fatigue and anti-oxidation [J]. Food Hydrocoll,2011, 25 (5): 1350-1353.
[19]Liu X, Sun Z, Zhang M, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicas[J]. Carbohydr Polym, 2012, 90 (4): 1664-1670.
[20]Thao N P, Cuong N X, Luyen B T, et al. Anti-inflammatory Asterosaponins from the starfish Astropecten monacanthus [J]. J Nat Prod, 2013,76 (9): 1764-1770.
[21]Ivanchina N V, Kalinovsky A I, Kicha A A, et al. Two new Asterosaponins from the far eastern starfish Lethasterias fusca [J]. Nat Prod Commun, 2012, 7 (7): 853-858.
[22]Wang W, Kim H, Nam S J, et al. Antibacterial Butenolides from the Korean tunicate Pseudodistoma antinboja [J]. J Nat Prod, 2012, 75 (12): 2049-2054.
[23]Carroll A R, Nash B D, Duffy S, et al. Albopunctatone, an antiplasmodial anthrone-anthraquinone from the Australian ascidian Didemnum albopunctatum [J]. J Nat Prod, 2012, 75 (6): 1206-1209.
[24]Feng Y, Davis R A, Sykes M L, et al. Antitrypanosomal pyridoacridine alkaloids from the Australian ascidian Polysyncraton echinatum [J]. Tetrahedron Lett, 2010, 51 (18): 2477-2484.
[25]Trong D T, Ngoc B P, Ronald J Q. Structure determination of pentacyclic pyridoacridine alkaloids from the Australian marine organisms Ancorina geodides and Cnemidocarpa stolonifera [J]. Eur J Org Chem, 2014, 22: 4805-4816.
[26]Nuzzo G, Ciavatta M L, Kiss R, et al. Chemistry of the nudibranch aldisa andersoni: structure and biological activity of phorbazole metabolites [J]. Mar Drugs, 2012, 10 (8): 1799-1811.
[27]Mascheka J A, Emily M, Thushara D, et al. Palmadorin chemodiversity from the Antarctic nudibranch Austrodoris kerguelenensis and inhibition of Jak2/STAT5-dependent HEL leukemia cells [J]. Tetrahedron, 2012,68 (44): 9095-9104.
[28]Andrianasolo E H, Haramaty L, McPhail K L, et al. Bathymodiolamides A and B, Ceramide derivatives from a Deep-Sea Hydrothermal Vent Invertebrate Mussel, Bathymodiolus thermophilus [J]. J Nat Prod, 2011,74 (4): 842-846.
[29]Davis R A, Sykes M, Avery V M, et al. Convolutamines I and J,antitrypanosomal alkaloids from the bryozoans Amathia tortusa [J]. Bioorg Med Chem, 2011, 19 (22): 6615-6619.
[30]Carroll A R, Wild S J, Duffy S, et al. Kororamide A, a new tribrominated indole alkaloid from the Australian bryozoans Amathia tortuosa [J]. Tetrahedron Lett, 2012, 53 (23): 2873-2875.
[31]Li Y, Tang H F, Tian X R, et al. Three new cytotoxic isomalabaricane triterpenes from the marine sponge Stelletta tenuis [J]. Fitoterapia,2015, 106: 226-230.
[32]Santos E A, Quintela A L, Ferreira E G, et al. Cytotoxic Plakortides from the Brazilian marine sponge Plakortis angulospiculatus [J]. J Nat Prod, 2015, 78 (5): 996-1004.
[33]Shaala L A, Youssef D T, Badr J M, et al. Bioactive secondary metabolites from the red sea marine verongid sponge Suberea Species [J]. Mar Drugs, 2015, 13 (4): 1621-1631.
[34]Zhan K X, Jiao W H, Yang F, et al. Reniochalistatins A-E, cyclic peptides from the marine sponge Reniochalina stalagmitis [J]. J Nat Prod, 2014, 77 (12): 2678-2684.
[35]Grkovic T, Blees J S, Bayer M M, et al. Tricyclic guanidine alkaloids from the marine sponge Acanthella cavernosa that stabilize the tumor suppressor PDCD4 [J]. Mar Drugs, 2014, 12 (8): 4593-4601.
[36]Piao S J, Zhang H J, Lu H Y, et al. Hippolides A-H, acyclic manoalide derivatives from the marine sponge Hippospongia lachne [J]. J Nat Prod, 2011, 77 (5): 1248-1254.
[37]Tabakmakher K M, Denisenko V A, Guzii A G, et al. Monanchomycalin C, a new pentacyclic guanidine alkaloid from the far-eastern marine sponge Monanchora pulchra [J]. Nat Prod Commun, 2013, 8 (10): 1399-1402.
[38]Zhang J R, Li P L, Tang X L, et al. Cytotoxic tetraprenylated alkaloids from the south China sea gorgonian Euplexaura robusta [J]. Chem Biodivers, 2012, 9 (10): 2218-2224.
[39]Prodip K R, Wilmar M, Michael C R, et al. Five new diterpenoids from an Okinawan soft coral, Cespitularia sp.[J]. Mar Drugs, 2012, 10 (12): 2741-2748.
[40]Liang L F, Kurtán T, Mándi A, et al. Unprecedented diterpenoids as a PTP1B inhibitor from the Hainan soft coral Sarcophyton trocheliophorum Marenzeller [J]. Org Lett, 2013, 15 (2): 274-277.
[41]Ramezanpour M, da Silva K B, Sanderson B J. Venom present in sea anemone (Heteractis magnifica) induces apoptosis in non-small-cell lung cancer A549 cells through activation of mitochondria-mediated pathway [J]. Biotechnol Lett, 2014, 36 (3): 489-495.
[42]Fedorov S, Dyshlovoy S, Monastyrnaya M, et al. The anticancer effects of actinoporin RTX-A from the sea anemone Heteractis crispa [J]. Toxicon, 2010, 55 (4): 811-817.
[43]Liu X F, Song Y L, Zhang H J, et al. Simplextones A and B, unusual polyketides from the marine sponge Plakortis simplex [J]. Org Lett,2011, 13 (12): 3154-3157.
[44]Su J H, Huang C Y, Li P J, et al. Bioactive cadinane-type compounds from the soft coral Sinularia scabra [J]. Arch Pharm Res, 2012, 35 (5): 779-784.
[45]Wang X, Duggan B M, Molinski T F, et al. Mollenynes B-E from the marine sponge Spirastrella mollis. Band-selective heteronuclear single quantum coherence for discrimination of bromo-chloro regioisomerism in natural products [J]. J Am Chem Soc, 2015, 137 (38): 12343-12351.
[46]Youssef D T, Shaala L A, Alshali K Z. Bioactive hydantoin alkaloids from the red sea marine sponge Hemimycale Arabica [J]. Mar Drugs,2015, 13 (11): 6609-6619.
[47]Smyrniotopoulos V, Rae M, Soldatou S, et al. Sulfated steroid-amino acid conjugates from the irish marine sponge Polymastia boletiformis [J]. Mar Durgs, 2015, 13 (4): 1632-1646.
[48]Youssef D T, Shaala L A, Mohamed G A, et al. Theonellamide G, a
ligands of peroxisome proliferator-activated receptor γ [J]. J Med Chem,2012, 55 (19): 8303-8317.
[61]Cheruku P, Plaza A, Lauro G, et al. Discovery and synthesis of namalide reveals a new anabaenopeptin scaffold and peptidase inhibitor [J]. J Med Chem, 2012, 55 (2): 735-742.
[62]Yamanokuchi R, Imada K, Miyazaki M, et al. Hyrtioreticulins A-E,indole alkaloids inhibiting the ubiquitin-activating enzyme, from the marine sponge Hyrtios reticulates [J]. Bioorg Med Chem, 2012, 20 (14): 4437-4442.
[63]Lee J S, Abdjul D B, Yamazaki H, et al. Strongylophorines, new protein tyrosine phosphatase 1B inhibitors, from the marine sponge Strongylophora strongilata collected at Iriomote Island [J]. Bioorg Med Chem Lett, 2015, 25 (18): 3900-3902.
[64]Liang L F, Kurtán T, Mándi A, et al. Unprecedented diterpenoids as a PTP1B inhibitor from the Hainan soft coral Sarcophyton trocheliophorum Marenzeller [J]. Org Lett, 2013, 15 (2): 274-277.
[65]Gros E, Al-Mourabit A, Martin M T, et al. Netamines H-N, Tricyclic alkaloids from the marine sponge Biemna laboutei and their antimalarial activity [J]. J Nat Prod, 2014, 77 (4): 818-823.
[66]Xu M, Andrews K T, Birrell G W, et al. Psammaplysin H, a new antimalarial bromotyrosine alkaloid from a marine sponge of the genus Pseudoceratina [J]. Bioorg Med Chem Lett, 2011, 21 (2): 846-848.
[67]Davis R A, Duffy S, Fletcher S, et al. Thiaplakortones A-D: antimalarial thiazine alkaloids from the Australian marine sponge Plakortis lita [J]. J Org Chem, 2013, 78 (19): 9608-9613.
[68]Melek F R, Tadros M M, Yousif F, et al. Screening of marine extracts for schistosomicidal activity in vitro. Isolation of the triterpene glycosides echinosides A and B with potential activity from the sea cucumbers Actinopyga echinites and Holothuria polii [J]. Pharm Biol, 2012, 50 (4): 490-496.
[69]Pardanani A, Tefferi A, Guglielmelli P, et al. Evaluation of plitidepsin in patients with primary myelofibrosis and post polycythemia vera/ essential thrombocythemia myelofibrosis: results of preclinical studies and a phase II clinical trial [J]. Blood Cancer J, 2015, 5: e286.
[70]Goldwasser F, Faivre S, Alexandre J, et al. Phase I study of elisidepsin(Irvalec®) in combination with carboplatin or gemcitabine in patients with advanced malignancies [J]. Invest New Drugs, 2014, 32 (3): 500-509. potent antifungal and cytotoxic bicyclic glycopeptide from the red sea marine sponge Theonella swinhoei [J]. Mar Drugs, 2014, 12 (4): 1911-1923.
[49]Wang Z, Zhang H, Yuan W, et al. Antifungal nortriterpene and triterpene glycosides from the sea cucumber Apostichopus japonicus Selenka [J]. Food Chem, 2012, 132 (1): 295-300.
[50]Daletos G, Kalscheuer R, Koliwer-Brandl H, et al. Callyaerins from the marine sponge Callyspongia aerizusa: cyclic peptides with antitubercular activity [J]. J Nat Prod, 2015, 78 (8): 1910-1925.
[51]Fan G, Li Z, Shen S, et al. Baculiferins A-O, O-Sulfated pyrrole alkaloids with anti-HIV-1 activity, from the Chinese marine sponge Iotrochota baculifera [J]. Bioorg Med Chem, 2010, 18 (15): 5466-5474.
[52]Palem J R, Bedadala G R, Sayed K A, et al. Manzamine A as a novel inhibitor of herpes simplex virus type-1 replication in cultured corneal cells [J]. Planta Med, 2011, 77 (1): 46-51.
[53]Shin H J, Rashid M A, Cartner L K, et al. Stellettapeptins A and B, HIV-inhibitory cyclic depsipeptides from the marine sponge Stelletta sp.[J]. Tetrahedron Lett, 2015, 56 (40): 5482.
[54]Kyung L, Jung-Rae R. A new sesterterpenoid showing anti-inflammatory effect from the marine sponge Haliclona species [J]. J Korean Magn Reson Soc, 2015, 19 (1): 23-28.
[55]Makarieva T N, Ogurtsova E K, Denisenko V A, et al. Urupocidin A: a new, inducing iNOS expression bicyclic guanidine alkaloid from the marine sponge Monanchora pulchra [J]. Org Lett, 2014, 16 (16): 4292-4295.
[56]Yin C T, Wen Z H, Lan Y H, et al. New anti-inflammatory norcembranoids from the soft coral Sinularia numerosa [J]. Chem Pharm Bull, 2015, 63 (9): 752-756.
[57]Huang T Z, Chen B W, Huang C Y, et al. Eunicellin-based diterpenoids,hirsutalins N-R, from the formosan soft coral Cladiella hirsute [J]. Mar Drugs, 2014, 12 (5): 2446-2457.
[58]Putra M Y, Ianaro A, Panza E, et al. Sinularioside, a triacetylated glycolipid from the Indonesian soft coral Sinularia sp., is an inhibitor of NO release [J]. Bioorg Med Chem Lett, 2012, 22 (8): 2723-2725.
[59]Noda A, Sakai E, Kato H, et al. Strongylophorines, meroditerpenoids from the marine sponge Petrosia corticata, function as proteasome inhibitors [J]. Bioorg Med Chem Lett, 2015, 25 (13): 2650-2653.
[60]Festa C, Lauro G, De Marino S, et al. Plakilactones from the marine sponge Plakinastrella mamillaris. Discovery of a new class of marine

[专家介绍] 奚涛 :博士,教授,博士生导师,现任中国药科大学生物技术研究中心和海洋药物中心主任。现为CFDA新药与保健食品评审专家、江苏省药品监督管理局新药审评专家、卫生部特殊食品评审专家、国家自然科学基金评审专家、国家科技部“863”项目和国际科技合作项目审评专家;担任中国海洋药物学会理事,江苏省药学会生物技术专业委员会秘书长,江苏省药理学会理事等。
多年来主要从事分子药理学和海洋药物研究工作。以抗肿瘤药物靶标和肿瘤发病机制为主要研究方向,建立了系统的肿瘤相关基因筛选,基因功能研究以及microRNA对肿瘤发生、发展及转移的调控研究,抗肿瘤药物作用机制的研究技术平台。在海洋药物研究中,建立了来自南北极地的海洋微生物种子库和海洋微生物次生代谢活性产物研究的技术平台。
Recent Progress in Research on Bioactive Substances from Marine Animals
LI Yanqing, LU Yuanyuan, XING Yingying, XI Tao
(Department of Marine Pharmacy, China Pharmaceutical University, Nanjing 210009, China)
Marine animals have received extensive attention from pharmaceutical researchers because of their great potential in producing bioactive substances with anti-microbial, anti-cancer, anti-viral and immune-regulatory activities. In recent years, several thousand active compounds with novel structures have been isolated from marine animals, laying a solid foundation for the development of new drugs. The latest progress in research on bioactive substances from marine animals such as marine sponge, coral, sea cucumber and ascidiacea were briefly introduced in this paper to provide
for further exploration and utilization of marine animals with medicinal value.
marine animal; anti-cancer; anti-microbial; anti-viral; anti-inflammatory; bioactive substance
R282.77
A
1001-5094(2015)12-0905-10
接受日期:2015-11-20
*通讯作者:奚涛,教授;
研究方向:分子药理学和海洋药学;
Tel:025-83271389;E-mail: xi_tao18@sina.com

