动物毒素及相关药物研究进展
吕秋敏,赖仞
(中国科学院昆明动物研究所动物模型与人类疾病机理重点实验室,云南 昆明650223)
·药用动物资源开发利用·
动物毒素及相关药物研究进展
吕秋敏*,赖仞
(中国科学院昆明动物研究所动物模型与人类疾病机理重点实验室,云南 昆明650223)
动物毒素是指有毒动物毒器分泌的毒液中,结构和功能丰富多样的蛋白质和多肽,其具有高活力、高结构多样性、高专一性等特点,是药物开发的重要资源。综述了动物毒素药物的特点以及进入临床药物和候选药物分子的研究进展,同时分析了我国动物毒素类药物研发中需要重视的问题。
有毒动物;毒素;离子通道;受体
1 动物毒素的药用价值
1.1 动物毒素的特点
动物毒素是有毒动物分泌的毒液中,结构和功能丰富多样的蛋白质和多肽。动物来源的多肽毒素具有如下特性(见图1)。①高活力。自然界亿万年的“加速进化”赋予动物毒素高活力。动物毒素作用于通道和受体的半数有效剂量达到皮摩尔水平,较其他类型活性物质高103~106倍[1]。②高结构多样性。在协同进化驱动下,多数动物毒素具有多拷贝基因和高进化速率的特点,从而呈现出惊人的分子多样性。如每种蜘蛛毒液至少含有300种活性多肽,每种蝎子毒液至少含有100种以上的活性多肽[2]。③高专一性。高度的结构多样性决定了动物毒素的高专一性。动物毒素能有效区分膜通道、受体以及转运体分子,是研究和识别膜通道、受体以及转运体分子的最有效的工具。④高趋同进化。作为动物毒素的主要来源,有毒动物有多种类群,且这些类群的有毒动物在分类学地位上有显著的差异,但由于自然选择的作用,这些不同类群的有毒动物采取了雷同的生物学生存法则[3]。很多不同的有毒动物采用趋同的生存策略,因此这些趋同的生存策略是非常有效的,其策略的物质基础是最完美的活性分子组合。每种有毒动物体内含有很多种毒素分子,且每种毒素分子的作用具有高活性,高专一性,很多都可以作为药物前体分子进行开发,因此被称为“上帝的药方”。⑤高成药率。不同来源的化合物产生新药的概率不同。代谢产物类化合物成药率小于0.3%;人工合成化合物库小于0.001%;而动物毒素多肽中产生新药的概率大于1%,至少是代谢产物类化合物的3倍或人工合成化合物的1 000倍以上。例如,目前只有不到600种的蜘蛛毒素多肽被研究,但在不到10年时间内,这600种毒素多肽中就有10种以上应用于临床[4-5]。⑥高未开发比例。传统的新药研发主要还是集中于小分子化合物。
由于技术和资源等原因,天然活性多肽作为一类特殊的药物研发资源尚未受到足够重视,导致90%以上的天然活性多肽还未被研究和利用。例如,全球超过1 000万种的蜘蛛毒素多肽中被研究的只有不到600种[6]。
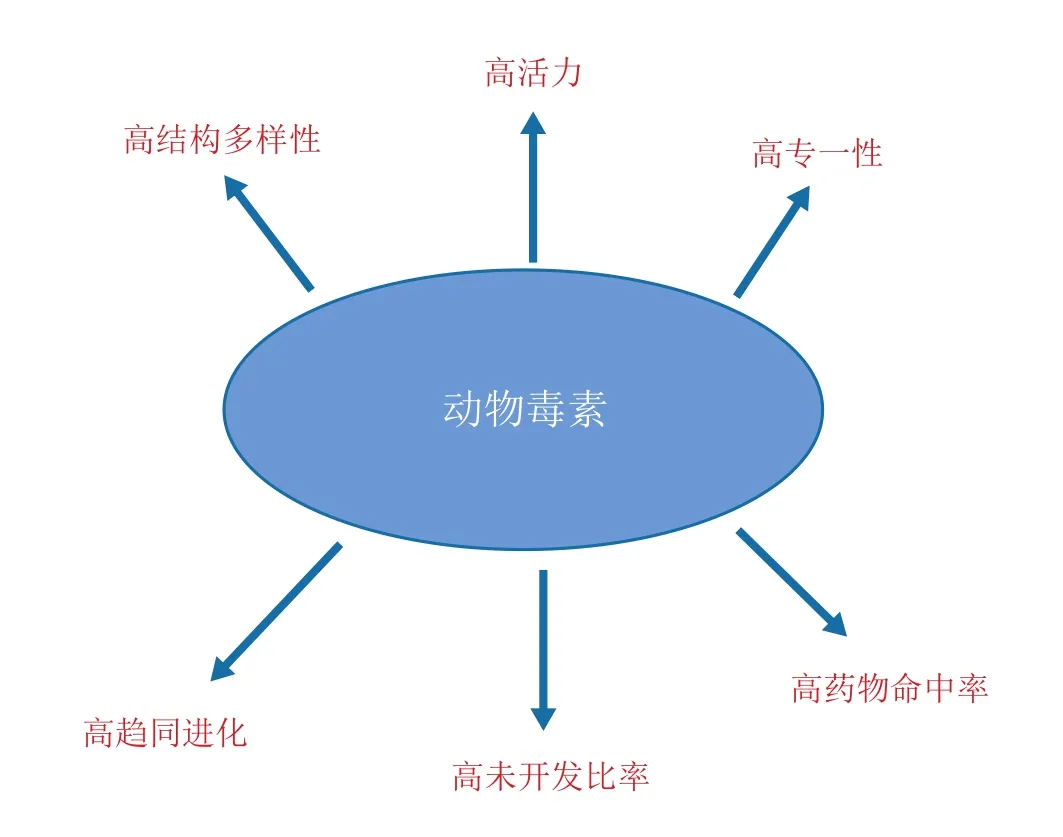
图1 动物毒素的特点Figure 1 Features of animal toxins
1.2 动物毒素与疾病的关系
自然选择的进化造就了人类精巧的身体构造,产生了极为复杂的适应性机制。可以这样简单地理解:人类各种生理过程其实是一种平衡,例如,血液系统中同时存在促凝和抗凝的成分,通过精妙的调控机制使正常生理过程中促凝和抗凝处于平衡态。当这一平衡被打破时,如意外受伤造成出血,机体即会启动促凝机制使血液凝固,防止失血过多[7]。这种平衡态也存在于神经、免疫等系统中,当这些平衡被遗传、外界影响等因素打破,超出机体能够调控的范围,就会导致疾病,如血栓、癌症、感染、疼痛、糖尿病、自身免疫性疾病等。
有毒动物在数亿年的进化过程中,为了捕食、防御等目的,产生了特异性的可以作用于猎物或捕食者机体的各种毒素[1,3]。这些毒素能够使猎物或者捕食者机体在极短时间内失衡,引起血液凝固、疼痛、神经麻痹等,从而使得有毒动物可以成功捕食或者逃脱被捕食得以生存[4]。在利用动物毒素开发药物的过程中,应遵循发挥动物毒素药理学功能,使机体维持或者重建平衡的原理(见图2)。例如,有毒动物利用多肽毒素阻断或抑制被捕食动物的离子通道,通过麻醉作用来达到捕食目的。运用此原理所开发的治疗慢性疼痛的药物能够阻断或者抑制疼痛相关的离子通道[4-5]。很多时候,疼痛的产生是由于疼痛相关的离子通道过度敏感或者过度激活,在一些疾病的治疗过程中也会利用通道或者受体的脱敏,即通道接触到可激活通道的毒素后,会在一定程度上失去对毒素的敏感性。因此在利用动物毒素开发药物时,必须对疾病机制和动物毒素结构与功能这两方面有深入的了解,利用动物毒素抑制或者激活机体本身的调控机制。另一方面,可以利用动物毒素本身的“毒性”来帮助机体清除外界影响,例如利用抗菌肽消灭病原微生物,利用肿瘤细胞特异的多肽抑制肿瘤细胞生长[6]。
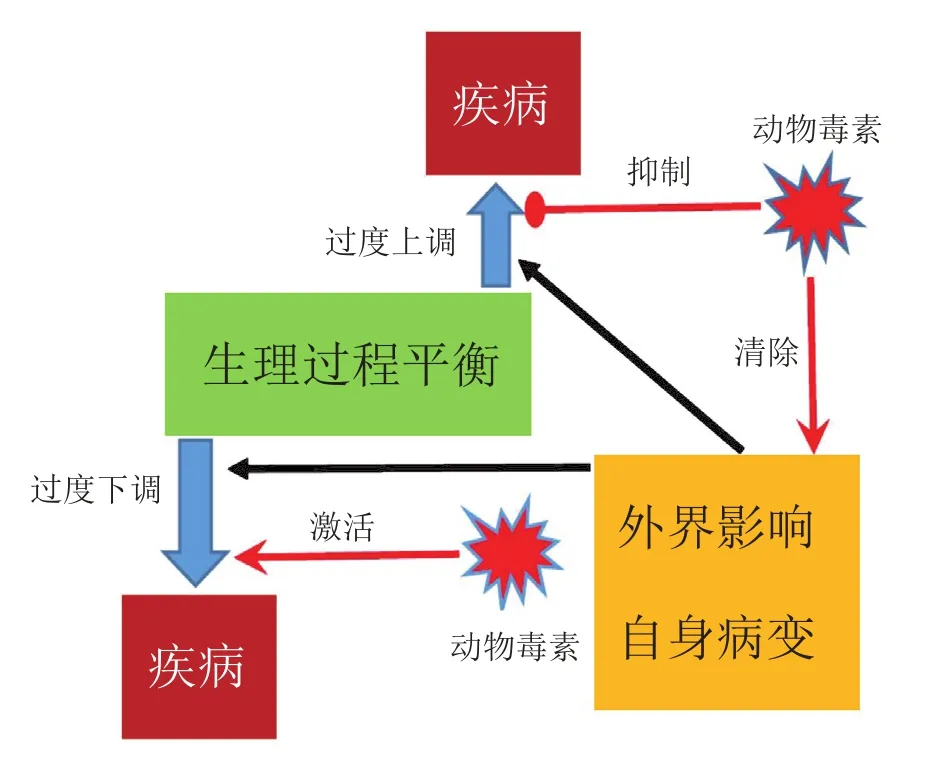
图2 动物毒素与疾病的关系Figure 2 Relationship between animal toxins and human diseases
1.3 动物毒素的作用靶点
动物毒素的药理学作用非常广泛,与血液系统、免疫系统、神经系统中的关键部位联系较为紧密。动物毒素可以分别作用于血液系统的各个因子[7]、补体系统[8]、多种细胞膜受体和离子通道[9-11]等。此外,很多动物毒素对微生物,特别是细菌、真菌有非常强效的杀灭作用[12-13](见图3)。
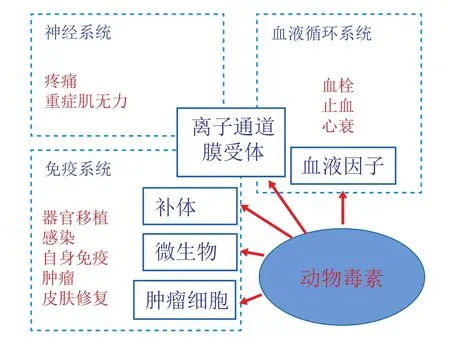
图3 动物毒素的作用靶点和适用疾病Figure 3 The targets and indications of animal toxins
1.4 动物毒素类药物的来源
很多动物为了捕食、消化、防御等,一些器官(如蛇的毒腺、两栖类动物的皮肤、昆虫/节肢动物的唾液腺等)演化出了特殊的功能。这些器官可以分泌活性特异、作用专一的蛋白质和多肽。虽然两栖类动物皮肤分泌物中的多肽和蛋白质并不是严格意义上的“动物毒素”,但是它们由于含量大、活性高而对哺乳动物“有毒”。能分泌动物毒素的动物主要包括爬行动物,例如毒蛇、毒蜥蜴等;两栖动物,如蟾蜍、蛙;软体动物,例如蜗牛、芋螺;刺细胞动物,如海葵、水母等;节肢动物,如蜘蛛、蜱、蜈蚣、蝎子、胡蜂、牛虻等(见图4)[1]。我国具有丰富多样的有毒物种资源,迄今为止已发现芋螺百余种,蝎类30余种,蛇类200余种,两栖类400余种,蜘蛛4 000多种,昆虫数万种以及数量众多的其他有毒动物[1,3]。我国地域广阔、生态复杂,动物多肽毒素的上述特点使它们早已成为天然药物的资源宝库。目前,已经有近50种动物中药材列入我国药典,而全国范围内实际应用的动物中药材有上百种。
2 动物毒素类药物开发实例
2.1 成功开发上市的动物毒素类药物
目前约有60种肽类药物上市,2010年的销售额约为130亿美元(见表1)。此外还有数十种动物毒素来源药物处于临床研究阶段[6-7]。最早开发为药物的动物毒素是从南美矛头蝮中分离的血管紧张素受体抑制剂卡托普利(captopril)。在此基础上,研究人员于1971年合成了舒缓激肽增强肽(bradykinin potentiating peptide);1981年,通过结构改造成功研发出可口服的卡托普利,成为治疗高血压的常规药物[14]。卡托普利研发的成功极大鼓舞了从动物毒素中开发药物。同一时期,国内也开发了一些酶类毒素药物,来源于五步蛇和蛇岛蝮蛇的去纤酶等,也成功地应用于临床[3]。蛇毒来源的酶类被用于血栓治疗,非酶类药物的研发进展很缓慢。直到1998年才研发出了作用于血小板膜受体GPⅡb/Ⅲa的药物埃替非巴肽(eptifibatide)和替罗非班(tirofiban),它们可以抑制血小板聚集,从而防止血液凝固。埃替非巴肽和替罗非班的结构都是模拟蛇毒来源的含有RGD结构的去整合素多肽[15]。在临床中,它们被用于冠心病的治疗和预防。近期成功开发的一些药物来源于具有丰富的结构和功能多样性的芋螺多肽毒素。于2004年被FDA批准上市的齐考诺肽(ziconotide),用于治疗多种慢性疼痛。该药特异性地作用于钙离子通道2.2亚型,可阻断沿脊髓传导的痛觉信号[16]。此外来源于水蛭唾液腺、用于治疗血栓的水蛭素(hirudin)和来源于蜥蜴唾液腺、用于治疗糖尿病的GLP-1[6]也是成功案例。水蛭素为特异性的凝血酶抑制剂,而GLP-1能够抑制胰高血糖素受体[6]。国内在20世纪80年代克痛宁注射液研制的基础上,开发了眼镜蛇毒素来源的口服镇痛药克洛曲[17]。
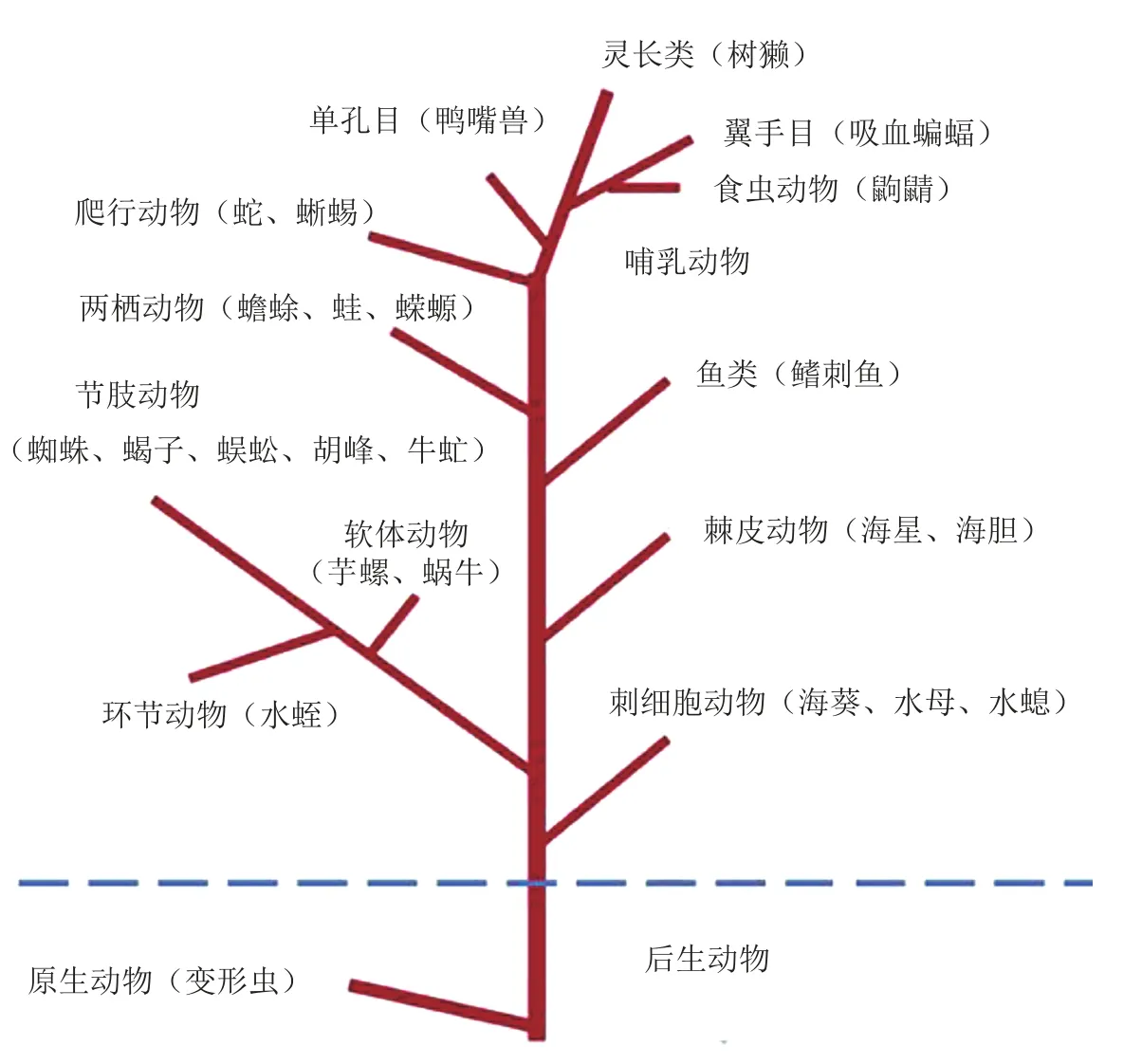
图4 能分泌动物毒素的动物Figure 4 Toxin-secreting animals
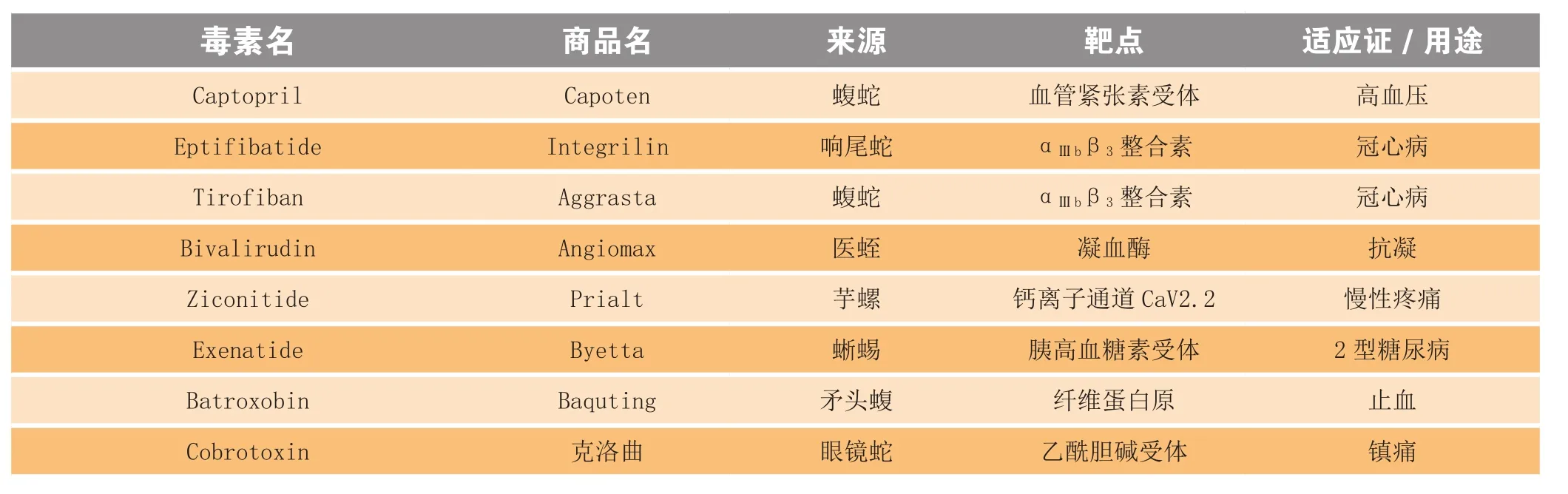
表1 部分已经上市的毒素来源药物[6]Table 1 Examples of marketed drugs developed from animal toxins
2.2 处于临床试验的动物毒素类药物
现今,多种动物毒素来源的多肽处于临床试验阶段(见表2)。继齐考诺肽之后,研究人员还尝试对其他多种芋螺毒素进行开发,但因各种问题终止了临床研究。例如ω-conotoxin CVID的临床试验因为毒副作用而宣告失败[18];另一种芋螺毒素α-conotoxin Vc1.1,其作用机制较为复杂,起初被鉴定为乙酰胆碱受体抑制剂,之后的研究发现它可通过作用于GABA-B受体引起钙离子电流下降,从而抑制疼痛[19]。然而,临床试验显示其疗效不佳。Xen2174是合成的芋螺毒素χ-conopeptide Mr1A的类似物,其可抑制神经元吸收肾上腺素,在动物实验中展示了很好的镇痛效果。虽然通过了Ⅰ期临床研究,但在之后的研究中发现,Xen2174具有剂量依赖性毒性[20]。来源于蝎子的chlorotoxin可以抑制氯离子通道,而且还可以抑制基质金属蛋白酶,具有用于治疗胶质瘤的潜力,也可用于协助其他抗胶质瘤药物的靶向给药[21]。然而,该药物由于其研发公司破产,相关的临床研究也被迫终止。
也有很多毒素药物的临床研究进展顺利。例如,蛇毒来源的心钠素类似物DNP与人源C-型心钠素融合成的新结构分子CD-NP,可以激活心钠素受体A和B[22]。它在慢性心衰病人体内的药动学、药效学、安全性、耐受性试验已完成[23],研究显示其在心肌梗死治疗中对左心室具有保护功能。海葵毒素来源的合成多肽ShK-186是一种钾离子通道抑制剂,正在进行早期临床试验。其可以通过抑制Kv1.3离子通道来治疗T-细胞自身免疫性疾病,如多发性硬化等[23]。河豚毒素(tetrodotoxin)可以抑制多种钠离子通道亚型,目前正在进行将其用于治疗晚期癌症疼痛的临床实验,初期结果显示河豚毒素能够明显减轻病人的疼痛反应[24]。眼镜蛇来源的神经毒cobratoxin经过修饰减毒后可以刺激T-细胞的细胞因子分泌,目前正在进行将其用于治疗多发性硬化、运动神经元疾病、病毒感染的临床试验[25]。
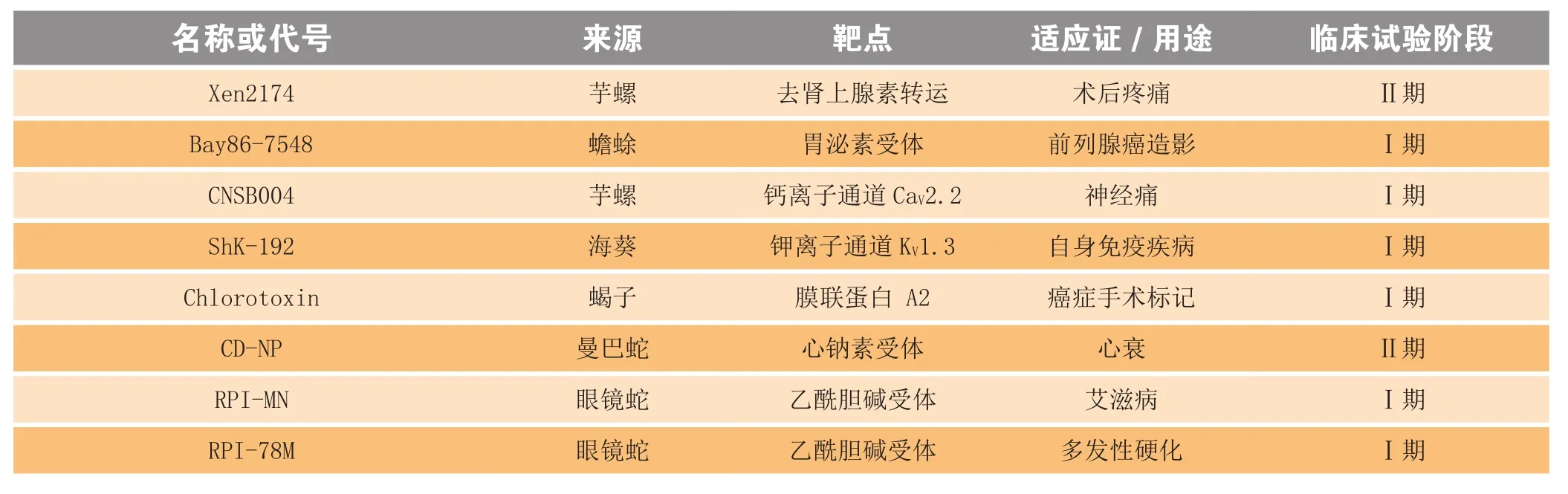
表2 部分处于临床试验阶段的毒素来源药物[6]Table 2 Examples of drugs from animal toxins in clinical trials

续表2
3 具有开发潜力的候选动物毒素
更多数量的动物毒素仍处于临床前研发阶段。研究人员对芋螺毒素的热情毫无减退,最近报道了98个有希望开发为药物的芋螺毒素,它们为具有神经或心脏保护作用的芋螺多肽。其中包括作用于N-甲基-D-天冬氨酸(NMDA)受体的conantokin以及其他一些钾离子通道抑制剂。还有一些芋螺毒素作用于钠离子通道和包括乙酰胆碱受体、神经紧张素受体、去肾上腺素受体、五羟色胺受体等在内的受体。例如μ-conotoxin因具有持续镇痛的作用,获选进入了临床开发,目前研发状态尚未披露[26]。
其他动物如蜘蛛、蛇、蝎子、蜜蜂、马蜂来源的毒素,也均被证明对某些疾病有疗效,其作用多体现在镇痛和癫痫治疗方面[1-6]。例如蜘蛛来源的PcTx1可以抑制ASIC1a酸敏感通道,可以用于镇痛药物开发[27]。来源于澳大利亚蛇类的毒素被用于止血、预防失血、预防内出血,治疗心衰等适应证的相关药物开发[6]。蛇毒来源的毒素也具有镇痛效果,例如眼镜王蛇来源的毒素prohanin虽然是一种乙酰胆碱受体抑制剂,但是却不会麻痹肌肉,它可能作用于一氧化氮相关途径[28]。美洲响尾蛇来源的14肽crotalphine作用于鸦片受体,其作用机制还包括一氧化氮途径,目前在巴西进行临床前研究[29]。最近在黑色曼巴蛇中发现了具有镇痛作用的多肽,可以抑制外周和中枢的酸敏感通道,在多个疼痛模型中被证明有效,该多肽是三指型毒素家族的新成员,被命名为mambalgin[30]。来源于蜈蚣的一个由47个氨基酸构成的多肽µ-SLPTX-Ssm6a对钠离子通道1.7亚型(NaV1.7)具有抑制作用,其对NaV1.7具有高度选择性,对其他离子通道没有作用或作用很弱。在疼痛模型小鼠中进行的研究表明,µ-SLPTX-Ssm6a具有比吗啡更强效的镇痛作用[31-32]。除了用作药物外,某些动物毒素还被开发为杀虫剂,例如来源于蜘蛛的一些离子通道抑制剂[33]。
我国湖南师范大学与北京大学未名生物工程公司合作研发的国家1类新药——N-型钙通道抑制剂HWAP-I具有强效镇痛作用,已完成临床前研究,获得临床试验批文。军事医学科学院从芋螺中发现的专一作用于N型钙通道的抑制剂SO-3,镇痛活性高于临床药物齐考诺肽,目前即将完成临床前试验。上海大学研究人员考察了东亚钳蝎多肽毒素对疼痛或镇痛动物模型的行为学影响,发现蝎毒中含有多种致痛/镇痛或癫痫/抗癫痫的膜钠或钾通道型活性成分[1,3]。中国科学院昆明动物研究所发现超过1 000种抗菌肽,其中来源于金环蛇毒和蛙皮肤的抗菌肽被国际同行评价为迄今为止发现的最具潜力的抗感染候选药物[34];从传统抗血栓中药材牛虻中发现了大量的抗血栓多肽,包括抗血小板集聚因子、凝血酶抑制剂、抗凝血丝氨基酸蛋白酶、纤维蛋白原水解酶、血管舒张因子、免疫抑制剂多肽、抗菌肽、透明质酸酶、抗氧化的金属硫蛋白等九大类共56种功能分子,这些活性物质主要作用于宿主的心血管系统和免疫系统,发挥抗血液凝固、抗血栓和抗免疫排斥反应等作用[35-36];从蛙类皮肤中发现了20种抗氧化多肽,这些多肽具有强大和快速的氧化自由基清除能力,由这些多肽组成的抗氧化体系被称为“第3套抗氧化系统”[37];从两栖动物皮肤中发现多个具有促进皮肤伤口愈合的多肽,细胞和动物模型研究表明,它们可以促进细胞的迁移和粘附,促进皮肤损伤动物模型皮肤愈合。它们通过激活NF-κB和c-Jun细胞信号通路而导致TGF-β的表达上调,进而再通过活化TGF-β的下游Smads通路而发挥一系列的细胞效应。该类小肽能促进内源性促创伤愈合因子(如TGF-β1)的表达而不产生促有丝分裂活性[38-39];从少棘蜈蚣毒液中分离得到一种多肽,可以调控疼痛相关的TRPV1通道[40]。同样来源于少棘蜈蚣毒液的一个KV1.3离子通道抑制剂κ-SLPTX-Ssm4a,可专一结合在KV1.3通道上,能够有效抑制T细胞的增殖,但对T细胞没有杀伤性。另外,其可以有效抑制诸如TNF-α、IL-2、IL-23等许多与牛皮癣发病相关的细胞因子的表达。
在转基因银屑病模型小鼠中进行的研究表明,该药物能有效防止银屑病的复发;与常规药物相比,该药具有疗效好,治疗周期短,不易复发等优势(该项研究结果尚未发表)。
4 动物毒素类药物研发应注意的问题
总体来说,大分子蛋白与多肽类药物开发的成功率要高于小分子化合物。此类药物退出临床的主要原因为无效(30%)、毒性(30%)、商业原因(20%),成功率为10%左右[41]。从动物毒素药物开发的成功和失败当中,我们应该注意以下一些问题。
4.1 毒素分子挖掘和功能评价技术
由于动物毒素的有效成分大多是多肽和蛋白类,而多肽与蛋白质的生物活性容易受到破坏,因此需要较为温和、低温的提取与分离纯化条件,对整个提取与分离纯化过程采用比较苛刻的管理与操作,才可能保证动物毒素的有效成分的功能与活性不被破坏。在对动物毒素的有效成分进行功能识别时,需要选择合适、更为敏感的细胞模型与动物模型。应整合多种技术,包括生物信息学技术、结构测定技术、蛋白质组学技术、电生理技术、分子生物学技术、细胞生物学技术、动物行为学和动物模型等,并注重技术创新。
4.2 有效性和毒性验证模型
虽然基因组学和其他现代生物技术的发展迅速,但是不能以药物对单一靶点的作用来判定药物对疾病的影响。运用系统性的生物学功能分析可以正确反映疾病的病理学,为了提高有效性,在动物毒素药物开发中必须兼顾高通量筛选和系统性评估。不同物种的同一生理过程中的关键靶点可能是不同的,在采用动物模型评价毒性和药效时,应摸索合适的动物模型。可尽量采用和人类较为接近的树鼩、猕猴等动物模型。
4.3 以毒素分子为工具进行人类重大疾病机制的研究
自然界上亿年的“加速进化选择”赋予了动物毒素高活力、高专一性和多样性。它们可以作用于人体的多种器官和组织,其分子结构和很多人类分子具有同源性[42]。动物毒素的多样性与结构特征、动物毒素对非膜蛋白分子靶点和细胞膜通道及受体的选择性、动物毒素与膜通道及受体相互作用、动物毒素应用基础等方面的研究均是今后应予以关注的重点,开展上述领域的研究,形成后基因组时代以动物毒素功能为基础、以解析重大疾病发病机制,发现新药物作用靶点和创制动物毒素药物为导向的创新药物研发网络体系和平台,从而为毒素药物研发提供理论和技术支撑。
4.4 我国特有的有毒动物类资源的调查与保护
应加强对有毒动物及其生存环境的保护,对资源量较少的种类应设立专门的自然保护区。对有毒动物的生态习性、繁殖规律、资源量和可更新能力进行调查研究。建立养殖基地,开展对珍稀、濒危有毒动物的人工养殖、放养等。在资源调查的基础上,建立和完善动物毒素资源库(毒素基因文库,多肽毒素组学库,有毒动物种质资源库等)与数据库。同时要注意知识产权的保护。这些工作对有毒动物伤害的防治与有毒动物资源的保护、开发和可持续利用有着深远的意义。
5 展望
许多动物毒素是高效、专一的酶,或是离子通道和受体的抑制剂/激活剂,是解析人类重大疾病机制的工具和治疗人类疾病的优秀先导药物分子,有巨大的临床应用潜力。然而,动物毒素药物的开发过程中也存在诸多问题,例如多肽药物的开发中有一些制约因素(如半衰期短、稳定性差、给药方式特殊、口服生物利用度低等)[43],目前已有研究人员展开了动物毒素的筛选、设计和优化工作,以克服上述缺陷[44]。可以相信,随着现代药物生物技术手段的发展以及对人类重大疾病机制认识的加深,我们定能加快从动物毒素资源宝库中筛选、优化和设计出药效和安全性良好的药物的进程,造福人类。
[1]Zhang Y. Why do we study animal toxins [J]. Zool Res, 2015, 36 (4): 183-222.
[2]Yan S, Wang X. Recent advances in research on widow spider venoms and toxins [J]. Toxins (Basel), 2015, 7(12):5055-5067.
[3]梁宋平. 动物多肽毒素及其药物学研究 [J]. 湖南师范大学学报:医学版, 2012, 9(1): 1-5.
[4]Casewell N R, Wüster W,Vonk F J, et al. Complex cocktails: the evolutionary novelty of venoms [J]. Trends Ecol Evol, 2013, 28(4): 219-229.
[5]Prashanth J R, Brust A, Jin A H, et al. Cone snail venomics: from novel biology to novel therapeutics [J]. Fut Med Chem, 2014, 6(15): 1659-1675.
[6]King G F. Venoms as a platform for human drugs: translating toxins into therapeutics [J]. Expert Opin Biol Ther, 2011, 11(11): 1469-1484.
[7]Kini R M. Toxins in thrombosis and haemostasis: potential beyond imagination [J]. J Thromb Haemost, 2011, 9 (Suppl 1): 195-208.
[8]Vogel C W, Fritzinger D C, Gorsuch W B, et al. Complement depletion with humanised cobra venom factor: efficacy in preclinical models of vascular diseases [J]. Thromb Haemost, 2015, 113(3): 548-552.
[9]Kalia J, Milescu M, Salvatierra J, et al. From foe to friend: using animal toxins to investigate ion channel function [J]. J Mol Biol, 2015, 427(1): 158-175.
[10]de Lera Ruiz M, Kraus R L. Voltage-gated sodium channels: structure,function, pharmacology, and clinical indications [J]. J Med Chem, 2015,58(18):7093-7118.
[11]Wexler P. Encyclopedia of Toxicology [M]. Pittsburgh: Academic Press,2014: 252-259.
[12]Bordon K C, Wiezel G A, Amorim F G, et al. Arthropod venom Hyaluronidases: biochemical properties and potential applications in medicine and biotechnology [J]. J Venom Anim Toxins Incl Trop Dis,2015, 21:43.
[13]Van Dessel N, Swofford C A, Forbes N S. Potent and tumor specific: arming bacteria with therapeutic proteins [J]. Ther Deliv, 2015, 6(3): 385-399.
[14]Camargo A C, Ianzer D, Guerreiro J R, et al. Bradykinin-potentiating peptides: beyond captopril [J]. Toxicon, 2012, 59(4): 516-523.
[15]Lincoff A M. What role for glycoproteinIIb/IIIa inhibition in contemporary coronary intervention [J]. JACC Cardiovasc Interv, 2015,8(12): 1583-1585.
[16]Pope J E, Deer T R, Kramer J. A systematic review: current and future directions of dorsal root ganglion therapeutics to treat chronic pain [J]. Pain Med, 2013, 14(10): 1477-1496.
[17]吕秋敏, 赖仞, 张云. 动物毒素与人类疾病: 从单一成分到组学研究,从理化性质到疾病机理, 从粗毒利用到理性药物设计 [J]. 动物学研究, 2010, 31(1): 2-16.
[18]Kolosov A, Goodchild C S, Cooke I. Studies of synergy between morphine and a novel sodium channel blocker, CNSB002, in rat models of inflammatory and neuropathic pain [J]. Pain Med, 2010, 11(1): 106-118.
[19]Adams D J, Berecki G. Mechanisms of conotoxin inhibition of N-type(CaV2.2) calcium channels [J]. Biochim Biophys Acta, 2013, 1828(7): 1619-1628.
[20]Lewis R J. Discovery and development of the χ-conopeptide class of analgesic peptides [J]. Toxicon, 2012, 59(4): 524-528.
[21]Zhao L, Shi X, Zhao J. Chlorotoxin-conjugated nanoparticles for targeted imaging and therapy of glioma [J]. Curr Top Med Chem, 2015,15(13): 1196-1208.
[22]Vink S, Jin A H, Poth K J, et al. Natriuretic peptide drug leads from snake venom [J]. Toxicon, 2012, 59(4): 434-445.
[23]Chi V, Pennington M W, Norton R S, et al. Development of a sea anemone toxin as an immunomodulator for therapy of autoimmune diseases [J]. Toxicon, 2012, 59(4): 529-546.
[24]Hagen N A, Lapointe B, Ong-Lam M, et al. A multicentre open-label safety and efficacy study of tetrodotoxin for cancer pain [J]. Curr Oncol,2011, 18(3): e109-e116.
[25]Harvey A L. Toxins and drug discovery [J]. Toxicon, 2014, 92: 193-200.
[26]Essack M, Bajic V B, Archer J A. Conotoxins that confer therapeutic possibilities [J]. Mar Drugs, 2012, 10(6): 1244-1265.
[27]Klint J K, Senff S, Rupasinghe D B, et al. Spider-venom peptides that target voltage-gated sodium channels: pharmacological tools and potential therapeutic leads [J]. Toxicon, 2012, 60(4): 478-491.
[28]Koh C Y, Kini R M. From snake venom toxins to therapeutics--cardiovascular examples [J]. Toxicon, 2012, 59(4):497-506.
[29]De Marco Almeida F, de Castro Pimenta A M, Oliveira M C, et al. Venoms, toxins and derivatives from the Brazilian fauna: valuable sources for drug discovery [J]. Acta Physiol Sin, 2015, 67 (3): 261-270.
[30]Diochot S, Baron A, Salinas M, et al. Black mamba venom peptides target acid-sensing ion channels to abolish pain [J]. Nature, 2012,490(7421): 552-555.
[31]Yang S, Xiao Y, Kang D, et al. Discovery of a selective NaV1.7 inhibitor from centipede venom with analgesic efficacy exceeding morphine in rodent pain models [J]. Proc Natl Acad Sci USA, 2013, 110(43): 17534-17539.
[32]Hakim M A, Yang S, Lai R. Centipede venoms and their components: resources for potential therapeutic applications [J]. Toxins (Basel), 2015,7(11):4832-4851.
[33]Smith J J, Herzig V, King G F, et al. The insecticidal potential of venom peptides [J]. Cell Mol Life Sci, 2013, 70(19): 3665-3693.
[34]Xu X, Lai R. The chemistry and biological activities of peptides from amphibian skin secretions [J]. Chem Rev, 2015, 115(4): 1760-1846.
[35]Ma D, Wang Y, Yang H, et al. Anti-thrombosis repertoire of bloodfeeding horsefly salivary glands [J]. Mol Cell Proteomics, 2009, 8(9): 2071-2079.
[36]An S, Ma D, Wei J F, et al. A novel allergen Tab y 1 with inhibitory activity of platelet aggregation from salivary glands of horseflies [J]. Allergy, 2011, 66(11): 1420-1427.
[37]Yang H, Wang X, Liu X, et al. Antioxidant peptidomics reveals novel skin antioxidant system [J]. Mol Cell Proteomics, 2009, 8(3): 571-583.
[38]Mu L, Tang J, Liu H, et al. A potential wound-healing-promoting peptide from salamander skin [J]. FASEB J, 2014, 28(9): 3919-3929.
[39]Liu H, Duan Z, Tang J, et al. A short peptide from frog skin accelerates diabetic wound healing [J]. FEBS J, 2014, 281(20):4633-4643.
[40]Yang S, Yang F, Wei N, et al. A pain-inducing centipede toxin targets the heat activation machinery of nociceptor TRPV1 [J]. Nat Commun, 2015,6: 8297.
[41]Arrowsmith J, Miller P. Trial watch: phase II and phase III attrition rates 2011-2012 [J]. Nat Rev Drug Discov, 2013, 12(8): 569.
[42]Kalia J, Milescu M, Salvatierra J, et al. From foe to friend: using animal toxins to investigate ion channel function [J]. J Mol Biol, 2015,427(1):158-175.
[43]Rashid M H, Mahdavi S, Kuyucak S. Computational studies of marine toxins targeting ion channels [J]. Mar Drugs, 2013, 11(3): 848-869.
[44]Santos P L, Guimaraes A G, Barreto R S, et al. A review of recent patents on the ASICs as a key drug target [J]. Recent Pat Biotechnol,2015, 9(1):30-41.

[专家介绍] 吕秋敏:男,1972年6月生。中国科学院昆明动物研究所副研究员,专注于动物毒素蛋白多肽家族的结构功能、作用机制和生物学意义等方面的研究,为临床治疗药物的开发提供先导结构。参与完成一个新药(克洛曲)的临床前和临床研究。在国际SCI核心刊物发表论文全文40余篇,获中国专利3项,获省部级科学技术奖二等奖多项。
Advances in Research on Animal Toxins and Related Drugs
LYU Qiumin, LAI Ren
(Key Laboratory of Animal Models and Human Disease Mechanisms of Chinese Academy of Sciences & Yunnan Province, Kunming Institute of Zoology, Kunming 650223, China)
Animal toxins are secreted by venom apparatus of venomous animals and contain a group of proteins and peptides with diverse structures and functions. With potent activity, high selectivity and rich structural diversity, animal toxins become important resources for new drug development. In this paper, the features of animal toxin-derived drugs as well as advances in research on drugs in clinical studies and candidate molecules were reviewed. At the same time, important issues on the research and development of animal toxin-derived drugs in China were also discussed.
venomous animal; toxins; ion channel; receptor
Q956;R282.74
A
1001-5094(2015)12-0897-08
接受日期:2015-11-01
*通讯作者:吕秋敏,副研究员;
研究方向:天然活性多肽;
Tel:0871-5199086;E-mail: lvqm@mail.kiz.ac.cn

