颞叶癫痫患者rs-fMRI功能连接及其与记忆功能关系的研究
邓艳青,黄华品,车春晖,邓丽霞,陈琳,魏笑凡,孙斌,林海龙,林霖
颞叶癫痫患者rs-fMRI功能连接及其与记忆功能关系的研究
邓艳青1,黄华品2a,车春晖2a,邓丽霞2a,陈琳2a,魏笑凡2a,孙斌2b,林海龙2b,林霖2b
目的:分析颞叶癫痫患者静息态磁共振(rest-fMRI)功能连接及其与记忆功能之间的关系,探讨其脑功能连接的异常及其对记忆障碍诊治的应用价值。方法:对16例颞叶癫痫患者(癫痫组)和与之相匹配的16例健康对照者(对照组)进行静息态脑功能成像和记忆功能测评,比较2组间的脑区差异,分析与记忆功能相关的脑区。结果:癫痫组与对照组比较,海马与全脑功能连接增高的脑区有:左侧旁中央小叶、左侧中央前回、左侧中央后回、左侧前运动皮质和辅助运动区、左侧内侧额叶等;减低的脑区有:右侧小脑、左侧颞上回等。癫痫组海马与全脑功能连接与记忆商呈正相关的脑区有:双侧前扣带回、双侧楔前叶/后扣带回等;呈负相关的脑区有:左侧额下回、左侧中央后回等。结论:左侧旁中央小叶、左侧中央前回、左侧中央后回、左侧前运动皮质和辅助运动区、左侧内侧额叶等脑区可能构成颞叶癫痫患者的癫痫网络,在癫痫发生和发展过程中起重要作用;右侧小脑、左侧颞上回等脑区的功能异常可能与颞叶癫痫患者认知功能损伤有关。双侧前扣带回、双侧楔前叶/后扣带回、左侧额下回、左侧中央后回等脑区与海马之间的功能连接与记忆相关,其对记忆功能具有潜在临床预测价值。
颞叶癫痫;记忆功能;静息态功能磁共振;双侧海马;功能连接
癫痫(epilepsy)是神经科仅次于脑血管疾病的第二大高发疾病,目前我国癫痫患病率高达 0.7% [1],其中20%~30%为难治性癫痫,以颞叶癫痫(temp oral lobe epilepsy,TLE)最为常见,颞叶内侧前部切除术为主要治疗手段,精确定位癫痫灶和功能区(如语言、记忆)能有效降低颞叶切除术后认知障碍的风险。本文通过研究TLE患者静息态功能磁共振(reststate fMRI)功能连接及其与记忆功能之间的关系,探讨其脑功能连接的异常在记忆障碍中的应用价值,为确定记忆功能脑区、评价癫痫患者记忆功能提供客观的依据。
1 资料与方法
1.1 一般资料
选取2012年1月至2013年3月福建医科大学附属协和医院神经内科门诊和住院部诊治的TLE患者16例为癫痫组,男11例,女5例;年龄13~38岁,平均(23.8±1.5)岁。纳入标准:①符合国际抗癫痫联盟癫痫发作的分类诊断方案(2001),并参考Pittau[2]和Manford等[3]的TLE诊断标准,符合以下2项或2项以上条件者:临床发作症状提示致癫痫灶位于颞叶;影像学检查提示海马硬化或萎缩;发作期或发作间期内EEG提示致癫痫灶位于颞叶。②病程≥1年,发作频率≥1次/年。排除标准:脑部结构异常(海马硬化除外)、颅内感染等病史;长期酗酒和药物滥用史;长期服用抗癫痫药物以外的药物;存在严重认知障碍或精神异常,合作不良者。同时选取16例健康体检者为对照组,男10例,女6例;年龄18~30岁,平均(24.3±0.8)岁。入组标准:无任何系统性疾病及神经系统症状体征;无神经系统疾病家族史;头部MRI检查正常。所有入选者皆为右利手。2组年龄、性别、教育程度均匹配,差异无统计学意义(P>0.05);癫痫组记忆商低于正常组(P<0.05)。记忆测评采用中国科学院心理研究所编制的临床记忆量表乙套,所有受试者均在试验前签署知情同意书。
1.2 方法
嘱受检者静息平卧闭目,平静呼吸,使用泡沫头垫固定头部,最大限度减少头部及其他部位的主动和被动运动,同时要求受试者尽量不要思考,不要入睡,使用橡皮耳塞降低噪音。MRI扫描采用美国GE公司生产的MR750 3.0 T超导磁共振机,配套头部正交线圈。静息态fMRI扫描序列采用梯度回波单次激发的平面回波成像序列(GRE-EPI序列),层厚5mm,间隔0,TR 2 000ms,TE 35ms,翻转角80°,分辨率64×64,FOV 240mm,矩阵64×64,进行BOLD fMRI扫描,扫描层数35层,扫描时间6’10”,前10”不做数据采集,共180个时相。解剖图像采用三维快速扰相梯度翻转恢复(3D SPGR)序列:TR 24ms,TE 6ms,FA35%,层厚0.9mm,FOV 220mm&220mm,矩阵256&256。2组均行常规T1WI及T2WI以除外脑部实质性病变。
采用静息态脑功能数据辅助处理(data processing assistant forresting-state fMRI,DPARSF)软件,预处理包括转换数据格式、去除前10个时间点、时间点校正、头动校正(去除平移超过2.5mm或者旋转角度超过2.5°的数据)、空间标准化、平滑(Smoothing,FWHM均设为4)、去线性漂移、滤波(设定频段为 0.01~0.08Hz)。在AAL模版中选取37(左侧海马)、38(右侧海马)双侧海马为种子点(ROI),然后通过REST中Reslice image重采样,最后生成3 cm×3 cm×3 cm大小的图像。将选定的ROI(双侧海马)与全脑所有体素逐一地进行FC分析,得到全脑功能连接图(反映双侧海马与全脑的功能连接情况),使用Fisher r-to z变换将相关系数转化为Z值待分析。
1.3 统计学处理
采用REST软件,采用单样本t检验分析2组各组的功能连接(A lphaSim校正P<0.05后最小体素85);双样本t检验分析2组的组间差异(模版为癫痫组和对照组单样本 t检验并集的 MASK,AlphaSim校正P<0.05后最小体素46)。将癫痫组zFC图像与其记忆商作相关(默认MASK,A lphaSim校正P<0.05后最小体素85),得出癫痫组中与记忆商呈相关的脑图。完成校正后将图片导出并保存对应图片的Cl report文档。
2 结果
2.1 海马与全脑功能连接情况
癫痫组海马与全脑功能连接高于对照组的脑区有:左侧旁中央小叶、左侧中央前回、左侧中央后回、左侧前运动皮质和辅助运动区、左侧内侧额叶等脑区;低于对照组的脑区有:右侧小脑、左侧颞上回等脑区,见表1、图1。

表1 2组海马与全脑zFC的差异
2.2 癫痫组海马与全脑功能连接与记忆商的相关关系(默认MASK)
癫痫组海马与全脑功能连接与记忆商呈正相关的脑区有:双侧前扣带回、双侧楔前叶/后扣带回等脑区;呈负相关的脑区有:左侧额下回、左侧中央后回等脑区,见表2、图2。
3 讨论
本文发现癫痫组海马与全脑功能连接高于对照组的脑区包括左侧旁中央小叶、左侧中央前回、左侧中央后回、左侧前运动皮质和辅助运动区、左侧内额叶等脑区。这些脑区负责躯体的运动和感觉功能,双侧海马与这些脑区的功能连接增强,组成了癫痫网络,可能与癫痫发作时口角歪斜、眼球上翻、肢体的抽搐等异常有关。研究者采用基于低频振荡幅度算法的EEG-fMRI技术对TLE研究,结果显示在双侧中央运动区均异常的有低侧频振荡,认为可能是癫痫发作时肢体抽搐、口角歪斜等行为异常的原因[4]。Zeng等[4]用ReHo的方法研究内侧颞叶癫痫患者在静息态下的脑活动,发现双侧感觉运动皮质增高,与本研究结果一致。
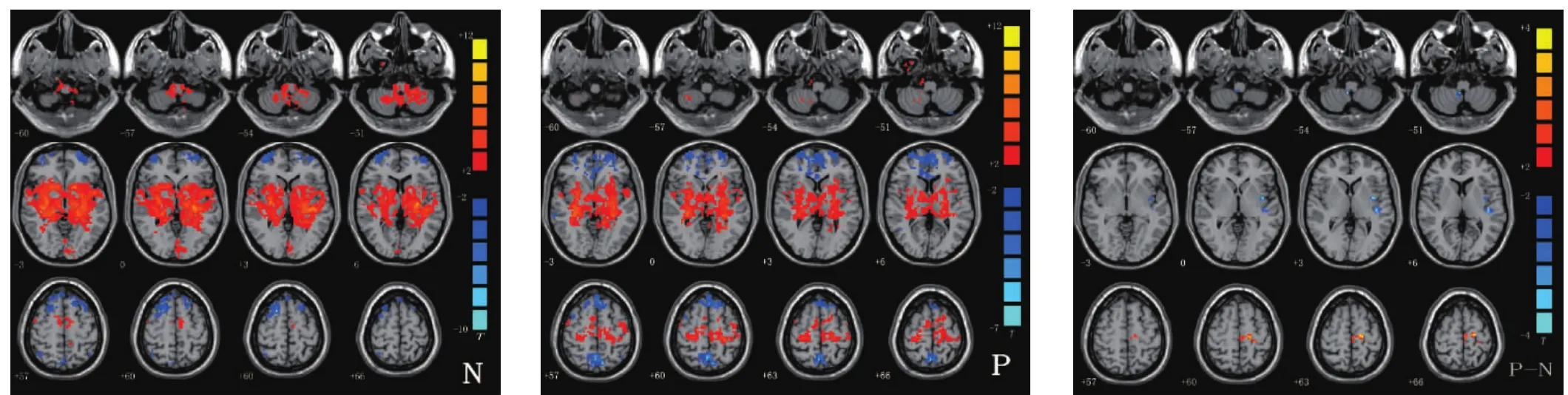
图1 癫痫组和对照组海马与全脑zFC的差异
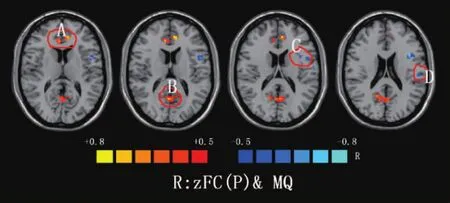
图2 癫痫组海马与全脑功能连接及记忆商的相关性
癫痫组海马与全脑功能连接低于对照组的脑区包括右侧小脑、左侧颞上回等脑区。张志强等[5]将TLE与正常人振幅相比,减弱的脑区为双颞上回、小脑后叶的广泛区域 ;成文莲等[6]、Zeng等[4]利用基于ReHo的统计方法,发现在静息状态下,患者大脑的局域一致性在小脑后叶等脑区则表现为降低,与本研究结果一致。过去认为小脑仅与运动协调、姿势调整与精细运动密切相关。但是最近研究表明,小脑功能远超出这些,小脑还参与高级认知功能,如语言[7]、情绪处理过程[8]。在神经心理学研究中发现小脑损害者可出现执行功能、学习和记忆、注意和人格障碍等认知功能障碍,结合本研究结果,双侧海马与小脑功能连接减弱可能是影响癫痫患者认知功能的另一机制[9,10]。小脑在癫痫患者中的作用不明,现在有研究认为小脑对癫痫活动起着抑制作用[11-13]。颞上回位于外侧裂与颞上沟之间,包括初级听觉皮质和Wernicke区两个重要的脑功能区。初级听觉皮质负责对声音的感知,优势半球的Wernicke区是感觉性语言中枢,与躯体感觉、听觉和视觉相关的联络皮质有广泛联系。研究显示颞上回在记忆编码和再现时出现激活,表明颞上回与记忆过程有关[14]。杨志根等[15]尝试用独立成分分析(independent componentanalysis,ICA)对15例单侧TLE患者和17例正常对照的缺省网络模式进行分析,结果表明TLE患者的缺省模式网络大部分区域连接度下降,其中,以前额叶和同侧颞上回明显。胡崇宇等[16]采用静息态功能磁共振研究部分性发作癫痫患者功能磁共振默认网络模式网络功能连接的改变时,也发现左侧颞上回病人组较正常组低,与本研究结果一致。结合本研究结果,癫痫患者认知功能减退可能与小脑、颞上回的功能连接减弱有关。
本研究表明癫痫组海马与全脑功能连接与记忆商呈正相关的脑区有双侧前扣带回/内侧前额叶、双侧楔前叶/后扣带回等脑区。研究者认为PCu主要负责高度整合的任务[17],包括维持觉醒状态[20,21]、情景记忆[5]和视空间的表像等。研究发现TLE患者的pC/pCC无论是功能还是结构的连接均显著降低[20]。楔前叶是静息态代谢率最高的激活脑区,静息时要比其他脑皮质多消耗35%的葡萄糖。楔前叶的功能被分为4大类:视空间意象、情景记忆提取、自我处理以及意识[17]。张洪英[21]、Wang[22]、Doucent等[23]、Holmes等[24]研究发现后扣带回与海马之间的功能连接强度与情景记忆测试得分具有相关性。McCorm ick等[25]研究TLE患者后扣带回与海马之间的功能连接,结果显示后扣带回与病侧海马在术前连接度越强,术前记忆越强,术后记忆损害越严重;后扣带回与对侧海马连接度越强,术后记忆减退越少;说明海马与扣带回之间的联系与患者的记忆功能密切相关。与本研究结果一致。本研究发现双侧海马与前扣带回/内侧前额叶也成正相关,Doucet等[23]研究发现在右侧TLE患者中,左侧内侧颞叶与内侧前额叶的功能连接与延迟记忆即非语义记忆呈正相关,说明内侧颞叶与内侧前额叶的连接度与记忆功能相关。本研究结果提示双侧海马与后扣带回、前扣带回之间的功能连接强度与记忆商呈正相关,其对记忆功能具有潜在的预测价值。
癫痫组海马与全脑功能连接与记忆商呈负相关的脑区有左侧中央后回、左侧额下回等脑区。中央后回是目前比较公认的癫痫网络的一部分;越来越多的影像学证据支持额下回也构成m TLE网络,参与mTlE的发生发展[26]。其与双侧海马功能连接越强,表示癫痫更易扩散,患者发病频率越高,认知功能特别是记忆功能损伤越严重。癫痫组双侧海马与左侧中央后回、左侧额下回的功能连接度与记忆商呈负相关,其对记忆功能具有潜在的临床预测价值。
综上所述,TLE患者静息态脑功能连接与正常对照组存在差异,这些差异脑区对于理解癫痫的发生发展和大脑认知功能的异常具有非常重要的作用。癫痫患者静息态功能连接与其记忆测评相关的脑区在功能定位以及临床预后预测和评估上具有一定的应用前景。
[1]王文志,吴建中,王德生等.中国五省农村人群癫痫流行病学抽样调查.中华医学杂志, 2002,82:449-452.
[2]Pittau F,Grova C,Moeller F,et al.Patterns of altered functional connectivity in mesial temporal lobe epilepsy [J].Epilepsia,2012,53: 1013-1023.
[3]Manford M,Fish DR,Shorvon SD.An analysis of clinical seizure patterns and their localizing value in frontal and temporal lobe epilepsies[J]. Brain,1996,19:17-40
[4]Zeng H,Pizarro R,Nair VA,et al.Alterations in regional homogeneity of resting-state brain activity inmesial temporal lobeepilepsy[J]. Epilepsia,2013,54:658-666.
[5]张志强,卢光明,钟元等.低频振幅算法功能磁共振成像对双侧海马硬化颞叶癫痫的研究[J].中华医学杂志,2008,88:1594-1598.
[6]成文莲,钱志余,张志强等.基于ReHo方法的颞叶癫痫功能磁共振成像研究[J].生物物理学报,2008,24:460-464.
[7]Katanoda K,Yoshikawa K,Sugishita M.A functional MRI study on the neural substrates for writing[J].Hum Brain Mapp,2001,13:34-42.
[8]Sm ith KA,Ploghaus A,Cowen PJ,et al. Cerebellar responses during anticipation of noxiousstimuli in subject recovered from depression .Functional magnetic resonance imaging study[J]. Br JPsychiatry,2002,181:411-415.
[9]Konarski JZ,M cIntyre RS,Grupp LA,et al. Is the cerebellum relevant in the circuitry of neuropsychiatric disorders? [J]. J Psychiatry Neurosci,2005,30:178-186.
[10]JD Schmahmann,JB Weilburg,JC Sherman.The neuropsychiatry of the cerebellum-insights from the clinic[J].Cerebellum,2007,6: 254-267.
[11]Engel J,Pedley TA.Epilepsy:a comprehensive textbook [M]. Philadelphia: Lippincott-Raven,1998:133-157,323-341.
[12]Kohsaka S,Kohsaka M,M izukam i S,et al. Bm instcm activates paroxysmal discharge in human generalized epilepsy[J].Brain Res,2001, 903:53-61.
[13]Hamandi K,Salek-Haddadi A,Laufs H,et al.EEG-fMRIof idiopathic and secondarily generalized epilepsies[J].Neuroimage,2006,31: 1700-1710.
[14]Fletcher PC,Frith CD,Grasby PM,et al. Brain systems for encoding and retrieval of auditory-verbalmemory.An in vivo study in humans [J].Brain,1995,118:401-416.
[15]杨志根,王惠南,张志强等.基于ICA的颞叶癫痫缺省模式网络的研究[J].生物物理学报, 2008,24:291-297.
[16]胡崇宇,高小平,肖波等.部分性发作癫痫患者静息状态功能磁共振默认模式网络的功能连接改变 [J].中华神经科杂志,2012,45: 478-483.
[17]Cavanna AE,Trimble MR.The precuneus: a review of its functional anatomy and behavioural correlates [J].Brain,2006,129: 564-583.
[18]Vogt BA,Laureys S.Posterior cingulate, precuneal and retrosplenial cortices:cytology and components of the neural network correlates of consciousness[J].Prog Brain Res,2005,150: 205-217.
[19]Spectrums C.The Precuneus and Consciousness[J].Cns Spectrums,2007,12:545-552.
[20]LiaoW,Zhang Z,Pan Z,etal.Default mode network abnormalities in mesial temporal lobe epilepsy:a study combining fMRI and DTI[J]. Hum Brain Mapp,2011,32:883-895.
[21]张洪英,王世杰,杨明等.静息状态功能磁共振成像观察轻度阿尔茨海默病后扣带回功能连通性的变化[J].中华神经科杂志,2008,4l: 471-475.
[22]Wang L,Laviolette P,O'Keefe K,eta1.Intrinsic connectivity between the hippocampus and posteromedial cortex predictsmemory performance in cognitively intact older individuals [J].Neuroimage,2010,52:910-917.
[23]Doucet G,Osipow icz K,Sharan A,et al. Extratemporal functional connectivity impairments at rest are related to memory performance inmesial temporalepilepsy[J].Hum Brain Mapp, 2013,34:2202-2216.
[24]Holmes M,Folley BS,Sonmezturk HH,et al.Resting state functional connectivity of the hippocampus associated w ith neurocognitive function in left temporal lobe epilepsy[J].Hum Brain Mapp,2014,35:735-744.
[25]M cCorm ick C,Quraan M,Cohn M,et al. Default mode network connectivity indicates episodic memory capacity in mesial temporal lobeepilepsy[J].Epilepsia,2013,54:809-818.
[26]Blumenfeld H,M cNally KA,Vanderhill SD,eta1.Positive and negative network correlations in temporal lobe epilepsy[J].Cereb Cortex, 2004,14:892-902.
(本文编辑:王晶)
Correlation between Brain Functional Connection with Resting State fMRI and Memory Function in Patients with Temporal Lobe Epilepsy
DENG Yan-qing,HUANG Hua-pin,CHEChun-hui,DENG Li-xia,CHEN Lin,WEIXiao-fan,SUN Bin,LIN Hai-long,LIN Lin.Department of Neurology,Renmin Hospital of Shiyan,Hubei442000,China
Objective:To analyze the relationship between brain functional connection using resting state fMRI and memory function in patients with temporal lobe epilepsy; To explore the characteristics of connectivity of rest-fMRI in patients with temporal lobe epilepsy and its value in evaluating the memory impairment. Methods: Rest-fMRI scanning and neuropsychological-scale memory function test were performed in 16 patients with temporal lobe epilepsy and 16 gender, age and educational levels matched normal controls. The difference of brain connectivity was compared between the two groups and the areas related with memory were to explored. Results: Compared with normal control group, patients with temporal lobe epilepsy showed higher connectivity in regions of bilateral hippocampus and whole brain including left paracentral lobule, left precentral gyrus, left postcentral gyrus, left premotor cortex and supplementary motor area, left medial frontal brain regions. The following areas in patients presented lower connectivity than the normal controls including right cerebellum, left superior temporal gyrus The positive correlation between the brain connection and memory funciton was found in bilateral anterior cingulate gyrus, bilateral precuneus / posterior cingulate; The negative correlation between brain connection and memory function existed in left inferior frontal gyrus, left postcentral gyrus. Conclusion: The left paracentral lobule, left precentral gyrus, left postcentral gyrus, left premotor cortex and supplementary motor area, left medial frontal brain areas may constitute epilepsy network in patients with temporal lobe epilepsy, which may play an important role in the pathological process of epilepsy. The function abnormalities of right cerebellum, left superior temporal gyrus may be related to cognitive impairment in patients with temporal lobe epilepsy. The connectivity in Bilateral anterior cingulate gyrus, bilateral precuneus / posterior cingulate, left inferior frontal gyrus, left postcentral gyrus is relevant to memory function.
temporal lobe epilepsy; memory function; the resting state fMRI; bilateral hippocampus; functional connectivity
R741;R742.1;R741.04
A DOI 10.3870/sjsscj.2015.06.013
1.十堰市人民医院神经内科1病区湖北十堰442000 2.福建协和医院 a.神经内科b.影像科福州350000
2015-01-13
邓艳青 495560637@qq.com

