白腐菌降解木质素的研究进展(综述)
李阿敏 李国庆 常 艳 蔡永萍* 林 毅 聂 凡 陈静娴
白腐菌降解木质素的研究进展(综述)
李阿敏1李国庆2常 艳1蔡永萍1*林 毅1聂 凡2陈静娴2
(1.安徽农业大学生命科学学院,合肥 230036;2.安徽省农业科学院园艺研究所,合肥 230031)
白腐菌能够分泌木质素降解酶,具有较强的降解木质素能力。利用白腐菌的木质素酶系统可以降解秸秆,提高秸秆的营养价值和利用率。通过参阅分析34种相关文献和研究心得,从降解木质素的白腐菌种类,白腐菌降解木质素的主要时期,白腐菌降解木质素途径、条件,以及木质素降解分子生物学等方面综述白腐菌降解木质素的研究进展。
白腐菌;木质素降解酶;降解产物;分子生物学
秸秆富含营养物质,其主要成分为纤维素、半纤维素和木质素。其中,木质素是由聚酚化合物组成的大分子聚合物,是结构复杂、稳定、多样的无定形三维体型大分子,其与半纤维素以共价键形式结合,将纤维素分子包埋在其中,形成一种天然屏障,使微生物不易与纤维素分子接触,降低秸秆的利用率和营养价值。常用的破除木质素的方法有辐射、蒸汽爆破、膨化、研磨、酸解法、碱处理法、氧化处理法、有机溶剂法等,但这些传统的物理、化学方法仅可脱除植物纤维原料中约50%的木质素,且带来了高能耗、二次污染等一系列问题[1]。用生物法降解木质素不仅可以减轻环境污染,节省能耗,还可以变废为宝,实现秸秆资源再利用。
自然界参与降解木质素的微生物种类有真菌、放线菌和细菌等,但迄今为止最有效、最主要的木质素降解微生物是白腐真菌,可彻底降解木质素使之成为CO2和H2O。白腐真菌是一类丝状真菌,因附生在树木或木材上,引起木质白色腐烂而得此名。分类学上,白腐真菌属于真菌门,绝大多数为担子菌纲,少数为子囊菌纲。本文将从分类、生理生化、分子生物学等方面综述白腐菌降解木质素的研究进展。
1 降解木质素的白腐菌种类
降解木质素的真菌大致分为三类:白腐菌、褐腐菌和软腐菌。根据白腐菌优先降解细胞壁成分的不同可将其分为两类:第一类,既降解木质素,又降解纤维素和半纤维素,代表菌株为少数黄孢原毛平革菌(P.)[3];第二类,优先降解木质素,后降解纤维素和半纤维素,代表菌株为粗毛栓菌、平菇[2,4]。本实验室研究发现大多数糙皮侧耳菌株()如苏平1号、皖平1号、苏平3号、黑平A等菌株优先降解秸秆中木质素,后降解纤维素和半纤维素[2]。
在处理秸秆的微生物中,以第二类白腐菌为重要,研究它可为生物降解秸秆、提高秸秆的营养价值以及消化率奠定基础。白腐菌可广泛应用于木材、秸秆等木质纤维素的降解,可将稻草、麦秆等多种难以降解利用的农业废弃物转变为有价值的产品,用作动物饲料或其他食品[4];还可利用白腐菌的木质素酶系统对有机污染物、生物异源物质和工业废弃物等进行有效的降解。
2 降解木质素的主要时期
白腐菌的生长分为菌丝体和子实体两个时期。黄慧等[5]用黄孢原毛平革菌处理玉米秸秆,发现前15天内木质素降解率不高,15天后则出现木质素含量大幅度下降。这是因为前15天主要进行菌丝体生长,该过程消耗较多营养物质,在所需营养物质不足时,木质素降解酶开始对秸秆中的木质素进行分解。分解进行到第35~40天,培养基中营养物质、水分等已基本耗尽,pH、固液比等已不适宜菌体生长,菌体对秸秆木质素的分解也达到最大限度。
李晓博[6]对双孢蘑菇的研究结果,木质素降解最快的时期是在原基形成前,认为双孢菇营养生长阶段对木质素的养料需求较多。本实验室研究糙皮侧耳降解棉秸发现,各菌株对木质素、纤维素降解率,营养生长阶段均高于子实体阶段,说明菌株降解木质素主要发生在营养生长阶段[2,7]。潘迎捷也发现香菇木质素降解主要在营养生长阶段[8]。由上述可知,白腐菌降解木质素主要发生在原基形成前的营养生长阶段。
3 降解木质素的途径
3.1 降解途径
白腐菌对木质素的降解主要分为两步:先利用菌丝进行吸附,然后分泌酶对木质素分解进行催化反应。在H2O2存在的条件下,漆酶(Laccase)、锰过氧化物酶(Manganese peroxidase),以及木质素过氧化物酶(Lignin peroxidase)协同作用于连接木质素结构单元之间的酯键或醚键,使木质素分解成单个的结构单元,然后再进一步催化苯丙烯醇之间的Cα-Cβ键断成两分子的苯丙烯醇,最后苯丙烯醇链降解为小分子的化合物而完成木质素的降解[9]。白腐真菌降解木质素的代谢途径[10]、漆酶的催化反应机理[11]、木质素过氧化物酶和锰过氧化物酶的催化反应机理,分别如图1、图2和图3、图4所示[12]。
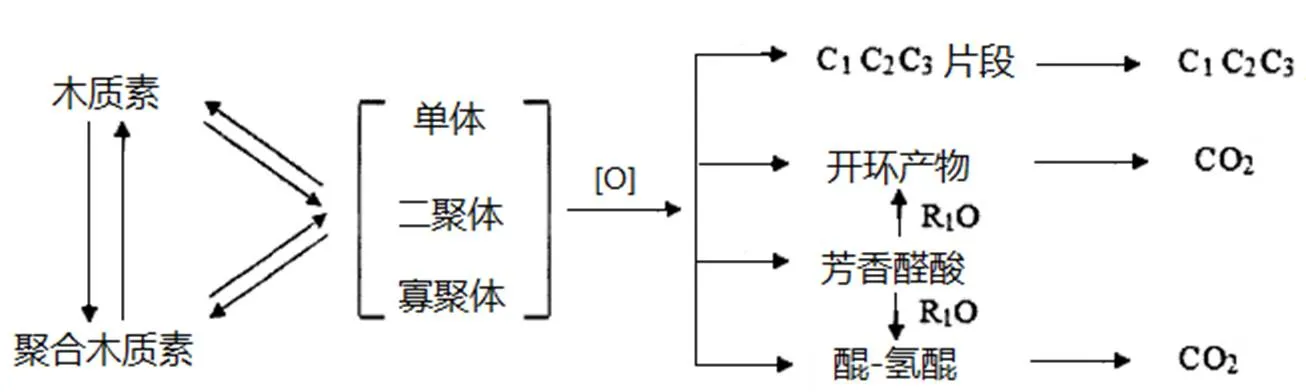
图1 白腐菌降解木质素的代谢途径
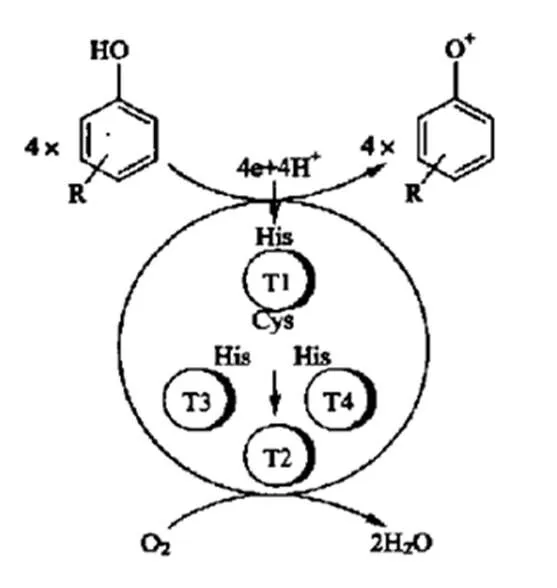
图2 漆酶的催化循环
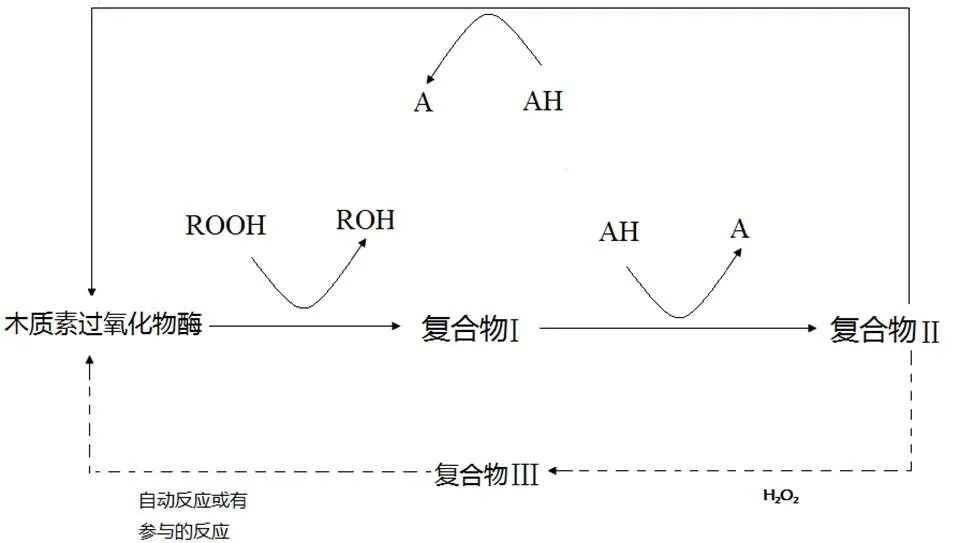
图3 木质素过氧化物酶的催化反应机理
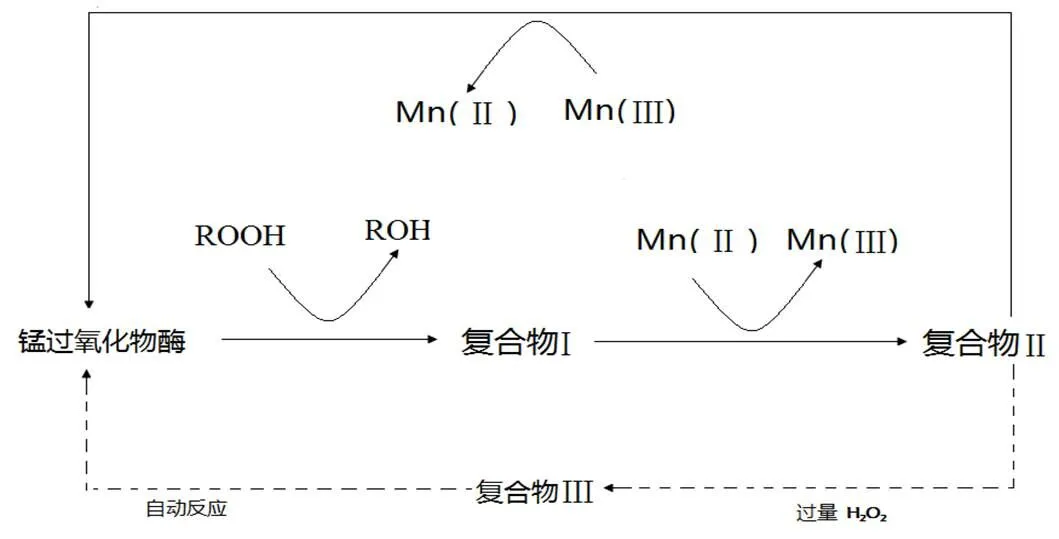
图4 锰过氧化物酶的催化反应机理
3.2 木质素降解酶活性与结构功能
(1)木质素降解过程中酶活性的变化。白腐菌分泌的木质素降解酶活性阶段性变化因种类不同而有异;也可能因栽培料成分、含量的不同导致诱导产生木质素降解酶的活性不同。此外,这些酶的活性阶段性变化不同还可能与其担负着如子实体发育等其他功能有关。潘迎捷等[13]研究发现,香菇和糙皮侧耳在菌丝开始生长时就表现出较高的胞外漆酶活性,当菌丝生长到25~30天时酶活性迅速上升达到最高峰,之后又急剧下降;原基形成时,糙皮侧耳胞外漆酶的活性较低,甚至降到最低点。路等学等研究发现[14],茶薪菇的漆酶和过氧化物酶活性均随栽培时间的延长而逐渐降低。李娟等[15]也发现金顶侧耳的漆酶和过氧化物酶活性均随栽培时间的延长而逐渐降低。Turner[16]研究发现香菇的胞外漆酶活性栽培前期较高,后期逐渐消失。周长青等[17]以白灵菇为研究材料,发现胞外漆酶在菌丝生长阶段(接种至后熟结束)较低,催蕾阶段大幅升高,到子实体生长阶段又持续降低。
(2)木质素降解酶的结构与功能分析。检测、分离、纯化白腐菌木质素降解酶,研究其生化性质、氨基酸序列(N末端)、降解酶晶体结构,有助于揭示其功能与催化作用机制。目前关于白腐菌木质素降解酶的结构与功能的具体研究结果有:漆酶的C-尾部羧基基团与His140形成氢键,参与质子传递,影响酶活性、稳定性以及动力学特性;T1位置附近有保守三肽,三肽调节O2的运输。锰过氧化物酶含有10个主螺旋,1个副螺旋,分布在两个区域,各含一个Ca2+,含有5个二硫键,第5个二硫键为其特有,有2个糖基化位点,其功能与增强酶的热稳定性有关,使蛋白C-端尾部远离主体,利于形成Mn结合位点。木质素过氧化物酶分子量38~43 kD,单个LiP分子含有8个主螺旋,3条短的反平行折叠片,其功能为在以H2O2为辅助底物时,催化木质素分子间的β-O-4键。
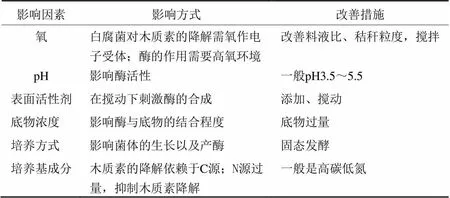
表1 影响白腐菌降解木质素的外界条件
4 降解木质素的条件
白腐菌胞外的降解酶系催化完成木质素的降解,因此凡影响降解酶系活性的因素都将直接影响木质素的降解效果,如氧(料/液比)、培养基成分(碳源、氮源、维生素及矿物质元素等)、pH、缓冲成分、底物浓度以及培养方式等。目前外界条件对白腐菌降解木质素影响的相关研究见表1。
5 降解木质素产物分析
将木质素转化成单体物质的方法有物理法(高温、高压)、酸或碱催化法,以及生物法。但总的来说,物理法效率低、研磨细化或爆破的成本高,化学法存在二次污染问题,而生物法采用微生物进行降解,可以将秸秆的木质纤维素分解为小分子的碳水化合物,高效、无污染,还可实现一定的经济价值。
由于木质素降解不完全,其降解产物可以分为低分子木质素降解产物和高分子木质素降解产物两大类。对于低分子降解产物的分离,主要采用溶剂抽提,首先经乙酸乙醋抽提,而后把抽提产物进行不同强度的碱性溶液分级处理。木质素低分子降解产物又可分成低分子酚类、低分子酸类和中性组分,通过对得率的计算表明,中性物质含量很少,低分子酚类和低分子酸类是木质素降解产物的主要组分。对于高分子降解产物的分离,在降解之前先用苯醇溶剂抽提,之后再用乙酸乙酯抽提除去低分子降解产物。有研究表明,木质素在降解的初期产生的高分子物质有醌式结构以及ą-羧基酸。
气相色谱是通过对比未知组分的保留时间与相同条件下标准物质的保留时间来实现对化合物的定性分析的。用该法来处理复杂样品时很难得到理想的鉴定结果[18]。另外气相色谱法还具有对样品处理要求高、衍生化不彻底等缺点,所以近年来常采用液相色谱、气-质联仪法定量分析木质素降解产物[19]。
付时雨等[20]研究发现木质素降解过程中主要发生了氧化反应,并且木质素低分子量降解产物的主要组分是低分子酚和低分子酸。进一步的研究发现这些低分子酸主要包括紫丁香酸、香草酸、对羟基苯甲酸及其衍生物,证实木质素生物降解过程发生了侧链Cα-Cß键的氧化断裂。通过计算愈创木基、紫丁香基、对羟基苯基的比例,还可证明生物降解过程中木质素的愈疮木基与对羟苯基结构单元优先降解。
邓勋等[4]研究糙皮侧耳对稻草中木质素的降解,产物中检测出大量含有苯环的小分子,如紫丁香基、愈创木基等,证明木质素聚合体的降解首先发生在单体的侧链及单体间的连键上,出现Cα-Cβ、β-O-4等断裂,形成了单体。在进一步的降解过程中,糙皮侧耳表现出其自身特有的降解机制,取代苯环单体上的甲氧基为甲基,而后发生苯环的开裂,这与报道的白腐菌降解过程有所不同。
对比生物降解前后木质素分子结构发现,经过生物处理后的木质素α-羰基含量增加同时产生芳香羧酸结构,形成这种结构与侧链氧化以及Cα-Cβ裂解直接相关。有研究进一步推测在侧链氧化时,苯环也被氧化裂解。Ellwardt等[21]使用13C-NMR对木质素生物处理时发生苯环开裂的推断提供了更为直接的证据。根据其研究结果,木质素经过生物处理后产生如下几种化合物:α-芳香羧酸,为Cα-Cβ, 氧化裂解产物;香草醇,可能为α-芳香羧酸还原产物或包括Cα-Cβ氧化裂解在内的其他反应途径产物;芳香乙酸或芳香乙醇,可能来自β-芳基醚结构的Cα-Cβ氧化裂解。Enoki等[22]利用白腐真菌处理带有β-芳基醚键的模型化合物4-乙氧基-3-甲氧基酚丙三醇-β-愈创木基醚得到降解产物2-(邻甲氧基酚)乙醇也证实了β-芳基醚键的断裂。另外,通过芳香乙酸还原或其他途径也可以得到芳香乙醇结构。
6 木质素降解分子生物学研究进展
6.1 白腐菌木质素降解酶基因克隆
为了深入了解食用菌分泌的各种酶参与木质素降解的机理,人们从分子生物学角度进行研究。自从Germann等在1986年利用RT-PCR技术首先从粗糙脉孢菌中克隆出漆酶基因以来[23],迄今已经有大约30种不同来源的漆酶基因被克隆和测序,包括粗糙脉孢菌、栓菌、偏肿革裥菌、糙皮侧耳漆酶等(表2)。

表2 白腐菌木质素降解酶基因克隆
6.2 白腐菌降解酶基因的表达
鉴于木质素降解酶的作用底物非常广泛,它们在制浆造纸废水处理、生物漂白、有毒环境污染物转化、农业秸秆处理、染料脱色,以及能源开发等很多领域具有非常高的潜在价值,成为近年来倍受关注的环境友好型材料[29]。但是,目前限制这些酶广泛应用的重要因素是产量低,价格昂贵。解决该问题的一个可行办法是进行相关酶基因的克隆与表达,以期获得高产酶菌株。同时还要进一步研究酶的分离、纯化工艺,提高分离、纯化的效率,从而降低酶的生产成本,使其得到更广泛的应用。
Sun H. R. 等[30]在多孔菌中过表达漆酶,发现相较于野生型而言,过表达菌株的漆酶活力、对RBBR染料的脱色能力、木质素总重量损失率,以及木质素损失率都提高了很多。孙亚范[31]将木质素过氧化物酶在毕赤酵母中表达,以黎芦醇为底物进行酶活测定,得到最高胞外木质素过氧化物酶活力为1997 U/L,较出发菌株(899 U/L)提高了122.1%。T. Irie等[32]将重组的锰过氧化物酶基因在糙皮侧耳中同源表达,结果显示MnP活性比野生型高好几倍。但是基因的表达仍然会受到一定因素的影响,例如:N端加工以及糖基化作用会影响蛋白质的分泌,C端的加工则可能调控着酶的活性,C端加工位点突变或C端被截短会影响漆酶的活性[33]。漆酶的光谱学、动力学、定点突变及重组漆酶的研究表明,还原电势的高低决定着真菌漆酶的活性高低,即还原电势越高,漆酶活性越大。另外,由于是异源表达,不同物种密码子的偏好性不同,同样会影响漆酶的活性[34]。杨建强等[34]利用基因重组技术,以及定点突变技术在野生革耳漆酶C端添加了15个氨基酸残基,得到该漆酶的一个突变体并在毕赤酵母中成功实现了高活性表达,为今后研究提高木质素降解相关酶基因的异源表达提供了新的思路和方法。
7 小 结
综上所述,关于白腐菌降解木质素的适宜条件、木质纤维素降解及相关酶的变化规律等仍有许多值得研究的课题,如:①关于木质纤维素的变化与酶活性变化之间的关系目前还鲜有报道。②由于糙皮侧耳降解木质素所得产物复杂多样,目前只是根据产物简单推断降解过程可能发生的反应,而对于木质素代谢的具体途径未见研究报道。③分子生物学方面的研究主要集中在木质素降解相关酶基因的克隆,以及同源、异源表达方面,以期解决酶产量低、价格高这一难题,而对于相关酶基因表达的调控机理与调控因素的研究则很少。
可以预见,未来关于白腐菌降解木质素的研究仍将朝着基础研究和应用研究两个方向发展。基础研究方面,开发相关酶基因的高表达菌株,探索酶合成的影响因子及其在降解木质素过程中的调控方式,完善木质素的新陈代谢网络,构建相关酶基因工程菌,利用基因敲除、诱变等方法对相关酶基因的功能以及表达调控机制进行研究。应用研究方面,本着服务人类生活以及健康、环境保护及治理等宗旨,一方面继续研究食用菌对秸秆的降解,利用降解后的成分生产糖类、酒精、饲料等,真正做到资源的充分利用;另一方面,利用食用菌能降解多环芳香类污染物或废弃物,降解重金属、农药残留等,保护环境,同时还可获得一定的经济效益。
[1] 李建华, 张越, 刘仲齐. 化学处理方法对木质素降解效率的影响评述[J]. 生物技术进展, 2011, 1(6): 421-425.
[2] 李国庆, 王金宁, 韩芹芹, 等. 高效降解棉秸秆木质素糙皮侧耳菌株的筛选[J]. 中国食用菌, 2013, 32(5):16-20.
[3] Kerem Z, Friesem D, Hadar Y. Lignocellulose Degradation during Solid-State Fermentation: Pleurotus ostreatus versus Phanerochaete chrysosporium[J]. Applied and Environmental Microbiology. 1992, 4(58): 1121-1127.
[4] 邓勋, 宋瑞清, 宋小双. 平菇()对稻草中木质素的生物降解及降解产物分析[J]. 菌物研究, 2007,5(2): 93-97.
[5] 黄慧, 申源源, 陈宏. 黄孢原毛平革菌对玉米秸秆木质素的降解研究[J].西南大学学报, 2011,33(7): 93-97.
[6] 李晓博, 李晓, 李玉. 双孢蘑菇生产中木质素、纤维素和半纤维素的降解及利用研究[J]. EDIBLE FUNGI, 2009, (2):6-8,10.
[7] 李国庆,李阿敏, 王金宁,等. 棉秸秆栽培糙皮侧耳菌株研究[J]. 北方园艺, 2014(10): 138-142.
[8] 潘迎捷.香菇生长过程中木质纤维素的生物降解规律[J]. 食用菌学报,1995, 2(2):18-22.
[9] 郭旭生, 崔慰贤, 姚爱兴. 白腐真菌在降解秸秆木质素中的应用[J]. 饲料博览, 2003 (2): 36-39.
[10] 陶用珍, 管映亭. 木质素的化学结构及其应用[J]. 纤维素科学与技术, 2003, 11(1): 42-55.
[11] 唐菊, 段传人, 黄友莹, 等. 白腐菌木质素降解酶及其在木质素降解过程中的相互作用[J]. 生物技术通报, 2011, 10: 32-36.
[12] 刘玲, 叶博, 刘长江. 白腐真菌及其木质素酶的研究进展[J]. 饲料工业, 2006, 27(8): 25-28.
[13] 潘迎捷,陈明杰,郑海歌等. 香菇和平菇生长发育中漆酶、酪氨酸酶和纤维素酶活性的变化[J]. 上海农业学报,1991,(2): 21-26.
[14] 路等学, 王龙, 高静梅. 茶薪菇不同生长期几种胞外酶活性的测定[J]. 农学报, 2009, 24(增刊): 275-277.
[15] 李娟, 倪新江, 樊守金. 金顶侧耳不同生长期几种胞外酶活性变化[J]. 吉林农业大学学报, 2006, 28(6): 619-622.
[16] Turner E M. Phenoloxidase activity in relation to substrate and development stage in the mushroom Agaricus bisporus[J]. Trans Br Mycol Soc. 1974, 63: 541-547.
[17] 周长青,王秀峰,李玉.白灵菇生长发育过程中胞外酶活性的变化规律[J]. 食用菌学报, 2008, 15(2): 64-68.
[18] 许伟. 基于气质联用和红外光谱的混合培养降解木质纤维素机理研究[D]. 湖南: 2013湖南大学硕士论文.
[19] Pallavi Dwivedi, V. Vivekanand, Nidhi Pareek,. Bleach Enhancement of Mixed Wood Pulp by Xylanase–Laccase Concoction Derived Through Co-culture Strategy[J]. Appl Biochem Biotechnol. 2010, 160: 255-268.
[20] 付时雨 , 余惠生, 文湘辉等. 白腐菌降解稻草木素机理研究(一)低分子木素降解产物各组分的分离及特征[J]. 纤维素科学与技术, 1997, 5(1): 21-28.
[21] Ellwardt PC von, Haider K, Ernst L. Untersuchungen des mikrobiellen Ligninabbaues durch13C-NMR Spektroskopie an spezifisch13C-angereichertem DHP-Lignin aus Coniferyl- alcohol[J]. Holzforschung. 1981, 35 : 103-109.
[22] Enoki A, Goldsby GP, Gold MH. β-Ether cleavage of the lignin model compound 4-ethyxy-3-methoxyphenylglycerol-β-guaiacyl ether and derivatives by Phanerochaete chrysosporium[J]. Arch Microbiol. 1981(a): 129:141–145.
[23] Germann U A, Lerch K. Isolation and partial nucleotide sequence of the laccase genefrom Neurospora crassa:Amino acid sequence homology of the proteinto humancerulo plasmin[J]. Proc Natl Acad Sci USA. 1986, 83:8854- 8858.
[24] 刘腾, 郭九峰, 那日, 等. 3种食用菌漆酶活性比较及其基因的克隆与序列分析[J].安徽农业科学, 2013, 41(28): 11278-11285.
[25] 朱刚, 吴林, 陈明杰, 等. 草菇锰过氧化物酶编码基因生物信息学分析及其转录水平和酶活性的测定[J]. 菌物学报, 2013, 32(5): 919-927.
[26] Andrawis A, Pease EA, Kuan IC, et al. Characterization of two lignin peroxidase clones from Phanerochaete chrysosporium[J]. Biochemical and Biophysical Communications,1989, 162(2): 673-680.
[27] Charles C Lee, Dominic W.S. Wong, George H Robertson. Cloning and characterization of two cellulase genes from Lentinula edodes[J]. Journal of Microbiology, 2001, 205(2): 355-360.
[28] Oku T; Roy C; Watson DC, et al. Amino acid sequence and thermostability of xylanase A from Schizophyllum commune[J]. Febs Letters, 1993, 334(3): 296-300.
[29] 郭梅, 蒲军, 路福平, 等. 白腐菌漆酶特性及其应用前景[J]. 天津农学院学报, 2004, 11(3): 44-47.
[30] Sun H. R., Myung K C, Myungkil K. et al. Enhanced Lignin Biodegradation by a Laccase-Overexpressed White-Rot Fungus Polyporus brumalis in the Pretreatment of Wood Chips[J]. Appl Biochem Biotechnol, 2013, 171:1525–1534.
[31] 孙亚范. 木质素过氧化物酶基因表达载体的构建及其在甲醇毕赤酵母中的表达[D]. 天津: 2004年天津科技大学硕士论文.
[32] BETTS, W. B, DART, R. K. The degradation of lignin-related compounds by Aspergillus flavis[J]. Journal of General Microbiology, 1988, 134: 2413-2420.
[33] Bulter T, Alcalder M, Sieber V,et alFunctional expression of a fungal laccase in Saccharomyces cerevisiae by directed evolution[J]. Appl Environ Microbiol, 2003, 69: 987.
[34] 杨建强, 刘刚, 汤国营, 等. 改构的野生革耳漆酶基因在毕赤酵母中的表达和活性鉴定[J].生物技术通讯, 2005, 16(3): 255-258.
Research progress on lignin degradation by white rot fungi
Li Amin1, Li Guoqing2, Chang Yan1, Cai Yongping*1, Lin Yi1Nie Fan2, Chen jingxian2
(1.College of life science, Anhui Agriculture University, Anhui Hefei 230036; 2.Horticulture Research Institute of Anhui Academy of Agricultural Sciences, Anhui Hefei 230031)
White rot fungi can secrete lignin-degrading enzymes, which have a strong ability to degrade lignin. Using the enzyme system of white rot fungi can degrade straw lignin, improve the nutritional value and utilization of straw. The research of lignin degradation by white rot fungi, including white rot fungi lignin-degrading enzymes, lignin degradation products, lignin degradation condition and molecular biology of lignin degradation etc.are reviewed.
White rot fungi; lignin-degrading enzymes; degradation products; molecular biology
S646
A
2095-0934(2015)02-95-07
安徽省科技计划项目“农业废弃物栽培食用菌关键技术研究与应用(1101c0603062)”;安徽省农科院院长青年创新基金项目(14B0322);安徽省棉花、蔬菜产业技术体系(食用菌);安徽省棉花11.5创新团队
李阿敏(1989—),女,安徽农业大学在读硕士,主要从事食用菌降解木质素方面研究
*为通讯作者,E-mail:swkx12@ahau.edu.cn

