尼莫地平对脂多糖诱导的急性肺损伤小鼠P38MAPK信号通路的调控作用
陈旭如,张佳彦
(1复旦大学附属上海市第五人民医院,上海200240;2上海市第八人民医院,上海200235)
尼莫地平对脂多糖诱导的急性肺损伤小鼠P38MAPK信号通路的调控作用
陈旭如1,张佳彦2
(1复旦大学附属上海市第五人民医院,上海200240;2上海市第八人民医院,上海200235)
目的:研究尼莫地平对细菌内毒素脂多糖(LPS)诱导的急性肺损伤(ALI)的保护作用及其对P38MAPK信号通路的调控作用.方法:用LPS诱导免疫炎症损伤来建立ALI动物模型.40只健康昆明小鼠分成对照组(n=8)、LPS模型组(n=16)和尼莫地平干预组(n=16).除对照组外,其余小鼠腹腔注射LPS(5 mg/kg);尼莫地平干预组在注射LPS 0.5 h前注射尼莫地平(20 mg/kg);对照组注射等量生理盐水.药物注射完毕后1 h、3 h各取每组中的半数处死取肺组织,HE染色观测病理改变,ELISA检测血清中炎症因子变化,Western Blotting方法检测其肺组织丝裂原活化蛋白激酶(MAPK)、MKK3/6、活化转录因子ATF⁃2表达变化.结果:实验结果发现尼莫地平干预组能够减轻肺病理损伤,降低血清中炎症因子TNF⁃α和 IL⁃1β含量,抑制小鼠肺组织中的 p⁃P38MAPK、p⁃PMKK3/6、p⁃ATF⁃2的表达量.结论:尼莫地平能减轻LPS诱导的肺组织损伤,主要通过抑制P38MAPK信号通路的激活,减少炎症因子的产生,从而发挥对ALI的保护作用.
尼莫地平;急性肺损伤;炎症因子;P38MAPK信号通路
0 引言
急性肺损伤(acute lung injury,ALI)是各种肺内、肺外因素引起的肺泡上皮细胞以及毛细血管内皮细胞损伤所导致的一种急性进行性呼吸衰竭[1].其病理特点为:肺泡上皮和毛细血管细胞发生广泛性的损伤,导致肺泡毛细血管通透性增加,进而出现血浆蛋白漏出,形成富含蛋白质的肺透明膜,最终出现炎性细胞浸润,形成了肺部水肿和微血栓[2].最终临床表现为严重的低氧血症和持续加重的进行性呼吸困难.
目前对于该病的治疗主要以机械通气为主,辅以药物治疗,但治疗策略极为有限.近年来对该病的研究很多,但临床发病率及死亡率仍居高不下,因此进一步研究其发病机制及治疗措施极为必要.在临床上,与脓毒症合并的ALI发病率较高,而脓毒症感染的常见原因之一是革兰阴性杆菌感染.革兰阴性细菌细胞壁外膜的主要成分脂多糖(lipopolysaccharide,LPS)是主要的致病因素[3],因此可利用LPS诱导ALI模型,探讨ALI的发病机制及其治疗措施.
尼莫地平在临床上用于预防蛛网膜下隙出血后的血管痉挛,近年研究发现尼莫地平可调节免疫和细胞增殖,因此本研究利用腹腔注射LPS建立小鼠免疫炎症模型,从免疫调节出发,考察尼莫地平是否对LPS诱导的ALI具有保护作用,以及其可能的作用机制,是否通过调控P38MAPK信号通路发挥保护作用,以期为临床用药提供实验依据.
1 材料和方法
1.1实验试剂 尼莫地平(Nimodipine,上海博蕴生物科技有限公司);LPS(E.coli serotype 055:B5,Sigma公司);丝裂原活化蛋白激酶(mitogen⁃activated protein kinase,MAPK)、活化转录因子(ATF⁃2)、MKK3/6和β⁃actin抗体(Bioworld Company).
1.2实验动物模型制作健康昆明小鼠40只,雄性,体质量35~40 g,将小鼠分笼喂养于室温控制在25±2℃的室内,自由进食进水,12 h光照.动物适应5 d后开始实验.将动物分成对照组(n=8)、LPS模型组(n=16)和尼莫地平干预组(n=16).LPS模型组和尼莫地平干预组小鼠腹腔注射LPS(5 mg/kg);尼莫地平干预组在注射LPS 0.5 h前注射尼莫地平,剂量为20 mg/kg;对照组腹腔给予等量的生理盐水.脂多糖注射1、3 h后各取每组中的半数动物处死,取肺组织.
2 标本处理及指标测定
2.1血清收集 4%水合氯醛麻醉小鼠后,剪除小鼠胡须,采用眼球取血法收集血液约1 mL.在4℃冰箱静置过夜,2000 g离心10 min后取上清,放置-80℃保存备用.
2.2肺组织收集 分离右肺叶,右肺上叶用4%多聚甲醛固定,苏木素⁃伊红(htoxylin eosin,HE)染色进行病理学检测.右肺中叶快速置于液氮中冻存,用于肺组织免疫印迹分析(Western Blot)检测.取右肺下叶用于肺组织湿干重比(W/D)的测量.
2.3HE病理染色 肺组织在4%多聚甲醛中固定,组织蜡块包埋后切片,厚度为5 μm.将组织切片进行HE染色,中性树胶封片.
2.4ELISA法测血清中细胞因子水平 血清中细胞因子TNF⁃α和IL⁃1β的含量根据酶联免疫试剂盒的说明书逐步进行.
2.5肺组织湿干重(W/D)比值测定 取右肺下叶用于肺组织湿干重比测量.首先用吸水纸将肺组织表面的水渍吸干后再行称重,此为肺组织湿重.之后置于80℃烘箱中烘烤24 h,再次称量得到肺组织的干重,湿重/干重的比值即为肺组织的湿干重比.
2.6Western Blot法检测肺组织P38MAPK信号通路各蛋白表达 将提取的肺组织用0.9%的生理盐水研磨成组织匀浆,离心后取其上清液,利用bicincho⁃ninic acid(BCA)法测蛋白浓度.电泳每孔上样量为50 μg,经转膜、一抗、二抗孵育后,加入BeyoECL Plus混合发光液,用Clinx Science Instrucment成像系统采集图像.利用Image J软件进行半定量分析,目的蛋白与β⁃actin条带的灰度值之比即为目的蛋白的相对表达量.
3 结果
3.1各组小鼠肺组织病理学变化 HE染色后利用光学显微镜观察,发现正常组小鼠肺组织结构完整清晰,肺泡壁比较薄,没有炎性细胞渗出(图1A),而LPS模型组小鼠的肺组织可见到肺泡壁增厚的现象,中性粒细胞渗出,富含蛋白质的水肿液渗出,微血栓形成,透明膜形成(图1B),尼莫地平干预组小鼠肺组织结构破坏较模型组明显减轻,与正常组相比肺泡壁略增厚,较模型组相比中性粒细胞渗出减少,富含蛋白质的水肿液渗出减少,有少量红细胞渗出(图1C).
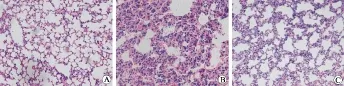
图1 肺组织病理学变化
3.2各组小鼠肺组织湿干重比(W/D) 如图2所示,LPS模型组小鼠的肺组织湿干重比较对照组明显升高,差异具有统计学意义(P<0.01),而尼莫地平干预组较模型组明显降低(P<0.01),其中1 h和3 h的作用时间点差异不明显.
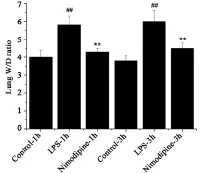
图2 肺组织湿干重比变化
3.3各组小鼠血清中TNF⁃α水平 图3显示了尼莫地平对LPS诱导炎症小鼠血清中TNF⁃α的影响.LPS组在注射LPS 1 h和3 h后TNF⁃α含量显著性升高,与正常对照组相比差异有统计学意义(P<0.01),而尼莫地平干预组在注射尼莫地平后较LPS组TNF⁃α显著下降,差异有统计学意义(P<0.01).
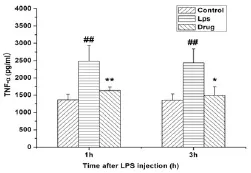
图3 尼莫地平对LPS诱导炎症小鼠血清中TNF⁃α的影响
3.4各组小鼠血清中IL⁃1β水平 尼莫地平对LPS诱导炎症小鼠血清中IL⁃1β的影响如图4所示:LPS组在注射LPS1 h和3 h后IL⁃1β含量显著性升高,与正常对照组相比,差异有统计学意义(P<0.01),而尼莫地平干预组在注射尼莫地平后IL⁃1β含量显著下降,与LPS组相比,差异有统计学意义(P<0.01).
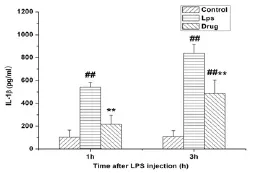
图4 尼莫地平对LPS诱导炎症小鼠血清中IL⁃1β的影
3.5P38MAPK蛋白磷酸化水平 如图5所示,LPS模型组小鼠肺组织P38MAPK蛋白磷酸化水平较对照组升高,组间差异有统计学意义(P<0.01),尼莫地平干预后发现肺组织的P38MAPK蛋白磷酸化水平,相对于模型组明显降低,差异有统计学意义(P<0.01).
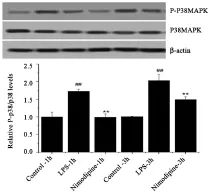
图5 尼莫地平对LPS诱导炎症小鼠肺组织P38MAPK蛋白表达的影响
3.6MKK3/6蛋白磷酸化水平 LPS模型组小鼠肺组织MKK3/6蛋白磷酸化水平,与正常对照组相比升高,而尼莫地平干预后该蛋白的磷酸化水平较模型组明显降低(图6),组间差异有统计学意义(P<0.01),

图6 尼莫地平对LPS诱导炎症小鼠肺组织MKK3/6蛋白表达的影响
3.7肺组织核转录因子ATF⁃2表达 如图7所示,LPS模型组肺组织ATF⁃2蛋白磷酸化水平较对照组升高,组间差异有统计学意义(P<0.01),尼莫地平干预组较模型组明显降低,差异有统计学意义(P<0.01).

图7 尼莫地平对LPS诱导炎症小鼠肺组织ATF⁃2蛋白表达的影响
4 讨论
炎症反应是维持组织稳态、预防感染的重要保护措施,但失控的炎症反应可导致机体组织发生损伤[4].ALI是全身炎症反应在肺部的表现,也是机体内正常炎症反应过度表达造成的结果[5].在LPS诱导的ALI气道炎症反应中,LPS通过巨噬细胞膜表面上的Toll样受体4(toll⁃like receptor 4,TLR4)激活巨噬细胞[6-7].巨噬细胞一旦被激活,将会释放多种细胞因子,其中最主要的是TNF⁃α和IL⁃1β.此类细胞因子的产生不仅可放大炎症反应,同时可以导致肺组织在内的靶器官中多种效应细胞的活化,募集并释放活性氧代谢产物和蛋白酶,引起细胞损害[8].在ALI的发病中,这些炎性细胞、炎症介质以及细胞因子的广泛参与起到关键性作用.
LPS通过与TLR4结合可以激活下游信号通路,将细胞外刺激信号传导至细胞内[9].丝裂原活化蛋白激酶(mitogen⁃activated protein kinases,MAPKs)信号通路与LPS引起的TLR4信号通路激活有关[10].研究表明MAPKs在炎症和氧化应激的细胞内信号传导中发挥重要作用[11],包括细胞外调节蛋白激酶(extracellular signal⁃regulated kinas,ERK)信号通路、P38MAPK信号通路、JNK/SAPK通路.各种应激、细胞生长因子和炎性细胞因子均可激活P38MAPK信号[12].P38 MAPK由MAP激酶(MKK)3/6选择性地激活,同时MAPK信号通路可以激活下游的信号蛋白,将刺激信号传导至核内,活化核内蛋白转录活化因子(ATF)⁃2、c⁃jun、c⁃fos等,这些因子可以调节其与转录因子活化蛋白的结合,进而影响DNA的转录活性[13-14].
本研究利用LPS腹腔注射建立ALI模型,诱导小鼠出现炎症性肺损伤.症状与文献报道相一致,肺组织切片利用HE染色进行观测,发现有ALI的基本特征,如中性粒细胞聚集、血管内皮细胞和肺泡上皮细胞破坏、肺水肿现象,符合ALI疾病特点.ELISA实验结果发现血清中细胞因子含量、肺W/D比均显著增高,与正常对照组相比均有统计学意义.蛋白印迹实验发现P38MAPK信号通路蛋白磷酸化水平在LPS模型组中表达升高,说明该通路被激活.应用尼莫地平干预后,肺损伤明显减轻,炎症因子释放减少,蛋白磷酸化水平下降,说明抑制了P38MAPK信号通路的激活.由于LPS诱导的巨噬细胞活化主要由核内蛋白转录活化因子调控的炎症反应来调节,所以我们通过测量其水平检测核转录因子是否被尼莫地平抑制.在本研究中尼莫地平有效抑制了ATF⁃2的活化.
终上所述,尼莫地平应用于LPS诱导的ALI后,可降低血清中的炎性细胞因子,减轻肺组织炎症损伤,抑制P38MAPK信号通路蛋白以及核转录因子的磷酸化,因此尼莫地平可能通过P38MAPK信号通路来发挥对LPS诱导的ALI的保护作用.
[1]Silva PL,Rocco PR,Pelosi P.FG⁃4497:a new target for acute respiratory distress syndrome?[J].Expert Rev Respir Med,2015,9(4):405-409.
[2]Hoeboer SH,Groeneveld AB,van der Heijden M,et al.Serial inflammatory biomarkers of the severity,course and outcome of late onset acute respiratory distress syndrome in critically ill patients with or at risk for the syndrome after new⁃onset fever[J].Biomark Med,2015,9(6):605-616.
[3]Xu Y,Zhang R,Li C,et al.Dexmedetomidine attenuates acute lung injury induced by lipopolysaccharide in mouse through inhibition of MAPK pathway[J].Fundam Clin Pharmacol,2015,29(5):462-471.
[4]Bhargava M,Wendt CH.Biomarkers in acute lung injury[J].Transl Res,2012,159(4):205-217.
[5]El Kebir D,Gjorstrup P,Filep JG.Resolvin E1 promotes phagocyto⁃sis⁃induced neutrophil apoptosis and accelerates resolution of pulmo⁃nary inflammation[J].Proc Natl Acad Sci U S A,2012,109(37):14983-14988.
[6]Zhang X,Li C,Li J,et al.Protective effects of protocatechuic acid on acute lung injury induced by lipopolysaccharide in mice via p38MAPK and NF⁃κB signal pathways[J].Int Immunopharmacol,2015,26(1):229-236.
[7]Feng G,Sun B,Li TZ.Daidzein attenuates lipopolysaccharide⁃induced acute lung injury via toll⁃like receptor 4/NF⁃kappaB pathway[J].Int Immunopharmacol,2015,26(2):392-400.
[8]He Z,Gao Y,Deng Y,et al.Lipopolysaccharide induces lung fibroblast proliferation through Toll⁃like receptor 4 signaling and the phosphoinositide3⁃kinase⁃Akt pathway[J].PLoS One,2012,7(4):e35926.
[9]Zhang Z,Chen N,Liu JB,et al.Protective effect of resveratrol against acute lung injury induced by lipopolysaccharide via inhibiting the myd 88⁃dependent toll⁃like receptor 4 signaling pathway[J].Mol Med Rep,2014,10(1):101-106.
[10]Wu J,Zhang YY,Guo L,et al.Bupleurum polysaccharides attenuates lipopolysaccharide⁃induced inflammation via modulating Toll⁃like receptor 4 signaling[J].PLoS One,2013,8(10):e78051.
[11]Runchel C,Matsuzawa A,Ichijo H.Mitogen⁃activated protein kinases in mammalian oxidative stress responses[J].Antioxid Redox Signal,2011,15(1):205-218.
[12]Wang F,Meng Y,Zhang Y,et al.Ketamine reduces lipopolysaccha⁃ride⁃induced high⁃mobility group box⁃1 through heme oxygenase⁃1 and nuclear factor erythroid 2⁃related factor 2/p38 mitogen⁃activated protein kinase[J].J Surg Res,2015,194(2):599-613.
[13]Wei L,Matsumoto H,Yamaguchi H.Propofol attenuates lipopo⁃lysaccharide⁃induced monocyte chemoattractant protein⁃1 production through p38 MAPK and SAPK/JNK in alveolar epithelial cells[J].J Anesth,2013,27(3):366-373.
[14]Pei YH,Cai XM,Chen J,et al.The role of p38 MAPK in acute paraquat⁃induced lung injury in rats[J].Inhal Toxicol,2014,26(14):880-884.
RegulatingeffectsofNimodipineonthe P38MAPK signaling pathways in lung tissue of ALI mice induced by lipopolysaccharide
CHEN Xu⁃Ru,ZHANG Jia⁃Yan
The Fifth People's Hospital of Shanghai,Fudan University,Shanghai 200240,China;The Eighth People's Hospital of Shanghai,Shanghai 200235,China
AIM:To study the protective effects of nimodipine on the acute lung injury(ALI)induced by the bacterial endotoxin lipopolysaccharide(LPS)and its regulation on the P38MAPK signaling pathways.METHODS:ALI animal model was built by intraperitoneal injection of LPS to induced inflammatory immune injury.Forty healthy mice were divided into three groups:control group(n=8),LPS model group(n=16)and Nimodipine group(n=16).Mice were intraperitoneally injected with LPS(5 mg/kg)except control group mice.Nimodipine group mice were given nimodipine(20 mg/kg)half hour before LPS treatment.Control group mice were given equal saline.The lung tissue was collected after 1 h and 3 h of LPS treatment.HE staining was used to observe the pathological changes of lung tissue.TNF⁃α and IL⁃1β in the serum were measured by ELISA;MKK3/6,p38MAPK,ATF⁃2 and its phosphorylation were evaluated by Western blotting.RESULTS:The results showed that Nimodipine could reduce lung injury,decrease TNF⁃α and IL⁃1β in serum,and inhibit phosphorylation of P38MAPK,MKK3/6 and ATF⁃2.CONCLU⁃SION:Nimodipine could alleviate the LPS⁃induced inflammatory injury,probably associating with decrease of inflammatory factors level in serum and inhibition of P38MAPK activation in lung tissue.
Nimodipine;acute lung injury;inflammatory factors;P38MAPK signal pathways
R644
A
2095⁃6894(2015)10⁃001⁃04
2015-07-20;接受日期:2015-08-08
陈旭如.本科,住院医师.研究方向:呼吸内科.Tel:021⁃64308151-8499 E⁃mail:cxr1128@163.com
张佳彦.E⁃mail:zjy_wayne@163.com

