mRNA降解与血痕遗留时间相关性探索
龙 兵,罗 杨,皮建华,周 豪
(1.四川警察学院 四川泸州 646000;2.泸州市公安局 四川泸州 646000)
案发时间的判断对于案件的侦破具有十分重要的意义。血痕是现场非常常见的生物物证,通常能够比较准确地反映案发时间。血痕遗留时间的推断一直是刑事科学技术领域研究的热点和难点[1-4]。
RNA是分子生物学领域的研究热点,同时受到法医学研究者的关注。许多研究报道机体组织RNA会随着死亡时间的延长而发生降解,降解与死亡时间具有一定的相关性[5-7]。这些研究大多以组织器官为研究对象,关于血痕RNA降解的研究相对较少。本次研究以管家基因β-actin和血液中特异性表达的HBB为目的基因,18s rRNA为内参基因,探讨血痕在离体72小时时间内mRNA的降解情况。
一、材料与方法
(一)样本。
采集6名个体静脉血(3名男性,3名女性),各1mL,EDTA抗凝。取20μL血液滴于吸水滤纸上,共制作42份样本,室温保存,分别于0.5h、2h、6h、12h、24h、48h、72h后提取RNA。
(二)仪器与试剂。
采用TRIzol试剂(美国Invitrogen公司)提取RNA。采用Bioneer逆转录试剂盒进行逆转录。实时定量PCR扩增采用的试剂盒为Roche公司FastStart Universal SYBR Green Master(ROX)荧光定量试剂盒,扩增仪器为AB-7500实时定量PCR仪。
(三)方法。
1.RNA抽提。剪取制作的血痕于1.5mL离心管,加入0.5mLTRIzol试剂,室温下震荡混匀5min,加0.1mL氯仿,混匀,放置3min; 12000g离心15min;取上清,加入250μL异丙醇,混匀,12000g离心10min;弃上清,加入75%乙醇1mL,7500g离心5min。弃上清,短暂室温干燥,加入DEPC水溶解,-80保存。实验操作均在冰上进行,离心均为-4℃低温离心。
2.RNA逆转录。反应体系为5μL模板RNA,基因特异性逆转录引物浓度为20pmol,总反应体系为20μL。 反应条件为50℃保温1h,95℃变性5min。

表1 逆转录基因特异性引物
3.实时定量PCR。HBB、β-actin和18s rRNA的扩增引物见表2。实时荧光定量PCR扩增反应体系:5μL SYBR Green,前后引物终浓度均为0.5μM,总反应体系为10μL。

表2 HBB、β-actin和18s rRNA扩增引物
扩增条件为:
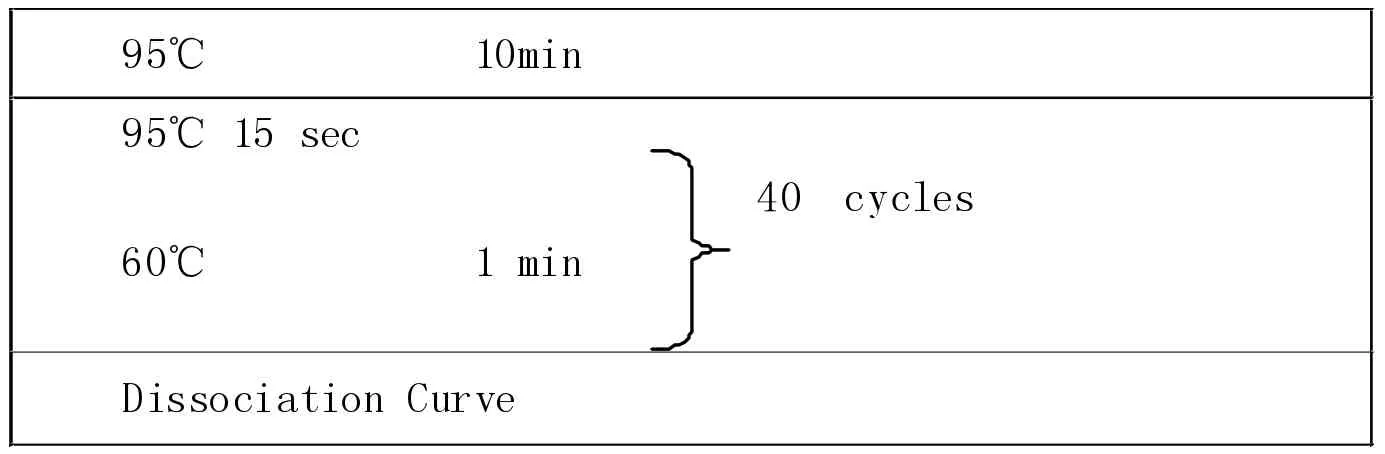
?
(四)数据分析。
以实时定量PCR的CT值进行统计学处理,分析软件为Excel2007、GraphPad Prism5。
二、结果
(一)聚丙烯酰胺凝胶电泳检测。
聚丙烯酰胺凝胶电泳银染检测PCR扩增片段,片段大小与预期大小相符合,见图1。

图1 PCR产物电泳图
从左至右分别为Marker、18s rRNA、β-actin、HBB。
(二)RNA降解与血痕遗留时间的相关性。
获得各样本实时定量PCR扩增CT值,HBB、18s rRNA、β-actin实时定量PCR扩增曲线见图2。

图2 实时定量PCR扩增曲线
从左至右分别为HBB、18s rRNA、β-actin。
以18s rRNA为内参计算ΔCT值,即ΔCT=CT(target mRNA)-CT(reference DNA)[8],建立ΔCT值与血痕遗留时间的相关性。结果显示在72小时时间内,血痕β-actin、HBB基因mRNA具有较强的稳定性,mRNA降解与血痕遗留时间没有相关性(p>0.05)。HBB、β-actin基因mRNA降解与血痕遗留时间的相关性见图3、图4。
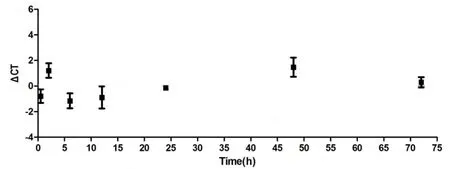
图3 HBB基因mRNA降解与血痕遗留时间相关性(r=0.4325,p=0.3324)

图4 β-actin基因mRNA降解与血痕遗留时间相关性(r=0.3985,p=0.3759)
三、讨论
RNA在细胞内以多种形式存在,主要包括mRNA、tRNA、rRNA等。18s rRNA与核糖体蛋白紧密结合,受到核糖体蛋白的保护,稳定性强,不易发生降解[9]。许炎等[10],在研究中发现血痕18s rRNA在8-15天都没有发生明显降解。研究中,我们以18s rRNA为内参对HBB和β-actin两个目的基因CT值进行标准化处理,能够更加准确的观察血痕mRNA的降解情况,更好的反映mRNA降解与血痕遗留时间的相关性。
许多研究报道机体死亡后细胞mRNA在数天甚至数小时内发生快速降解[7,11]。我们在研究中发现血痕HBB和β-actin基因mRNA在72小时时间内都保持了很强的稳定性,这与机体在死亡后细胞mRNA降解有很大差异。我们认为导致血痕mRNA降解速度慢的原因,一方面可能与血痕在滤纸上迅速干燥,RNA酶以及相关因子的活性降低有关;另一方面,可能与实验环境相对理想化,受到外界的污染相对较小有关。该研究涉及的血痕遗留时间相对较短,在以后的研究中,我们将进一步延长血痕遗留时间,同时探讨温度、湿度等因素对血痕RNA降解的影响。
[1]Bremmer RH,De Bruin KG,Van Gemert MJ,et al.Forensic quest for age determination of bloodstains[J].Forensic science international,2012,216(1-3):1-11.
[2]Anderson SE,Hobbs GR,Bishop CP.MμLtivariate analysis for estimating the age of a bloodstain[J].Journal of forensic sciences,2011,56(1):186-193.
[3]Anderson S,Howard B,Hobbs GR,et al.A method for determining the age of a bloodstain[J].Forensic science international,2005,148(1):37-45.
[4]Bauer M,Polzin S,Patzelt D.Quantification of RNA degradation by semi-quantitative duplex and competitive RTPCR:a possible indicator of the age of bloodstains?[J].Forensic science international,2003,138(1-3):94-103.
[5]朱 怡,董迎春,梁伟波,等.2011-小鼠死后脑RNA降解与死亡时间的相关性[J].法医学杂志,2011,26(3):161-163.
[6]Young ST,Wells JD,Hobbs GR,et al.Estimating postmortem interval using RNA degradation and morphological changes in tooth pμLp[J].Forensic science international,2013,229(1-3):e161-166.
[7]Sampaio-Silva F,Magalhaes T,Carvalho F,et al.Profiling of RNA degradation for estimation of post morterm interval[J].PloS one,2013,8(2):e56507.
[8]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔCT Method[J].Methods,2001,25(4):402-408.
[9]Houseley J,Tollervey D.The many pathways of RNA degradation[J].Cell,2009,136(4):763-776.
[10]许 炎,蒋 巍,平 原,等.应用RNA分析技术推断现场血痕形成时间[J].法医学杂志,2010,26(5):340-342.
[11]Deng W,Lv M,Wang L,et al.mRNA degradation pattern analysis in post-mortem normalized using the DNA[J].Forensic Science International:Genetics Supplement Series,2013,4(1):e266-e267.

