新碳青霉烯类抗生素百纳培南的小鼠泌尿道感染药效学研究
卢曦,李聪然,庞晶,胡辛欣,聂彤颖,杨信怡,李雪,李国庆,王秀坤,游雪甫
新碳青霉烯类抗生素百纳培南的小鼠泌尿道感染药效学研究
卢曦,李聪然,庞晶,胡辛欣,聂彤颖,杨信怡,李雪,李国庆,王秀坤,游雪甫
目的 评价新碳青霉烯类抗生素百纳培南对小鼠大肠埃希菌泌尿道上行性感染的体内疗效。
方法 通过泌尿道钝针头插管法,向小鼠膀胱内注入 0.05 ml浓度为 1010cfu/ml的大肠埃希菌 9612菌液,建立小鼠泌尿道感染模型。于感染后 6、24和 30 h皮下给药,感染后 48 h处死动物,取肾剖面盖印并研磨计数,对百纳培南进行体内药效学评价,并与对照药美罗培南、厄他培南进行比较。
结果 对大肠埃希菌 9612泌尿道上行性感染小鼠,百纳培南 8、2和 0.5 mg/kg剂量组小鼠肾组织匀浆菌落计数明显低于对照组(P<0.01);8、2、0.5和 0.125 mg/kg剂量组肾剖面盖印结果均与对照组有显著差异(P<0.01或 P<0.05)。百纳培南与相同剂量美罗培南、厄他培南组相比,除 0.125 mg/kg剂量组肾剖面盖印结果与厄他培南组有显著性差异(P<0.01)外,其他剂量组肾组织匀浆菌落计数和肾剖面盖印结果均无显著性差异(P>0.05)。
结论 对于小鼠泌尿道大肠埃希菌 9612上行性感染,百纳培南可显著降低小鼠的肾组织菌落计数和肾剖面盖印阳性率,疗效与美罗培南、厄他培南相近。
泌尿道感染; 药效学评价; 尿路致病性大肠埃希菌; 百纳培南
泌尿道感染是临床常见病和多发病,在妇女、儿童和老年人、HIV感染者、糖尿病及肿瘤等患者中均有较高的发病率,且由于抗生素的滥用、耐药菌的出现,泌尿道感染的药物治疗不断面临新的挑战[1]。
百纳培南(benapenem)为山东轩竹医药科技有限公司研制的新碳青霉烯类抗生素(国家化药1.1类),目前处于 I期临床研究,主要通过与细菌细胞膜上的青霉素结合蛋白(PBPs)结合,抑制细菌细胞壁合成而产生杀菌作用。百纳培南为广谱抗菌药物,之前的研究显示其对绝大多数革兰阴性菌和革兰阳性菌具有强大抗菌作用,对各类 β-内酰胺酶包括超广谱 β-内酰胺酶(ESBLs)稳定。百纳培南显示了与已上市同类药物美罗培南相似的体内外抗菌活性。泌尿生殖系统感染是碳青霉烯类抗生素的主要临床适应证之一,因此本研究以小鼠大肠埃希菌泌尿道上行性感染为评价模型[2],评价百纳培南的体内疗效。
1 材料与方法
1.1 材料
1.1.1 实验药品及培养基 百纳培南由山东轩竹医药科技有限公司提供,批号 20100526,纯度为99.04%,水分 7.912%;美罗培南由石药集团河北中润制药有限公司提供,批号 591101114,纯度为99.1%,水分 12.4%;注射用厄他培南购自澳大利亚默沙东公司,批号 R2097,规格 1.0 g/瓶,效价70.4%;药物配制时按实际活性药物计算。MH肉汤培养基、酵母提取物培养基为美国 Difco公司产品;中国蓝琼脂培养基为中国药品生物制品检定所产品。
1.1.2 实验菌株 临床分离致病菌大肠埃希菌9612(β-内酰胺酶阳性,超广谱酶阴性)作为泌尿道感染菌株。实验前转种活化,以新鲜菌液用于实验。以大肠埃希菌 ATCC 25922作为微稀释法测定最低抑菌浓度(MIC)的质控菌株。
1.1.3 实验动物 ICR小鼠,雌性,体重 20~22 g,由北京维通利华实验动物技术有限公司供应,许可证号:SCXK(京)2006-0009。
1.2 方法
1.2.1 感染菌液制备 大肠埃希菌 9612接种于10 ml增菌汤(2.5%MH肉汤 +0.5%酵母提取物)中,6 h后转种(1∶50)于 10 ml新鲜培养基中活化,培养过夜。菌液于 5000 r/min、4℃ 离心10 min,沉淀用约 1/10菌液体积的生理盐水重悬后即为感染用菌液,菌液终浓度为 9.75×109cfu/ml,感染量为 4.88×108cfu/只小鼠。
1.2.2 药物配制 称取适量药物粉末,用生理盐水配制成 5 mg/ml母液保存于 –20℃。配制药物时取出保存的母液,用 MH肉汤稀释到所需要的药物浓度。
1.2.3 试验菌株的 MIC测定 MIC测定参照CLSI标准[3],采用 96孔板 MH肉汤微稀释法进行。质控菌株选用大肠埃希菌 ATCC 25922。受试菌株接种于新鲜 MH肉汤中,37℃ 培养过夜。受试药物百纳培南和对照药物美罗培南、厄他培南用生理盐水配制为母液后,用 MH肉汤稀释得到 128~0.03 μg/ml二倍系列稀释的各浓度药液,100 μl/孔分装到相应的 96孔板中。菌液适当稀释,接种于含不同药物浓度的各孔中,使终浓度为 5× 105cfu/ml。37℃ 培养 16~18 h,观察结果,无菌生长的最低药物浓度即为药物的最小抑菌浓度(MIC)。
1.2.4 小鼠泌尿道感染实验 参照文献[4-6],通过钝针头经尿道插入膀胱注入菌液,引发小鼠泌尿道上行性感染来研究百纳培南及对照药美罗培南、厄他培南对泌尿道感染的疗效。具体如下:ICR小鼠 130只,试验前禁水 16 h,而后按体重随机分为 13组(百纳培南、美罗培南、厄他培南不同浓度治疗组各 4组,分别为 8 mg/kg组、2 mg/kg组、0.5 mg/kg组和 0.125 mg/kg组,感染对照组1组),每组 10只。小鼠用戊巴比妥钠(70 mg/kg)麻醉后仰卧于操作板上,尿道口周围用酒精消毒,然后用 4.5号钝针头经尿道插入膀胱,注入菌液0.05 ml感染。小鼠腹面朝上放入笼中,继续禁水 6 h。于感染后 6、24和 30 h颈后皮下给药(0.2 ml/20 g)。末次给药后 18 h小鼠断颈处死,在无菌条件下取出两侧肾脏,横向中间位置剖开两肾,将两肾剖面盖印于中国蓝琼脂平皿上,而后将肾脏放入无菌研磨器中,每 1 g组织加入 9 ml生理盐水研磨,匀浆液适当稀释后涂布中国蓝琼脂平皿。肾剖面盖印平皿及肾组织匀浆菌落计数平皿于35℃ 培养 24 h。记录肾组织匀浆涂布平皿上菌落数,计算动物的 cfu/g数值。
1.3 统计学处理
使用 SPSS13.0软件进行方差分析,比较各组差异显著性。肾剖面盖印结果按下述分级标准[4]记录:++++为细菌密集生长,范围达接种面积的90% 以上;+++为细菌大量生长,出现的菌落无法计数;++为培养板上出现的菌落可计数,且≥20;+为培养板上出现的菌落数 ≥3且 <20;±为培养板上出现的菌落数 <3;–为培养板上无细菌生长。结果用非参数秩和检验进行统计学处理。

表1 百纳培南及对照药对大肠埃希菌的 MIC值Table 1 The minimum inhibitory concentrations of benapenem and control drugs to Escherichia coli
2 结果
2.1 百纳培南及对照药对受试菌株的 MIC测定
受试药百纳培南及对照药美罗培南、厄他培南对大肠埃希菌 9612及质控菌大肠埃希菌 ATCC 25922的 MIC值见表 1。美罗培南、厄他培南对质控菌大肠埃希菌 ATCC 25922的 MIC值均在可接受范围内[7]。百纳培南的体外抗大肠埃希菌9612活性稍弱于对照药美罗培南、厄他培南。
2.2 百纳培南及对照药皮下给药对小鼠泌尿道上行性感染大肠埃希菌 9612的疗效
受试药百纳培南及对照药对小鼠泌尿道局部感染的疗效结果见表 2和表 3。百纳培南 8、2、0.5和 0.125 mg/kg给药组肾组织匀浆菌落计数对数值与对照组相比,分别下降了 3.80、3.36、2.67 和 1.02,其中,除最低剂量 0.125 mg/kg组外,其他给药组肾组织匀浆菌落计数均显著低于对照组(P<0.01)。对照药美罗培南和厄他培南与对照组相比,8、2、0.5和 0.125 mg/kg组肾组织匀浆菌落计数对数值分别下降了 3.84、3.22、2.68、1.31(美罗培南)和 3.70、3.23、2.27、1.08(厄他培南),并且除最低剂量 0.125 mg/kg组外,其他给药组肾组织匀浆菌落计数也均显著低于对照组(P<0.01)。百纳培南与同剂量组美罗培南和厄他培南相比,肾组织匀浆菌落计数无显著性差异(P>0.05),表明对小鼠泌尿道大肠埃希菌上行性感染,百纳培南与现有市售的碳青霉烯类抗生素美罗培南、厄他培南具有相似的疗效。百纳培南及对照药美罗培南、厄他培南对大肠埃希菌泌尿道上行性感染小鼠的肾组织匀浆菌落计数显示剂量依赖性的降低作用。
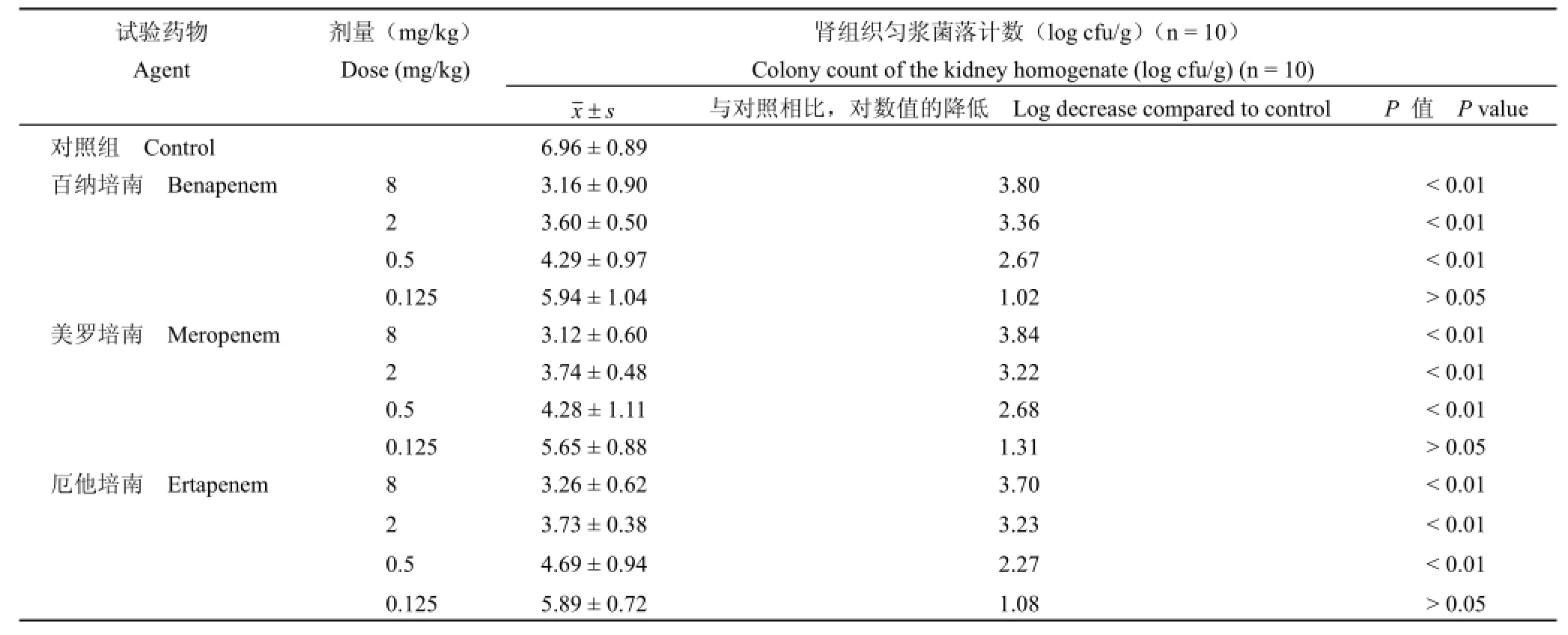
表2 百纳培南及对照药对小鼠大肠埃希菌 9612泌尿道感染的疗效——肾组织匀浆菌落计数Table 2 The efficacy of benapenem and control drugs against the ascending urinary track infections in mice caused by E.coli 9612——viable colony counts of kidney homogenates
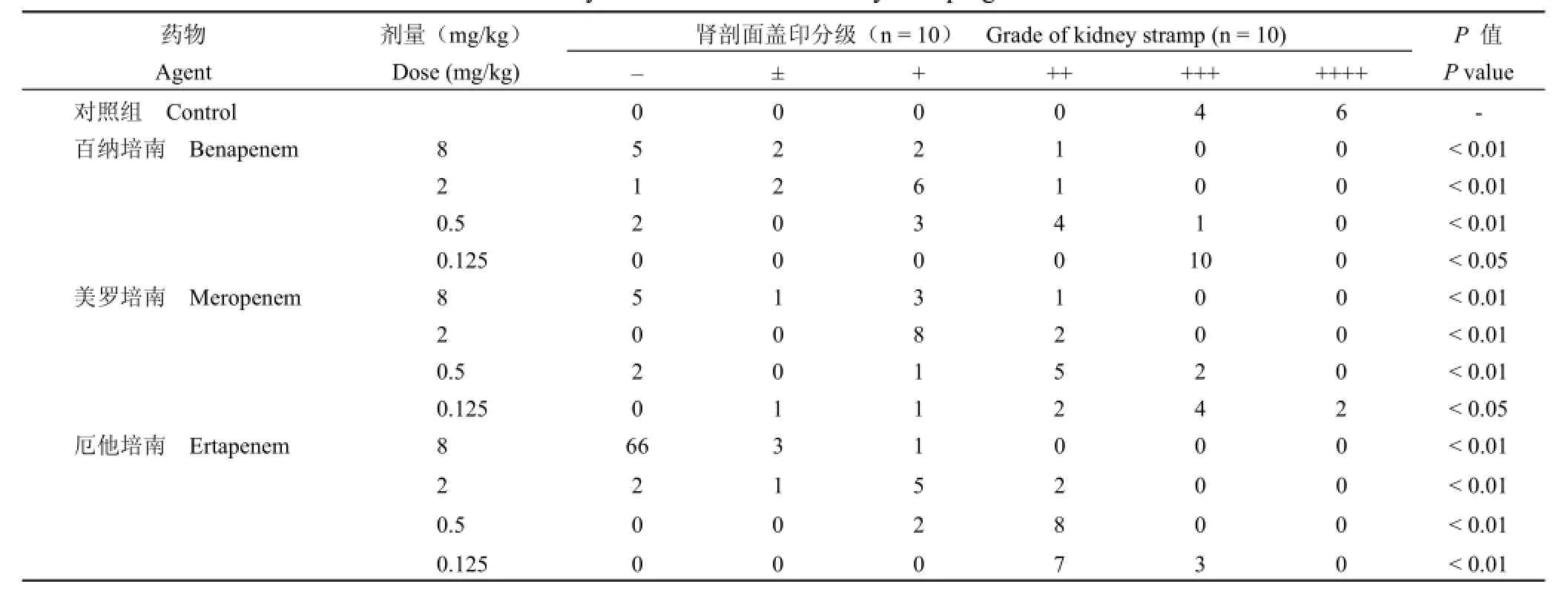
表3 百纳培南及对照药对小鼠大肠埃希菌 9612泌尿道感染的疗效——肾剖面盖印Table 3 The efficacy of benapenem and control drugs against the ascending urinary track infections in mice caused by E.coli 9612——kidney stamping
肾剖面盖印结果同样显示,与对照组相比,百纳培南及对照药美罗培南、厄他培南各给药组均有显著疗效(P<0.01或 P<0.05)。百纳培南与已上市的碳青霉烯类抗生素美罗培南、厄他培南同剂量组相比,除最低剂量组(0.125 mg/kg组)疗效显著弱于厄他培南(P<0.01)外,其他剂量组无显著性差异(P>0.05)。
3 讨论
尿路感染是泌尿系统的常见病、多发病,女性发病高于男性,致病菌多为革兰阴性杆菌[8],难治性尿路感染为临床药物治疗提出了更大的挑战。碳青霉烯类抗生素是抗菌谱最广,抗菌活性最强的非典型 β-内酰胺抗生素,因其具有对 β-内酰胺酶稳定以及毒性低等特点,已经成为治疗严重细菌感染最主要的抗菌药物之一。百纳培南作为我国自主研发的碳青霉烯类药物,在体内外抗菌研究中,显示出较好的活性,但尚未开展针对尿路感染模型的体内抗菌活性研究。
本研究中,我们通过小鼠泌尿道上行性感染模型评价了百纳培南对大肠埃希菌泌尿道感染的疗效。结果表明,百纳培南皮下给药对小鼠大肠埃希菌泌尿道上行性感染具有较好疗效。与市场上现有的碳青霉烯类抗生素美罗培南、厄他培南相比,虽然体外 MIC测定结果显示百纳培南体外抗大肠埃希菌 9612活性稍弱于对照药美罗培南、厄他培南,但小鼠肾组织匀浆菌计数结果及肾剖面盖印结果表明,对于小鼠泌尿道大肠埃希菌 9612上行性感染,百纳培南具有相似的体内疗效。本研究为百纳培南的临床抗感染治疗,特别是急性尿路感染的临床治疗,提供了参考依据。
[1] Gu XC,Wang Y,Shao TT.Current status of research on establishment of animalmodels of urinary tract infection.Chin J Comp Med,2010,20(4):69-73.(in Chinese)
顾向晨,王怡,邵汀汀.泌尿道感染动物模型制作研究现状.中国比较医学杂志,2010,20(4):69-73.
[2] Hopkins WJ.Mouse model of ascending urinary tract infection//Zak O,Sande MA.Handbook of animal models of infection:experimental models in antimicrobial chemotherapy.Salt Lake City:Academic Press,1999:435-439.
[3] Clinical and Laboratory Standards Institute.Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically;approved standard-eighth edition.CLSI document M07-A8.Wayne,PA:2009.
[4] You XF,Li CR,Yang XY,et al.In vivo antibacterial activity of vertilmicin,a new aminoglycoside antibiotic.Antimicrob Agents Chemother,2009,53(10):4525-4528.
[5] Zak O,Sande MA.Handbook of animal models of infection: experimental models in antimicrobial chemotherapy.Salt Lake City: Academic Press,1999.
[6] Zheng L,Hong XR,Chen H,et al.Effects of adhesin PapG of uropathogenic Escherichia coli on the ascending urinary tract infection in mice.Chin J Zoonoses,2004,20(6):477-480.(in Chinese)
郑铃,洪新如,陈豪,等.P菌毛粘附素在致肾盂肾炎大肠埃希菌对小鼠尿道上行感染中的作用.中国人兽共患病杂志,2004,20(6): 477-480.
[7] Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing;19th informational supplement. CLSI document M100-S19.Wayne,PA:2009.
[8] Tal S,Guller V,Levi S,et al.Profile and prognosis of febrile elderly patients with bacteremic urinary tract infection.J Infect,2005,50(4):296-305.
Methods The urinary track infection model in mice was established by inserting a round-point needle transurethrally for injection of 0.05 ml of an E.coli 9612 suspension(challenge dose,1010cfu/ml)into the bladder.The compounds were administered subcutaneously at 6,24,and 30 h post infection.The mice were sacrificed 48 h after infection.The kidney stamping was performed and viable colony counts of kidney homogenate samples were determined.The efficacy of benapenem was evaluated and compared with that of meropenem and ertapanem.
Results Benapenem showed good efficacy against the ascending urinary track infections caused by E.coli 9612 in mice. Significant decreases in kidney viable colony counts(P<0.01)were observed in 8,2 and 0.5 mg/kg groups in comparison with that of control group.The stamping results of 8,2,0.5 and 0.125 mg/kg groups were significant different(P<0.01 or P<0.05)from that of control group.When comparing the same dosing groups for different compounds,significant different stamping result(P<0.01)was seen in 0.125 mg/kg benapenem group,compared with that of 0.125 mg/kg ertapenem group,while no significant difference (P>0.05)in kidney stamping and viable colony counts of kidney homogenates was observed for other benapenem groups incomparison with the same dosing groups of meropenem and ertapenem.
Conclusion Benapenem exhibits good antibacterial efficacy against the ascending urinary track infections in mice caused by E.coli 9612.The therapeutic efficacy of benapenem is generally similar to those of meropenem and ertapenem.
Pharmacodynamic evaluation of benapenem,a new carbapenem antibiotic,in mouse urinary tract infection model
LU Xi,LI Cong-ran,PANG Jing,HU Xin-xin,NIE Tong-ying,YANG Xin-yi,LI Xue,LI Guo-qing,WANG Xiu-kun,YOU Xue-fu
Objective To evaluate the in vivo antibacterial efficacy of benapenem against the ascending urinary track infections caused by Escherichia coli in mice.
Urinary tract infections;Pharmacodynamic evaluation;Uropathogenic Escherichia coli;Benapenem
s:WANG Xiu-kun,Email:xiukunwang@139.com;YOU Xue-fu,Email:xuefuyou@hotmail.com
10.3969/cmba.j.issn.1673-713X.2015.02.008
“十二五”国家科技重大专项(2012ZX09301002-001、2012ZX09301002-005、2014ZX09507009-012);国家自然科学基金(81321004、81361138020);北京市重点实验室科技创新基地培育与发展工程(Z141102004414065)
100050北京,中国医学科学院医药生物技术研究所药理室
王秀坤,Email:xiukunwang@139.com;游雪甫,Email:xuefuyou@hotmail.com
2014-12-04
www.cmbp.net.cn 中国医药生物技术,2015,10(2):139-143
Author Affiliation:Department of Pharmacology,Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences& Peking Union Medical College,Beijing 100050,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(2):139-143

