CAR-T细胞在肿瘤治疗中的研究进展
赵玲娣 综述 高全立 审校
·综述·
CAR-T细胞在肿瘤治疗中的研究进展
赵玲娣 综述 高全立 审校
以嵌合型抗原受体(chimeric antigen receptor,CAR)为基础的细胞免疫治疗是一种新的治疗恶性肿瘤的模式,为部分晚期实体瘤患者带来治愈的希望。选择合适的目标靶分子、应用安全的基因转导方法、防治CAR-T细胞治疗的不良反应、将使CAR-T细胞造福越来越多的晚期肿瘤患者。
嵌合型抗原受体 免疫治疗 肿瘤
嵌合型抗原受体(chimeric antigen receptor,CAR)是由抗体源性靶向区与T细胞信号区融合而成,当T细胞表达CARs后赋予T细胞抗原特异性,而这种特异性是由CARs中的靶向区决定的。尽管在B细胞源性肿瘤中CAR-T细胞治疗取得了较好的疗效,但在实体瘤中CAR-T细胞则面临挑战。为获得较好临床疗效CAR-T细胞必须具有以下功能:首先必须对明确区分肿瘤与正常组织的抗原具有特异性;其次必须归巢并且渗透至围绕肿瘤的促结缔组织形成基质;当到达肿瘤内后,必须能够扩增、持续存在并且在主要由免疫抑制介质组成的微环境中发挥细胞毒作用。这些可通过内在和/或外在对CAR-T细胞进行修饰来实现。本综述将阐述CARs结构、CAR-T细胞抗肿瘤的原理、CAR-T细胞在临床上的应用以及CAR-T细胞治疗的不良反应。
1 CAR结构及CAR-T细胞抗肿瘤机制
1.1CAR结构
CARs由T细胞受体(T cell receptor,TCR)的胞内信号区(如CD3ζ和CD28)、跨膜区以及胞外抗原结合区组成,而这个胞外区具有抗体单链可变区片段功能即识别特定肿瘤抗原的功能(图1)[1]。这种CARs转染的T细胞具有抗体的特异性和效应T细胞的细胞毒作用。CARs的特异性由其胞外区决定,而这个胞外区源于抗体的抗原结合基序,具有连接VH和VL序列构建单链可变区(single chain fragment variable,SCFV)的作用。当肿瘤相关抗原(tumor-associated angtige,TAA)本身为受体时,CARs胞外区则为配体或多肽使其对受体具有特异性。CARs一旦与TAA结合,可通过由CD3或高亲和性受体FcεRI的胞内区使T细胞活化发挥效应功能[2]。
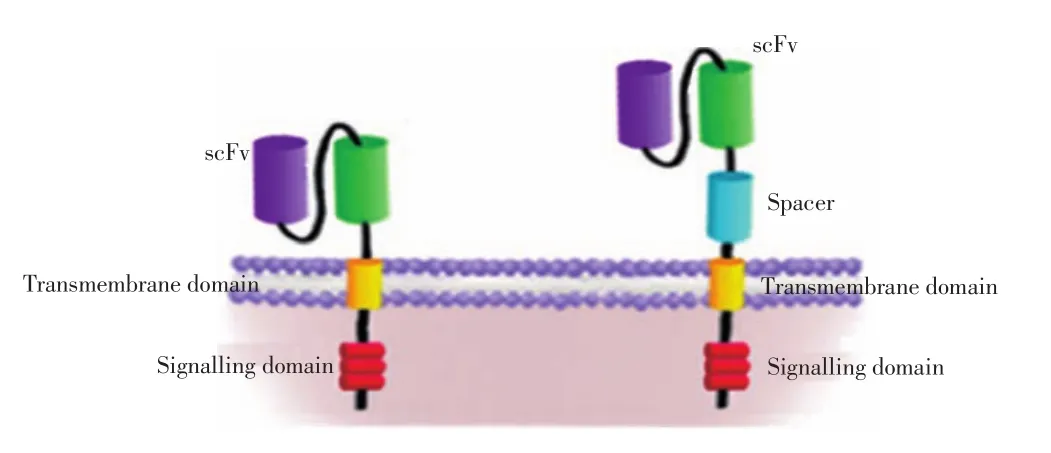
图1 CAR的结构示意图Figure 1Schematic of chimeric antigen receptor(CAR)
CARs与TAA结合后为CAR-T细胞提供活化信号引起CAR-T细胞活化,表现为CARs依赖的杀伤、增殖及细胞因子释放。这些效应功能可用来设计合成新的CARs如包含多个嵌合活化区的CARs,这种CARs重复修饰序列引起了胞内具有1个、2个或3个
信号基序的1代、2代和3代CARs(图2)[1]。2代CARs是在1代的基础上添加一个胞内信号区,而这个信号区提供共刺激信号(如CD28、CD137);3代CARs则在胞内添加了两个串联的共刺激信号区。最近又出现了第4代CARs(又称TRUCKs),即应用编码CAR和/或CAR反应性启动子的载体构建CAR,在转基因产生的细胞因子作用下CAR产生有效的信号[3],而这些细胞因子还可招募免疫系统的其他成分使抗肿瘤免疫效应放大。
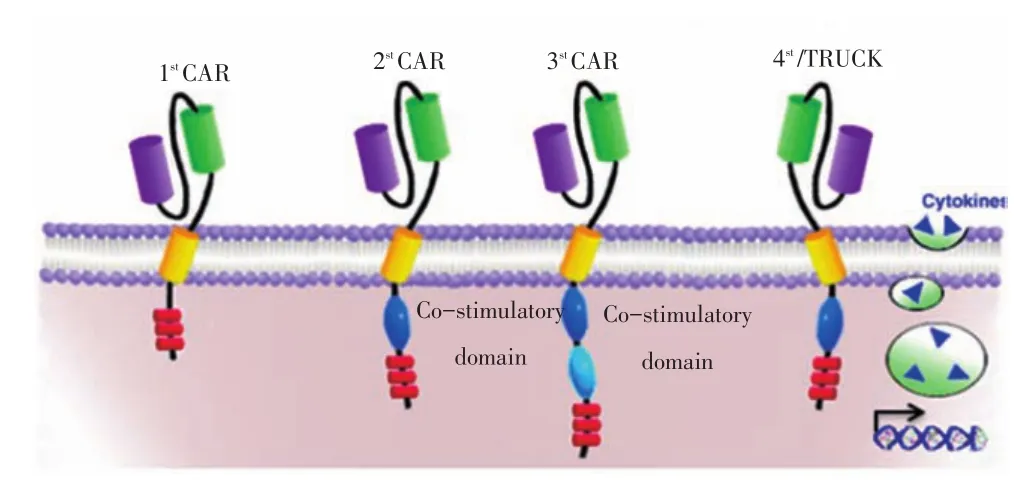
图24 代CAR结构示意图Figure 2 Schematic of the four-generation CAR
输注的CAR-T细胞在患者体内持续存在与潜在的疗效相关,因此研究者在设计CARs时通常会考虑到CAR-T细胞在体内的存在时间。由于1代CARs的信号主要通过CD3ζ上的免疫受体酪氨酸激酶活化基序(immunoreceptor tyrosine-based activation motif,ITAM)传导,早期临床研究发现在多数患者中输注的CAR-T细胞不能持续存在[4-5]。2代CARs的胞内信号区为CD3-ζ与共刺激分子串联组成,从而提高了T细胞的效应功能[6],因此目前临床研究中所输注的CAR-T细胞为2代CAR-T细胞。3代CARs中含有2个共刺激分子胞内区(如CD28与CD137/CD134嵌合体与CD3-ζ串联组成),这有利于信号放大[7]。
1.2CAR-T细胞抗肿瘤的机制
CAR-T细胞是如何发挥抗肿瘤作用,需先了解细胞毒T细胞(cytotoxic T cells,CTL)是如何活化并杀伤肿瘤细胞的。CTL是经抗原递呈细胞激活的CD8+T淋巴细胞。T细胞的活化需要双信号途径(图3)[8],第一信号途径为抗原递呈细胞上的MHC分子-抗原肽复合体与T细胞上的TCR结合,第二信号为抗原递呈细胞上的共刺激分子B7与T细胞上的CD28分子结合,在这两种信号的共同作用下,T细胞会活化增殖为CTL细胞。当CTL细胞再次遇到携带有相同MHC分子-抗原肽复合体的肿瘤细胞时,就会通过同样的机制与之结合,并分泌穿孔蛋白、粒酶及细胞因子协同作用杀死肿瘤细胞。CTL具有十分强大的杀伤肿瘤细胞的能力,理论上讲一个CTL可以杀死数十到上百个肿瘤细胞。

图3 T细胞活化的双信号途径Fig 3Double signal pathway of T cell activation
在T细胞活化的第一信号途径中,接受肿瘤抗原信息的TCR分子本身并不能直接传递信号,CD3分子负责向T细胞传递信号。CD3的结构示意图(图4)[9],CD3由3对复合物构成,分别为εδ、εγ及ζζ分子。εδ及εγ分子各含有一对ITAM,而ζζ分子含有3对IATM,这样一共合起来有5对ITAM能够对下游蛋白激酶产生磷酸化。当TCR与MHC-抗原肽复合体结合后,TCR又与CD3结合形成复合体后,引起ITAM磷酸化激活下游蛋白使T细胞活化增殖。因此,ITAM的作用就像一个信号放大器,这样的复合分子能够很敏感地感知TCR受体的情况并及时地激活T细胞,使T细胞增生活化转变为CTL细胞,CTL细胞反过来对含有肿瘤抗原的肿瘤细胞进行免疫攻击。
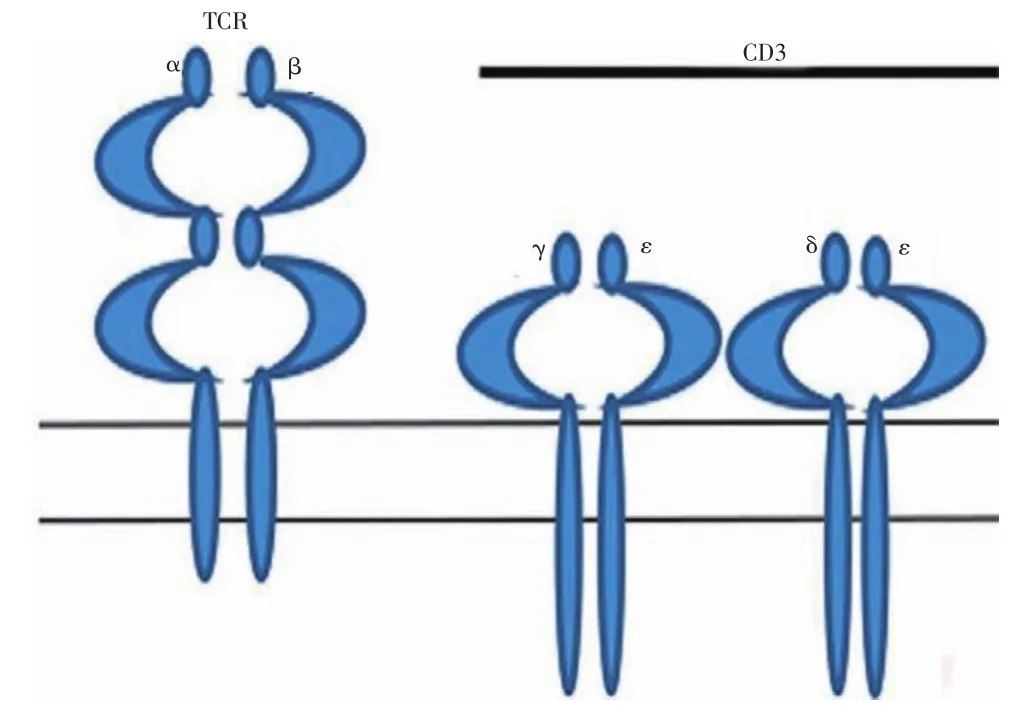
图4 TCR-CD3复合物示意图Fig 4Structure of classical TCR-CD3 complex
1.3CAR T细胞的设计及临床应用路线
早期设计的CARs比较简单,仅有一个胞内信号区,又称第1代CARs(图2)[1]。与CD3分子相比,只有3个ITAM,且缺乏共刺激分子传导的第2信号,因此第1代CARs只有较弱的抗肿瘤作用,由于缺乏T细胞增殖的第2信号,T细胞在结合肿瘤抗原后很难
进一步增殖,因此在临床应用中效果较差[4]。在此基础上,人们将CARs进行了改造,将传递第2信号的CD28或4-1BB分子的活性域整合到CAR中,即第2代CARs[10]。当在体内遇到肿瘤抗原后,第2代CAR-T细胞在杀死肿瘤细胞的同时,还能完成自身的扩增。在CAR-T细胞中加入共刺激信号4-1BB可增强CAR-T细胞在体内的存活时间、肿瘤定位的CAR-T细胞增多以及抗肿瘤能力提高[11]。因此,第2代CARs在临床应用中表现出了良好的抗肿瘤作用。然而在缺乏外源性共刺激分子的情况下所有2代CARs均不能产生足够的IL-2促进T细胞增殖,当给予外源性B7共刺激分子时这些转基因CART细胞则可产生IL-2促进其增殖[12-13]。基于此产生了第3代CARs,其胞内信号区除CD28分子外还有另一共刺激分子(通常为OX40或4-1BB)[14],与2代CARs相比,3代CARs具有相当的细胞溶解作用[15-16],但其体内扩增能力及产生细胞因子能力更强[15]。从CART细胞胞内信号区及活化区结构及功能直接推论其体内抗肿瘤活性的话,2代CARs优于1代CARs,3代CARs优于2代CARs,但最近研究表明CAR T细胞的功能活性除与其胞内的信号序列有关外,还与靶细胞提供的内源性受体有关[17],3代CARs是否优于第2代CARs有待于临床验证。
1~3代CARs的缺点在于在输注CAR-T细胞前均需对患者进行预处理(全身照射或大剂量化疗)以获得理想的临床疗效,并且临床疗效与预处理方案的强度呈正相关[18],因预处理方案的毒性限制了其临床应用。为解决预处理方案的临床限制性,第4代CARs应运而生,Pegram等[3]设计了具有分泌IL-12且靶向CD19的CAR-T细胞,在缺乏环磷酰胺预处理情况下具有抗CD19+肿瘤作用外,同时还有诱导B细胞发育不全作用。4代CARs的出现使患者免受预处理治疗的毒副反应,拓宽了CAR-T细胞的临床应用范围。最近又有双特异性CAR-T细胞出现,在动物体内的研究表明这种CAR-T细胞具有招募抗体以及抗肿瘤的活性[19]。
在临床应用中,CAR-T细胞的主要操作步骤为将含有CARs基因的载体转染到T细胞中[20],或者利用SB系统进行电转染T细胞[21],然后应用现有的T细胞扩增技术,在体外大量扩增T细胞,然后将扩增的T细胞回输给经预处理后的肿瘤患者,这个过程也叫做重新引导T细胞攻击肿瘤细胞(redirecting T cells towards tumor cells)。
2 CAR-T细胞的临床应用
2.1CD19的CAR-T细胞
CD19特异性表达于恶性和正常B细胞以及B细胞前体细胞,而造血干细胞及非造血细胞则不存在CD19表达。因此针对CD19的CARs是目前临床上研究最多的CAR-T细胞[20]。因1代CARs的临床疗效不佳,目前所用的CAR19-T细胞多数为2代CARs[22]。Sloan-Kettering纪念医院用CAR-T细胞治疗了16例难治复发的急性淋巴细胞白血病(B-ALL)者,14例患者出现了完全缓解,缓解率达88%;即便是Ph+的高危患者,仍能取得同样的效果[23]。部分接受抗CA19的CDR-T治疗患者出现急性不良反应,这些不良反应通常与血清中炎性细胞因子水平升高有关[24]。尽管抗CD19的CAR-T细胞治疗还处于研究的早期阶段,但在患者中观察到的抗原特异性活性表明输注抗CD19的CAR-T细胞可能成为部分B细胞肿瘤患者的标准治疗[25]。
2.2HER-2/Neu的CAR-T细胞
HER-2是跨膜表皮生长因子受体家族成员,在几种人腺癌中存在过表达,是目前肿瘤免疫治疗研究最多的TAA之一[26]。Sun等[27]构建的人源化抗-HER-2的CAR,体外研究表明这种CAR-T细胞具有特异的抗HER-2(+)肿瘤细胞作用,在动物模型体内具有明显抑制HER-2(+)肿瘤生长作用;说明HER-2特异性CAR-T细胞在体外不仅具有识别和杀伤HER-2(+)癌细胞作用,并且体内具有诱导肿瘤消退作用,这一结果为部分HER-2(+)肿瘤患者的治疗带来了新的希望。
2.3神经节苷脂2(diasialoganglioside,GD2)的CAR-T细胞
神经节苷脂是一类细胞膜上的糖鞘脂类化合物,正常组织很少表达GD2,而黑色素瘤、成细胞纤维瘤、小细胞肺癌、骨肉瘤、软组织肉瘤等肿瘤细胞高表达GD2,而GD2具有促进原发及转移肿瘤生长作用。Pule等[5]应用针对GD2的1代CAR-T细胞治疗11例儿童神经母细胞瘤患者,在8例可评价疗效患者中4例患者出现肿瘤坏死与消退,其中1例患者为完全缓解,这11例患者随访2年时未见明显不良反应。对19例接受抗GD2-CAR-T细胞治疗的高危神经母细胞瘤患者进行长期随访,发现GD2-CAR-T细胞具有抗神经母细胞瘤作用,这些CAR-T细胞可在患者体内扩增、持续存在,而CAR-T细胞的持续存在与患者的长期生存相关[28]。
2.4间皮素的CAR-T细胞
间皮素为细胞表面糖蛋白,在多种肿瘤中高表达,如恶性胸膜间皮瘤、胰腺癌、卵巢癌及部分肺癌[29],在正常的胸膜、腹膜以及心包膜表面低表达。临床前研究表明针对间皮素的CAR-T细胞具有潜在抗肿瘤作用[16];应用间皮素特异性mRNA-CAR-T细
胞治疗间皮素高表达的晚期实体瘤取得了较好的临床疗效,这为CAR-T细胞的设计提供了新的策略,mRNA-CAR-T细胞可能对实体瘤具有治疗效果[30]。
2.5其他TAA的CAR-T细胞
目前世界范围内多个中心进行针对不同TAA的CAR-T细胞治疗的临床研究,这些TAA主要有CD133、CD138、CD20、CD30、EGFR、c-MET等。
3 CAR-T细胞治疗的不良反应
CAR-T细胞治疗是一种免疫治疗,尽管其为部分晚期肿瘤患者带来治愈的希望,但在治疗过程中具有一定的不良反应,并且部分不良反应有可能是致命的。因此在开展CAR-T细胞治疗时,一定要先考虑到其可能的不良反应。
3.1细胞因子释放综合征(cytokine release syndrome,CRS)
CRS是CAR-T细胞治疗常见且致死性的并发症。CRS发生发展与CAR结构、肿瘤类负荷及类型以及患者基因多态性等相关,可通过设计安全的CARs或CAR-T细胞并严格限制每次输注的细胞数量来降低CRS发生。糖皮质激素及细胞因子拮抗剂具有降低CRS相关死亡的作用[31]。
CRS临床表现有恶心、头痛、心动过速、低血压、皮疹、胸闷气短[32]。输注CAR-T细胞后T细胞、B细胞、NK细胞以及单核/巨噬细胞释放大量的炎性介质(如细胞因子和趋化因子),这些炎性介质触发急性炎症反应诱导上皮及组织损伤,导致微血管渗漏、心衰甚至死亡[33]。因此在CAR-T细胞治疗过程中及时恰当控制CRS是非常重要的。
3.2肿瘤溶解综合征(tumor lysis syndrome,TLS)
在早期CAR-T细胞治疗的临床研究中观察到TLS发生,主要与输注CAR-T细胞的体内增殖以及体内细胞因子释放有关[25,34],在输注CAR-T细胞后的几周内进行严密监测及时给予处理预防和/或可控制TLS。
3.3脱靶效应(on-target toxicity)
由于CAR-T细胞针对TAA,对TAA具有高度亲和力,当其与正常组织表达的TAA结合后对正常组织产生的毒性则为脱靶效应;这种毒性由抗原介导可应用抗体封闭正常组织上的TAA、降低每次输注的CAR-T细胞数量[35]、构建跨信号CAR(CAR结构中T细胞活化信号1即CD3ζ与共刺激信号CD28分子不直接相连)[36]或者通过引入自杀基因系统[37]来预防及治疗这种脱靶毒性。例如B细胞缺乏便是CAR19-T细胞治疗的脱靶毒性,B细胞缺乏可引起长期的低γ球蛋白血症,可通过输注丙种球蛋白替代[38]。
4 结语
实体瘤CAR-T细胞治疗的最终目的是治愈,这就需要设计新的、能够在实体瘤微环境中存在和增殖的CAR-T细胞,目前在临床前研究方面已向这一最终目标迈出了具有重要意义的一大步。然而由于选择的多样性、对既定实体瘤和其微环境评价的谨慎性,缩小了CAR-T细胞最可能诱导临床疗效的范围。在将来比较不同基因修饰策略改造的CAR-T细胞的临床研究有利于优化CAR-T细胞治疗,使其治疗实体瘤从希望变为现实。
1Cheadle EJ,Gornall H,Baldan V,et al.CAR T cells:driving the road from the laboratory to the clinic[J].Immunol Rev,2014,257(1):91-106.
2Abken H,Hombach A,Heuser C.Immune response manipulation: recombinant immunoreceptors endow T-cells with predefined specificity[J].Curr Pharm Des,2003,9(24):1992-2001.
3Pegram HJ,Lee JC,Hayman EG,et al.Tumor-targeted T cells modified to secrete IL-12 eradicate systemic tumors without need for prior conditioning[J].Blood,2012,119(18):4133-4141.
4Jensen MC,Popplewell L,Cooper LJ,et al.Antitransgene rejection responses contribute to attenuated persistence of adoptively transferred CD20/CD19-specific chimeric antigen receptor redirected T cells in humans[J].Biol Blood Marrow Transplant,2010,16(9): 1245-1256.
5Pule MA,Savoldo B,Myers GD,et al.Virus-specific T cells engineered to coexpress tumor-specific receptors:persistence and antitumor activity in individuals with neuroblastoma[J].Nat Med,2008,14(11):1264-12670.
6Kowolik CM,Topp MS,Gonzalez S,et al.CD28 costimulation provided through a CD19-specific chimeric antigen receptor enhances in vivo persistence and antitumor efficacy of adoptively transferred T cell[J].Cancer Res,2006,66(22):10995-11004.
7Zhao Y,Wang QJ,Yang S,et al.A herceptin-based chimeric antigen receptor with modified signaling domains leads to enhanced survival of transduced T lymphocytes and antitumor activity[J].J Immunol,2009,183(9):5563-5574.
8Riella LV,Paterson AM,Sharpe AH,et al.Role of the PD-1 pathway in the immune response[J].Am J Transplant,2012,12(10):2575-2587.
9Gao J,Bernatchez C,Sharma P,et al.Advances in the development of cancer immunotherapies[J].Trends Immunol,2013,34(2):90-98.
10 Kolos M,Levine BL,Porter DL,et al.T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia[J].Sci Transl Med,2011,3(95): 95ra73.
11 Song DG,Ye Q,Carpenito C,et al.In vivo persistence,tumor localization,and antitumor activity of CAR-engineered T cells is enhanced by costimulatory signaling through CD137(4-1BB)[J]. Cancer Res,2011,71(13):4617-4627.
12 Brentjens RJ,Santos E,Nikhamin Y,et al.Genetically targeted T cells eradicate systemic acute lymphoblastic leukemia xenografts[J]. Clin Cancer Res,2007,13(18 Pt 1):5426-5435.
13 Beecham EJ,Ortiz-Pujols S,Junghans RP.Dynamics of tumor cell killing by human T lymphocytes armed with an anti-carcinoembry-
onic antigen chimeric immunoglobulin T-cell receptor[J].J Immunother,2000,23(3):332-343.
14 Till BG,Jensen MC,Wang J,et al.CD20-specific adoptive immunotherapy for lymphoma using a chimeric antigen receptor with both CD28 and 4-1BB domains:pilot clinical trial results[J].Blood,2012,119(17):3940-3950.
15 Pule MA,Straathof KC,Dotti G,et al.A chimeric T cell antigen receptor that augments cytokine release and supports clonal expansion of primary human T cells[J].Mol Ther,2005,12(5):933-941.
16 Carpenito C,Milone MC,Hassan R,et al.Control of large,established tumor xenografts with genetically retargeted human T cells containing CD28 and CD137 domains[J].Proc Natl Acad Sci U S A,2009,106(9):3360-3365.
17 Cheadle EJ,Rothwell DG,Bridgeman JS,et al.Ligation of the CD2 co-stimulatory receptor enhances IL-2 production from first-generation chimeric antigen receptor T cells[J].Gene Ther,2012,19(11):1114-1120.
18 Dudley ME,Yang JC,Sherry R,et al.Adoptive cell therapy for patients with metastatic melanoma:evaluation of intensive myeloablative chemoradiation preparative regimens[J].J Clin Oncol,2008,26(32):5233-5239.
19 Kobold S,Steffen J,Chaloupka M,et al.Selective bispecific T cell recruiting antibody and antitumor activity of adoptive T cell transfer[J].J Natl Cancer Inst,2015,107(1):364.
20 Jena B,Dotti G,Cooper LJ.Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor[J].Blood,2010,116(7):1035-1044.
21 Singh H,Manuri PR,Olivares S,et al.Redirecting specificity of T-cell populations for CD19 using the Sleeping Beauty system[J]. Cancer Res,2008,68(8):2961-2971.
22 Hosing C,Kebriaei P,Wierda W,et al.CARs in chronic lymphocytic leukemia-ready to drive[J].Curr Hematol Malig Rep,2013,8(1):60-70.
23 Davila ML,Riviere I,Wang X,et al.Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J].Sci Transl Med,2014,6(224):224ra25.
24 Kochenderfer JN,Rosenberg SA.Treating B-cell cancer with T cells expressing anti-CD19 chimeric antigen receptors[J].Nat Rev Clin Oncol,2013,10(5):267-276.
25 Porter DL,Levine BL,Kalos M,et al.Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J].N Engl J Med,2011,365(8):725-733.
26.Arteaga CL,Sliwkowski MX,Osborne CK,et al.Treatment of HER2-positive breast cancer:current status and future perspectives[J].Nat Rev Clin Oncol,2012,9(1):16-32.
27 Sun M,Shi H,Liu C,et al.Construction and evaluation of a novel humanized HER2-specific chimeric receptor[J].Breast Cancer Res, 2014,16(3):R61.
28 Louis CU,Savoldo B,Dotti G,et al.Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma[J].Blood,2011,118(23):6050-6056.
29 Chang K,Pastan I.Molecular cloning of mesothelin,a differentiation antigen present on mesothelium,mesotheliomas,and ovarian cancers[J].Proc Natl Acad Sci U S A,1996,93(1):136-140.
30 Beatty GL,Haas AR,Maus MV,et al.Mesothelin-specific chimeric antigen receptor mRNA-engineered T cells induce anti-tumor activity in solid malignancies[J].Cancer Immunol Res,2014,2(2): 112-120.
31 Xu XJ,Tang YM.Cytokine release syndrome in cancer immunotherapy with chimeric antigen receptor engineered T cells[J].Cancer Lett,2014,343(2):172-178.
32 Morgan RA,Yang JC,Kitano M,et al.Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2[J].Mol Ther,2010,18(4):843-851.
33 Lee WL,Slutsky AS.Sepsis and endothelial permeability[J].N Engl J Med,2010,363(7):689-691.
34 Kochenderfer JN,Dudley ME,Carpenter RO,et al.Donor-derived CD19-targeted T cells cause regression of malignancy persisting after allogeneic hematopoietic stem cell transplantation[J]. Blood,2013,122(25):4129-4139.
35 Lamers CH,Sleijfer S,van Steenbergen S,et al.Treatment of metastatic renal cell carcinoma with CAIX CAR-engineered T cells: clinical evaluation and management of on-target toxicity[J].Mol Ther,2013,21(4):904-912.
36 Lanitis E,Poussin M,Klattenhoff AW,et al.Chimeric antigen receptor T Cells with dissociated signaling domains exhibit focused antitumor activity with reduced potential for toxicity in vivo[J].Cancer Immunol Res,2013,1(1):43-53.
37 Gargett T,Brown MP.The inducible caspase-9 suicide gene system as a"safety switch"to limit on-target,off-tumor toxicities of chimeric antigen receptor T cells[J].Front Pharmacol,2014,5:235.
38 Davila ML,Kloss CC,Gunset G,et al.CD19 CAR-targeted T cells induce long-term remission and B Cell Aplasia in an immunocompetent mouse model of B cell acute lymphoblastic leukemia[J]. PLoS One,2013,8(4):e61338.
(2014-10-07收稿)
(2014-12-31修回)
(编辑:杨红欣)
Research progress of CAR T-cell in tumor therapy
Lingdi ZHAO,Quanli GAO
Quanli GAO;E-mail:gaoquanli@aliyun.com
Adoptive cell transfusion based on chimeric antigen receptor(CAR)is a new approach for treating malignant diseases and even advanced malignancies.More patients with advanced malignancies are expected to benefit from CAR T-cells once the suitable target molecules are selected,the safe method of gene transduction is applied,and the side effects of CAR T-cells are prevented.
chimeric antigen receptor,immunotherapy,tumor

10.3969/j.issn.1000-8179.20141675
郑州大学附属肿瘤医院,河南省肿瘤医院(郑州市450008)
高全立gaoquanli@aliyun.com
TheAffiliated Hospital of Zhengzhou University and Henan Cancer Hospital,Zhengzhou 450008,China
赵玲娣专业方向为恶性肿瘤的生物免疫治疗及化疗。
E-mail:lingdi1010@126.com

