PI3Kδ抑制剂CAL-101对淋巴瘤细胞系Raji和SUDHL-10的作用及其机制研究*
王亚非 夏冰 屈福莲 李晓武 郭姗琦 袁田 赵伟鹏 张翼鷟
·基础研究·
PI3Kδ抑制剂CAL-101对淋巴瘤细胞系Raji和SUDHL-10的作用及其机制研究*
王亚非 夏冰 屈福莲 李晓武 郭姗琦 袁田 赵伟鹏 张翼鷟
目的:探讨PI3Kδ抑制剂CAL-101对弥漫大B细胞淋巴瘤细胞系SUDHL-10和Burkitt淋巴瘤细胞系Raji的作用及其相关机制,为这类疾病的治疗提供新的思路。方法:用不同浓度的CAL-101处理Burkitt淋巴瘤细胞系Raji和弥漫大B细胞淋巴瘤细胞系SUDHL-10,以MTT法检测CAL-101对两种细胞系的增殖抑制作用;以Annexin V/PI流式细胞术和DAPI染色法检测细胞的凋亡情况;迁移实验检测淋巴瘤细胞向淋巴瘤基质细胞系HK的迁移比例;Western blot法检测CAL-101处理后淋巴瘤细胞表达磷酸化ERK的变化;MTT法结合CalcuSyn software软件分析检测CAL-101是否可协同硼替佐米抑制淋巴瘤细胞的增殖。结果:5 μmol/L及更高浓度的CAL-101对Raji细胞和SUDHL-10细胞的增殖有明显的抑制作用,且呈剂量依赖性。5、10、15、20 μ mol/L CAL-101作用于Raji细胞48 h,细胞增殖抑制率分别为(29.17±1.23)%、(38.15±1.51)%、(46.46±1.78)%、(55.8±2.01)%,空白对照组为(1.15±0.02)%(P<0.05)。作用于SUDHL-10 48 h,细胞增殖抑制率也逐渐增加(P<0.05)。CAL-101可诱导淋巴瘤细胞的凋亡,10、20 μmol/L CAL-101作用于Raji细胞24 h,AnnexinV-FITC/PI双标法显示其凋亡率分别为(22.69±3.83)%和(49.96± 7.36)%,均高于对照组(5.23±2.04)%(P<0.05);作用于SUDHL-10细胞同样得到相似的结果(P<0.05)。CAL-101可显著降低淋巴瘤细胞向基质细胞的迁移,且对Raji细胞和SUDHL-10细胞的迁移率的抑制作用也呈浓度依赖性,差异均具有统计学意义(P<0.05);Western blot检测发现CAL-101处理细胞后磷酸化ERK的表达明显降低;CAL-101与硼替佐具有协同作用,可显著抑制淋巴瘤细胞的增殖,CI<1。结论:PI3Kδ抑制剂CAL-101可抑制淋巴瘤细胞Raji和SUDHL-10的增殖,诱导凋亡,抑制其向淋巴瘤基质细胞的迁移,其机制可能通过阻断ERK信号途径而实现;CAL-101有望为侵袭性淋巴瘤的治疗带来希望。
淋巴瘤 Raji细胞 SUHDL-10细胞 PI3Kδ CAL-101 ERK通路
Department of Hematology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer
Tianjin Key Laboratory of Cancer Prevention and Therapy,National Clinical Research Center for Cancer Tianjin 300060,China
This work was supported by the Training Plan of Tianjin Education Commission for Young Creative Talents Project.
磷脂酰肌醇3-激酶(phosphoinostide 3'-kinase,PI3K)是一种细胞内磷脂酰肌醇激酶,具有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶的活性,可整合和转导分子表面的多种信号,特别是B细胞受体(B-cell receptor,BCR)信号,而后者被认为是导致多种B细胞淋巴瘤发病的重要信号通路[1-2]。PI3Kδ主要在造血细胞中表达,在维持B细胞稳态和各种功能中发挥重要作用[3]。CAL-101又称GS-1101,一种口服的新药,为PI3Kδ的高度选择性抑制剂[4],在多种B细胞的恶性肿瘤,如慢性淋巴细胞白血病[5]、套细胞淋巴瘤[4]和多发性骨髓瘤[6]中被证实可促进肿瘤细胞的凋亡;在临床研究中也显示了乐观的应用前景[7-8]。但关于CAL-101对Burkitt淋巴瘤(Burkitt lymphoma,BL)和弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)这两类侵袭性淋巴瘤的作用及其机制鲜见报道,本研究进行了初步探讨并报道如下。
1 材料与方法
1.1材料
1.1.1主要试剂PI3Kδ选择性抑制剂CAL-101为美国Selleck公司产品,以DMSO溶液配制成10 mM的贮存液,-20℃储存;MTT试剂盒购自美国Sigma公司;Annexin V FITC凋亡检测试剂盒购自美国BD公司;DAPI核酸染色按试剂盒购自美国Intitrogen公司;硼替佐米是西安杨森公司赠药,以DMSO溶液配制成10 mM的贮存液,-20℃储存;TRIzol Reagent购自美国Invitrogen公司;兔抗人ERK1/2、p-ERK1/2(Thr202/Tyr204)单克隆抗体为美国Cell Signaling Technology公司产品。
1.1.2细胞系来源及培养Burkitt淋巴瘤细胞系Raji购自中国科学院上海细胞库,DLBCL细胞系SUDHL-10和淋巴瘤基质细胞系HK由美国Moffitt Cancer Center and Institute血液肿瘤科Sotomayor教授、陶建国教授惠赠。细胞接种于含有10%胎牛血清的RPMI 1640培养基(Thermo Fisher Scientific,美国)中,置于37℃、体积分数为5%的CO2培养箱中,饱和湿度下培养,取对数生长期的细胞用于实验。
1.2方法
1.2.1MTT法检测淋巴瘤细胞增殖的抑制率调整Raji细胞和SUDHL-10细胞浓度为4×104/mL,接种于96孔板中培养6 h。分组如下:空白对照组(不加CAL-101)、阴性对照组(仅含有等量RPMI 1640培养液)、实验组(CAL-101药物终浓度分别为5、10、15、20 μmol/L),各组设6个复孔,于培养箱中分别培养48 h。于预定时间取出培养板,每孔加入MTT溶液,继续培养4 h,弃培养液后加入DMSO,选择570 nm波长测定各孔吸光度A值计算增殖率,增殖抑制率=[(阴性对照组A值-空白组A值)-(实验组A值-空白组A值)]/(阴性对照组A值-空白组A值)×100%。实验重复3次。
1.2.2流式细胞术和DAPI核酸染色法检测淋巴瘤细胞的凋亡情况取对数生长期细胞加入CAL-101溶液,使药物终浓度分别为10 μmol/L和20 μmol/L,于培养箱中分别培养24 h。收集各组细胞行Annexin V-PI双染色,流式细胞仪检测凋亡率。DAPI核酸染色按试剂盒说明进行操作,检测凋亡细胞形态。
1.2.3迁移实验采用24孔趋化板,孔径大小为5 μm。上室加入1.5×105/mL Raji或SUDHL-10细胞,分别加入5 μmol/L或10 μmol/L CAL-101处理2 h,下室加入8×104/孔的HK细胞,以不经药物处理的或不加HK细胞的DMEM培养液作为对照。在37℃、5%CO2培养箱中孵育,5 h后收集下室悬液中的细胞,流式细胞术计数细胞数并计算迁移率。迁移率=下室细胞数/原上室细胞悬液细胞数×100%。
1.2.4Western blot法检测ERK、磷酸化ERK蛋白的表达收集上述各组细胞,用蛋白裂解液充分裂解细胞,离心后收集上清提取总蛋白。用BCA法测定蛋白浓度,均取30 μg蛋白行SDS-PAGE电泳,电转至PVDF膜,封闭后分别加入各蛋白一抗,洗膜后分别加入相应的辣根过氧化物酶标记的二抗,反应90 min,洗膜后ECL发光法显色。
1.2.5与硼替佐米的协同实验将Raji和SUDHL-10细胞分别以6×103/孔接种于96孔板中,加入CAL-101和硼替佐米,药物浓度分别以各自IC50的固定比值分组接种。培养48 h,MTT方法检测OD值并计算增殖抑制率,应用CalcuSyn software(Biosoft,Ferguson,MO,美国)
软件分析协同指数(combination index,CI)[9-10],结果分别以CI<1、≈1、>1代表具有协同作用、相加作用(additive effect)、拮抗作用。实验至少重复3次以上。
1.3统计学方法
数据资料采用SPSS 19.0软件进行分析,对符合正态分布且方差齐性的计量资料以i T表示,两组间比较应用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1CAL-101对淋巴瘤细胞增殖的影响
MTT检测发现,CAL-101对Raji及SUDHL-10细胞增殖具有明显的抑制作用,且在一定范围内其抑制作用呈剂量依赖性。5、10、15、20 μmol/L CAL-101作用于Raji细胞48 h,细胞增殖抑制率分别为(29.17±1.23)%、(38.15±1.51)%、(46.46±1.78)%、(55.8±2.01)%,空白对照组为(1.15±0.02)%(P<0.05)。作用于SUDHL-10 48h,细胞增殖抑制率分别为(25.64±2.48)%、(54.06±1.92)%、(58.54±2.75)%,(74.58±1.18)%,空白对照组为(2.35±0.01)%(P<0.05)。
2.2CAL-101对淋巴瘤细胞系凋亡的影响
流式细胞术检测结果显示CAL-101可诱导淋巴瘤细胞的凋亡,10、20 μmol/L CAL-101作用于Raji细胞24 h,AnnexinV-FITC/PI双标法显示其凋亡率分别为(22.69±3.83)%和(49.96±7.36)%,高于对照组(5.23±2.04)%(P<0.05);作用于SUDHL-10细胞24 h,凋亡率分别为(30.08±4.68)%和(55.29±1.65)%,高于对照组(2.67±0.97)%(P<0.05,图1);用DAPI染料染细胞核,荧光显微镜下可见经CAL-101处理的细胞出现核固缩、溶解等现象,且随着药物浓度的增加愈加明显(图2)。

图1 不同浓度的CAL-101对淋巴瘤细胞凋亡的诱导Figure 1Different concentrations of CAL-101 induced lymphoma cell apoptosis
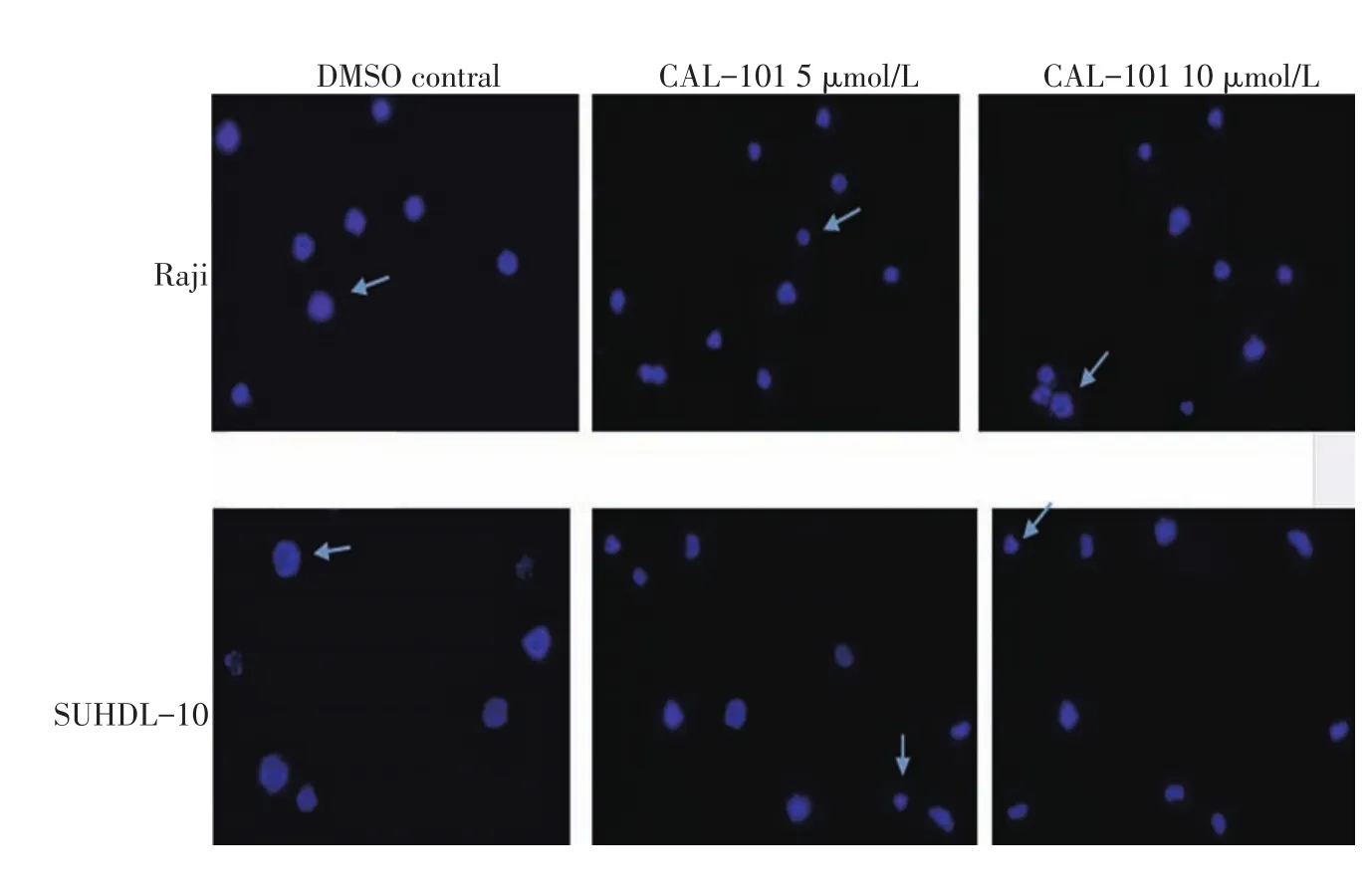
▶图2DAPI核酸染料染细胞核,荧光显微镜下比较细胞核的形态改变(×400)Figure 2DAPI staining and verification of the deformation of cell nucleus under a fluorescence microscope(Original magnification×400),The arows show the typical neuclear changes
2.3CAL-101处理对淋巴瘤细胞迁移的影响
计算淋巴瘤细胞向骨髓基质细胞HK的迁移率,设不加CAL-101处理的对照组细胞迁移率为100%。结果显示,Raji细胞经5 μmol/L和10 μmol/L的CAL1-101处理后,迁移率显著降至(69.87±9.15)%(P=0.03)和(34.85±5.68)%(P=0.003)。在不加HK细胞的对照组,不经药物处理的Raji细胞的迁移率为(18.21±3.71)%;SUDHL-10细胞经5 μmol/L和10 μmol/L的CAL1-101处理后,迁移率显著降至(74.61±9.60)%(P=0.045)和(46.61±9.72%)(P=0.011)。在不加HK细胞的对照组,不经药物处理的SUDHL-10细胞的迁移率为(12.11± 4.04)%(图3)。
2.4CAL-101处理对淋巴瘤细胞ERK、磷酸化ERK蛋白表达的影响
应用Western blot检测发现Raji和SUDHL-10细胞均存在磷酸化ERK的表达,经CAL-101处理后,磷酸化ERK的表达明显下降,且随药物剂量的增加而减低(图4)

图3 CAL-101对淋巴瘤细胞向基质细胞迁移的影响Figure 3CAL-101 affected MSC-mediated lymphoma cell migration beneath the marrow stromal cells
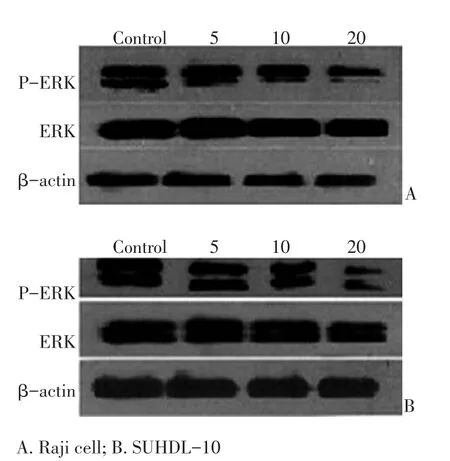
图4 不同浓度的CAL-101(μmol/L)对淋巴瘤细胞ERK1/2、p-ERK表达的影响Figure 4Different concentrations of CAL-101 affected the expression of ERK1/2 and p-ERK in lymphoma cells(μmol/L)
2.5CAL-101协同硼替佐咪对淋巴瘤细胞增殖的抑制作用
MTT法检测CAL-101和硼替佐米的协同作用,以两种药物分别单独处理细胞作为对照(图5A、5B),两药联合应用对Raji和SUDHL-10细胞的增殖抑制作用均明显强于单药。利用CalcuSyn software分析软件测定联合作用指数(combination index,CI),结果两种细胞系的CI值均<1.0(图5C、5D),证实了CAL-101与治疗侵袭性淋巴瘤的药物硼替佐米存在协同作用。
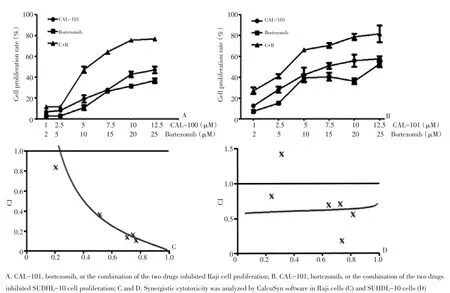
图5 CAL-101可联合硼替佐米联合抑制淋巴瘤细胞的增殖Figure 5Combining CAL-101 with bortezomib inhibited the proliferation of lymphoma cells
3 讨论
PI3K又名磷脂酰肌醇-3-激酶,依其结构、底物及调剂亚基的不同可分为三大类:Ⅰ类包含一个由催化亚基和调节亚基组成的一组异质二聚体蛋白,PI3K能磷酸化磷脂酰肌醇(PI)为磷脂酰-4-肌醇(PIP)和磷脂酰-4,5-肌醇(PIP2)。Ⅱ类有三个成员:PI3KC2α、PI3KC2β和PI3KC2γ。Ⅲ类仅包含一个成员Vps34,在细胞内吞和囊泡转换中起作用。因对后两类目前所知甚少,通常所说的PI3K仅指第一类[11-12]。PI3K1又依据其调节亚基及上游的活化因子不同分为1A、1B两型,1A型由调节亚基P85及催化亚基P110组成。P110包括P110α、P110β及P110δ,P110δ主要在造血细胞中表达。当接受来自细胞膜外的各种刺激后,p110δ亚基通过与p85亚基结合将底物PIP2转化为PIP3,PIP3可以和蛋白激酶B(AKT)的N端PH(pleckstrin homology)结构域结合,使AKT从细胞质转移到细胞膜上,并在3-磷酸肌醇依赖性蛋白激酶-1的辅助下,使AKT蛋白上的苏氨酸磷酸化位点(Thr308)和丝氨酸磷酸化位点(Ser473)磷酸化而最终使其激活[11-13]。ERK是PI3K下游的另一条关键的信号通路,与AKT通路共同调节细胞的生存、凋亡等多种功能,可整合和转导分子表面的多种信号,特别是B细胞受体(B-cell receptor,BCR)信号,而BCR受体被认为是导致多种B细胞淋巴瘤发病的重要信号通路[1,14]。
CAL-101又名GS-1101,是一种口服的PI3Kδ高度选择性抑制剂。近年来该药在血液肿瘤,特别是B细胞肿瘤的治疗中取得了令人瞩目的成绩。Tausch等[7]报道了CAL-101单用或与利妥昔单抗/苯达莫司汀联合用药治疗慢性淋巴细胞白血病(chronic lymphocytic lymphoma,CLL)的Ⅰ期临床试验,入组者均为复发或难治性病例。55例接受CAL-101单药治疗,54例接受联合治疗。结果79%患者出现淋巴结缩小,在治疗的前8周超过50%患者出现淋巴结锐减。单药治疗的中位无进展生存期>12个月,联合用药的中位无进展生存期虽尚未得出,但远超过12个月。Lopez等[8]进行CAL-101单药或联合利妥昔单抗/苯达莫司汀联治疗包括滤泡细胞性淋巴瘤、小淋巴细胞淋巴瘤、淋巴浆细胞淋巴瘤和边缘区淋巴瘤在内的惰性非霍奇金淋巴瘤的Ⅰ期临床试验,结果显示无论单药还是联合用药,绝大多数患者出现了瘤体的减小。单药组总反应率为38%;联合用药组的总反应率为83%,有15%~25%的患者达到完全缓解。
在此同时,一些基础研究也在探讨CAL-101治疗B细胞恶性肿瘤的详尽机制,如Hoellenriegel等[15]研究发现CAL-101可抑制CLL细胞向趋化因子CXCL12、CXCL13和骨髓基质细胞的迁移,抑制AKT和ERK的磷酸化,特别是克服CLL与骨髓基质细胞相互作用后诱发的耐药。Ikeda等[6]研究了PI3K/ p101δ在多发性骨髓瘤(multiple myeloma,MM)细胞中的表达及其引发的生物效应,发现以小干扰RNA敲除p101δ基因的老鼠出现了明显的MM细胞生长受抑,并且检测到p110δ在MM细胞中的高表达。CAL-101可对LB、INA-6等MM细胞系及患者的原代细胞产生明显的细胞毒性作用,同时抑制磷酸化AKT的表达。CAL-101还可逆转MM细胞与IL-6、骨髓基质细胞及胰岛素衍生因子共培养后诱导的促生长作用,表明该药有望成为MM治疗的新方法,但其疗效还有待于临床试验的验证。Meadows等[16]研究了霍奇金淋巴瘤(Hodgkin's lymphoma,HL)的5种细胞系L428、L540、L591、L1236、KM-H2,均发现存在较高水平的PI3K δ表达及ERK的活化。当用CAL-101处理HL细胞后,ERK磷酸化减少、细胞凋亡率增高。
弥漫大B细胞淋巴瘤(DLBCL)和Burkitt(BL)淋巴瘤均属于侵袭性淋巴瘤,一般患者对初始治疗非常敏感,但约40%的患者最终难免进展,发生耐药导致死亡,因此探索这类疾病更有效的治疗策略是肿瘤领域亟待解决的难题。迄今为止,关于CAL-101对侵袭性淋巴瘤的作用及其机制的研究甚少。本文初步探讨了CAL-101对Raji和SUDHL-10细胞的作用,发现如同对CLL细胞的抑制,该药也同样抑制Raji和SUDHL-10细胞的增殖,诱导其凋亡,抑制其向基质细胞的迁移,并与蛋白酶体抑制剂硼替佐米具有协同抑制作用,且该研究提示对ERK通路的共同抑制作用是上述协同作用产生的关键机制之一。关于此类药物对侵袭性淋巴瘤作用的详尽机制尚需要进一步探索。近期Dasmahapatra等[17]报道了另一种抑制BCR功能的药物BTK通路抑制剂PCI-32765(该药与CAL-101同为近年来研发的对B细胞肿瘤疗效明显的药物)可诱导DLBCL细胞的凋亡,其机制大概与抑制AKT和NF-κB通路及其下游的Mcl-1、Bcl-xl,XIAP等的活性有关,由此推测CAL-101可能作用于类似通路从而抑制DLBCL细胞。在关于CAL-101抑制MM细胞增殖的研究中[6],发现该药亦可与硼替佐米产生协同作用,其机制可能为两药联用进一步抑制AKT的磷酸化。本文关于CAL-101协同硼替佐米的机制是否与此有关需要下一步的深入研究来证实。
综上所述,CAL-101这一口服的PI3Kδ选择性抑制剂有望为DLBCL和BL的治疗带来一线曙光,进一步的机制探讨和临床效果的验证还有赖于开展更多
更深入的基础研究和临床试验。
1Chen L,Monti S,Juszczynski P,et al.SYK inhibition modulates distinct PI3K/AKT-dependent survival pathways and cholesterol biosynthesis in diffuse large B cell lymphomas[J].Cancer Cell,2013,23(6):826-838.
2Okkenhaug K,Vanhaesebroeck B.PI3K in lymphocyte development,differentiation and activation[J].Nat Rev Immunol,2003,3(4):317-330.
3Jou ST,Carpino N,Takahashi Y,et al.Essential nonreduntant role for the phosphoinostitde 3-kinase p110delta in signaling by the B-cell receptor complex[J].Mol Cell Biol,2002,22(24): 8580-8591.
4Lannutti BJ,Meadows SA,Herman SE,et al.CAL-101,a p110(delta)selective phosphatidylinositol-3-kinase inhibitor for the treatment of B-cell malignancies,inhibit PI3K signaling and cellular viability[J].Blood,2011,117(2):591-594.
5Herman SE,Gordon AL,Wanger AJ,et al.Phosphatidylinositol-3-kinase-delta inhibitor CAL-101 shows promising preclinical activity in chronic lymphocytic leukemia by antagonizing intrinsic and extrinsic cellular survival signals[J].Blood,2010,116(12): 2078-2088.
6Ikeda H,Hideshima T,Fulciniti M,et al.PI3K/p110(delata)is a novel therapeutic target in multiple myeloma[J].Blood,2010,116(9):1460-1468.
7Tausch E,Stilgenbauer S.Chronic lymphocytic leukemia:current standards and novel approahes[J].Internist(Berl),2014,55(12):1400,1402-1404,1406-1409.
8Lopez JP,Jimeno A.Idelalisib for the treatment of indolent non-Hodgkin's lymphoma[J].Drugs Today(Barc),2014,50(2): 113-120.
9Sun W,Modak S.Emerging treatment options for the treatment of neuroblastoma:potential role of perifosine[J].Onco Targets Ther,2012,5(1):21-29.
10 Hayashi T,Hideshima T,Akiyama M,et al.Arsenic trioxide inhibits growth of hμmol/Lol/Lan multiple myeloma cells in the bone marrow microenvironment[J].Mol Cancer Ther,2002,1(3):851-860.
11 Vanhaesebroeck B,Leevers SJ,Ahmadi K,et al.Synthesis and function of 3-phosphorylated inositol lipids[J].Annu Rev Biochem,2001,70:535-602.
12 Fratti RA,Backer JM,Gruenberg J,et al.Role of phosphatidylinositol 3-kinase and Rab5 effectors in phagosomal biogenesis and mycobacterial phagosome maturation arrest[J].J Cell Biol,2001,154(3):631-644.
13 Ciraolo E,Morello F,Hirsch E.Present and future of PI3K pathway inhibition in cancer:perspectives and limitations[J].Curr Med Chem,2011,18(18):2674-85.
14 Bodo J,Zhao X,Sharma A,et al.The phosphatidylinositol 3-kinases(PI3K)inhibitor GS-1101 synergistically potentiates histone deacetylase inhibitor-induced proliferation inhibition and apoptosis through the inactivation of PI3K and extracellular signal-regulated kinase pathways[J].Br J Haematol,2013,163(1):72-80.
15 Hoellenriegel J,Meadows SA,Sivina M,et al.The phosphoinositide 3'-kinase delta inhibitor,CAL-101,inhibits B-cell receptor signaling and chemokine networks in chronic lymphocyic leukemia[J]. Blood,2011,118(3):3603-3612.
16 Meadows SA,Vega F,Kashishian A,et al.PI3K δ inhibitor,GS-1101(CAL-101),attenuates pathway signaling,induces apoptosis,and overcomes signals from the microenvironment in cellular models of Hodgkin lymphoma[J].Blood,2012,119(4):1897-1900.
17 Dasmahapatra G,Patel H,Dent P,et al.The bruton tyrosine kinase(BTK)inhibitor PCI-32765 synergistically increases proteasome inhibitor activity in diffused large B-cell lymphoma(DLBCL)and mantle cell lymphoma(MCL)cells sensitive or resistant to bortezomib[J].Br J Hematol,2013,161(7):43-56.
(2014-05-29收稿)
(2015-01-10修回)
(编辑:郑莉)
Inhibitory effects of the phosphoinostitide-3'-kinase delta inhibitor CAL-101 on Raji and SUDHL-10 lymphoma cells and its relative mechanism
Yafei WANG,Bing XIA,Fulian QU,Xiaowu LI,Shanqi GUO,Tian YUAN,Weipeng ZHAO,Yizhuo ZHANG
Yizhuo ZHANG;Email:aprilzyz@yahoo.com
Objective:To detect the inhibitory effects of CAL-101,a selective inhibitor of phosphoinostitide-3'-kinase delta(PI3K δ),on Burkitt's lymphoma cell line Raji and diffused large B-cell lymphoma cell line SUDHL-10 and elucidate its relative mechanism. Methods:Raji and SUDHL-10 cells were treated with various concentrations of CAL-101.Methyl thiazolyl tetrazolium(MTT)assay was performed to determine the inhibitory effect of CAL-101 on lymphoma cells,and cell apoptosis was measured by Annexin V/PI and DAPI staining.Migration assays were performed with transwell to detect the migration of lymphoma cells derived from the stromal cell line HK.Western blot was used to detect the phosphorylation status of the ERK pathway.MTT and CalcuSyn software analyses were preformed to detect whether or not combining CAL-101 with bortezomib induces synergistic cytoxicity.Results:CAL-101 at concentrations of 5,10,15,and 20 μmol/L inhibited cell proliferation in a dose-dependent manner.The proliferation rates of the Raji cells treated with 5,10,15,and 20 μmol/L for 48 h were 29.17%±1.23%,38.15%±1.51%,46.46%±1.78%,and 55.8%±2.01%,respectively,which were significantly higher(P<0.05)than that of the control group(1.15%±0.02%).Similar results were found in the SUDHL-10 cells after treatment with CAL-101(P<0.05).CAL-101 also exerted an apoptotic effect on the lymphoma cells.The apoptotic rates of the Raji cells treated with CAL-101 for 21 h were 22.69%±3.83%and 49.96%±7.36%,respectively,which were significantly higher(P<0.05)than that of the control group(5.23%±2.04%).Similar results were found in the SUDHL-10 cells(P<0.05).
lymphoma,Raji cell,SUDHL-10 cell,PI3Kδ,CAL-101,ERK pathway

10.3969/j.issn.1000-8179.20140912
天津医科大学肿瘤医院血液科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060)
*本文课题受天津市教委创新人才中青年骨干培养计划基金项目资助
张翼鷟aprilzyz@yahoo.com
Treatment with 5 and 10 μmol/L CAL-101 dose-dependently inhibited the migration activity of lymphoma cells to stromal cells(P< 0.05).Western blot analysis showed that the expression level of ERK phosphorylation protein was significantly downregulated in the cells treated with CAL-101.A synergistic effect between CAL-101 and bortezomib was verified.That is,these two drugs can significantly inhibit the proliferation of lymphoma cells with CI values less than 1.Conclusion:The PI3Kδ-specific inhibitor CAL-101 suppressed the proliferation of Raji and SUDHL-10 cells,induced apoptosis,and inhibited stromal cell-derived migration.This inhibitory effect may be induced by blocking the ERK pathway.Overall,our study indicated that CAL-101 is a novel and potential agent in the therapeutic strategy against aggressive B-cell lymphoma.
王亚非专业方向为多发性骨髓瘤与淋巴瘤的基础与临床研究。
E-mail:drwang2005@163.com

