锂离子电池Li1.1Ni0.35Mn0.55O2正极材料的低温放电效率研究
钟盛文, 王巧阁, 张 骞, 乔晓宁, 杨海洋
(江西理工大学材料科学与工程学院,江西赣州341000)
低温性能是锂离子电池环境适应能力的重要参考指标之一[1],为了提高锂离子电池的低温性能,研究者们做了大量研究[2-4]。综合来说,影响锂离子电池低温性能的因素主要有:低温条件下,电解液电导率下降;低温条件下,在电极材料中,锂的传递阻力变大;低温条件下,在电极和电解液界面间锂扩散和电荷转移较缓慢;低温条件下,电解液对隔膜的浸湿性以及锂离子对隔膜的穿透性较差[2]。作为锂离子电池组成部分的正极材料的性能也会在很大程度上影响其低温性能。Li2MnO3· (1-x)LiMO2(M=Mn,Ni,Co…)类正极材料庞大,具有很大的发展潜力,引起了研究者们的广泛关注[5-7]。
本实验室研究组针对Li1.1Ni0.35Mn0.55O2正极材料做了相关的课题研究,常温下,其循环性能较好,但是该材料在低温下的放电效率相较于LiCoO2、LiMn2O4、三元材料等市场常见正极材料偏低,-20℃测试环境,0.2C电流放电,该材料的低温放电效率大概只有30%。本研究组曾通过改善电池制作工艺提高该材料的低温放电效率到60%,本文通过制备Li1.1Ni0.35-Mn0.55O2正极材料,期望通过优化合成制度改善材料自身结构,并通过掺杂改性进一步优化材料的低温放电性能,提高其低温放电效率,增大该材料的商业价值。
1 实验
1.1 Li1.1Ni0.35Mn0.55O2材料的制备
将NiSO4·6 H2O与MnSO4·H2O按化学计量比n(Ni)∶n(Mn)=35∶55混合配制成摩尔浓度为2 mol/L的盐溶液,与配制好的4 mol/L NaOH溶液反应,反应液中以NH3·H2O为络合剂,控制pH值为10.90~11.00,水浴55℃下反应制得前驱体。
将前驱体清洗、过滤、真空110℃干燥24 h后,与Li2CO3粉末混合均匀后,压实,置于氧化铝坩埚中,于立式炉中,空气气氛下,采用不同烧结温度,保温时间进行高温烧结制得6个粉末样品。
1.2 Li[(Li0.1Ni0.35Mn0.55)0.9Co0.1]O2材料的制备
将NiSO4·6 H2O、MnSO4·H2O、CoSO4·7 H2O按照化学计量比配制成摩尔浓度为2 mol/L的盐溶液,按照前面研究所采用的实验参数合成前驱体,混锂烧结制得掺Co的正极材料Li[(Li0.1Ni0.35Mn0.55)0.9Co0.1]O2。
1.3 材料的成分测试与表征
X射线衍射光谱法(XRD)分析使用X Pert Powder型转靶X射线衍射仪,Cu Kα靶辐射,λ=0.154 18 nm,扫描步长为0.02°,扫描范围2θ=10°~90°,石墨弯晶单色器Rc=0.3 mm,扫描电压4 kV,扫描电流40 mA。扫描电子显微镜法(SEM)测试使用EVO 10扫描电镜。电化学测试采用蓝电测试仪及低温测试柜。
1.4 电化学性能测试
正极材料分别为制备好的Li1.1Ni0.35Mn0.55O2、Li[(Li0.1Ni0.35-Mn0.55)0.9Co0.1]O2,Super P作为导电剂,聚偏氟乙烯为粘结剂,采用N-甲基吡咯烷酮作为溶剂,高速球磨混合制成粘稠度合适的浆料,进行涂布干燥。将石墨碳、KS-6、Super P、聚偏氟乙烯称量混合,N-甲基吡咯烷酮为溶剂,进行高速混合,将稠度适中的负极浆体均匀涂布干燥,制成电池负极片。电解液选择低温电解液,在通有流动干燥空气的干燥室内,组装成软包电池。
采用LAND 2000电池循环测试系统配合低温测试柜对组装好的软包电池进行测试,测试步骤为:常温25℃下,2.75~4.2 V,0.1C电流化成,0.2C电流循环5次后,再进行4.2 V截止电压充电,然后放在低温测试柜中,设置环境温度-20℃,0.2C电流放电至2.75 V结束。
2 结果与讨论
2.1 烧结温度对 Li1.1Ni0.35Mn0.55O2材料晶体结构的影响
图1为不同温度下烧结12 h合成的Li1.1Ni0.35Mn0.55O2粉末样品的XRD衍射图谱,三个烧结温度样品的图谱衍射峰位置基本相同,具有相同的晶体结构。属于α-NaFeO2型结构,六方晶系,空间群R-3m型,在20°~25°之间出现一组较小的衍射峰,这是由于Li、Ni、Mn离子在过渡金属层中的超晶格排列所引起的[8]。其中,850℃时合成材料的衍射峰强度稍弱;随着温度的升高,衍射峰变得尖锐,衍射峰宽度变小。从图谱中可以明显看出(006)/(102)和(108)/(110)分裂峰,表明合成的材料具有二维层状结构。

图1 不同温度下合成的Li1.1Ni0.35Mn0.55O2的XRD图谱
表1是不同温度Li1.1Ni0.35Mn0.55O2的晶体结构参数表,烧结温度900℃的材料具有最小的晶胞参数c/a比值及最大的I(003)/I(104)衍射峰峰强比值,其中后者可以反映阳离子混排情况,其值越大,阳离子混排越弱,也表明该材料具有较好的晶型结构,充放电过程中,正极材料内部锂离子扩散阻力更小,从而有利于锂离子的扩散[2,9]。

表1 不同温度下合成的LiNi MnO的晶体结构参数
2.2 保温时间对 Li1.1Ni0.35Mn0.55O2材料晶体结构的影响
通过前面的实验研究,采用900℃作为烧结温度,考察保温时间对材料电化学性能的影响。图2是烧结温度900℃,不同保温时间下合成的Li1.1Ni0.35Mn0.55O2粉末样品的XRD图,不同保温时间下合成样品的图谱衍射峰位置基本相同,保温时间的改变对材料的晶体结构影响不大。

图2 不同保温时间下合成的Li1.1Ni0.35Mn0.55O2的XRD图
表2是不同保温时间Li1.1Ni0.35Mn0.55O2的晶体结构参数表,保温时间对该材料的晶胞参数c值影响较大,其中保温时间12 h的c/a值最小。
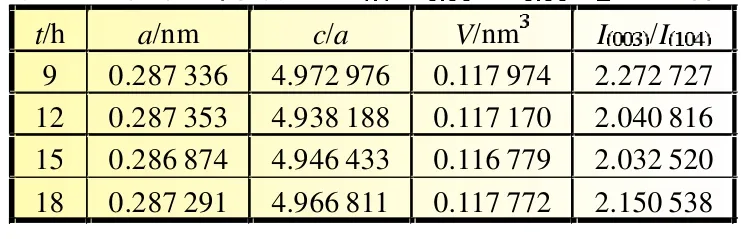
表2 不同保温时间下合成的LiNiMnO的晶体结构参数
2.3 Li1.1Ni0.35Mn0.55O2的微观形貌分析
图3为900℃保温12 h合成的Li1.1Ni0.35Mn0.55O2样品的SEM形貌图,合成Li1.1Ni0.35Mn0.55O2粉末样品是由许多一次颗粒团聚成饭团状的二次颗粒组成的,二次颗粒的尺寸分布范围窄,颗粒大小均匀。

图3 900℃保温12 h合成的Li1.1Ni0.35Mn0.55O2的SEM形貌
2.4 Li1.1Ni0.35Mn0.55O2材料的电化学性能测试
将组装好的软包电池进行充放电测试,测试制度按照充放电电压范围2.75~4.2 V,常温下0.2C(72 mA)电流循环充电,低温-20℃、0.2C(72 mA)电流放电。图4是温度组样品在常温25℃与低温-20℃下的放电曲线对比图,放电曲线平滑,常温下900与950℃样品放电平台相近,低温-20℃下,900℃样品的放电平台高出其他两个样品。由表3可知,常温下,900与950℃的放电比容量较高,低温-20℃下,烧结温度900℃的材料表现出最高的低温放电效率52.67%,950℃时则只有48.77%。

表3 不同烧结温度的LiNiMnO的低温放电性能数据对比表
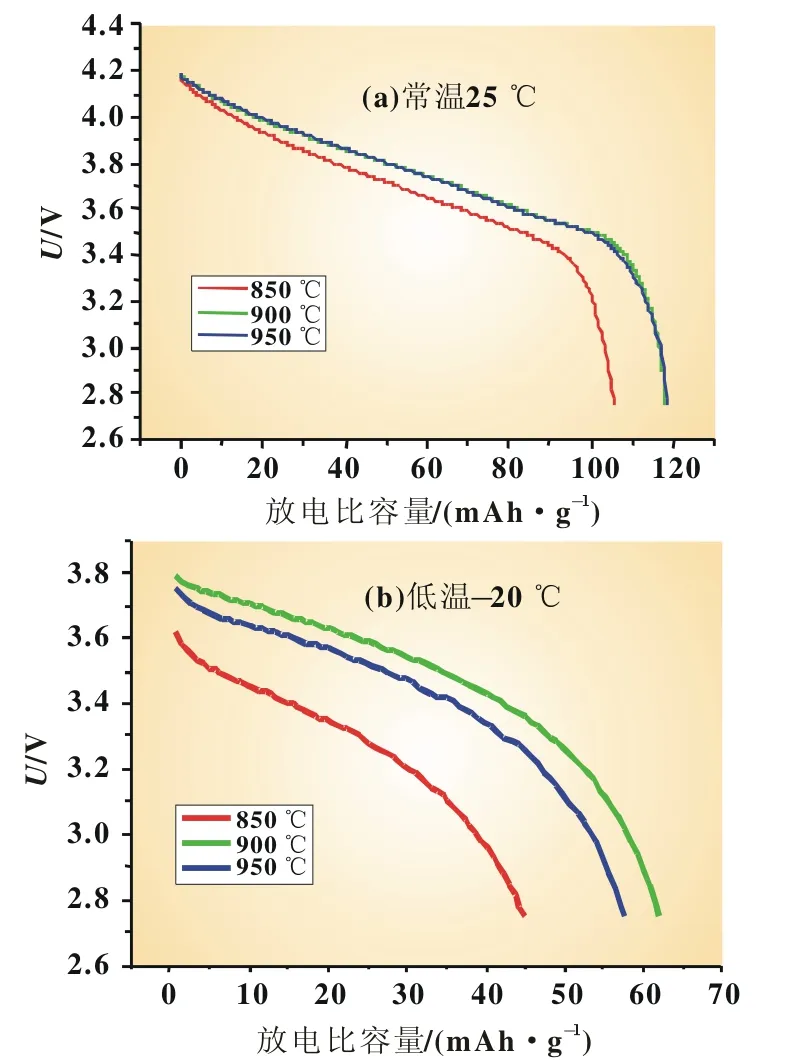
图4 不同烧结温度的Li1.1Ni0.35Mn0.55O2在常温与低温-20℃下的放电曲线
由图5可知,放电曲线平滑,常温下不同保温时间的样品放电平台相近,在低温-20℃下,保温时间12 h样品的放电平台高出其他样品。由表4可知,常温25℃下,保温时间12 h的放电比容量并不占优势,在低温-20℃下,保温时间12 h的材料表现出最高的低温放电效率。
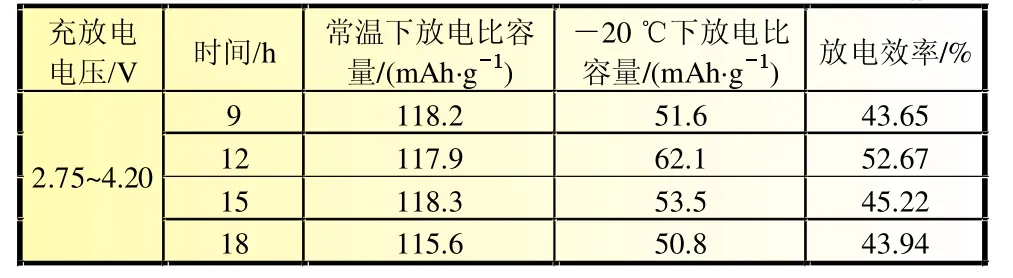
表4 不同保温时间的LiNiMnO的低温放电性能
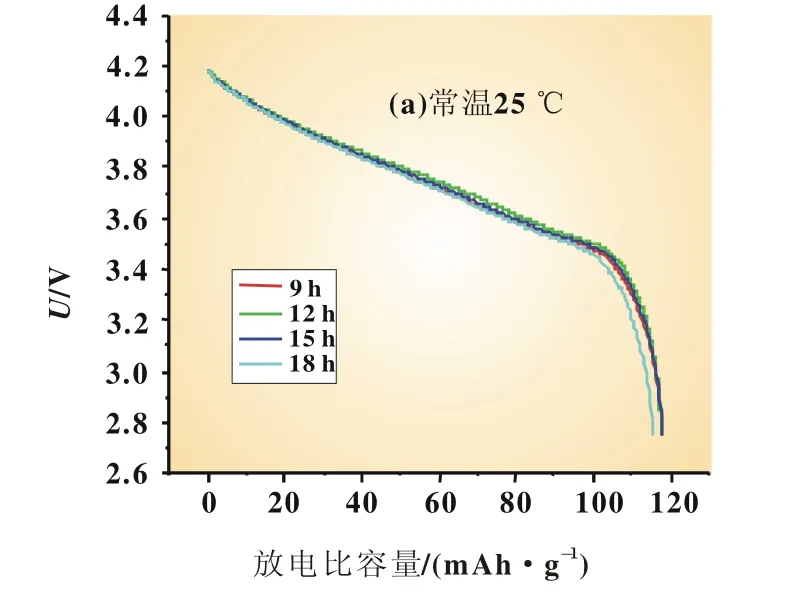
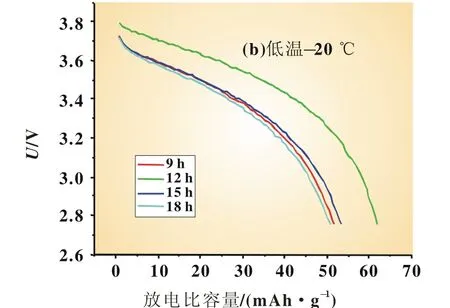
图5 不同保温时间的Li1.1Ni0.35Mn0.55O2在常温与低温-20℃下的放电曲线对比图
3 掺杂改性
在前面实验研究的基础上,通过掺杂少量Co制备出Li[(Li0.1Ni0.35Mn0.55)0.9Co0.1]O2正极材料。图6是掺杂前后两种正极材料的XRD图,掺杂Co后,材料峰位置没有发生明显变化,也没有杂质峰出现,这表明Co的掺杂没有改变材料本身的晶体结构。
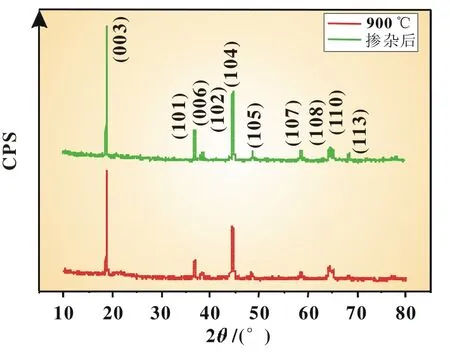
图6 Li1.1Ni0.35Mn0.55O2与Li[(Li0.1Ni0.35Mn0.55)0.9Co0.1]O2粉末样品的XRD图
由表5可知,掺杂Co后的样品晶胞体积相对于之前制得的纯相900℃样品要小,这主要是因为Co3+(0.054 5 nm)与Mn4+(0.054 nm)的半径相似,小于Ni2+(0.069 nm)。而晶胞体积小有利于层间电子向层内转移,层内原子之间的相互作用增强,增加了材料结构的稳定性[10];另一方面,晶胞体积变小,Li+扩散途径变短,充放电过程中,有利于材料内部的Li+扩散传输。图7是掺杂前后材料25℃与低温-20℃的放电曲线对比图,掺杂少量Co后提高了材料常温及低温下的放电比容量,低温放电时,相较于之前的样品,放电平台时间也有所延长。
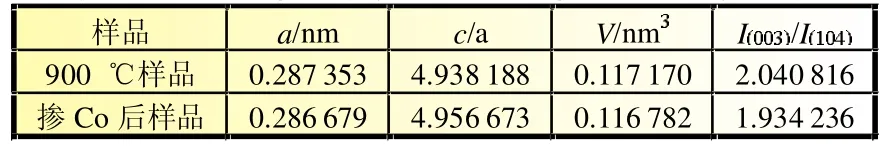
表5 900 ℃样品与掺杂Co后样品的晶体参数表
表6是掺杂前后样品的放电性能数据对比表,掺杂少量Co后,材料的低温放电效率提高到了64.56%,相对于之前的52.67%,大大提高了材料本身的商业竞争力。

表6 LiNiMnO与Li[(LiNiMn)Co]O粉末样品的低温放电性能
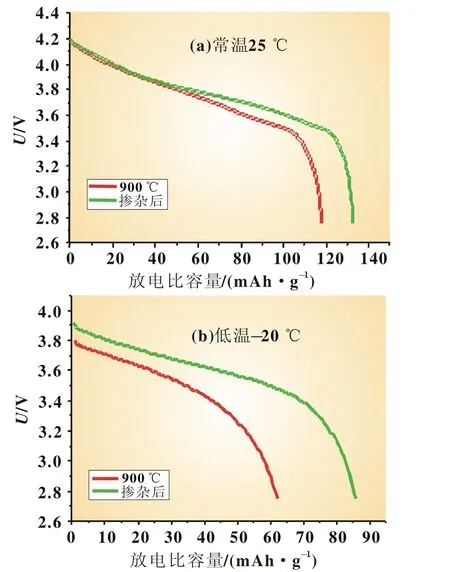
图7 掺杂前后材料在25℃与低温-20℃的放电曲线对比图
4 结论
本文采用共沉淀法制备前驱体,与碳酸锂混合在不同的烧成制度下合成了Li1.1Ni0.35Mn0.55O2锂离子正极材料,并对其进行了Co掺杂。研究表明:900℃烧结12 h为最佳合成条件,材料晶体结构完整,结晶度较好,具有α-NaFeO2层状结构,有利于锂离子的扩散。常温充电至4.2 V后,-20℃、0.2C电流下表现出较高的低温放电效率(52.67%),采用该合成条件进行Co掺杂后,材料的低温放电效率提高到了64.56%,大大改善了其低温放电能力。
[1] RALF W,NINA P,STEFANO P,et al.Current research trends and prospects among the various materials and designs used in lithium-based batteries[J].J Appl Electrochem,2013,43:481-496.
[2] 张丽娟,李法强,诸葛芹,等.锂离子二次电池低温电解液的研究进展[J].盐湖研究,2009,17:57-62.
[3] XIAO W Z,GUO Y Z,LIN Y,et al.A new charging mode of Li-ion batteries with LiFePO4/C composites under low temperature [J].Therm Anal Calorim,2011,104:561-567.
[4] AVIRUP D,AWALENDRA K T,KUMAR K.Exploring low temperature Li+ion conducting plastic battery electrolyte[J].Ionics,2013,19:1811-1823.
[5] 陈燕彬,涂文,李碧平,等.富锂正极材料Li2MnO3-LiMO2(M=Ni,Co,Mn…)的研究进展[J].电源技术,2013,37(8):1470-1473.
[6] HYO J J,CHUNG S K,GI W Y,et al.The influence of lithium content inxLi[Li1/3Mn2/3]O2·(1-x)Li[NiaCobMn(1-a+b)]O2cathode materials prepared by co-precipitation method[J].Electroceram,2013,30:172-178.
[7] JOHNSON C S,LI N C,THACKERAY M M,et al.Anoma-lous capacity and cycling stability ofxLi2MnO3·(1-x)LiMO2electrodes(M=Mn,Ni,Co)in lithium batteries at 50℃[J].Electrochem Commun,2007,9(4):787-795.
[8] XU H Y,WANG Q Y,CHEN C H.Synthesis of Li[Li0.2Ni0.2Mn0.6]-O2by radiated polymer gel method and impact of deficient Li on its structure and electrochemical properties[J].Solid State Electrochem,2008,12:1173-1178.
[9] 钟盛文,吴甜甜,徐宝和,等.层状锰基材料 Li[Li0.2Mn0.54Ni0.13-Co0.13]O2的固相合成及电化学性能[J].电源技术,2012,36:59-62.
[10] 张海朗,任秀君.钴铝掺杂对Li1.1Ni0.4Mn0.4-Co0.15Al0.05O2结构和电化学性能的影响[J].应用化工,2013,42(2):264-267.

