不同基因型金黄色葡萄球菌临床分离株体外侵袭力差异性研究
王俊瑞, 魏常梅, 塔 拉, 崔晶花, 杜小莉, 韩艳秋
(1.内蒙古医科大学附属医院检验科,内蒙古呼和浩特010050;2.中国疾病预防控制中心传染病预防控制所,北京102206)
金黄色葡萄球菌是目前医院感染的主要病原菌之一,可引起多种侵袭性感染,如骨髓炎、血流感染等[1-2]。金黄色葡萄球菌侵袭力的强弱与其表达的多种毒力因子密切相关,如各种黏附素(纤维黏连蛋白结合蛋白、凝聚因子和胶原蛋白结合蛋白等)、多种细胞外毒素(各种溶血素、杀白细胞毒素、肠毒素)等[3],且不同金黄色葡萄球菌克隆株毒力因子分布特征存在明显差异[4-6]。从侵袭性感染部位分离的金黄色葡萄球菌菌株表现出更强的体外侵袭及生物被膜形成能力,且高表达毒力调控基因agr和sarA[7]。金黄色葡萄球菌侵入宿主细胞后,由于受到细胞屏障的保护,其菌落特征及致病力方面更容易发生改变,难以清除[8]。这些研究结果提示,不同临床来源的金黄色葡萄球菌分离株由于特定毒力因子分布及表达水平的不同,其侵袭力可能存在显著差异,并决定其临床感染进程和结局。因此,本研究以呼和浩特地区43例住院患者分离的43株金黄色葡萄球菌为研究对象,采用分子分型方法进行基因分型,分别采用抗菌药物保护试验和流式细胞内化试验探究不同基因型金黄色葡萄球菌体外侵袭力是否存在差异及其特征,为进一步研究金黄色葡萄球菌致病特征及其可能机制提供新的实验数据,更好地指导临床防控和治疗金黄色葡萄球菌感染。
材料和方法
一、菌株来源
以2011年12月至2013年10月间内蒙古呼和浩特地区43例住院患者分离的医院感染金黄色葡萄球菌43株作为研究对象,其中22株分离自伤口分泌物,8株分离自血样本,6株分离自脓液样本,3株分离自痰样本,2株分离自中段尿样本,1株分离自咽拭子样本,1株分离自胸腹水样本。
二、主要仪器、试剂和菌株
VITEK-2 Compact全自动微生物鉴定和药物敏感性分析系统及配套革兰阳性菌鉴定卡GP(法国生物梅里埃公司)、2720型聚合酶链反应(polymerase chain reaction,PCR)仪(美国 ABI公司)、脉冲场凝胶电泳(pulse field gel electrophoresis,PFGE)设备(美国 Bio-Rad公司)、流式细胞仪(FACS,美国BD公司)。
头孢西丁药物敏感性纸片购自英国Oxoid公司,溶葡萄球菌素购自Sigma公司,细菌基因组提取试剂盒购自北京天根生化科技有限公司,胎牛血清和DMEM培养基购自Gibco公司,5-二醋酸羧基荧光素琥珀酸单胞菌酯(5-carboxyfluorescein diacetate N-succinimidyl ester,CFSE)、台芬蓝和万古霉素购自Sigma公司,24孔细胞培养板购自Coming公司。
A549肺腺癌细胞株及体外药物敏感性试验用质控菌株金黄色葡萄球菌(ATCC 25923)由内蒙古医科大学附属医院检验科保存;PFGE用标准菌株沙门菌H9812菌株由中国疾病预防控制中心传染病预防控制所提供。
三、方法
1.菌株鉴定和耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)筛查 所有金黄色葡萄球菌分离株均采用VITEK-2 Compact全自动微生物鉴定和药物敏感性分析系统再次鉴定,并采用头孢西丁纸片扩散法筛查MRSA,依据美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)2013年版标准进行判断和确认。
2.PFGE分型菌株 常规培养16~18 h配置菌悬液[3.5~4.5 麦氏单位,(1.05~1.35)×109cfu/mL]。250μL菌悬液中加入2μL溶葡萄球菌素(1 mg/mL),移液枪充分吹打混匀。取250μL溶菌素处理后的菌悬液与预热的1%SeaKemGold(SKG)等体积混合后加入模具,室温静置10~15 min制备胶块。加入4 mL蛋白酶K/CLB细胞裂解液混合液中裂解。标准菌株处理方法相同。切取制备好的胶块分别置于XbaⅠ内切酶缓冲液及SmaⅠ限制性内切酶缓冲液中孵育。胶块在PFGE仪中进行电泳,以标准菌株进行条带标准化处理。胶块间图像比较采用BioNumerics(Version 5.1,Applied Maths,Inc)软件进行处理。设置条带差异容许度为1.5%。采用UPGMA(组间非加权的几何平均数)方法进行聚类分析,采用Dice系数计算菌株相关性。
3.多位点序列分型(multi locus sequence typing,MLST) 根据文献[9]的方法,随机选取不同PFGE图谱型2~3株MRSA为代表株(共25株)进行 7 个管家基因(arcC、aroE、glpF、gmk、pta、tpi和yqiL)序列测定。首先对各菌株纯培养物进行DNA提取(细菌基因组DNA提取试剂盒,北京天根生化科技有限公司),利用各基因特异性引物进行PCR扩增,PCR引物合成及PCR产物测序由上海生工生物工程技术有限公司完成。PCR扩增与序列测定使用同一对引物。测序结果在http://saureus.mlst.net网站进行序列比对。
4.抗菌药物保护试验 金黄色葡萄球菌各PFGE型菌株在5 mL水解酪蛋白胨液体培养基中37℃恒温摇床过夜培养。4℃,3 000×g离心10 min收集细菌,用 pH值7.4磷酸盐缓冲液(phosphate buffer saline,PBS)清洗3次,在分光光度计下测吸光度(A)值(600 nm波长),计算细菌浓度,离心后菌体用无抗菌药物的DMEM细胞培养液均匀悬浮备用。
A549细胞用75 mL培养瓶培养,培养液含90%DMEM和10%胎牛血清。当细胞生长到75%~85% 时,用0.25%胰蛋白酶消化离心计数,接种到24孔培养板内培养 ,每孔约加入5×104。37℃孵育24~36 h,每孔加入各型待测金黄色葡萄球菌悬液,细菌与细胞比例约为20∶1,37℃孵育2 h。PBS清洗2次,每孔加入含终浓度为200μg/mL万古霉素的DMEM细胞培养液500μL,5%CO2条件下37℃孵育1 h,用以杀灭未侵入细胞内的细菌,包括游离于培养液中的细菌和仅与细胞发生黏附的细菌。PBS清洗2次,每孔加入 0.5%Triton 500 μL,作用 30 min。取10μL混悬液接种在羊血琼脂血平板上,37°C孵育18~24h后计数菌落数。以回收细菌菌落数占侵袭试验初始接种菌量的比例(%)表示该株细菌侵袭力的大小。
5.流式细胞内化试验 采用流式细胞内化试验对抗菌药物保护试验中检测到的侵袭力差异明显的菌株进行进一步验证。(1)细菌标记:在进行流式细胞仪检测前,用CFSE荧光对金黄色葡萄球菌标记(标记流程为:用分光光度计调整细菌浓度至1×109cfu/mL,用无菌PBS清洗3次,加入用 pH值 7.4 PBS配置的终浓度为1μg/mL的CFSE液体内,置于37℃孵育2 h,给予不间断震荡摇晃)[10]。CFSE标记的细菌用PBS清洗离心3次后用于细胞侵袭试验;(2)细胞侵袭试验:以约5×104/孔细胞密度接种A549细胞到24孔培养板内,添加培养液培养24~36 h,用PBS清洗3次,调整细菌浓度,以细菌与A549细胞感染复数(multiplicity of infection,MOI)为20∶1的比例进行体外侵袭试验,37℃孵育1 h。之后用PBS清洗2次。用0.25%胰酶消化2 min收集细胞,用PBS清洗,1 000×g离心5 min共2次,细胞加入含终浓度为0.2%台芬蓝溶液中。直接上流式细胞仪检测,检测参数包括CFSE荧光标记细菌的细胞百分率和每个细胞的相对平均荧光强度。以A549细胞常规培养组作为阴性对照,该组细胞未加入金黄色葡萄球菌。在流式细胞仪的散点图上根据前向散射光和侧向散射光2个参数设定无荧光标记A549细胞群(M1)和荧光标记细胞群(M2)。共计数10 000个细胞。以绿色荧光(CFSE)阳性细胞占总细胞的百分数来代表细菌的侵入率,以吸收系数表示不同菌株侵袭力的强弱[10]。吸收系数=平均每个细胞的平均CFSE荧光强度×CFSE阳性细胞比例。吸收系数越大表示相应菌株侵袭能力越强。
四、统计学方法
采用SPSS 15.0软件对不同菌株体外侵袭力进行比较。体外侵袭力大小采用独立样本t检验进行比较。以P<0.05为差异有统计学意义。
结 果
一、MRSA筛查
头孢西丁纸片扩散法试验结果显示,43株金黄色葡萄球菌中23株为甲氧西林敏感金黄色葡萄球菌(methicillin-sensitive Staphylococcus aureus,MSSA),其中伤口分泌物样本11株、血流样本5株、脓液样本4株、胸腹水样本1株、痰液样本1株、尿液样本1株;23株MSSA临床科室分布情况如下:皮肤科5株、普通外科4株、急诊科3株、骨科2株、新生儿科2株、消化内科2株、血液内科1株、内分泌科1株、神经内科1株、泌尿内科1株、蒙医科1株。20株为MRSA,其中伤口分泌物11株、全血样本3株、脓液样本2株、痰液样本2株、尿液样本1株、咽拭子样本1株;20株MRSA临床科室分布情况如下:骨科6株、神经外科3株、泌尿内科2株、神经内科2株、口腔科1株、普通外科1株、重症监护病房1株、泌尿外科1株、血液内科1株、急诊科1株、中医科1株。
二、分子分型
PFGE分型结果显示,43株金黄色葡萄球菌呈现多样性的基因背景特征,按照80%相似度的判断依据,43株菌共分为12个基因型。其中,优势型为Ⅰ型和Ⅱ型,分别占25.6%(11/43)和34.9%(15/43),其它型为少见型,占 39.5%(17/43),见图1。头孢西丁筛选试验结果显示,Ⅰ型菌株和少见型菌株主要为MSSA(85.7%,24/28),而 Ⅱ 型菌株均为MRSA(100.0%,15/15)。选择各PFGE型菌株共25株进行MLST分型,分型结果见图1。
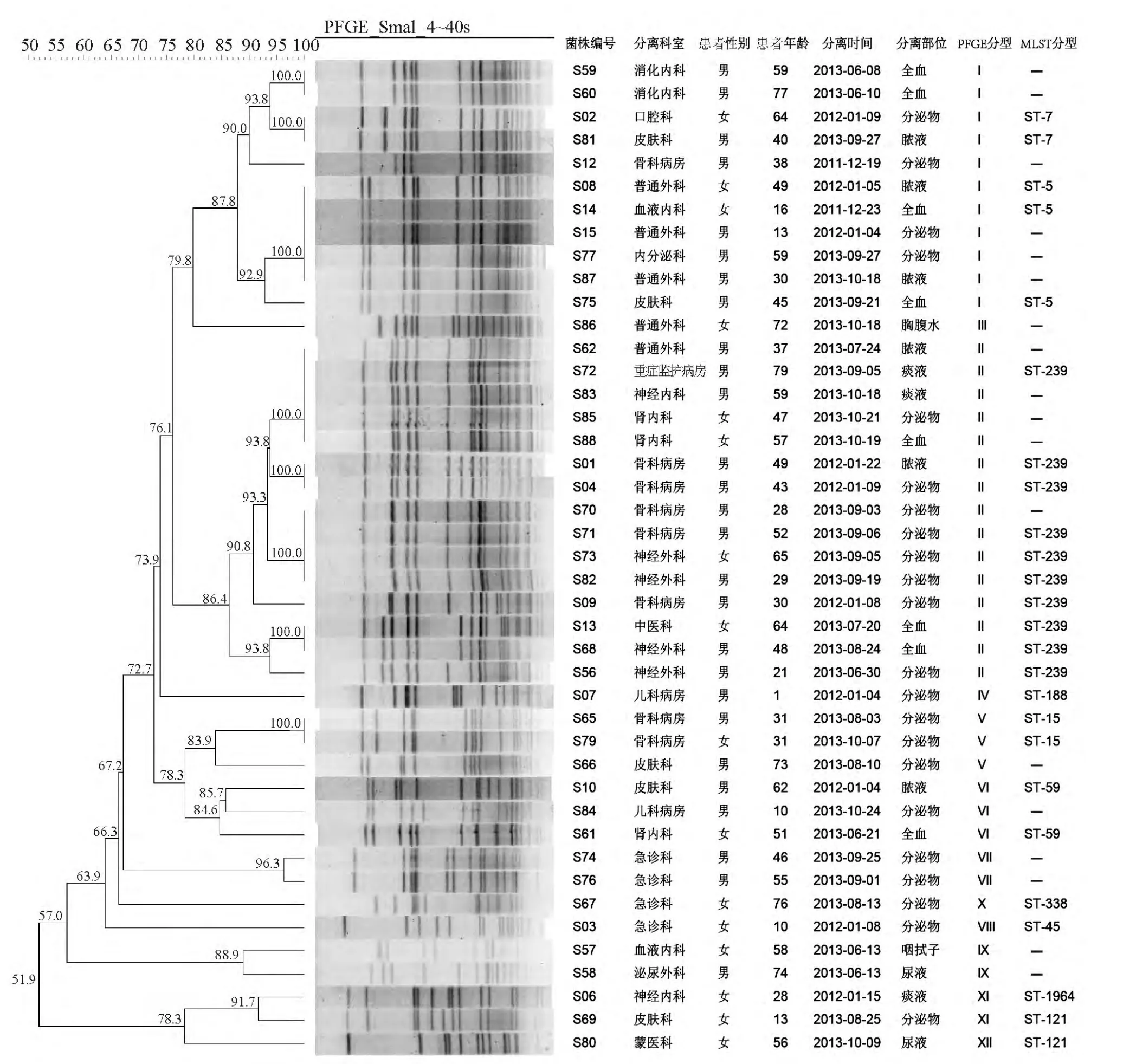
图1 43株金黄色葡萄球菌PFGE和MLST分型结果
三、抗菌药物保护试验
共选择不同PFGE型菌株22株进行体外侵袭试验,不同菌株间体外侵袭力差异明显,结果见图2。侵袭力最强的3株菌分别为S82、S08和S87,侵入率分别为3.27%、3.15%和3.09%。侵袭力最弱的3株菌为S06、S57和 S74,侵入率分别为0.22%、0.24%和1.16%。Ⅰ型菌株和Ⅱ型菌株体外侵袭力比较,差异无统计学意义(t=0.84,P>0.05),Ⅰ型、Ⅱ型菌株体外侵袭力均显著高于少见型,差异有统计学意义(t=3.15、4.9,P<0.01)。
四、流式细胞内化试验
经抗菌药物保护试验检测具有不同侵袭力的4株菌株(S06、S74、S79、S82)进行流式细胞内化试验。结果显示,4株金黄色葡萄球菌侵袭力差异明显,4株菌对A549细胞株的侵入率分别为4.03%、8.63%、16.51%和 20.31%,吸收系数分别为1.13、2.34、5.77和6.81。见图3。
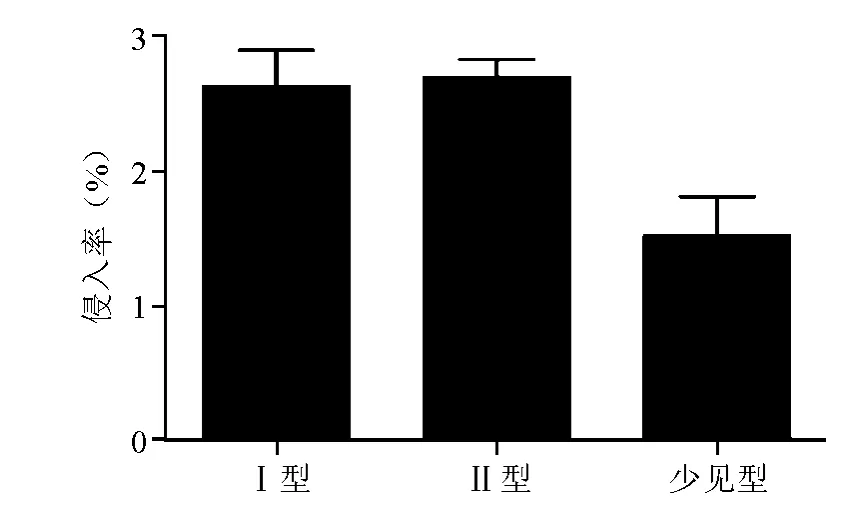
图2 不同基因型金黄色葡萄球菌临床分离株体外侵袭力比较

图3 流式细胞内化试验检测4株不同金黄色葡萄球菌侵袭力结果
讨 论
金黄色葡萄球菌由于表达多种毒力因子而表现出强的侵袭能力,已被证实是造成多种侵袭性感染的主要病原菌之一,如骨髓炎、关节炎等,这些菌株常高表达特定毒力因子,特别是多种黏附素[11-12]。金黄色葡萄球菌的侵袭不仅能够诱导宿主细胞凋亡及组织坏死,还能通过上调宿主细胞抗凋亡因子的表达使其能够长期存活在宿主细胞中[13]。能够在宿主细胞中长期存活的菌株在代谢活动、毒力因子表达等方面均发生相应变化以适应宿主环境[14],部分菌株生长速度非常缓慢、菌落细小,生物学特征与小菌落突变株[15]相同或相近。由于菌株代谢特征的变化及宿主细胞的屏障作用,这类菌株对抗菌药物的敏感性常明显降低[16],是造成慢性迁徙性感染的主要原因之一[17-18]。本研究对43株不同来源、不同耐药性的金黄色葡萄球菌临床分离株的体外侵袭力进行了初步研究后发现,不同基因型金黄色葡萄球菌体外侵袭力差异显著,而且优势型菌株侵袭力明显高于非优势型菌株,特别是ST-239型MRSA分离株。相关报道显示,包括 ST-239型在内的MRSA分离株携带更多的超抗原基因及PVL基因,进而造成其更强的致病力[5]。进一步针对ST-239型MRSA毒力因子携带特征及体内外致病特征的研究有待于开展,以进一步明确不同部位、不同地域环境分离株致病力差异与菌株耐药性演变之间存在的相关性及其机制。
针对不同临床分离株侵袭力差异的研究已有报道。PARK等[19]以菌血症患者分离菌株进行研究发现,不同分离株体外侵袭力差异显著,但与患者是否出现侵袭性感染的并发症无明显相关性。这一结果提示,金黄色葡萄球菌侵袭力强弱可能并不是金黄色葡萄球菌侵袭性感染结局的主要决定因素。但该研究入选菌株数量较少(10株MSSA)且入选患者均为社区获得性患者,对于医院感染菌株及MRSA菌株的特征尚不明确。我国学者发现ST-239型MRSA株sasX基因敲除前后,2株菌的定植能力、致病力变化明显[20]。这一结果提示,特定克隆株自身基因背景特征或毒力因子分布特征是造成菌株间致病力或侵袭力差异的主要原因。本研究所得结果相近,即临床分离的优势克隆株特别是ST-239型菌株具有更强的体外侵袭力,提示优势克隆株因其自身毒力特征具有更强的生存及致病能力。我们需对这些菌株的基因背景特征进一步分析。此外,本研究中检测到的体外侵袭力最弱的3株菌(S06、S57和S74)分别分离自咽部分泌物和痰液样本;而侵袭力最强的3株菌(S82、S08和S87)中,2株分离自脓液样本,1株分离自伤口分泌物样本。虽然菌株数量较少,但这一结果也提示不同部位来源菌株致病力可能存在明显差异,菌株遗传背景特征差异可能是造成其侵袭力不同的主要原因。
本研究中,我们采用流式细胞内化试验对抗菌药物保护试验筛选出的呈现不同体外侵袭力的4株金黄色葡萄球菌分离株进行进一步分析,得出一致的结果。2种方法相比较,抗菌药物保护试验在方法学上较为简便,对试验条件及设备要求较低,但需要依据待检测菌株耐药性特征选择适宜的抗菌药物,并需进行多次预试验来确定抗菌药物的作用时间。流式细胞内化试验在检测敏感性和准确性上更具优势,但对实验室条件和设备的要求更高,检测费用也相对较高。不同实验室可依据自身情况选择这2种方法进行相关研究。
总之,本研究发现不同基因型医院感染金黄色葡萄球菌临床分离株体外侵袭能力差异显著,优势克隆株特别是ST-239型MRSA株具有更强的体外侵袭能力。这一结果提示我们应对金黄色葡萄球菌优势克隆株的医院内传播及感染治疗给予更多关注。本研究的不足之处在于所研究的菌株数量有限,今后大样本的研究仍有待开展,以更为准确地阐明不同基因背景克隆株致病特征及其与感染进程之间的相关性。
[1]LATTAR SM,TUCHSCHERR LP,CENTRÓN D,etal.Molecular fingerprinting of Staphylococcus aureus isolated from patients with osteomyelitis in Argentina and clonal distribution of the cap5(8)genes and of other selected virulence genes[J].Eur J Clin Microbiol Infect Dis,2012,31(10):2559-2566.
[2]LI T,SONG Y,ZHU Y,etal.Current status of Staphylococcus aureus infection in a central teaching hospital in Shanghai,China[J].BMC Microbiol,2013,13:153.
[3]OTTOM.Staphylococcus aureus toxins[J].Curr Opin Microbiol,2014,17:32-37.
[4]MELZER M,EYKYN SJ,GRANSDEN WR,etal.Is methicillin-resistant Staphylococcus aureus more virulent than methicillin-susceptible S.aureus?A comparative cohort study of British patients with nosocomial infection and bacteremia[J].Clin Infect Dis,2003,37(11):1453-1460.
[5]YU F,LI T,HUANG X,etal.Virulence gene profiling and molecular characterization of hospitalacquired Staphylococcus aureus isolates associated with bloodstream infection[J].Diagn Microbiol Infect Dis,2012,74(4):363-368.
[6]SHUKLA SK,KAROW ME,BRADY JM,etal.Virulence genes and genotypic associations in nasal carriage,community-associated methicillin-susceptible and methicillin-resistant USA400 Staphylococcus aureus isolates[J].JClin Microbiol,2010,48(10):3582-3592.
[7]KALINKA J,HACHMEISTER M,GERACI J,etal.Staphylococcus aureus isolates from chronic osteomyelitis are characterized by high host cell invasion and intracellular adaptation,but still induce inflammation[J].Int J Med Microbiol,2014,304(8):1038-1049.
[8]TUCHSCHERR L,MEDINA E,HUSSAIN M,etal.Staphylococcus aureus phenotype switching:an effective bacterial strategy to escape host immune response and establish a chronic infection[J].EMBO Mol Med,2011,3(3):129-141.
[9]ENRIGHT MC,DAY NP,DAVIES CE,etal.Multilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones of Staphylococcus aureus[J]. J Clin Microbiol,2000,38(3):1008-1015.
[10]PILS S, SCHMITTER T, NESKE F, etal.Quantification of bacterial invasion into adherent cells by flow cytometry[J].JMicrobiolMethods,2006,65(2):301-310.
[11]ZAUTNER AE,KRAUSE M,STROPAHL G,etal.Intracellular persisting Staphylococcus aureus is the major pathogen in recurrent tonsillitis[J].PLoS One,2010,5(3):e9452.
[12]PATTI JM,BREMELL T,KRAJEWSKA-PIETRASIK D,etal.The Staphylococcus aureus collagen adhesin is a virulence determinant in experimental septic arthritis[J].Infect Immun,1994,62(1):152-161.
[13]KOZIEL J,MACIAG-GUDOWSKA A,MIKOLAJCZYK T, et al. Phagocytosis of Staphylococcus aureus by macrophages exerts cytoprotective effects manifested by the upregulation of antiapoptotic factors[J].PLoS One,2009,4(4):e5210.
[14]TUCHSCHERR L,HEITMANN V,HUSSAIN M,etal.Staphylococcus aureus small-colony variants are adapted phenotypes for intracellular persistence[J].J Infect Dis,2010,202(7):1031-1040.
[15]ALEXANDER EH, HUDSON MC. Factors influencing the internalization of Staphylococcus aureus and impacts on the course of infections in humans[J].Appl Microbiol Biotechnol,2001,56(3-4):361-366.
[16]GLÄSER R,BECKER K,VON EIFF C,etal.Decreased susceptibility of Staphylococcus aureus small-colony variants toward human antimicrobial peptides[J].JInvest Dermatol,2014,134(9):2347-2350.
[17]TAN NC,COOKSLEY CM,ROSCIOLI E,etal.Small-colony variants and phenotype switching of intracellular Staphylococcus aureus in chronic rhinosinusitis[J].Allergy,2014,69(10):1364-1371.
[18]KAHL BC.Small colony variants(SCVs)of Staphylococcus aureus--a bacterial survival strategy[J].Infect Genet Evol,2014,21:515-522.
[19]PARK WB,KIM SH,KANG CI,etal.In vitro ability of Staphylococcus aureus isolates from bacteraemic patients with and without metastatic complications to invade vascular endothelial cells[J].J Med Microbiol,2007,56(Pt 10):1290-1295.
[20]LI M,DU X,VILLARUZ AE,etal.MRSA epidemic linked to a quickly spreading colonization and virulence determinant[J].Nat Med,2012,18(5):816-819.

