刺五加提取物对无氧运动训练效果的影响
宋广侠,吴江涛
(徐州生物工程职业技术学院 体育系,江苏 徐州221006)
刺五加为五加科植物,我国的传统滋补性中药材,在我国大部分地区广泛分布[1-2].刺五加主要活性成分为刺五加苷、刺五加多糖、刺五加总黄酮等,对人体具有多种调节功能,在治疗心脑血管疾病、糖尿病、神经系统疾病中得到了应用[3-7].欧美国家将刺五加称为“西伯利亚人参”,认为其具有抵抗压力和减轻疲劳的功效,可以提高运动员在运动期间的氧气使用,显著增强运动耐力和恢复速度[8].我国人民的膳食结构与欧美国家不同,饮食中蛋白质含量较低,而碳水化合物含量较高,若完全按照欧美国家的无氧训练模式进行训练,可能会造成人员疲劳,训练效果下降.我国中药功能广泛,其中不乏具有提高机能,避免运动损伤,提高运动效果的药物,经过制备可以作为优秀的运动补剂[9].近年来,针对刺五加提高运动能力的研究已有大量报道.本文主要研究刺五加提取物对无氧运动训练效果的影响.
1 材料与方法
1.1 刺五加提取物的制备
刺五加提取物参考刺五加注射液(沈阳药科大学提供,批号:980830)的制备方法[10].首先,取干燥的东北产刺五加根茎10kg,粉碎后用筛网过滤,加入10倍体积蒸馏水,回流法抽提(反应3次,时间分别为3,2,1h).其次,将浓缩液保存于4 ℃冰箱24h,通过0.22μm 孔径的滤膜过滤,大孔吸附树脂法浓缩,可得到棕色浸膏.最后,在小孔树脂上样,得浓缩浸膏,经ODS中压层析提纯,得到注射用刺五加提取物.经高效液相色谱分析,1g提取物中含有150mg刺五加苷,120mg刺五加多糖,12.5mg刺五加总黄酮,11mg化合物.取50mL生理盐水溶解1g提取物,保存于4 ℃冰箱.
1.2 实验动物
实验选用SPF级雄性SD 大鼠(河北省实验动物中心).大鼠的平均体质量为(210.00±11.75)g,平均体长为(18.5±0.2)cm.大鼠饲养于国家甲级动物房,每笼随机挑选8只.生长期维持饲料喂养,饮用无菌蒸馏水,自由进食和饮水,每天由专业人员喂食并打扫环境.饲养房的室温为(22.5±1.0)℃,湿度为(50±5)%.饲养环境的昼夜变化由灯光控制,日照时间(灯光开启时间)为7:30~21:30.
将筛选出的90只大鼠随机分为3组,分别为安静对照组(每日不训练,不补充药物)、运动对照组(每日训练,只补充蒸馏水)、药物运动组(每日训练,训练前1h,灌胃1mL补充刺五加提取物,训练结束1h后,灌胃补充刺五加提取物).
1.3 实验模型设计
大鼠负重游泳运动模型参考文献[11],并做相应调整.在实验开始前,所有大鼠进行为期3d的游泳技能训练.泳池规格为1.0m×1.5m,水深为40cm,水温为(31±2)℃.第1天,适应水中环境,静水池中无负重状态自由游泳30min.第2天,采用大鼠尾部基底负重法,负重其自身质量的10%,游泳30 s,休息1min,连续进行20次训练.第3天,负重其自身质量的12%,游泳30s,休息1min,连续进行20次训练.第3次的游泳训练等同于筛选测试.
如果在训练过程中,大鼠出现3次下沉时间超过10s的情况,即被认为游泳能力差,不符合实验要求,将被淘汰.如果在3d的游泳训练中,大鼠表现异常,如精神萎靡、肢体不协调、口鼻出血、眼球充血和皮毛不顺等现象,也将被淘汰.完成上述游泳技能学习的大鼠休息2d,然后进入正式实验.
实验共进行8周,每次游泳30s,休息1min,训练20组,第1周共进行5d的训练.除安静观察组大鼠外,第1周各组大鼠负重其自身质量的12%游泳,第2周负重14%,第3周负重16%,第4周负重18%.之后的4周,每周增加负重2%,其他的训练方案不变.在任一训练阶段,当大鼠因负重过大影响游泳时,则停止增加负重,仍按计划训练.如果大鼠在训练后出现患病、死亡的情况,无法进行训练,也认为其只保存原有负重.只有大鼠完成一周5次的训练,才认为该大鼠完成了目前负重下的训练.
1.4 血液与组织样品采集
实验结束后,对大鼠进行腹主动脉采血.取1mL 全血用于血红蛋白测定,剩下的血制备成抗凝血和血清进行检测.将大鼠立即断颈处死,全身消毒后,用RPMI 1640型细胞基础培养基(美国Sigma公司)冲洗腹腔,从腹腔冲洗液中分离出腹腔巨噬细胞,接种至24孔细胞培养板中.
冰上分离大鼠心、肝、脾、肺、肾、脑组织和骨骼肌,用生理盐水冲洗干净.取部分置于预冷生理盐水中,制备成质量分数为10%的组织匀浆,在4 000g离心条件下,离心10min.取上清液,于4 ℃冰箱中保存,剩余部分保存于液氮中,等待进一步检测.
1.5 生理指标的测定
采用BSBS-330型全自助生化分析仪(深圳市迈瑞生物医疗股份有限公司)测定血清、肌肉、心脏、脑组织、肝脏组织匀浆的常规生化指标.采用液氮研磨法处理大鼠的肌肉样品.采用大鼠骨骼肌成分分析试剂盒(南京市建成科技有限公司)检测大鼠骨骼肌成分.采用相关试剂盒(上海市生工生物工程有限公司)检测糖酵解酶类.采用相关试剂盒(上海市杰美基因医药科技有限公司)检测线粒体酶类.
1.6 数据统计
采用SPSS 18.0进行统计学处理.计量资料以均数±标准差(±s)表示,采用t检验;计数资料以百分比表示,采用x2检验.p<0.05为差异具有统计学意义.
2 实验结果与分析
2.1 运动能力评估
与运动对照组相比,药物运动组的SD 大鼠在负重游泳的能力上有明显提高(p<0.05).当负重达到其自身质量的20%时,运动对照组中已有18只大鼠无法继续负重训练,而药物运动组有24只大鼠可以继续训练.当负重增至其自身质量的24%时,运动对照组的所有大鼠均无法负重游泳,已达到负重极限,而药物运动组中有4只大鼠可以继续训练.当负重达到其自身质量的26%时,药物运动组仍有1只大鼠可以完成负重训练.
2.2 动物体质量和食欲变化
实验组大鼠体质量均自然增长,其中,安静对照组的大鼠体质量增长最为明显,与各组相比差异具有统计学意义(p<0.05).与运动对照组相比,3个体质量增长均较慢,差异无统计学意义(p<0.05).
2.3 补充刺五加提取物对大鼠无氧训练运动能力的影响
补充刺五加提取物的无氧运动训练对大鼠生理生化指标的影响,结果如表1所示.表1中:与运动对照组比较,上标“#”代表p<0.05,“##”代表p<0.01.
由表1可知:安静对照组的肌糖原和肝糖原数值最低,运动对照组和药物运动组相比,差异具有统计学意义(p<0.05);运动对照组的血尿素(BUN)含量与安静对照组相比,差异具有高度统计学意义(p<0.01),药物运动组较运动对照组BUN 的含量下降,差异具有统计学意义(p<0.05);运动对照组肌酸激酶(CK)、乳酸脱氢酶(LDH)、血乳酸(LAC)含量较安静对照组明显升高,差异具有统计学意义(p<0.05),而药物运动组的这3项的数值与运动对照组相比明显下降,差异具有高度统计学意义(p<0.01),与安静对照组相比,差异无统计学意义;运动对照组的超氧化物歧化酶(SOD)含量降低,与安静对照组相比差异具有高度统计学意义(p<0.01),药物运动组SOD 数值上升与运动对照组差异无统计学意义(p<0.05),与安静对照组差异不具有统计学意义(p>0.05).
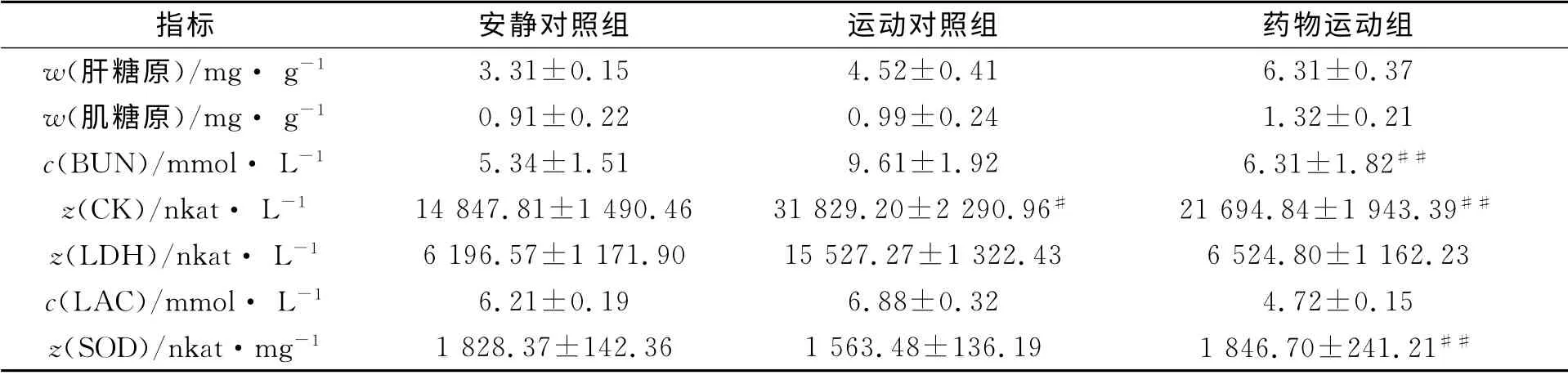
表1 无氧运动训练对大鼠生理生化指标的影响Tab.1 Effects of anaerobic exercise training on physiological and biochemical indexes of the mice
2.4 大鼠肌肉组分分析
无氧训练对各组大鼠肌肉组分的影响,结果如表2 所示.表2 中:与运动对照组比较,上标“*”代表p<0.05.由表2 可知:8周的无氧运动训练显著地增加了雄性大鼠肌肉的糖原含量(p<0.05),安静对照组大鼠肌肉的糖原含量仅为药物运动组的68%和运动对照组的61%;大鼠肌肉的总蛋白和含水量的影响,差异无统计学意义.

表2 无氧训练对大鼠肌肉组分分析Tab.2 Analysis of anaerobic exercise training on muscle components of the mice %
2.5 酶活性分析
大鼠肌肉的酶活性均在30 ℃的环境下进行测定,经过8周训练后的结果如表3所示.表3中:与运动对照组比较,上标“*”代表p<0.05.
从表3可知:在药物运动组、安静对照组及运动对照组中,己糖激酶、磷酸果糖激酶和丙酮酸激酶差异不具有统计学意义(p>0.05);而药物运动组乳酸脱氢酶(LDH)活性提高35.01%,显著高于运动对照组和安静对照组(p<0.05);药物运动组大鼠肌肉线粒体标志酶柠檬酸合成酶的活性较运动对照组显著降低(p<0.05),仅为对照组的35.71%;运动对照组细胞色素C氧化酶活性较其他两组,其差异不具有统计学意义(p>0.05).
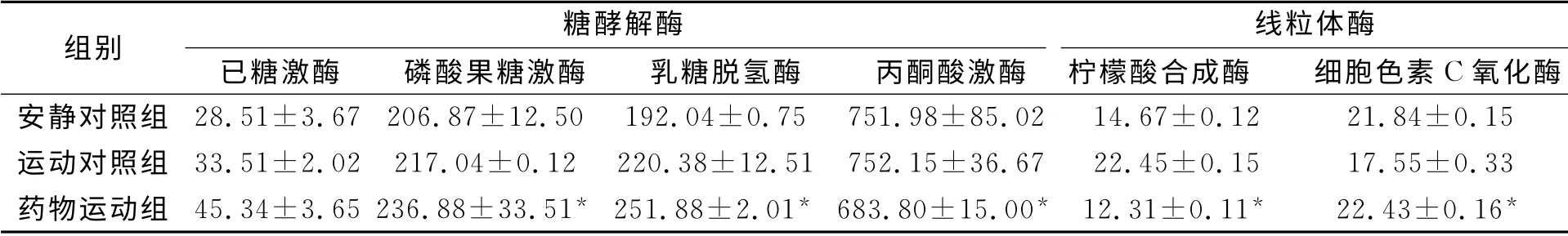
表3 大鼠肌肉的酶活性Tab.3 Muscle enzyme activity of the mice nkat·g-1
2.6 刺五加提取物对不同组织中含量及NOS酶活性的影响
经过8周无氧训练后,刺五加提取物对大鼠不同组织中一氧化氮(NO)含量及一氧化氮合酶(NOS)酶活性的影响,如表4所示.表4中:与安静对照组比,上标“##”代表p<0.05;与运动对照组相比,上标“**”代表p<0.05.
从表4可知:运动对照组大鼠心肌和肝脏组织中NO 的含量低于安静对照组(p<0.05),而药物运动组大鼠心肌和肝脏组织中NO 的含量高于运动对照组(p<0.05);各组大鼠组织中NOS酶候选存在明显差异.通过组内比较发现,在安静对照组中的NOS酶活性,肾脏>肝脏>脑组织>心肌;在运动对照组中的NOS酶活性,肾脏>脑组织>肝脏>心肌;在药物运动组中的NOS酶活性,肾脏>心肌>脑组织>肝脏.通过组间比较发现,药物运动组大鼠心肌中NOS酶活最高,较运动对照组和安静对照组,其差异均具有统计学意义;安静对照组大鼠肝脏中NOS酶活最高,较运动对照组和药物对照组,其差异均具有高度统计学意义(p<0.05);运动对照组大鼠脑组织中NOS酶活最高,较安静照组和药物运动组,其差异均具有统计学意义(p<0.05);运动对照组和药物运动组大鼠肾脏组织中NOS酶活较安静对照组均显著提高(p<0.05).

表4 不同组织中NO 含量和NOS酶活性的变化Tab.4 Changes of NO content and NOS enzyme activity in different tissues
2.7 免疫相关因子表达水平分析
经过8周训练后,大鼠腹腔巨噬细胞分泌的两种细胞因子(IL-1,IL-6)水平,如表5所示.从表5 可知:药物运动组的细胞因子(IL-1,IL-6)水平明显高于运动对照组和安静对照组(p<0.05),这表明训练对大鼠的IL-1,IL-6的表达有正调节的作用.证明使用刺五加提取物后会再次提高IL-1,IL-6的表达水平.在运动对照组和药物对照组中,肿瘤坏死因子(TNF)的表达水平未发生现在变化,说明无氧运动和刺五加提取物对TNF的表达水平无明显作用.
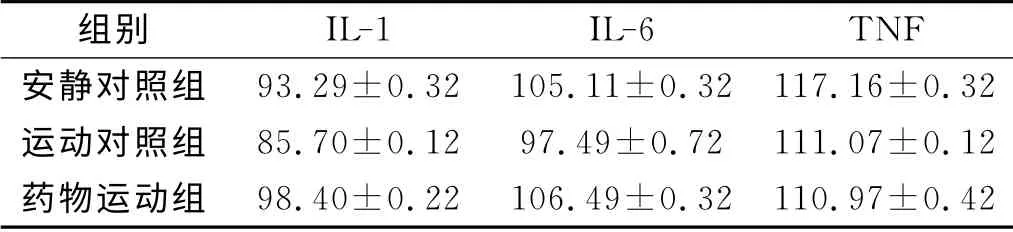
表5 大鼠免疫相关分子表达水平分析Tab.5 Analysis on the expression of mice′s immune molecules μg·mL-1
3 讨论
前期的研究表明:大鼠使用刺五加之后,体质量的增长速度明显高于对照组.但是,在实验中药物运动组的无氧运行训练效果较运动对照组提升较为明显.因此,认为刺五加提取物可以帮助SD 大鼠在无氧运动训练中提高训练效果[12].比较各组SD 大鼠的体质量可知:经过大负重无氧训练,药物组大鼠的体质量增长速度低于运动对照组,同时,大鼠的无氧负重运动能力得到了提高.实验结果表明:虽然药物运动组大鼠体质量保持较慢的增长速度,但是运动能力(力量、运动时间、运动耐力)得到了较为明显地提升.这可能是因为刺五加帮助大鼠增加肌肉的同时,降低了脂肪含量,达到了增肌减脂的功能.但这种现象具体的机制目前并不清晰,需要通过进一步研究证明.
实验结果表明:药物运动组大鼠的SOD 活性明显高于运动对照组(p<0.05),而MDA 的质量摩尔浓度又明显低于运动对照组(p<0.05),表面刺五加提取物在无氧运动中可以保护机体免受氧化损伤,提高机体的抗氧化能力.已知的刺五加药理功能为提高机体SOD 酶活[13],增强自由基清除能力,同时抑制自由基的合成,减少以MDA 为主的脂质过氧化产物的数量,进而提高机体的抗氧化能力.这一药理功能再次与实验结果相吻合.
研究结果表明:在刺五加提取物的作用下,可以显著提高乳酸脱氢酶的活性,表明此刻大鼠的糖酵解速度加快,证明提高了乳酸的生产能力.虽然大鼠乳酸的产量明显提高,但是由于刺五加提取物可以稳定红细胞膜结构,导致BUN 含量明显下降,因此,药物运动组大鼠未出现明显的乳酸堆积现象.
研究结果表明:运动对照组大鼠心肌和肝脏中的NO 含量明显低于安静对照组(p<0.05),证明大强度无氧训练抑制了NO 的产生,而在药物运动组中,这一现象得到了明显改善.研究表明,长期的运动训练人员血清中NOS活性在任何状态下均高于对照组,即运动训练可以有效提高人体NOS活性.研究结果表明:药物运动组的心肌中总NOS活性较运动对照组明显增高(p<0.05),而脑和肝脏组组中总NOS酶活性显著低于运动对照组(p<0.05).已有研究指出,中枢神经系统中的NO 浓度过高,将产生毒性作用,发生氧中毒.文中研究证明刺五加提取物对脑组织具有一定保护作用,在大负荷无氧运动中可以避免脑组织被过量的NO 损伤.
经过无氧负重训练,运动对照组SD 大鼠的免疫学指标(IL-1,IL-6)较安静对照组有明显下降(p<0.05),表明长时间的无氧运动训练,影响了SD 大鼠的免疫系统,降低了大鼠的免疫力.但是药物运动组在连续使用刺五加提取物后,提高了其免疫学指标的表达量(p<0.05),表明刺五加提取物对机体的免疫系统存在正调节的功能,可以保证SD 大鼠在无氧运动训练后仍然具有较为正常免疫学指标,避免疾病发生.
通过实验可以认为,刺五加提取物对无氧运行训练效果具有一定的提升作用,值得对刺五加提取物运动补剂的特性进行进一步研究.
[1]张东杰,冯昆,张爱武,等.刺五加茶饮料抗疲劳作用的实验研究[J].营养学报,2003,25(3):309-311.
[2]李强,吴永宁,王绪卿,等.刺五加制剂对中老年人恒定负荷运动中脂肪利用的影响[J].中国运动医学杂志,2000,19(4):365.
[3]郝红梅.刺五加配方颗粒抗运动性疲劳作用的实验研究[J].山西中医,2013,29(12):38-39.
[4]孟宪军,杨平,张丽,等.刺五加苷对D-半乳糖致衰老模型大鼠免疫功能的影响[J].中国老年学杂志,2010,30(2):216-218.
[5]姜红玉,睢大员,于晓风,等.刺五加叶皂苷对实验性脑缺血大鼠血液流变学及血小板功能的影响[J].吉林大学学报:医学版,2004,30(3):384-386.
[6]许光辉,吴艳萍,罗友华,等.刺五加增强小鼠睡眠剥夺模型免疫功能和抗疲劳能力的实验研究[J].中国实验方剂学杂志,2012,18(23):173-175.
[7]袁学千,王淑梅,高权国,等.刺五加多糖增强小鼠免疫功能的实验研究[J].中医药学报,2004,32(4):48-49.
[8]刘晓莉,张琴,乔德才,等.刺五加及其复合药对大鼠无氧运动能力的影响[J].沈阳体育学院学报,2006,25(5):11-13.
[9]申翘璇,楼青青,张丹毓,等.抗阻力运动在2型糖尿病治疗中的研究进展[J].中华护理杂志,2012,47(4):367-369.
[10]范丽静,蒋晓红,姚国恩,等.刺五加注射液的研究进展[J].中成药,2003,25(6):488-490.
[11]张军,王辉,李闻捷,等.运动饮料对大鼠负重游泳训练疲劳状态的干预效应[J].中国临床康复,2006,10(16):114-116.
[12]张琴.剌五加及其复合药对大鼠无氧运动能力的影响[D].太原:山西大学,2003:1-30.
[13]HAN Ning,Ding Su-ju,WU Tao,et al.Correlation of free radical level and apoptosis after intracerebral hemorrhage in rats[J].Neuroscience Bulletin,2008,24(6):351-358.

