pH值及黏土密度对壳聚糖改性絮凝剂除藻效果的影响
向 斯,刘世昌,赵以军,程 凯,*(.湖北工业大学资源与环境工程学院,河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068;.华中师范大学生命科学学院,湖北 武汉 430079)
pH值及黏土密度对壳聚糖改性絮凝剂除藻效果的影响
向 斯1,刘世昌2,赵以军1,程 凯1,2*(1.湖北工业大学资源与环境工程学院,河湖生态修复与藻类利用湖北省重点实验室,湖北 武汉 430068;2.华中师范大学生命科学学院,湖北 武汉 430079)
研究了不同pH值的改性絮凝剂对不同pH值铜绿微囊藻的絮凝除藻效果.结果表明:不论是对于室内培养的铜绿微囊藻DS,还是对于野外发生的铜绿微囊藻水华,藻液絮凝后的终点pH值均为影响絮凝效果的关键因素,伴随藻液pH值的逐步升高,需要同步调低絮凝剂的pH值并使终点pH值为7.0~7.3才最有利于形成絮凝体;对于高浮力的野生蓝藻水华,需要提高絮凝剂中黏土的密度才能使絮凝体有效沉降.上述结果说明,在使用壳聚糖改性絮凝剂控制铜绿微囊藻水华时,应根据水体pH值及藻生物量而调整絮凝剂配方,且应优先选择在水体pH值和藻生物量较低时进行控藻.
铜绿微囊藻;絮凝剂;pH值
在水体富营养化日益严重,水华频繁爆发的情况下,寻求高效安全的应急控藻工艺显得尤为重要[1].絮凝除藻技术是一种行之有效的快速除藻技术[2-3],潘刚等[4]在太湖进行的絮凝除藻原位实验就取得了不错效果.
在使用黏土矿物进行絮凝除藻时,为了避免因黏土用量过大而形成大量淤渣,通常需要对黏土进行改性以提高其除藻效率[5-6].但改性黏土絮凝剂的除藻效果仍受水体pH值的影响较大.罗岳平等[7]用高岭土-聚合氯化铝复合絮凝剂作用于铜绿微囊藻(Microsystis aeruginosa)时,当藻液pH值为7.5~9.0时除藻效果最好,而当藻液pH值超过10.5后除藻率明显下降.刘振儒等[8]在用壳聚糖改性黏土凝聚铜绿微囊藻时也发现,水体pH值在4~8时絮凝效果最好,而当水体pH值大于8后絮凝效果急剧下降.刘恋等[5,9]也发现壳聚糖改性黏土仅在酸性和弱碱性条件下絮凝效果较好,而无法有效处理碱性较强的藻液.Pan等[10]采用壳聚糖改性黏土用于太湖现场控藻实验,其絮凝除藻效果在水体pH值大于10后迅速下降.上述结果均说明较高的pH值不利于藻类的沉降,而Liu等人则发现,当用硝酸使藻液pH值降至4时,即使不加絮凝剂,某些养殖微藻也能够明显絮凝[11].
以上证据充分说明水体的pH值会显著影响絮凝效果.藻类生理活动所引起的水体pH值变化[12-17]是否会影响絮凝除藻效果,如何排除水体pH值变化对絮凝效果的负面影响并快速沉降高浮力的野生蓝藻水华,上述问题还难以准确回答,特别是针对野生微囊藻水华的相关研究更是未见报道.因此,系统研究pH值和黏土密度对藻液(特别是野生微囊藻水华)的絮凝和沉降效果的影响,对于提高壳聚糖改性絮凝剂除藻工艺的除藻效率具有重要的现实意义.
1 材料与方法
1.1 材料
藻种:铜绿微囊藻(M. aeruginosa)DS购自中国科学院武汉水生生物研究所藻种保藏中心,采用BG-11培养基,(25±1)℃,光照强度为2500lx左右,光暗比14:10条件下培养.野生藻采自武汉市南湖发生水华的区域,镜检结果显示其中铜绿微囊藻优势度超过95%.
改性絮凝剂:高岭土购自上海市纳辉干燥试剂厂(经研磨,180目筛分,粒度小于74 μm,干后使用),壳聚糖购自武汉远城科技发展有限公司(脱乙酰度>95%).改性方法为:称取90mg壳聚糖,加入20mL单蒸水,然后滴加少量的冰醋酸不断搅拌使之溶解,用单蒸水补足体积至30mL(壳聚糖终浓度为3000mg/L),最后添加1g高岭土混匀即得到壳聚糖改性高岭土溶液[18].
1.2 pH值对铜绿微囊藻DS絮凝效果的影响
分别利用碳酸钠溶液(1.88mol/L)和氢氧化钠溶液(0.5mol/L)将藻液的pH值调节至8.5、9.0、9.5、10.0;利用冰醋酸将壳聚糖改性高岭土溶液的pH值分别调节至2.5、3.0、3.5、4.0.取不同pH值的铜绿微囊藻藻液各50mL至50mL烧杯中,向其中加入不同pH值的壳聚糖改性高岭土溶液0.15mL.利用磁力搅拌器60r/min搅拌1min后静置5min,于液面下1cm处取样1mL进行藻细胞计数,同时测定藻液的终点pH值. 对照组不加絮凝剂.
1.3 日光照射时长对野生蓝藻絮凝效果的影响
将采集的野生藻(叶绿素a含量为0.4mg/L)置于室外,于夏季日光(晴天)下照射12小时,期间每隔1~3h取样1次,分别测量藻液pH值并取100mL藻液至100mL三角瓶,加入pH值为3.5的絮凝剂0.30mL,利用磁力搅拌器60r/min搅拌1min后静置5min,于液面下1cm处取样20mL测叶绿素a含量,同时测定藻液絮凝后终点pH值.对照组不加絮凝剂.
1.4 不同pH值絮凝剂对高pH值野生蓝藻的絮凝效果的影响
取日光照射10h后的野生藻液(叶绿素a含量为0.4mg/L),测得藻液pH值为10.6.利用冰醋酸将壳聚糖改性高岭土溶液的pH值分别调节至2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4.絮凝和取样方法同1.3.对照组不加絮凝剂.
1.5 絮凝剂中黏土密度对高浓度野生蓝藻沉降效果的影响
在发生铜绿微囊藻水华堆聚区,采集水面至水面下5cm水层的藻液(叶绿素a含量为4mg/L,pH值为10.0).
将高岭土和黄土按不同比例配制4种絮凝剂.先将2种黏土按不同比例混匀后分组:a高岭土(密度2250kg/m3),b高岭土:黄土=2:1(密度2340kg/m3),c高岭土:黄土=1:2(密度2440kg/m3),d黄土(密度2540kg/m3).分别称取1g的不同密度的黏土添加至30mL壳聚糖溶液(壳聚糖浓度为3000mg/L)中,调节pH值至3.0絮凝和取样方法同1.3.
1.6 统计分析
所有试验均设3平行,采用Origin作图,均值比较采用Graphpad Prism 5软件的ANOVA(多重比较采用的是Tukey方法)和成对法t检验.
2 结果与分析
2.1 絮凝剂pH值对铜绿微囊藻絮凝效果的影响
由图1可见,利用氢氧化钠溶液(图1a)或碳酸钠溶液(图1b)调节藻液pH值,絮凝剂pH值与藻液pH值均会对最终的絮凝效果产生明显影响:当藻液pH值不变时,絮凝除藻效果随着改性壳聚糖絮凝剂pH值的降低而明显增强;当壳聚糖絮凝剂的pH值不变时,絮凝效果随着藻液pH值的降低而明显增强.可见,增加絮凝剂的酸性有利于高pH值藻液的絮凝.

图1 不同pH值条件下的絮凝除藻效果Fig.1 Algae-removing effect at different pH conditions
表1是铜绿微囊藻絮凝结束后藻液的pH值,对照表1和图1可见,所有絮凝除藻效率超过95%的实验组的终点pH值均低于7.1,而所有终点pH值高于7.1的实验组的絮凝除藻效率均不超过35%.此外,对比图1a与图1b不难发现,同等pH值条件下,氢氧化钠组的絮凝除藻效果要显著高于碳酸钠组(P<0.05),其原因很可能是由于碳酸钠具有更强的pH值缓冲能力,这也与氢氧化钠组的终点pH值均低于同等条件下的碳酸钠组的结果(表1)是吻合的.
此外,实验还发现,当终点pH值高于6.0时,藻液如再经过5h的光照培养后,其pH值便能恢复到正常水平(且已沉降的铜绿微囊藻并未重悬),而对于终点pH值小于6.0的藻液,即使光照培养时间延长至24h,其pH值也不会恢复.
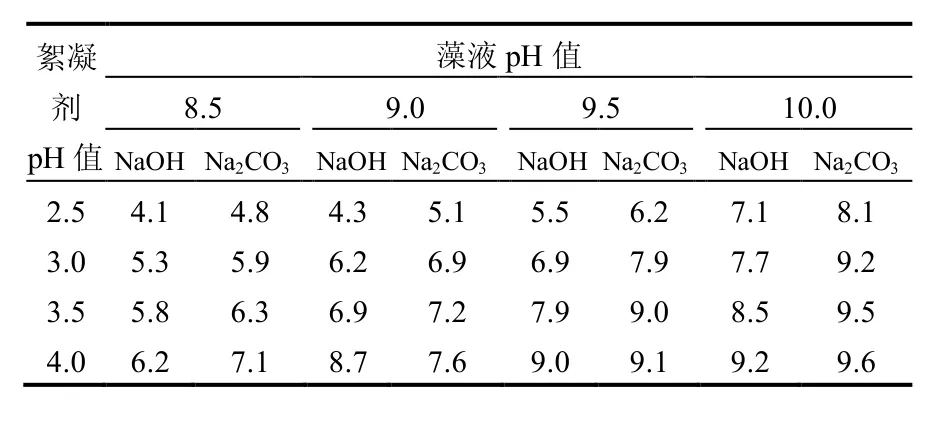
表1 絮凝结束时铜绿微囊藻藻液的终点pH值Table 1 The final pH of M.aeruginosa culture after flocculation
2.2 日光光照对野生蓝藻絮凝效果的影响
由表2可见日光能够引起水华藻液pH值的快速升高,特别是前6h藻液pH值的升幅即达1.6.

表2 不同初始pH值的蓝藻水华絮凝前后的pH值变化Table 2 The change of pH after the addition of flocculant to cyanobacterial blooms with different initial pH

图2 不同初始pH值的蓝藻水华的除藻效果Fig.2 Algae-removing effect of cyanobacterial blooms with different initial pH
由图2可见,前4组实验絮凝除藻结果均较好,其中,日光照射后藻液pH值达到9.2时的除藻效果最佳(除藻率达97.6%).而当藻液pH值升高至9.9以后(后5组),絮凝除藻效果突然变差,其上清液中的叶绿素a含量显著高于前4组(P<0.05).
结合图2与表2,可以发现除藻效果较好的前4组的终点pH值均不高于7.3(其中,除藻率最高组的终点pH值为7.0.),而除藻效果较差的后5组的终点pH值均不低于7.8.
2.3 不同pH值絮凝剂对高pH值野生藻液的絮凝除藻效果
由图3可见对于初始pH值高达10.6的野生蓝藻藻液,pH值 2.5~2.9(前5组)的絮凝剂的除藻效率显著高于pH值 3.0~3.4(后5组)的絮凝剂(P<0.05),且在此区间内(絮凝剂pH值 2.5~2.9)的除藻效果随着絮凝剂pH值的升高而增大.
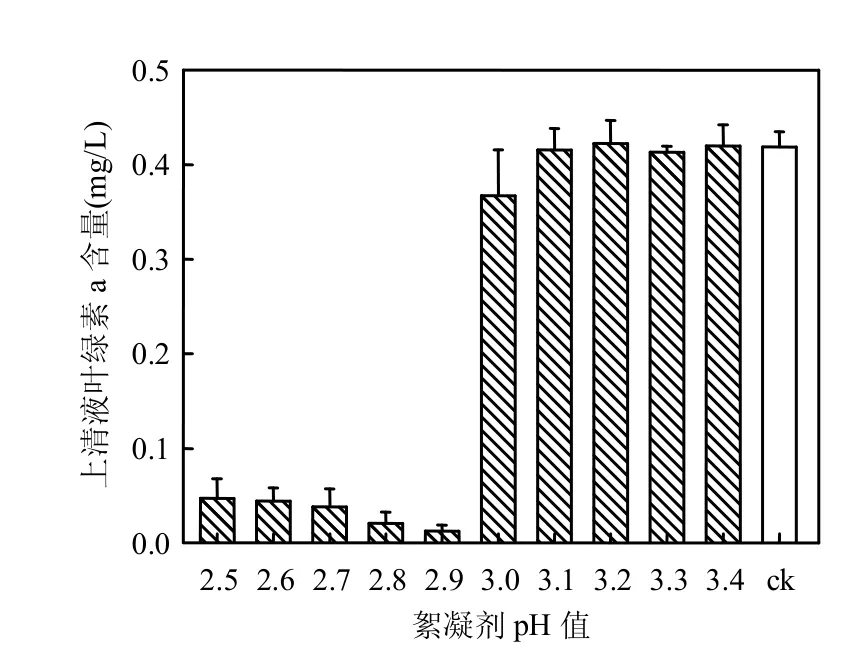
图3 不同pH值絮凝剂对pH值10.6的蓝藻水华的除藻效果Fig.3 The influence of the pH of flocculant on the algaeremoving effect of the cyanobacterial bloom with the initial pH of 10.6
表3是不同pH值絮凝剂处理高pH值(pH值为10.6)藻液的终点pH值,可见除藻率较高的前5组的终点pH值均不超过7.2,而加入pH值为3.0的絮凝剂时,其终点pH值则突增到9.6以上,藻液无法絮凝,除藻率迅速下降(图3).其中,絮凝剂pH值 2.9时的除藻率最高(97.0%),对应的终点pH值为7.2,这与前述2.1与2.2中观察到的终点pH值在7左右时的除藻效率最高的结果是吻合的.
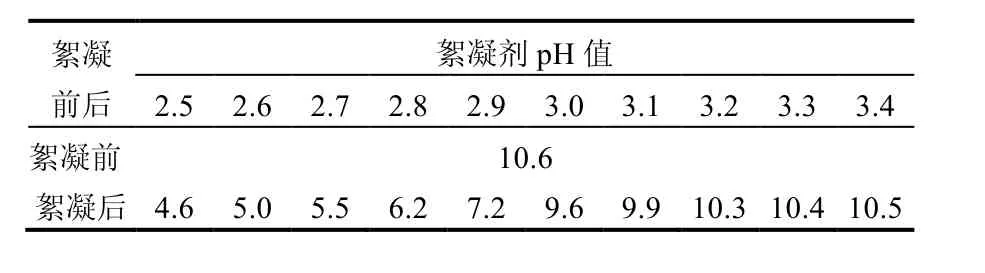
表3 不同pH值的絮凝剂处理pH值 10.6蓝藻水华的终点pH值Table 3 The final pH of cyanobacterial blooms,with the initial pH of 10.6, treated by flocculants with different pH
2.4 絮凝剂中黏土密度对高生物量藻类水华沉降效果的影响
试验发现不同生长阶段的蓝藻水华的藻细胞密度、群体大小等有所区别,而在絮凝沉降高生物量的野生蓝藻时,尽管藻细胞能快速有效絮凝,但却无法沉降,絮凝体全部漂浮于上层.为此,尝试通过增加黏土密度来加强沉降效果.由表4可见,野生藻液絮凝终点pH值均为7.1,与前述实验结果类似,此时所有的试验组均有明显的絮凝效果.但黏土密度较小的实验组藻细胞无法沉降(表4,图5),随着黏土密度的增大,沉降除藻效果逐步增加,其中,絮凝剂黏土密度最大的d组的絮凝沉降除藻效果显著好于其他实验组及对照组(P<0.05).a、b两组由于藻类絮凝聚集后漂浮于上层,其叶绿素a含量反而要高于对照组(P<0.05).此外,通过对d组的持续观测发现,絮凝结束后再经过2h的光照培养,其pH值便能从7.1恢复至超过9.0.

表4 不同黏土密度的絮凝剂处理高生物量水华现象Table 4 The phenomenon of high biomass blooms treated by flocculants with different clay densities
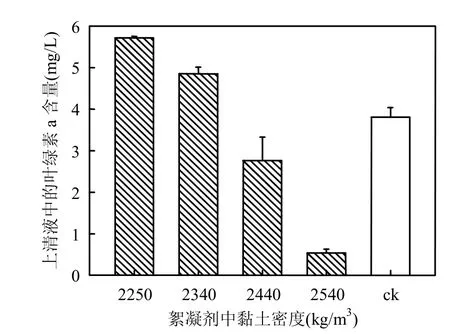
图4 不同黏土密度的絮凝剂对高生物量水华的除藻效果Fig.4 Algae-removing effect to high biomass blooms by flocculants with different clay densities
3 讨论
吴剑等[19]的研究表明,水华水体的pH值会随着水华的发生阶段、藻细胞密度甚至光照变化而发生规律性变化.首先,光照是导致水华水体pH值在1d内快速变化的重要原因:日光照射会驱动藻类进行光合作用,进而消耗水中的二氧化碳,影响水中HCO3-,CO2和OH-的平衡,从而使水体pH值升高,本研究也观察到,光照能够使野生蓝藻水华的pH值在6h内从8.9快速上升到10.4.其次,藻细胞的生长状态也是影响pH值的重要因素:对数期时由于藻类生长代谢活跃,其pH值高于延迟期与稳定期[19-20].
刘恋等[5,9-10]发现水体pH值的上升会严重干扰壳聚糖絮凝剂对蓝藻的絮凝效果,进而影响除藻效率.而本研究发现可以通过改变絮凝剂的pH值来控制藻液的终点pH值,从而保证在较高的水体pH值条件下获得较好的絮凝效果:不论是对室内培养的铜绿微囊藻DS,还是对野生铜绿微囊藻水华,均为终点pH值7.0~7.3时的絮凝效果最好,而当终点pH值高于7.3时絮凝效果明显变差.刘振儒等[8]发现,pH值对絮凝效果有如此大的影响的原因主要与改性剂——壳聚糖的性质有关.壳聚糖在pH值大于8时带弱负电荷,由于黏土颗粒与藻细胞在此状态下同样带负电荷[1]而相互排斥,因此难于形成絮凝体;在酸性条件下,壳聚糖带正电荷[8],此时虽然壳聚糖能够与黏土及藻细胞有效结合,但絮凝团中壳聚糖分子链上正电荷相互排斥,并不利于絮凝体的持续增大;而当终点pH值接近中性时,由于此时壳聚糖具有非离子性[8],既能够与黏土及藻细胞有效结合,也排除了壳聚糖分子链的同性相斥作用,使絮凝团更加紧密,絮凝效果更好.
从生态安全性的角度看,大部分淡水生态系统水体为中性或弱碱性[21],养殖水体中水产品能够安全生活的pH值范围是6.5~9.0(其中最适pH值范围为7.0~8.5)[22].显然,本研究所推荐的终点pH值7.0~7.3处在正常的天然淡水水体与养殖水体的pH值范围内.其次,由于蓝藻水华主要聚集于表层水体中,因此,在进行蓝藻水华的絮凝沉降除藻作业时,只需向上层水体喷洒絮凝剂并控制其终点pH值(而无需改变水体中、下层的pH值),随着上下层水的交换,投加絮凝剂对表层水pH值的影响会进一步减少.本研究也发现当终点pH值高于6.0时,絮凝后藻液的pH值能在5h内恢复至正常水平(2.1节),说明在本研究所推荐的终点pH值 7.0~7.3的范围内,水体pH值具有一定的自我恢复能力.
孔繁翔等[23]发现,蓝藻水华形成的过程中,蓝藻可以通过多种机制调节浮力进行垂直迁移,且其垂直迁移行为还受到诸多环境因素的影响,如,Yan[24]、张永生[25]、Kinsman[26]等发现在光限制条件下,蓝藻会上浮,而在光强过高时,藻细胞则会下沉.在蓝藻水华生物量较高时,由于表面的水华蓝藻大量堆聚产生遮光效应,使其下方的蓝藻处于光限制状态而大量上浮,不但顶托表面的藻类使其无法沉降,也导致了絮凝沉降除藻时藻类“絮”而不“沉”.本研究发现,在用前述控制终点pH值的策略实现有效絮凝的前提下,适当增加絮凝剂中的黏土密度即可使絮凝体有效沉降.
综上所述,本研究发现:水体pH值的时空异质性对壳聚糖改性黏土的絮凝除藻工艺提出了针对性的要求:从时间上看,由于水华水体的pH值在不断变化(如日照可使水华水体的pH值在数小时内提高2~3),需随着水体pH值的升高而降低絮凝剂pH值,黎明时和水华初期的水体pH值较低,此时实施絮凝控藻工程所需的酸度调节剂较少,时机较为合适;从空间上看,水下照度将会通过影响藻类的光合作用而影响水体中不同深度的pH值,因此在水深较深或上下层水交换速度较慢的水体中,需根据不同水深的pH值来配制絮凝剂以实现对深层生长的藻类的有效絮凝;此外,当处理高密度(高浮力)的野生铜绿微囊藻时,适当加大絮凝剂中黏土的密度将有利于絮凝体沉降.
4 结论
4.1 絮凝后的终点pH值是影响絮凝效果的关键因素,伴随藻液pH值的逐步升高,需要同步调低絮凝剂的pH值并使絮凝终点pH值为7.0~7.3才能有效形成絮凝体.
4.2 对于浮力较大的野生铜绿微囊藻水华,需将适当提高絮凝剂中黏土的密度提高才能使絮凝体有效沉降.
[1]邹 华,潘 纲,陈 灏.离子强度对黏土和改性黏土絮凝去除水华铜绿微囊藻的影响 [J]. 环境科学, 2005,26(2):148-151.
[2]卢光远,宋秀贤,俞志明,等.改性黏土絮凝海洋原甲藻对水体中氮、磷的影响研究 [J]. 中国环境科学, 2014,34(2):492-498.
[3]刘世昌,田小方,赵以军,等.搅拌方式对絮凝除藻效果的影响[J]. 中国环境科学, 2012,32(9):1688-1692.
[4]Zou H, Pan G, Chen H, et al. Removal of cyanobacterial blooms in Taihu Lake using local soils II. Effective removal of Microcystis aeruginosa using local soils and sediments modified by chitosan [J]. Environmental Pollution, 2006,141(2):201-205.
[5]刘 恋.壳聚糖改性黏土去除城市湖泊中藻类的研究 [J]. 环境科学与管理, 2012,37(3):83-87.
[6]Li L, Pan G. A Universal Method for Flocculating Harmful Algal Blooms in Marine and Fresh Waters Using Modified Sand [J]. Environmental Science & Technology, 2013,47(9):4555-4562.
[7]罗岳平,施 周,张丽娟,等.高岭土对铜绿微囊藻的PAC强化絮凝去除技术 [J]. 湖南大学学报(自然科学版), 2009,36(2):22-26.
[8]刘振儒,田重威.壳聚糖复合黏土矿凝聚铜绿微囊藻的研究 [J].环境工程, 2004,22(3):80-82.
[9]刘 恋,陈 兵,王志红.壳聚糖改性黏土对高藻水中藻类的絮凝去除 [J]. 环境工程学报, 2010,4(6):1296-1300.
[10]Pan G, Zou H, Chen H, et al. Removal of harmful cyanobacterial blooms in Taihu Lake using local soils III. Factors affecting the removal efficiency and an in situ field experiment using chitosan-modified local soils [J]. Environmental Pollution, 2006,141(2):206-212.
[11]Liu J, Zhu Y, Tao Y, et al. Freshwater microalgae harvested via flocculation induced by pH decrease [J]. Biotechnology for Biofuels, 2013,6(1):98-108.
[12]张艳晴,杨桂军,秦伯强,等.光照强度对水华微囊藻(Microcystis flos-aquae)群体大小增长的影响 [J]. 湖泊科学, 2014,(4):77-84.
[13]刘春光,金相灿,邱金泉,等.光照与磷的交互作用对两种淡水藻类生长的影响 [J]. 中国环境科学, 2005,25(1):33-37.
[14]Zhou Y, Zheng L L, Wang W, et al. Combined effects of temperature, light intensity, and nitrogen concentration on the growth and polysaccharide content of Microcystis aeruginosa in batch culture [J]. Biochemical Systematics and Ecology, 2012,41:130-135.
[15]庄树宏,Hendrik Sven.光强和光质对底栖藻类群落影响Ⅱ.群落和种群的动态和适应模式 [J]. 生态学报, 2001,12:2057-2066.
[16]陈雪初,孙扬才,曾晓文,等.低光照度对源水中铜绿微囊藻增殖的抑制作用 [J]. 中国环境科学, 2007,27(3):352-355.
[17]Esposito S, BotteV, Ludicone D, et al. Numerical analysis of cumulative impact of phytoplankton photoresponses to light variation on carbon assimilation [J]. Journal of Theoretical Biology, 2009,261:361-371.
[18]唐 晨,赵以军,肖慈琼,等.溶藻放线菌改性制剂对铜绿微囊藻的控制能力研究 [J]. 环境工程学报, 2010,4(4):756-760.
[19]吴 剑,孔 倩,杨柳燕,等.铜绿微囊藻生长对培养液pH值和氮转化的影响 [J]. 湖泊科学, 2009,21(1):123-127.
[20]王志红,崔福义,陈牧民,等.pH与水库水富营养化进程的相关性研究 [J]. 给水排水, 2004,05:37-41.
[21]张心昱,孙晓敏,袁国富,等.中国生态系统研究网络水体pH和矿化度监测数据初步分析 [J]. 地球科学进展, 2009,09:1042-1050.
[22]何南荣,杨鹏程,金帮宇.养殖塘pH值的变化规律及调控 [J]. 养殖技术顾问, 2013,(5):229.
[23]孔繁翔,高 光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考 [J]. 生态学报, 2005,25(3):589-595.
[24]Yan Xiao, Nanqin Gan, Jin Liu, et al. Heterogeneity of buoyancy in response to light between two buoyant types of cyanobacterium Microcystis [J]. Hydrobiologia, 2012,679:297-311.
[25]张永生,孔繁翔,于 洋,等.蓝藻伪空胞的特性及浮力调节机制[J]. 生态学报, 2010,18:5077-5090.
[26]Kinsman R, Ibelings B W, Walsby A E. Gas vesicle collapse by turgor pressure and its role in buoyancy regulation by Anabaena flosaquae[J]. Journal of General Microbiology, 1991,137:1171-1178.
致谢:本实验的部分工作获得了“三峡库区生态环境教育部工程研究中心”(KF2013-06)协助完成,在此表示感谢.
Effect of pH and clay density on the algae-removing efficiency using chitosan-modified flocculant.
XIANG Si1, LIU Shi-chang2, ZHAO Yi-jun1, CHENG Kai1,2*(1.Key Laboratory of Ecological Remediation of Lakes and Rivers and Algal Utilization of Hubei Province, College of Resources and Environmental Engineering, Hubei University of Technology,Wuhan 430068, China;2.Department of Life Sciences, Huazhong Normal University, Wuhan 430079, China). China Environmental Science, 2015,35(5):1520~1525
The effects of the pH of chitosan-modified flocculant and the pH of Microcystis aeruginosa culture on the algae-removingl efficiency were studied in the present work. The results indicate that: 1)The final pH after flocculation was the key factor affecting the flocculation efficiency for both indoor cultured M. aeruginosa and field M. aeruginosa blooms, the final pH should be adjusted to 7.0~7.3 to obtain the best flocculantion effect; 2) clay density should be increased for the efficient sedimentation of high-buoyancy cyanobacterial blooms. These results suggest that the composition of chitosan-modified flocculant must be changed according to the pH of water-body and the algal biomass to obtain the best algae-removing efficiency, and the flocculation process should be carried out when the pH of water-body is low and the algal biomass is small.
Microsystis aeruginosa;flocculant;pH
X17
A
1000-6923(2015)05-1520-06
向 斯(1990-),男,湖北兴山人,湖北工业大学资源与环境工程学院硕士研究生,主要从事溶藻微生物及控藻技术研究.
2014-09-12
国家自然科学基金项目(31200385);湖北省自然科学基金重点项目(2013CFA108)
* 责任作者, 教授, chengkaicn@163.com

