一种基于泡沫铜材料的无酶果糖传感器研究*
金姣姣,刘 伟,傅 均*,惠国华,陈裕泉
(1.浙江工商大学计算机与信息工程学院,杭州 310018;2.浙江大学生物医学工程与仪器科学学院,杭州 310027)
一种基于泡沫铜材料的无酶果糖传感器研究*
金姣姣1,刘 伟1,傅 均1*,惠国华1,陈裕泉2
(1.浙江工商大学计算机与信息工程学院,杭州 310018;2.浙江大学生物医学工程与仪器科学学院,杭州 310027)
本文尝试了一种基于泡沫铜材料的无酶果糖传感器。以泡沫铜材料作为工作电极,Pt片作为对电极,在0.1 mol/L 的NaOH溶液中以循环伏安法(CV)和电流-时间曲线法(i-t)探索了一种无酶果糖的定量检测方法。CV扫描结果证明果糖在泡沫铜电极表面易被氧化。i-t检测结果表明在线性范围0.18 mol/L~3.47 mol/L内泡沫铜电极检测果糖的灵敏度3.193 0 mA/(cm2·mmol/L),其检测限为13.8 μmol/L。对比实验表明,泡沫铜电极对果糖具有较好的选择性。该传感器具有响应速度快、成本低等优势,有望于糖类检测中得到应用。
果糖;泡沫铜;电化学;传感器;定量分析
果糖是人体内非常重要的一种还原性单糖。果糖的血糖指数很低,但过量过量会引起空腹血糖指数、甘油三酯和血压升高[1-2],因此对饮食中果糖的控制至关重要。果糖的定量定性检测方法已有一些报道,如基于葡萄糖氧化酶的葡萄糖传感器[3]。在酶法常由于酶活性降低而导致检测失效。非酶糖类传感器相继涌现,如碳纳米管表明修饰金属Pt合成Pt-MWCNTs用于葡萄糖检测,修饰过的Pt-MWCNTs电极具有很好的电催化活性,并且在amperometric最优条件检测下显示了很好的线性关系[4]。Bo等在有序多孔碳材料孔隙中嵌入Pt合成Pt/OMCs纳米材料来检测葡萄糖[5]。铜及含铜化合物因其成本低、易于制备并且处理简便等优点,在葡萄糖检测中得到广泛应用[6-8]。目前也有许多关于果糖检测的报道,如在丝网印刷碳电极上修饰高分子聚合物锇检测果糖[9],以LaMnO3fibers制备非酶果糖传感器检测果糖[10],采用铜钴氧化物复合纳米纤维通过热处理制备成电活性材料检测果糖[11],利用亚铁氰化物修饰丝网印刷碳电极检测果糖[12],以及利用纳米结构的Ni(Ⅱ)修饰玻碳电极用于分析果糖的电氧化过程[13]。
2003年,Shin等利用电沉积与析氢反应结合的方法合成了三维网状结构的泡沫铜。之后通过改变孔状大小,并且随着与基质的远离,孔直径越大,这将有利于分子或离子的自由移动以及提高电极的选择性和灵敏度[14]。近年来,研究人员开展大量研究以提高泡沫铜的可塑性、改善泡沫铜的几何形状及机械性能等[15]。Niu等利用泡沫铜在三电极体系电化学工作站上成功的检测了葡萄糖[16]。
本文尝试采用泡沫铜作为工作电极,Pt为对电极,探索了果糖的定性和定量检测方法,并开展了对照实验。结果表明传感器对果糖响应灵敏,i-t电流密度响应值与果糖浓度具有良好的线性关系,对照实验结果表明传感器对于对照物质无响应。
1 实验部分
1.1 试剂和仪器
NaOH,乙醇(国药集团上海试剂公司);D-果糖(天津广福精细化学研究所);氯化钠(成都科龙试剂公司);CHI-600E电化学工作站(上海辰华仪器公司);丙酮(国药集团);糖精钠(国药集团);85-2A型自动搅拌器(江苏新瑞仪器公司)。所有试剂均为分析纯,水是去离子水。
1.2 泡沫铜材料制备
以乙醇清洗聚氨酯软泡沫1 min,采用4%的NaOH溶液做浸泡处理,去除油渍和增加表面粗糙度。将聚氨酯泡沫放入溶液中,恒温45℃,5 min后取出[14-16]。初步粗化液采用8.0 g/L KMnO4与5.0 mL/L H2SO4混合,粗化时间10 min。二步粗化采用3 g/L,CrO3与4 mL/L H2SO4混合,室温浸泡24 h。粗化后泡沫材料开孔率显著提高,亲水性明显增强。然后采用 20 g/L SnCl2·2H2O与 40 mL/L HCl (36%)作为敏化液,加入锡粒少许,在45℃条件下敏化5 min。将敏化过后的泡沫材料于37℃下放入0.2 g/L的PdCl2活化液中处理5 min,然后取出以清水洗净。以甲醛作为还原剂镀铜,镀液的成分为12.0 g/L CuSO4·5H2O、42.0 g/L EDTA、20.0 g/L Na2SO4、20.0 mL/L HCHO,pH条件为12.5~13.0。然后将泡沫材料作为阴极,铜板电极作为阳极,在70 g/L CuSO4·5H2O、0.6 g/L的NaCl、0.03 g/L聚乙二醇、0.05 g/L十二烷基硫酸钠、25 mL/L H2SO4的电镀液中进行电镀,电压5 V,在泡沫上沉积铜层。
1.3 SEM表征
使用德国卡尔蔡司SUPRA 55 SAPPHIRE instrument(Carl ZeissMicroscopy GmbH 73447 Oberkochen,Germany)表征材料,电压为5.00 kV。
1.4 检测实验
果糖检测采用 CV法和i-t法,以0.1 mol/L NaOH作为电解质,泡沫铜电极与溶液的接触面积是0.17 cm2。CV扫描电压范围为-0.2 V~+0.7 V,扫描速率为50 mV/s。i-t检测是在+0.5 V恒电势下进行检测的。检测过程中每50 s滴加一滴0.1 mol/L的果糖溶液,每次实验滴加20滴,实验时间1 200 s。根据样品浓度与电流密度之间的关系建立定量分析方法。
本文选择糖精钠,无机盐NaCl和有机试剂丙酮作为对照试验。糖精钠,NaCl和丙酮均无还原性。以0.1 mol/L的糖精钠,NaCl和丙酮的检测结果作为对照与果糖的结果进行比较。检测方法与糖的检测方法相同。
2 结果与讨论
2.1 SEM表征结果
泡沫铜表征结果如图1所示。从图1(a)中可以看出,制备的泡沫铜具有均匀分布的三维网状孔结构,多层稳定的网状结构且连接紧密,铜的机械性能良好,可防止网状结构变形及塌陷,表面的断裂可能是由于运输及人为原因导致。从图1(b)中可以看出,表面网孔的直径在0.15 mm~0.35 mm之间,而其内部的网孔直径越来越小。
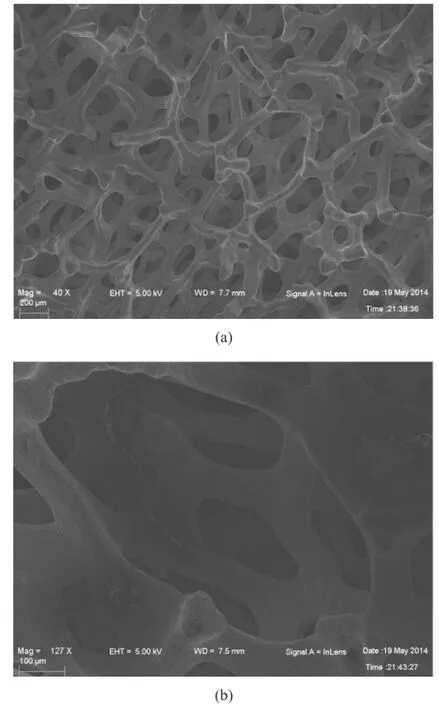
图1 泡沫铜扫描电镜图
2.2 果糖检测结果
2.2.1 CV检测结果
图2显示了在0.1 mol/L NaOH溶液中存在或者不存在果糖时的检测结果。当在0.1 mol/L NaOH溶液中添加0.1 mol/L待测溶液后,对图2及数据进行分析,加入0.1 mol/L的果糖的氧化峰比0.1 mol/L NaOH时明显升高了,并且还原峰降低了。说明加入果糖后,溶液在+0.14 V左右发生了不可逆的氧化还原反应。果糖是葡萄糖的同分异构体,虽然它是一种酮糖,但它在碱性环境下会发生烯醇化反应生成醛糖,即葡萄糖[10],然后生成的葡萄糖在碱性溶液中在泡沫铜表面会发生氧化还原反应,这是泡沫铜材料检测果糖的原理。
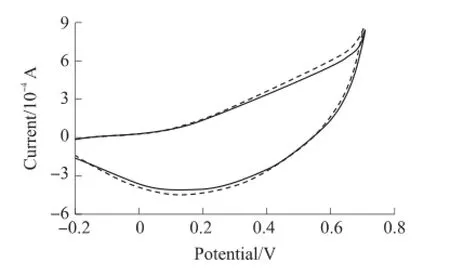
图2 果糖CV检测曲线
2.2.2 i-t检测结果
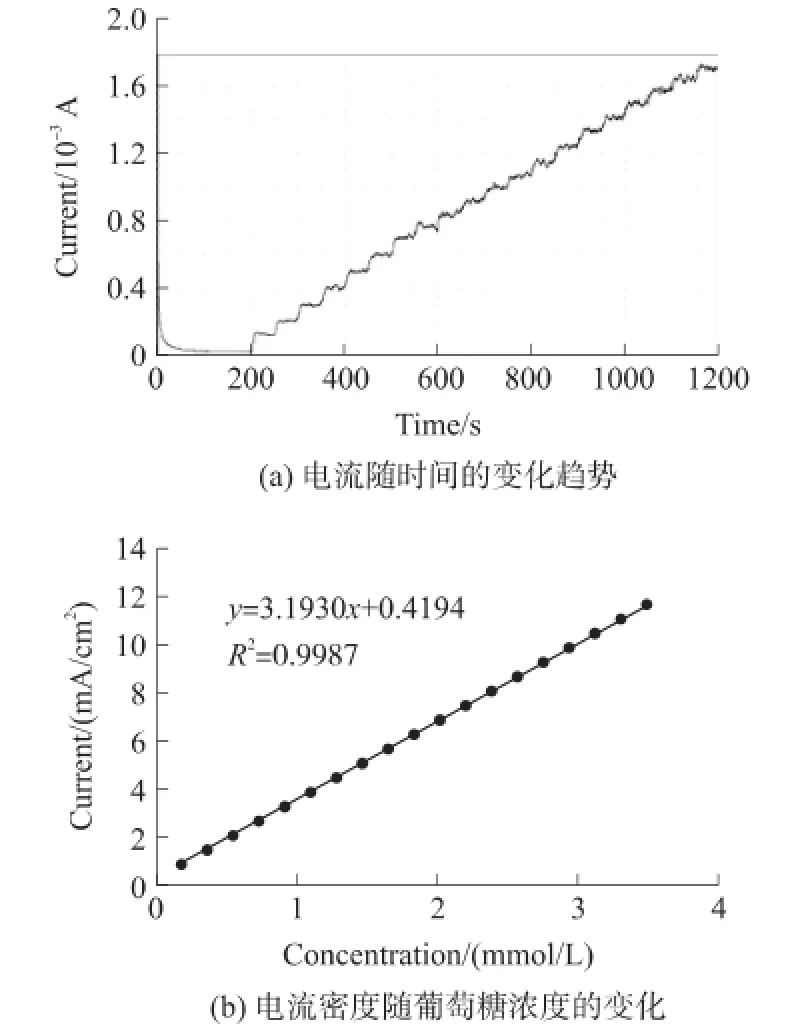
图3 果糖i-t检测曲线
i-t扫描结果如图3(a)所示,我们可以看到在基线稳定后,在搅拌条件下把0.1 mol/L的果糖溶液逐渐加入到0.1 mol/L NaOH溶液中,其在10 s左右达到稳定值,且电流响应值会随着时间的呈阶梯状上升。在图2(b)中,可以观察每次滴加后溶液中的糖溶液浓度与电流密度值的关系也是标准曲线。从线性拟合图中得知,果糖在 0.18 mol/L~3.47 mol/L的线性浓度范围内,其R2=0.998 7。泡沫铜检测果糖的灵敏度为3.193 0 mA/(cm2·mmol/L),检测限为13.8 μmol/L(S/N=3)。传统检测果糖的方法主要有高效液相色谱、气相色谱等方法,检测成本高,检测时间长,过程复杂,并且需要专业操作人员。本文研究的方法操作简便,检测灵敏好,并且拥有较低的检测限。
2.5 对照实验结果
图4是0.1 mol/L果糖、糖精钠、NaCl和丙酮i-t趋势的比较结果。从叠加图中可以看出,果糖溶液有很高的响应趋势,而随着0.1 mol/L NaOH中糖精钠、NaCl和丙酮的增多,其电流几乎没有变化,原因在于糖精钠、NaCl和丙酮没有还原性。果糖具有较强的还原性,在碱性溶液中果糖会发生烯醇化反应生成葡萄糖,泡沫铜表面会有电子的转移,进而以电流的形式被检测软件记录,其结果就是两者的电流趋势及强度很相似,并且都有很强的电流响应值。对于非还原性物质糖精钠、NaCl和丙酮来说,三者在泡沫铜表面几乎没有发生任何氧化还原反应,即泡沫铜表面没有电子转移而没有出现响应信号。
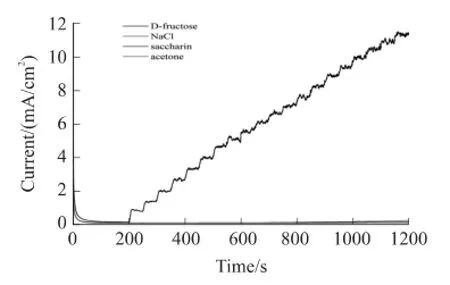
图4 对照实验结果
3 结论
本文以泡沫铜为工作电极,铂片为电极,采用CV和i-t方法探索了果糖的定量检测。CV扫描结果表明葡萄糖可被泡沫铜电极氧化产生电流,这是该传感器的检测基础。i-t扫描结果表明在线性范围0.18 mol/L~3.47 mol/L范围内该果糖传感器检测灵敏度为3.193 0 mA/(cm2·mmol/L),检测限为13.8 μmol/L。泡沫铜的微米级微孔结构增大了溶液接触面积,提高果糖检测灵敏度,根据果糖浓度与电流密度之间的线性关系实现果糖的定量检测。对比实验结果表明该传感器对糖精钠、NaCl和丙酮无明显响应。我们将开展进一步的研究工作探索该传感器在膳食糖类快速检测中的应用。
[1] Kelishadi R,Mansourian M,Heidari-Beni M.Association of Fructose Consumption and Components of Metabolic Syndrome in Human Studies:A Systematic Review and Meta-Analysis[J].Nutrition,2014,30(5):503-510.
[2] Zavaroni I,Chen Y I,Reaven G M.Studies of the Mechanism of Fructose-Induced Hypertriglyceridemia in the Rat[J].Metabolism-Clinical and Experimental,1982,31(11):1077-1083.
[3] Clark L C,Lyons C.Electrode Systems for Continuous Monitoring in Cardiovascular Surgery[J].Ann New York A Cad Sci,1962,102:29-45.
[4] Rong L Q,Yang C,Qian Q Y,et al.Study of the Nonenzymatic Glucose Sensor Based on Highly Dispersed Pt Nanoparticles Supported on Carbon Nanotubes[J].Talanta,2007,72(2):819-824.
[5] Bo X J,Ndamanisha J C,Bai J,et al.Nonenzymatic Amperometric SensorofHydrogen Peroxide and Glucose Based on Pt Nanoparticles/Ordered Mesoporous Carbon Nanocomposite[J].Talanta,2010,82(1):85-91.
[6] Fan Z J,Liu B,Liu X H,et al.A Flexible and Disposable Hybrid Electrode Based on Cu Nanowires Modified Graphene Transparent Electrode for Non-Enzymatic Glucose Sensor[J].Electrochimica Acta,2013,109:602-608.
[7] Meng F H,Shi W,Sun Y N,et al.Nonenzymatic Biosensor Based on CuxO Nanoparticles Deposited on Polypyrrole Nanowires for Improving Detection Range[J].Biosensors and Bioelectronics,2013, 42:141-147.
[8] Meng F H,Shi W,Sun Y N,et al.Nonenzymatic Glucose Sensor Based on Cu-Cu2S Nanocomposite Electrode[J].Electrochemistry Communications,2012,24:53-56.
[9] Antiochia R,Gorton L.A New Osmium-Polymer Modified Screen-Printed Graphene Electrode for Fructose Detection[J].Sensors and Actuators B,2014,195:287-293.
[10]Xu D,Luo L Q,Ding Y P,et al.A Novel Nonenzymatic Fructose Sensor Based on Electrospun LaMnO3Fibers[J].Journal of Electroanalytical Chemistry,2014,727:21-26.
[11]Wang Y,Wang W,Song W B.Binary CuO/Co3O4Nanofibers for Ultrafast and Amplified Electrochemical Sensing of Fructose[J]. Electrochimica Acta,2011,56(27):10191-10196.
[12]Biscay J,Rama E C,García M B G,et al.Amperometric Fructose Sensor Based on Ferrocyanide Modified Screen-Printed Carbon E-lectrode[J].Talanta,2012,88:432-438.
[13]Elahi M Y,Mousavi M F,Ghasemi S.Nano-Structured Ni(Ⅱ)-Curcumin Modified Glassy Carbon Electrode for Electrocatalytic Oxidation of Fructose[J].Electrochimica Acta,2008,54(2):490-498.
[14]Shin H C,Liu M L.Copper Foam Structures with Highly Porous Nanostructured Walls[J].Chemistry of Materials,2004,16(25):5460-5464.
[15]Wang H,Li R,Wu Y,et al.Plasticity Improvement in a Bulk Metallic Glass Composed of an Open-Cell Cu Foam as the Skeleton [J].Composites Science and Technology,2013,75:49-54.
[16]Niu X H,Li Y X,Tang J,et al.Electrochemical Sensing Interfaces with Tunable Porosity for Nonenzymatic Glucose Detection:A Cu Foam Case[J].Biosensors and Bioelectronics,2014,51:22-28.

金姣姣(1991-),女,硕士研究生,浙江工商大学食品与生物工程学院,主要从事食品质量与安全等领域研究;

傅 均(1980-),男,博士,副教授,硕士生导师。1999~2009年在浙江大学本科和直攻博学习,2009年至今在浙江工商大学任教。主要研究方向为智能化医学仪器、人工嗅觉及其气敏传感器、模式识别,junfu@zjgsu.edu.cn;

惠国华(1980-),男,副教授,硕士生导师,2008年获浙江大学工学博士学位,后赴法国国家科学研究中心从事生物信号处理的访问研究,现于浙江工商大学食品与生物工程学院任教,主要从事细胞传感器、气敏传感技术、智能仪器仪表、食品质量与安全等领域研究,承担国家自然科学基金、省自然科学基金等多项科研项目,已发表论文30余篇,多为SCI、EI收录,ghui@zjgsu.edu.cn。
Study of Non-Enzymetic Fructose Sensor Based on Cu Foam Materials*
JIN Jiaojiao1,LIU Wei1,FU Jun1*,HUI Guohua1,CHEN Yuquan2
(1.College of Computer Science and Information Engineering,Zhejiang Gongshang University,Hangzhou 310018,China;2.College of Biomedical Engineering and Instrument Science,Zhejiang University,Hangzhou 310027,China)
A non-enzymatic fructose sensor was investigated.Cu foam material was used as working electrode,and Pt electrode was counter electrode.In 0.1 mol/L NaOH solution,cyclic voltammetry(CV)and amperometric current-time (i-t)methods were utlized to detect fructose quantitatively.CV scanning results indicated that fructose was easily oxidized on the surface of Cu foam electrode.i-t measurement results demonstrated that this sensor presented a sensitivity of 3.193 0 mA/(cm2·mmol/L).Its detecting limit was 13.8 μmol/L in linear range between 0.18 mmol/L and 3.47 mol/L.Negative control results demonstrated that Cu foam electrode had good selectivity.This sensor presented anvantages including rapid responses,low cost,etc.It is promising in sweetener detection.
fructose;Cu foam;electrochemistry;sensor;quantitative analysis EEACC:7230J
TP212.6
A
1004-1699(2015)04-0603-04
10.3969/j.issn.1004-1699.2015.04.025
项目来源:国家自然科学基金项目(81000645,61305030);浙江省大学生科技创新活动计划项目(2014R408021);浙江工商大学大学生创新项目(12-160,12-161,13-157,13-158)
2014-11-09 修改日期:2015-01-13

