36种蔬菜抑制肝癌HepG2和结肠腺癌Caco-2细胞增殖活性评价
万红霞,刘仁斌,孙海燕,刘冬*
(1.深圳职业技术学院,广东深圳518055;2.十堰市人民医院中医科,湖北十堰442000)
36种蔬菜抑制肝癌HepG2和结肠腺癌Caco-2细胞增殖活性评价
万红霞1,刘仁斌2,孙海燕1,刘冬*1
(1.深圳职业技术学院,广东深圳518055;2.十堰市人民医院中医科,湖北十堰442000)
为明确36种中国主要消费蔬菜多酚提取物的总酚含量和抑制人肝癌细胞HepG2和人结肠腺癌细胞Caco-2增殖活性,分别采用Folin-Ciocalteu法确定了蔬菜提取物的总酚含量,采用亚甲基蓝法确定了其抗HepG2和Caco-2细胞增殖的活性,分析了总酚含量与抗HepG2和Caco-2细胞增殖活性之间的相关性。结果表明,36种蔬菜每百克中没食子酸当量:芥蓝(973.09±31.29)μmol/hg,莲藕(920.55±29.00)μmol/hg,它们的总酚含量最高;丝瓜(44.94± 4.16)μmol/hg,其总酚含量最低。在可测出抗增殖EC50值的蔬菜中,韭菜(15.96±0.88)mg/mL和蒜苔(17.54±0.03)mg/mL,它们的抗HepG2细胞增殖的活性最强;上海青(390.52±17.63)mg/mL和空心菜(394.25±11.89)mg/mL,它们的活性最弱。韭菜抗Caco-2细胞增殖的活性最强,为(21.08±1.67)mg/mL;青尖椒的活性最弱,为(390.17±4.78)mg/mL。这些蔬菜的抗HepG2和Caco-2细胞增殖活性与其总酚含量相关性均不显著(R2=0.027 1,p>0.05;R2=0.151 3,p>0.05),表明蔬菜的抗肿瘤活性不能单从其多酚含量的高低来推测。
蔬菜;多酚;人结肠腺癌Caco-2细胞;人肝癌HepG2细胞;抗增殖活性
流行病学调查表明,膳食方式与慢性疾病如癌症、心血管病、早老性痴呆症有密切联系,而膳食摄入充足的蔬菜可以有效减少这些慢性疾病的发病风险[1-3]。进一步的实验研究证实,蔬菜中多酚类物质和维生素通过抗氧化、诱导肿瘤细胞分化和凋亡,调控癌基因和抑癌基因表达,调控细胞周期,调节细胞信号传导通路,调节免疫力和新陈代谢等机制,发挥抗肿瘤作用和抑制心血管病等慢性疾病的发生[4-5]。
目前,国内外已有许多有关蔬菜抗肿瘤活性的研究报道。国外Chu等[6]对美国经常消费的10种蔬菜提取物抗HepG2细胞增殖的活性进行了研究。国内学者研究了洋葱、大蒜、混合蔬菜粉等对癌细胞增殖的抑制活性[7-11]。这些报道多是对某种或某几种蔬菜提取物的抗肿瘤细胞活性进行研究,目前系统研究我国经常消费的主要蔬菜抗肿瘤细胞增殖活性的研究还未见报道。
蔬菜中的多酚类物质除了少数以苷元形式可直接在小肠被吸收外[6,12],大约有90%直接进入结肠,经肠道微生物酶降解后在肠道发挥抗氧化、抗肿瘤作用,或在结肠吸收进入体内代谢而发挥抗肿瘤作用[13-14]。为此,选用分别代表人体物质吸收和代谢的结肠腺癌Caco-2细胞(与人体结肠上皮细胞生物学功能相似)和肝癌HepG2细胞(与人体肝细胞生物学功能相似)作为蔬菜抗肿瘤活性的评价标准物,对我国南北方普遍消费的36种蔬菜的抗肿瘤活性进行全面系统评价。研究结果不仅丰富了蔬菜的营养保健理论,也为消费者合理健康地食用蔬菜和预防癌症等疾病提供了科学的依据。
1 材料与方法
1.1材料与试剂
1.1.1蔬菜36种蔬菜均在最佳采摘时间采摘于各种蔬菜的中国主产区,采摘后于最佳食用时间进行抗增殖活性评价研究。供研究的各地蔬菜有:芹菜(潍坊产)、番茄(淄博产)、紫茄子(湛江产)、土豆(滕州产)、紫洋葱(济宁产)、蒜苔(临沂产)、韭菜(莘县产)、长豆角(青州产)、四季豆(聊城产)、青甜椒(青岛产)、青尖椒(青州产)、黄瓜(莘县产)、苦瓜(青州产)、胡萝卜(寿光产)、白萝卜(潍坊产)、香菇(龙泉产)、西兰花(临海产)、花椰菜(永年产)、空心菜(汕头产)、芥蓝(揭阳产)、菜心(广州产)、莴苣(定州产)、油麦菜(永年产)、生菜(永年产)、上海青(永年产)、菠菜(金乡产)、白菜(临海产)、紫包菜(新野产)、莲藕(临沂产)、木耳(凤仪产)、红苋菜(广州产)、丝瓜(广州产)、红扁豆(莘县产)、青南瓜(寿光产)、葫芦(永年产)、冬瓜(金乡产)。
1.1.2试剂没食子酸、Folin-ciocalteu试剂、HEPES、非必需氨基酸(100×)、青链霉素混合液(100×),胰岛素、氢化可的松、William’s Medium E培养基、台盼蓝,美国Sigma-Aldrich公司产品;高糖DMEM培养基、胎牛血清(FBS)、Hank’s平衡盐溶液(HBSS,1×)、质量分数0.05%胰酶-EDTA,美国Life-Technologies公司产品;Caco-2结肠腺癌细胞株和HegG2肝癌细胞株,美国ATCC(American Type Culture Collection)提供。其它试剂均为国产分析纯。
1.2仪器与设备
HERA cell 240型CO2细胞培养箱,美国Thermo公司制造;DM IRB型荧光倒置显微镜,德国Leica仪器公司制造;Spectra Max M5e多功能酶标仪,美国Molecular Devices公司制造;HR25850型飞利浦组织捣碎机,珠海飞利浦电器有限公司制造;T25 digital ULTRA-TURRAX匀浆机,德国IKA公司制造;5180 R型冷冻离心机,德国Eppendorf公司制造。
1.3方法
1.3.1蔬菜多酚的提取按照文献[6]方法并做改进:将蔬菜洗干净,沥干水,蔬菜多酚的提取做3次平行实验,每次平行称取蔬菜的可食用部分鲜质量100 g,加入预冷的体积分数80%丙酮200 mL,用组织捣碎机搅拌3 min,在冰浴条件下,高速匀浆5 min。匀浆液经Whatman 1号滤纸过滤,在滤渣中加入200 mL预冷的体积分数80%丙酮,冰浴条件下高速匀浆5 min,过滤,滤渣再次加入200 mL预冷的80%丙酮匀浆5 min,过滤。合并3次滤液,滤液在45℃条件下旋转蒸发至10 g以下,将浓缩液用超纯水定容至25 mL,分装成1 mL/管,于-80℃贮存备用。
1.3.2总酚含量的测定Folin-ocalteu法[6]配制没食子酸标准溶液,37℃水浴解冻样品,12 000 r/min离心15 min,分别取提取液及各浓度的标准液100 μL加至已加入400 μL去离子水的试管中,摇匀,加入100 μL Folin-Ciocalteu试剂,混匀,放置6 min,加入1 mL质量浓度7 g/dL的Na2CO3溶液和0.8 mL去离子水,混匀,在室温下反应90 min,在酶标仪上于760 nm测定OD值。每百克鲜菜的总酚含量用平均值±SD μmol没食子酸当量(GAE)/hg表示。
1.3.3细胞培养Caco-2细胞接种在高糖DMEM培养基中生长,培养基中含有体积分数10%胎牛血清(FBS)、10 mmol/L Hepes缓冲液、体积分数1%非必需氨基酸、100 U/mL青霉素和100 μg/mL链霉素。细胞在体积分数5%CO2、37℃条件下培养。待细胞进入对数生长期后用质量分数0.05%胰蛋白酶置于37℃培养箱中消化传代。HepG2细胞接种在Complete Medium培养基中生长,培养基中含有体积分数5%胎牛血清(FBS)、10 mmol/L Hepes缓冲液、5 μg/mL胰岛素、0.05 μg/mL氢化可的松、100 U/mL青霉素和100 μg/mL链霉素。细胞在体积分数5%CO2、37℃条件下培养。待细胞进入对数生长期后用质量分数0.05%胰蛋白酶消化传代。实验所用的细胞在第10—30代之间。
1.3.4蔬菜对HepG2和Caco-2细胞的毒性作用细胞毒性实验参照文献[15]方法进行并稍作改进:100 μL HepG2(或Caco-2)单细胞悬液接种到96微孔透明板中(4×104个/孔),体积分数5%CO2、37℃培养24 h后,吸出生长培养基,1×PBS清洗贴壁细胞,加入100 μL不同浓度的蔬菜提取物(不同浓度提取物用生长培养基稀释制备),设空白对照组(加入生长培养基)。体积分数5%CO2、37℃培养24 h,吸出提取物,1×PBS清洗贴壁细胞,加50 μL/孔亚甲基蓝溶液(1×HBSS含质量分数1.25%戊二醛和质量分数0.6%亚甲基蓝),体积分数5%CO2、37℃培养60 min,吸出亚甲基蓝溶液,将微孔板轻轻浸入去离子水中清洗3次至洗净细胞表面吸附的染料。将96孔板倒置在纸巾上控干水分,加100 μL/孔洗脱液(含体积分数49%1×PBS、体积分数50%乙醇、体积分数1%冰醋酸)。将96孔板室温旋转振荡20 min,置于Spectra Max M5e多功能酶标仪中测定570 nm处的OD值。如果样品组比对照组的OD值显著性减少即判断为蔬菜提取物有细胞毒性。
1.3.5蔬菜提取物抗HepG2和Caco-2细胞增殖活性抗细胞增殖活性实验所用的蔬菜浓度设在没有细胞毒性的范围内。抗增殖实验参照文献[15]方法并稍作改进:100 μL HepG2(或Caco-2)单细胞悬液接种到96微孔透明板中(2.5×104个/孔),体积分数5%CO2、37℃培养4 h(Caco-2细胞培养6 h),吸出生长培养基,加入100 μL不同浓度的蔬菜提取物(不同浓度提取物用生长培养基稀释制备),设空白对照组(只加入生长培养基)和控制对照组(只加入空白提取液),体积分数5%CO2、37℃培养72 h,吸出提取物,1×PBS清洗贴壁细胞,亚甲基蓝染色测定OD值(染色和测定步骤同1.3.4)。细胞抑制率
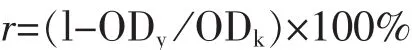
上式中,ODy是样品组吸光度值,ODk是空白对照组吸光度值。样品组OD值达到对空白对照组OD值50%时的样品浓度为抗增殖活性的半有效抑制浓度(EC50),EC50值越低表示抗增殖活性越高。
1.3.6统计分析数据结果以平均值±SD表示,实验数据的显著性检验和相关性分析分别运用SPSS 11.0统计软件的one-way ANOVA法(p<0.05视为有显著性差异)和双变量相关法进行分析(p<0.05视为显著性相关)。
2 结果与分析
2.1蔬菜总酚含量
蔬菜总酚含量见图1。
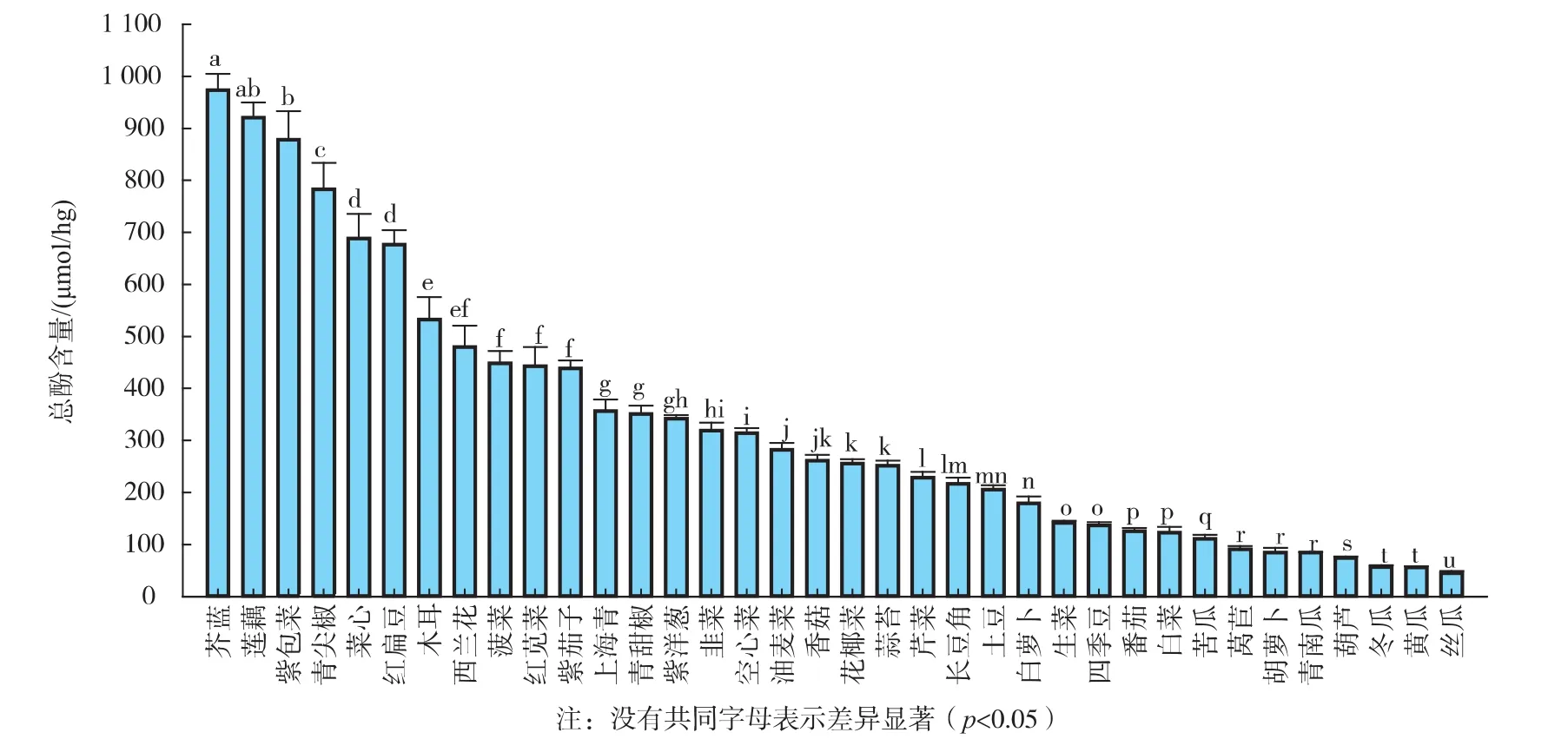
图1 36种中国主要蔬菜总酚含量Fig.1 Total phenolic content of 36 commonly consumed vegetable species in China
36种蔬菜每百克中GAE,芥蓝(973.09± 31.29)μmol/hg和莲藕(920.55±29.00)μmol/hg,总酚含量最高;其次是紫包菜(878.30±54.84)μmol/hg;其它蔬菜的总酚含量高低依次是:青尖椒(782.98± 50.33)μmol/hg,菜心(688.38±47.20)μmol/hg,红扁豆(676.76±27.42)μmol/hg,木耳(532.71±42.87)μmol/hg,西兰花(479.66±40.86)μmol/hg,菠菜(448.38± 23.28)μmol/hg,红苋菜(442.80±36.41)μmol/hg,紫茄子(438.59±15.19)μmol/hg,上海青(356.20± 22.60)μmol/hg,青甜椒(350.78±16.30)μmol/hg,紫洋葱(342.02±6.45)μmol/hg,韭菜(318.56±15.29)μmol/ hg,空心菜(314.17±9.77)μmol/hg,油麦菜(281.95± 13.11)μmol/hg,香菇(260.98±11.40)μmol/hg,花椰菜(255.27±8.93)μmol/hg,蒜苔(251.48±9.52)μmol/ hg,芹菜(228.75±11.00)μmol/hg,长豆角(216.97± 11.74)μmol/hg,土豆(205.31±8.73)μmol/hg,白萝卜(178.89±13.84)μmol/hg,生菜(141.51±4.66)μmol/ hg,四季豆(136.68±5.86)μmol/hg,番茄(125.41± 6.36)μmol/hg,白菜(122.95±10.72)μmol/hg,苦瓜(120±8)μmol/hg,莴苣(90.38±6.68)μmol/hg,胡萝卜(84.83±8.45)μmol/hg,青南瓜(84.62±0.93)μmol/ hg,葫芦(73.95±3.35)μmol/hg,冬瓜(56.89± 3.43)μmol/hg,黄瓜(56.17±1.86)μmol/hg;丝瓜的总酚含量(44.94±4.16)μmol/hg为最低。
Song等人[16]对美国消费的27种主要蔬菜总酚含量的测定结果表明,菠菜的总酚含量最高,油麦菜和黄瓜的总酚含量最低。本课题研究结果与Song等人的15种相同种类蔬菜提取物总酚含量之间的相关性极显著(R2=0.719 3,p<0.01),但其中菠菜、西兰花、油麦菜和芹菜的总酚含量差异较大,原因可能是蔬菜的产地、品种,以及采摘时间和贮存时间等因素不同造成的。本文作者所研究的36种蔬菜均在最佳采摘时间采摘于各种蔬菜的中国主产区,采摘后于最佳食用时间进行抗增殖活性评价研究,这样可以保证所研究对象的可比较性,研究结果对消费者的指导意义也更具有确定性。
2.2蔬菜提取物对HepG2细胞的毒性和抑制增殖活性
由蔬菜提取物对HepG2细胞的毒性和抑制增殖活性结果(见表1)可见,36种蔬菜提取物对HepG2细胞有毒性的质量浓度各不相同。研究中抗细胞增殖活性实验所用的蔬菜系列质量浓度均设置在没有细胞毒性的提取物质量浓度范围内,这样可以保证蔬菜提取物样品的HepG2细胞抗增殖作用不是由其本身的细胞毒性作用引起,而是由样品的抗肿瘤作用所引起(以下蔬菜提取物对Caco-2细胞的毒性和抑制增殖活性同此)。由表1可知,韭菜和蒜苔具有最高的抗HepG2细胞增殖活性,两者的抗增殖活性相近(p>0.05);土豆的抗增殖活性次之;其它蔬菜的抗增殖活性高低依次是紫洋葱﹥苦瓜≈香菇﹥紫茄子﹥西兰花﹥芥蓝﹥莲藕≈木耳﹥菠菜﹥长豆角≈菜心﹥白萝卜﹥青尖椒≈青南瓜≈莴苣≈四季豆﹥上海青≈空心菜;紫包菜、红扁豆、红苋菜、青甜椒、油麦菜、花椰菜、芹菜、生菜、番茄、白菜、胡萝卜、葫芦、冬瓜、黄瓜和丝瓜的抗增殖活性在本实验条件其EC50值均未测出。
Chu等人[6]对美国消费的10种主要蔬菜抗HepG2细胞增殖活性EC50值的测定结果表明,抗HepG2细胞增殖活性的高低依次为菠菜(42.51± 1.68)mg/mL,洋葱(100.25±4.00)mg/mL和西兰花(112.74±4.50)mg/mL,而土豆、莴苣、芹菜、胡萝卜和黄瓜的抗增殖EC50值未能测出。
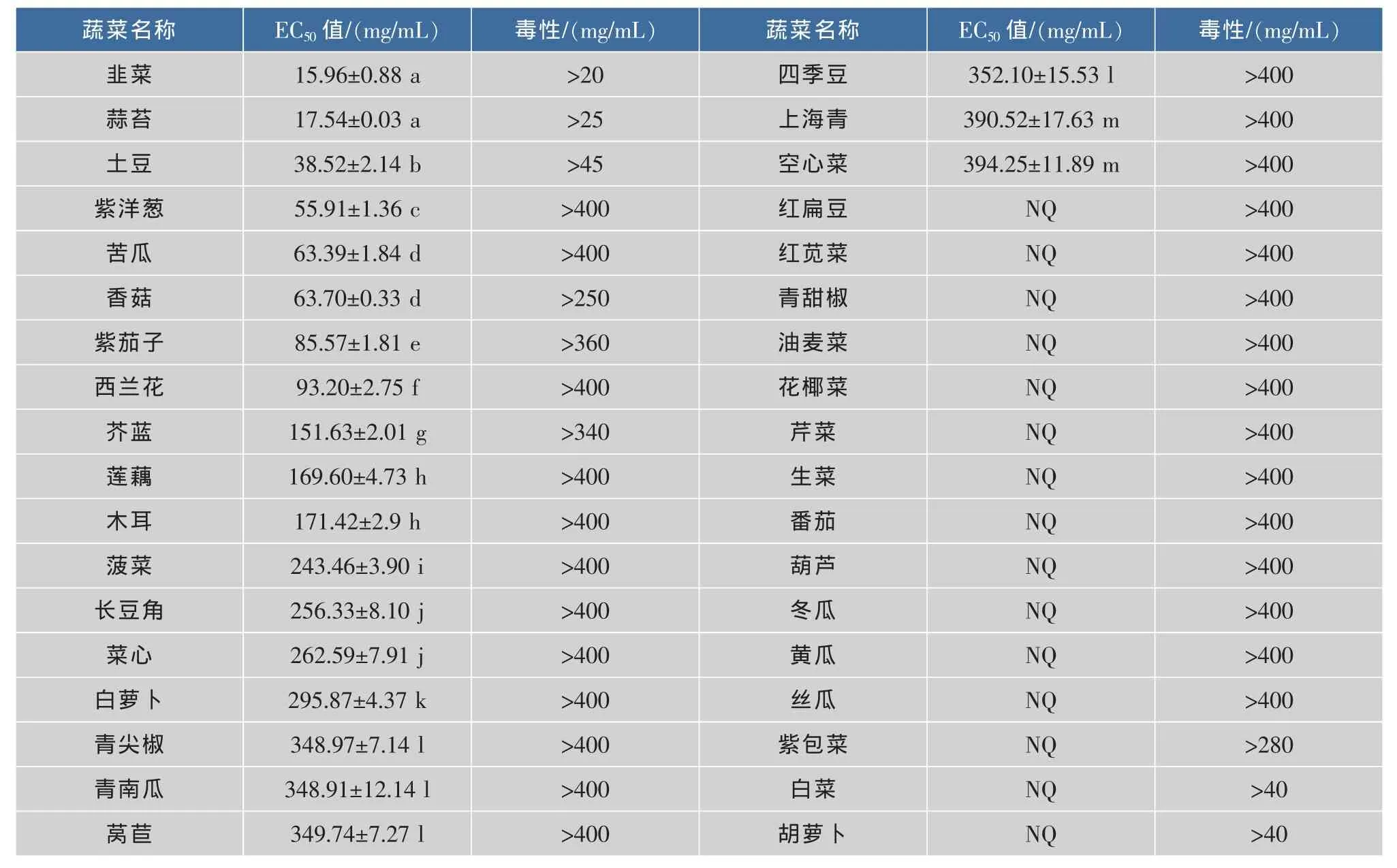
表1 36种蔬菜提取物抗HepG2细胞增殖的EC50值Table 1 EC50values of of antiproliferative activity of 36 vegetable extracts on HepG2 cells
蔬菜提取物的总酚含量与其抗HepG2细胞增殖活性之间的相关性不显著(R2=0.027 1,p>0.05),见表2。但其中总酚含量相对较高的紫包菜、红扁豆、红苋菜和青甜椒却未能测出抗HepG2细胞增殖的EC50值;总酚含量相对较高的芥蓝、莲藕、青尖椒和菜心,其抗HepG2细胞增殖活性也较低;苦瓜、土豆、蒜苔、韭菜和紫洋葱的总酚含量相对较低,但其抗HepG2细胞增殖活性却较高。蔬菜的抗增殖活性与其总酚含量的相关性与Chu等人[8]的研究结果一致,Chu等研究的10种蔬菜抗HepG2细胞增殖EC50值与其总酚含量之间的相关性不显著(R2=0.121 1,p>0.05)。
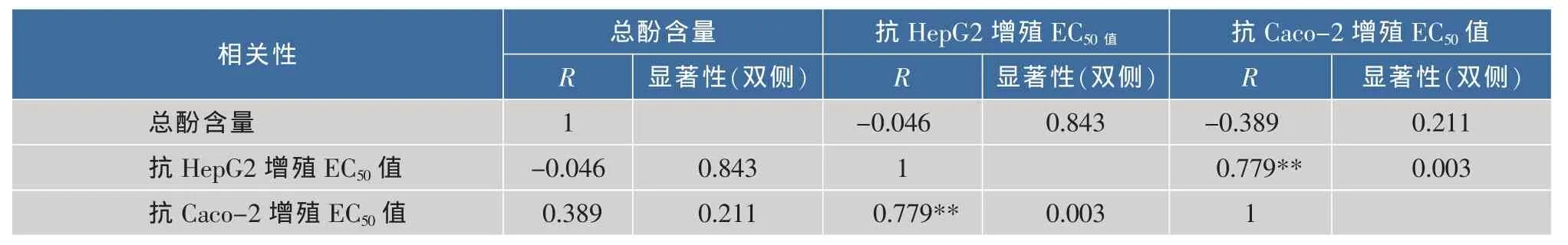
表2 蔬菜总酚含量与抗HepG2和Caco-2细胞增殖EC50值的相关性分析Table 2 Correlation analysis between total phenolic content and EC50values on HepG2 and Caco-2 cells
2.3蔬菜提取物对Caco-2细胞的毒性和抑制增殖活性
蔬菜提取物的总酚含量与其抗Caco-2细胞增殖活性的相关性不显著(R2=0.151 3,p>0.05)。其中总酚含量相对较高的紫包菜、红扁豆、木耳、菠菜、红苋菜、上海青和青甜椒却未能测出抗HepG2细胞增殖的EC50值;总酚含量相对较高的芥蓝、青尖椒、菜心和西兰花,其抗HepG2细胞增殖活性却较低;韭菜、土豆、蒜苔和香菇的总酚含量相对较低,但其抗Caco-2细胞增殖活性却较高。
蔬菜提取物对Caco-2细胞的毒性和抑制增殖活性的研究结果(见表3)显示,韭菜具有最高的抗Caco-2细胞增殖活性,土豆的抗增殖活性次之;其它蔬菜的抗增殖活性高低依次是蒜苔﹥香菇﹥莲藕﹥紫茄子﹥芥蓝﹥洋葱﹥莴苣﹥西兰花﹥菜心﹥青尖椒,它们间的抗增殖活性差异显著(p<0.05);紫包菜、红扁豆、木耳、菠菜、红苋菜、上海青、青甜椒、空心菜、油麦菜、花椰菜、芹菜、长豆角、白萝卜、生菜、四季豆、番茄、白菜、苦瓜、胡萝卜、青南瓜、葫芦、冬瓜、黄瓜和丝瓜的抗增殖EC50值均未能测出。
蔬菜的总酚含量与其抗增殖活性之间相关性不显著的结果表明,除总酚含量以外,蔬菜多酚的抗增殖活性还受到多酚的组成种类(黄酮类、花青素类或酚酸类等)及其不同酚类间的协同作用,以及其他植物化学成分的影响。因此,不能单从多酚含量的高低来推测其生物学活性[5-6]。
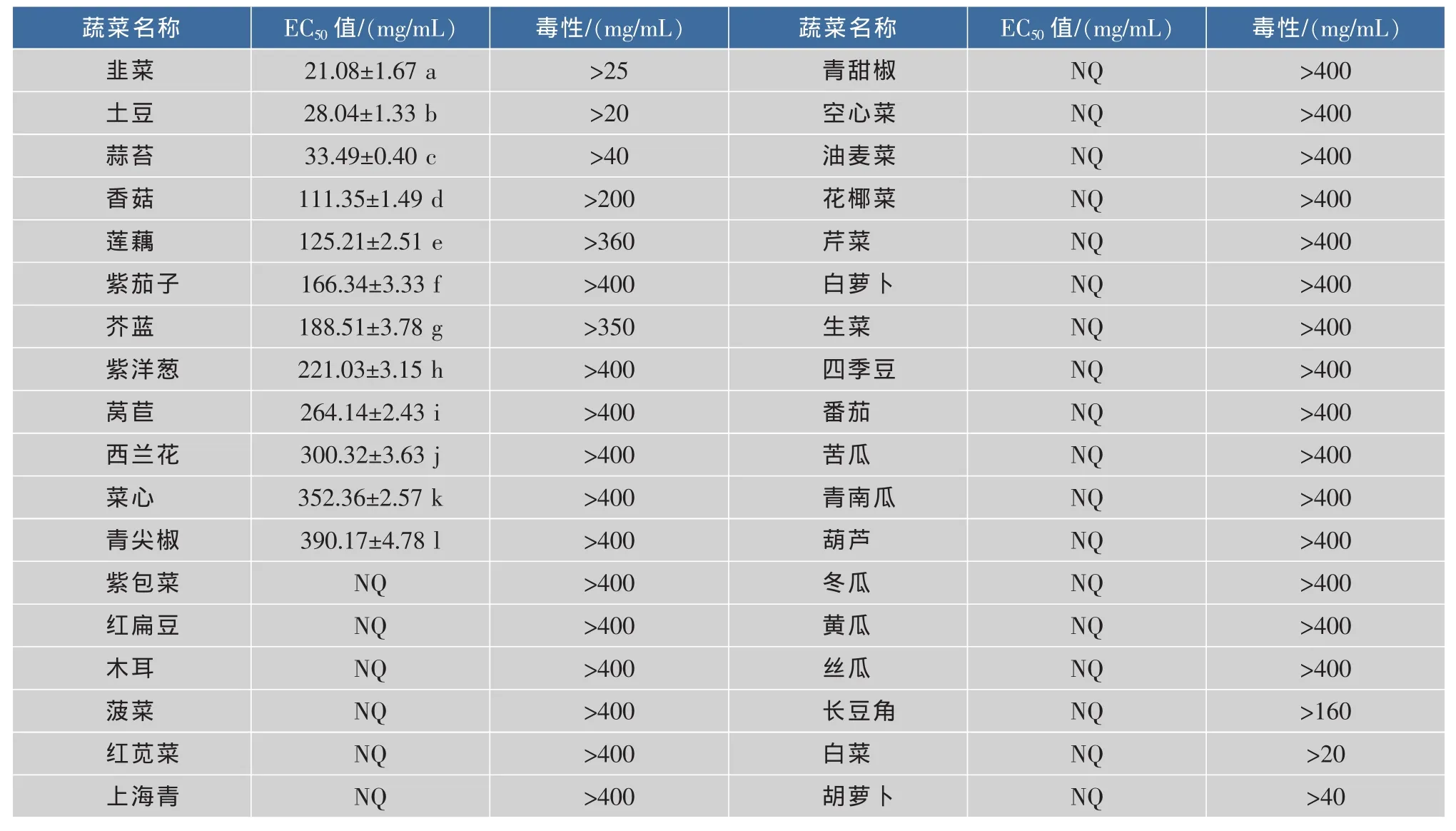
表3 36种蔬菜提取物抗Caco-2细胞增殖的EC50值Table 3 EC50values of of antiproliferative activity of 36 vegetable extracts on Caco-2 cells
3 结语
36种蔬菜提取物中GAE为:芥蓝(973.09± 31.29)μmol/hg,莲藕(920.55±29.00)μmol/hg,总酚含量最高;丝瓜(44.94±4.16)μmol/hg,总酚含量最低。在抑制细胞增殖活性方面,韭菜(15.96±0.88)mg/mL和蒜苔(17.54±0.03)mg/mL,抗HepG2细胞增殖活性最强;上海青(390.52±17.63)mg/mL和空心菜(394.25±11.89)mg/mL,抗HepG2细胞增殖活性最弱。韭菜抗Caco-2细胞增殖活性最强,为(21.08±1.67)mg/mL;青尖椒的抗Caco-2细胞增殖活性最弱,为(390.17±4.78)mg/mL。
蔬菜提取物的总酚含量与其抗HepG2细胞增殖活性之间的相关性不显著(R2=0.027 1,p>0.05);与其抗Caco-2细胞增殖活性之间的相关性也不显著(R2=0.151 3,p>0.05)。表明,蔬菜的抗肿瘤细胞增殖活性不能单从其多酚含量的高低来推测,蔬菜中某些种类多酚的抗肿瘤活性值得深入研究。
[1]Doll R,Peto R.The causes of cancer:quantitative estimates of avoidable risks of cancer in the United States today[J].J Natl Cancer Inst,1981,66(6):1191-1308.
[2]Willet W C.Diet and Health:what should we eat[J].Science,1994,254:532-537.
[3]Ames B N,Shigenaga M K,Hagen T M.Oxidants,antioxidants,and the degenerative diseases of aging[J].Proc Natl Acad Sci USA,1993,90(17):7915-7922.
[4]Eberhardt M V,LEE C Y,LIU R H.Antioxidant activity of fresh apples[J].Nature,2000,405:903-904.
[5]LIU R H.Potential synergy of phytochemicals in cancer prevention:mechanism of action[J].J Nutr,2004,134(12 Suppl):3479S-3485S.
[6]CHU Y F,SUN J,WU X Z,et al.Antioxidant and antiproliferative activities of common vegetables[J].J Agric Food Chem,2002,50(23):6910-6916.
[7]周阿成,金黑鹰,谈瑄忠,等.洋葱提取物对结肠癌细胞增殖的抑制作用[J].世界华人消化杂志,2011,19(19):2011-2015.
ZHOU Acheng,JIN Heiying,TAN Xuanzhong,et al.Allium cepa extracts inhibit the proliferation of colorectal can-cer in vitro[J].World Chinese Journal of Digestology,2011,19(19):2011-2015.(in Chinese)
[8]李招发,徐雪松,孙立文,等.大蒜提取液抑制人结肠癌细胞SW480和SW620的增殖和扩散[J].吉林大学学报:自然科学版,2005,43(5):687-690.
LI Zhaofa,XU Xuesong,SUN Liwen,et al.Restraint of proliferation and spreading of human colorectal cancer cells SW480 and SW620 by aqueous extract of garlic[J].Journal of Jilin University:Science Edition,2005,43(5):687-690.(in Chinese)
[9]何勇,黄承钰,候蕴华.八种蔬菜粉脂溶性粗提物对人胃癌细胞增殖的影响[J].现代预防医学,1998,25(3):278-281.
HE Yong,HUANG Chengyu,HOU Yunhua.Effects of the fat-soluble extracts of 8 kiands of vegetable powders on the proliferation of human gastric cancer cell[J].Morden Preventive Medicine,1998,25(3):278-281.(in Chinese)
[10]吕全军,黄承钰,姚树祥,等.蔬菜粉提取物和β-胡萝卜素对人肺癌细胞增殖和凋亡的影响[J].营养学报,2002,24(2):134-138.
LV Quanjun,HUANG Chengyu,YAO Shuxiang,et al.Effect of extracts from vegetable powder and β-carotene on proliferation and apoptosis of human lung cancer cells[J].Acta Nutrimenta Sinica,2002,24(2):1 34-138.(in Chinese)
[11]吕静,陶文沂,程景才,等.十字花科蔬菜提取物抗肿瘤作用的研究[J].食品与生物技术学报,2007,26(4):105-109.
LV Jing,TAO Wenyi,CHENG Jingcai,et al.Antitumor effects of extract from cruciferous vegetables[J].Journal of Food Science and Biotechnology,2007,26(4):105-109.(in Chinese)
[12]Requena T,Monagas M,Pozo-Bayon M A,et al.Perspectives of the potential implications of wine polyphenols on human oral and gut microbiota[J].Trends in Food Science&Technology,2010(10):1-13.
[13]Clfford M N.Diet-derived phenols in plasma and tissues and their implication for health[J].Planta Medica,2004,70(12):1103-1114.
[14]Manach C,Morand C,Texier O,et al.Quercetin metabolites in plasma of rats fed diets containing rutin and quercetin[J].J Nutr,1995,125(7):1911-1922.
[15]Dana L F,JIE S,LIU R H.A modified methylene blue assay for accurate cell counting[J].J Funct Foods,2009,1(1):109-118.
[16]SONG W,Derito C M,LIU M K,et al.Cellular antioxidant activity of common vegetables[J].J Agric Food Chem,2010,58(11):6621-6629.
Antiproliferative Activities of 36 Vegetables in China on HepG2 and Caco-2 Cells
WAN Hongxia1,LIU Renbin2,SUN Haiyan1,LIU Dong*1
(1.Shenzhen Polytechnic,Shenzhen 518055,China;2.Traditional Chinese Medical Science Section,Shiyan Renmin Hospital,Shiyan 442000,China)
The work was to determine the phenolic contents and the antiproliferative activities on human liver cells HepG2 and human colon cancer cells Caco-2 of 36 commonly consumed vegetables in China.Based on the Folin-Ciocalteu method,Brassica alboglabra L.H.Bailey(Chinese kale)(973.09±31.29 μmol GAE/100 g of fresh vegetable)and Nodus Nelumbins Rhizomatis(lotus root)(920.55±29.00 μmol GAE/100 g of fresh vegetable)were found to have the highest totalphenolic contents,whereas Luffa cylindrica(L.)(Roem.towel gourd)(44.94±4.16 μmol GAE/100 g fresh vegetable)had the lowest phenolic content.According to the methylene blue assay for the quantifiable antiproliferative activities,A.tuberosum(Chinese chive)and galic bolt(garlic sprout)had the strongest antiproliferative activities on HepG2 cells with EC50values of 15.96±0.88 mg/mL and 17.54±0.03 mg/mL,respectively,and A.tuberosum(Chinese chive)also had the strongest antiproliferative activity on Caco-2 cells(EC50value of 21.08±1.67 mg/mL);Brassicachinensis L.(Shanghai pakchoi)(EC50value of 390.52±17.63 mg/mL)and Ipomoea aquatica Forsk.(water spinach)(EC50value of 394.25±11.89 mg/mL)exerted the weakest antiproliferative activities on HepG2 cells,and Capsicum annuum(green chili pepper)(EC50value of 390.217±4.78 mg/mL)had the weakest activity on Caco-2 cells.The study did not prove a significant correlation between the total phenolic contents and the antiproliferative activities on HepG2(R2=0.0271,p>0.05)and Caco-2(R2=0.151 2,p>0.05)cells,indicating that the inhibition of cancer cells by vegetables could not be explained solely by their phenolic contents.
vegetable,polyphenol,HepG2 human liver cells,Caco-2 human colon cancer cells,antiproliferative activity
TS 201.4;R 151.3
A
1673—1689(2015)09—0995—07
2014-09-24
广东省自然科学基金项目(S20111010004455);广东省高等职业院校珠江学者岗位计划资助项目(2011);深圳市科技计划项目(JC201005280530A,JCYJ201303/1512222011)。
万红霞(1984—),女,河南濮阳人,工学硕士,助教,主要从事食品科学研究。E-mail:wanhongxias@szpt.edu.cn
刘冬(1968—),男,湖北十堰人,工学博士,教授,主要从事食品生物技术研究。E-mail:liudongsz@szpt.edu.cn

