食品中马源性成分的实时荧光PCR检测
王玮,吕青骎,朱卢玺,李春保,陈颖,葛毅强,周光宏
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏南京210095;2.南京农业大学公共管理学院,江苏南京210095;3.中国检验检疫科学研究院农产品安全研究中心,北京100123;4.中国农村技术开发中心,北京100045)
食品中马源性成分的实时荧光PCR检测
王玮1,吕青骎1,朱卢玺2,李春保1,陈颖3,葛毅强4,周光宏1
(1.南京农业大学食品科技学院,国家肉品质量安全控制工程技术研究中心,江苏南京210095;2.南京农业大学公共管理学院,江苏南京210095;3.中国检验检疫科学研究院农产品安全研究中心,北京100123;4.中国农村技术开发中心,北京100045)
针对马线粒体DNA细胞色素b基因设计特异性引物和探针,建立食品中马源性成分实时荧光PCR检测方法,并经特异性和灵敏度试验验证其可行性。结果表明:该体系可扩增马DNA片段,长度为127 bp,其他常见畜、禽肉成分均无法正常扩增。该体系的检测灵敏度为1.25 pg马DNA和质量分数0.001%马肉粉。经市售食品的检测验证,表明所建立的马引物探针体系具有特异性好、灵敏度高、快速、高效等优点,可用于对食品中马源性成分的掺假鉴别检测。关键词:马线粒体DNA细胞色素b基因;实时荧光PCR方法;定性检测
目前,国内市场上在肉及肉制品的生产销售过程中,利用掺杂掺假、以次充好等手段欺骗消费者而牟取暴利的事件频出。这不仅仅涉及食品安全、营养与经济价值等问题,更关系到消费者健康、宗教信仰等问题[1]。因此,对食品中原料肉进行掺假、掺杂检验显得尤为重要。目前对肉类鉴别的方法主要依赖于蛋白质鉴定(SDS-PAGE电泳法、等电聚焦电泳法、ELISA法)[2-4]和分子生物学鉴定(DNA分子杂交、PCR方法等)[5-7]。蛋白质鉴定技术现已成功应用于生肉的鉴别,但当肉类经过切碎、混合、蒸煮和熏烤等加工工艺处理后,将改变肉类蛋白质的结构和稳定性,从而破坏物种特有的蛋白质或抗原决定簇,影响其检测的准确性和可靠性[8]。而且,这些方法在实际应用中存在操作复杂、费时、成本高等问题,已不能满足现代肉类安全检测的需求。随着生物技术的发展,以物种间基因差异为基础的分子生物学鉴定方法成为肉类物种鉴定研究的热点[9]。本研究中根据马线粒体DNA细胞色素b基因设计特异性引物和探针,旨在建立一种快速、简便、灵敏、准确、可靠的马源性成分定性检测的实时荧光PCR方法,以满足当前相关食品掺假掺杂检验的需求。
1 材料与方法
1.1材料
1.1.1实验材料各种市售加工食品,如熏马肉、马肠、猪肉肠、牛肉丸和酱驴肉,以及马肉、猪肉、牛肉、驴肉、狗肉、山羊肉、绵羊肉、骆驼肉、兔肉、鱼肉、鸡肉、鹅肉、鸭肉、鹌鹑肉等样品,均购于南京市农贸市场或超市。
1.1.2引物和探针根据Gen Bank所公布的马线粒体DNA细胞色素b基因序列,利用Oligo 6.0软件,设计马特异性引物和探针;GeneBank Accession:JF511459,扩增目的片段长度为127 bp。扩增所用引物和探针由上海英骏生物技术有限公司合成,引物和探针序列见表1。

表1 实时荧光PCR引物和探针序列Table 1 Sequences of primers and probe for Real-time PCR
天根生化科技有限公司;溴化乙锭(EB)、蛋白酶K,购自大连宝生物公司;琼脂糖(电泳纯)、三氯甲烷、无水乙醇、异丙醇,购自上海生工公司;DNA MarkerⅠ,购自上海纪宁实业有限公司;实时荧光PCR混合液[FastStart Universal Probe Master(ROX)],购自美国罗氏公司。
CTAB提取缓冲液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L Na2EDTA,pH 8.0);CTAB沉淀液(5 g/L CTAB,40 mmol/L NaCl);蛋白酶K溶液(20 mg/mL);TE缓冲液(10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0);1.2 mol/L NaCl。均由作者所在实验室配制。
1.1.4仪器各种量程微量移液器,5804R离心机,德国Eppendorf公司制造;PHS-3C精密pH计,上海雷磁公司制造;BS电子天平,德国Sartorius公司制造;VORTEX 3型涡旋振荡器,德国IKA公司制造;Venticell精密烘箱,德国MMM公司制造;SPEX型冷冻研磨机,美国SPEX 6850公司制造;ABI7700型实时荧光PCR仪,美国ABI公司制造;DU640型核酸蛋白质分析仪,美国Beckman公司制造;DYY-6C电泳仪,北京六一仪器厂制造;凝胶成像仪,德国Gene Genius公司制造。
1.2方法
1.2.1样品的制备用冷冻研磨机将上述动物材料样品研磨成粉状,并于60℃烘干3 h。用马肉粉和牛肉粉混合,配制成分别含有质量分数10%、1%、0.5%、0.1%、0.05%、0.01%、0.001%和0.000 1%马肉粉的混合样品。
1.2.2DNA的提取称取100 mg已制备好的样品置于2 mL的离心管中,加入1.5 mL CTAB提取缓冲液和10 μL蛋白酶K溶液。60℃振荡过夜后13 000 g离心10 min,转移上清液至新的离心管中;加入750 μL三氯甲烷后用力振荡,13 000 g离心5 min,将上清液转移到新的离心管中;加入2倍体积的CTAB沉淀液,室温静置60 min,13 000 g离心15 min,弃去上清液。加入350 μL NaCl溶液将沉淀物进行悬浮。再加入350 μL三氯甲烷,涡旋振荡进行混匀,13 000 g离心10 min。转移上清液后加入0.6倍体积的异丙醇,室温放置20 min,13 000 g离心10 min,弃去上清液。加入500 μL体积分数70%乙醇溶液洗涤沉淀,溶解于100 μL TE溶液中,立即使用或-20℃保存备用。
1.2.3DNA质量浓度测定及配制用美国Beckman DU640型核酸蛋白质分析仪测定抽提样品DNA的质量浓度。用牛肉DNA溶液(100 ng/μL)将马肉DNA溶液(100 ng/μL)分别稀释成为2.5、0.25、0.025、0.002 5、0.000 25、0.000 025 ng/μL的DNA混合样品,用于灵敏度检测。
1.2.4PCR扩增马源性成分实时荧光PCR反应体系:实时荧光PCR混合液12.5 μL,正反向引物(10 μmol/L)各1 μL,探针(10 μmol/L)1 μL,DNA模板5 μL,加灭菌ddH2O至25 μL。扩增反应程序为:50℃预变性2 min;95℃变性15 min,95℃退火15 s,60℃延伸1 min,40个循环。
马源性成分普通PCR反应体系:10×Multi Hotstart buffer(含Mg2+)2.5 μL,dNTPs(2.5 mol/L)1.0 μL,5 U/μL HotMaster Taq DNA polymerase 0.2 μL,正反向引物(10 μmol/L)各0.5 μL,DNA模板5.0 μL,加灭菌ddH2O至25 μL。扩增反应程序为:95℃预变性15 min;94℃变性30 s,58℃退火30 s,72℃延伸20 s,40个循环;72℃延伸5 min。扩增结束,质量分数2%琼脂糖凝胶电泳分析结果。
2 材料与方法
2.1引物有效性验证
利用所设计的引物,对马DNA进行PCR扩增。由图1可知,5个样品均能扩增出约127 bp的DNA片段,与预期所设计的片段长度相符合。
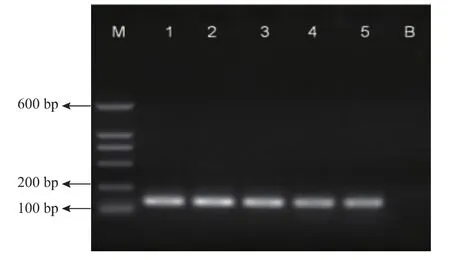
图1 PCR产物电泳图Fig.1 Gel electrophoresis of PCR products
2.2马源性成分的实时荧光PCR特异性检测
以马线粒体DNA细胞色素b基因为扩增靶基因,设计合成马源性检测引物和探针序列,用于对马和供试的其他动物进行检测分析,在马DNA中出现扩增,而在猪肉、牛肉、驴肉、山羊肉、绵羊肉、骆驼肉、狗肉、兔肉、野兔肉、鱼肉、鸡肉、鹅肉、鸭肉、鹌鹑肉等14种动物样品DNA中均无扩增,见图2。证实该检测方法具有物种特异性。
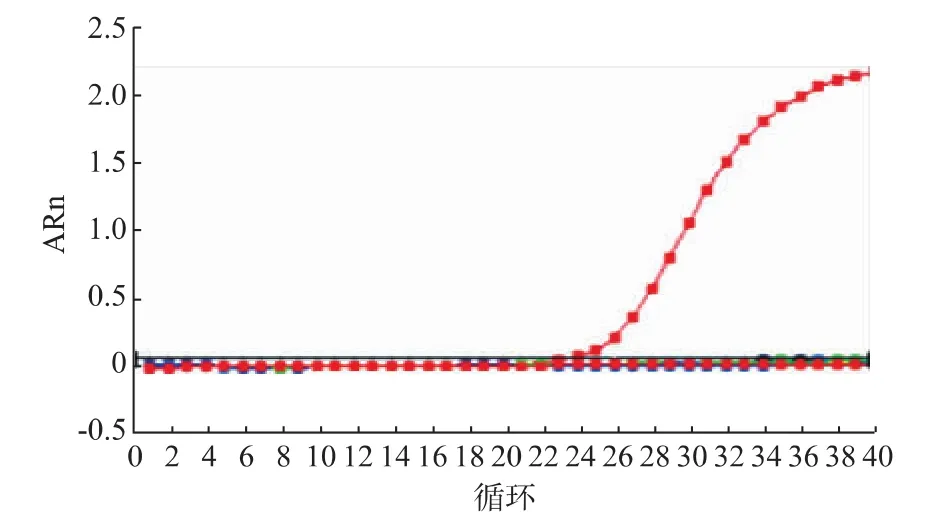
图2 马源性成分的物种特异性实时荧光PCR检测结果Fig.2 Specific detection of real-time PCR for horse
2.3马源性成分的实时荧光PCR灵敏度检测
使用马源性检测引物和探针对2.5、0.25、0.025、0.002 5、0.000 25、0.000 025 ng/μL马DNA进行实时荧光PCR测试,在2.5、0.25、0.025、0.002 5、0.000 25 ng/μL马DNA中均出现扩增曲线,在0.000 025 ng/μL马DNA中未出现扩增曲线,见图3。表明马源性检测引物检测灵敏度为1.25pg马DNA。
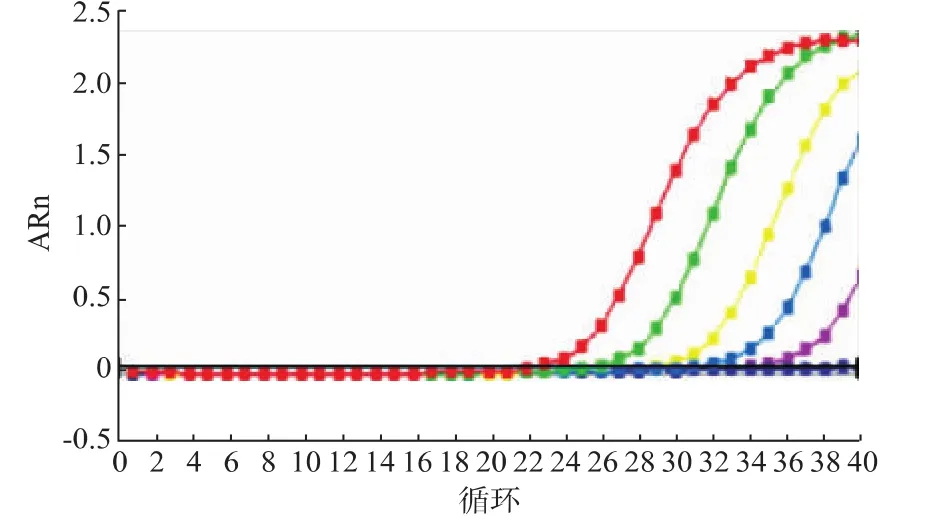
图3 马DNA实时荧光PCR检测灵敏度实验结果Fig.3 Amplification curve generated by serial dilution of Horse DNA
使用马源性检测引物和探针对质量分数10%、1%、0.5%、0.1%、0.05%、0.01%、0.001%和0.000 1%马肉粉含量的样品DNA进行检测。质量分数10%、1%、0.5%、0.1%、0.05%、0.01%和0.001%马肉粉均出现扩增曲线,而质量分数0.000 1%马肉粉未出现扩增曲线,见图4。实验表明,该方法的检测灵敏度为质量分数0.001%(10 mg/kg)马肉粉。
2.4市售食品中马源性成分的实时荧光PCR检测
见图5。使用建立的检测方法对5种市售食品检测,以验证检测方法的实用性。

图4 马肉粉质量分数实时荧光PCR检测灵敏度实验结果Fig.4Amplification curve generated by different horsepercentage

图5 食品中马源性成分的实时荧光PCR检测结果Fig.5 Detectionofhorse-derivedcomponentsin commercial food products
可知,市售的猪肉肠、牛肉丸、酱驴肉中均未检测到马源性成分,而熏马肉和马肠中确实能检测到马源性成分,其检测结果与食品标签相符合。表明该检测方法适用于食品中马源性成分的检测。
3 结语
实时荧光PCR方法因其高灵敏度和高特异性等优点被广泛应用于加工产品(尤其是深加工产品)的检测。靶基因的选择是影响实时荧光PCR检测灵敏度和特异性的关键因素,本研究中选择的目的基因(细胞色素b基因)位于线粒体,而大量的线粒体存在于多数细胞中,且该基因为多拷贝基因,故可达到较高灵敏度而宜于种源的定性研究[10]。实验中建立的方法可检测到1.25 pg马DNA和质量分数0.001%马肉粉的存在,且该马特异性引物和探针体系仅能扩增马源性成分,对其他畜禽肉样品均无法正常扩增,从而能保证特异、准确地检测出混合样品中的马源性成分。在阴性样品控制方面,Dooley等[11]将Ct值检测阳性限定为30循环,本研究中将Ct值限定在35循环以内,在检测的特异性、灵敏性和假阳性控制方面均可达到较好的效果。该方法经市售食品检测验证,可靠性和准确性良好,能满足对加工食品中马源性成分掺假定性检测的需要。
[1]Mane B G,Mendiratta S K,Tiwari A K,et al.Detection of adulteration of meat and meat products with buffalo meat employing polymerase chain reaction assay[J].Food Analytical Methods,2012(5):296-300.
[2]Zerifi A,Labie C,Benard G.SDS-PAGE technique for the species identification of cooked meat[J].Fleiswirtschaft,1992(1):54.
[3]Skarpeid H J,Kvaa K,Hildrum K I.Identification of animal species in ground meat mixtures by multivariate analysis of isoelectricfocusing protein profiles[J].Electrophoresis,1998,19(18):3103-3109.
[4]Chen F C,Hsieh Y H.Detection of pork in heat-processed meat products by monoclonal antibody-based ELISA[J].Journal of AOAC International,2000,83(1):79-85.
[5]Lockley A K,Bardsley R G.DNA-based methods for food authentication[J].Trends in Food Science&Technology,2000,11(2):67-77.
[6]Koh M C,Lim C H,Chua S B,et al.Random amplified polymorphic DNA(RAPD)fingerprints for identification of red meat animal species[J].Meat Science,1998,48(3/4):275-285.
[7]Koppel R,Daniels M,Felderer N,et al.Multiplex real-time PCR for the detection and quantification of DNA from duck,goose,chicken,turkey and pork[J].European Food Research and Technology,2013,236(6):1093-1098.
[8]Meyer R,Candrian U,Lüthy J.Detection of pork in heated meat products by polymerase chain reaction(PCR)[J].Journal of AOAC International,1994,77(3):617-622.
[9]Kesmen Z,Gulluce A,Sahin F,et al.Identification of meat species by TaqMan-based real-time PCR assay[J].Meat Science,2009,82(4):444-449.
[10]Ballin N Z,Vogensen F K,Karlsson A H.Species determination-Can we detect and quantify meat adulteration[J].Meat Science,2009,83(2):165-174.
[11]Dooley J J,Paine K E,Garrett S D,et al.Detection of meat species using TaqMan real-time PCR assays[J].Meat Science,2004,68(3):431-438.
Detection for Horse-Derived Components in Foods by Real-Time Polymerase Chain Reaction
WANG Wei1,LV Qingqin1,ZHU Luxi2,LI Chunbao1,CHEN Ying3,GE Yiqiang4,ZHOU Guanghong1
(1.College of Food Science and Technology,Nanjing Agricultural University;National center of Meat Quality and Safety Control,Nanjing 210095,China;2.College of Public Administration,Nanjing Agricultural University,Nanjing 210095,China;3.Agro-product Safety Research Center,Chinese Academy of Inspection and Quarantine,Beijing 100123,China;4.China Rural Technology Development Center,Beijing 100045,China)
Species-specific real-time PCR assay was developed for the detection of horse-derived materials in foods.Primers and probes were designed with horse conservative regions of the mitochondrial cytochrome b gene(amplicon=127 bp).The specificity was evaluated and no amplifications on DNA from other meats came under observation.The method was specific for horse-derived materials,and the limit of detection was 1.25 pg of horse DNA and 0.001%(w/w)for horse powder.All these results confirmed that the real-time PCR assay is a rapid,sensitive and specific routine food analysis for the detection of horse in foods.
horse mitochondrial DNA cytochrome b gene,real-time PCR,qualitative detection
Q 949.329.7
A
1673—1689(2015)09—0961—04
2014-06-04
国家“十二五”科技支撑计划项目(2012BAD28B02-03);江苏省产学研联合创新资金前瞻性联合研究项目(BY2011181);南京农业大学青年科技创新基金项目(KJ2013031)。
王玮(1982—),男,江苏泗洪人,工学博士,讲师,主要从事肉及肉制品质量安全控制研究。E-mail:wangwei821220@njau.edu.cn

