新型离子液体中脂肪酶催化薄荷醇选择性酯化
李明,徐晓丰,李在均,朱婷,彭杨
(1.江南大学食品胶体与生物技术教育部重点实验室,江苏无锡214122;2.江南大学化学与材料工程学院,江苏无锡214122;3.无锡市第三高级中学,江苏无锡214028)
新型离子液体中脂肪酶催化薄荷醇选择性酯化
李明1,2,徐晓丰3,李在均1,2,朱婷2,彭杨2
(1.江南大学食品胶体与生物技术教育部重点实验室,江苏无锡214122;2.江南大学化学与材料工程学院,江苏无锡214122;3.无锡市第三高级中学,江苏无锡214028)
设计合成了6种新型对称烷基咪唑六氟磷酸盐离子液体。以脂肪酶Candida antarctica催化(±)-薄荷醇和丙酸酐立体选择性酯化反应为模型反应,考察反应介质对酶行为的影响。结果发现,在1,3-二正辛基咪唑六氟磷酸盐([DnOIM][PF6])中酶的活性与立体选择性明显高于其他离子液体和正己烷。因此,[DnOIM][PF6]被选择作为反应介质。通过优化实验,得到最佳反应条件为:反应温度30℃,70 mg脂肪酶,3.0 mL离子液体,底物(±)-薄荷醇与丙酸酐物质的量比1∶1,反应时间20 h。此时,反应转化率与e.e.(p-)值分别可达48.1%与98.1%。酶在[DnOIM][PF6]中的稳定性是正己烷的4.3倍,且重复使用7次后催化活性没有显著降低。荧光光谱和圆二色谱研究结果表明,酶在[DnOIM][PF6]中有较大的酶蛋白质分子裸露程度和良好的二级结构稳定性。
离子液体;脂肪酶;立体选择性酯化;薄荷醇
(-)-薄荷醇是天然薄荷油的主要成分,可从天然薄荷油中单离而得。由于具有明显的清凉效果,(-)-薄荷醇及其酯已成为重要的香原料,广泛应用于食品、烟草、医药和化妆品等领域[1-3]。近年来,天然提取的(-)-薄荷醇的产量已无法满足工业需要,而常规化学法合成的大多为外消旋薄荷醇,用不对称合成法制备(-)-薄荷醇的工艺又不够成熟,很难找到合适的催化剂,生产成本高。因此,采用化学法合成外消旋薄荷醇,再利用生物技术(酶或微生物法)对消旋体进行拆分,这种有机合成与生物催化相结合的生产方法,是获得(-)-薄荷醇的新途径[4-6]。
离子液体是一种环境友好的绿色溶剂,可替代易挥发性有机溶剂应用于酶催化反应。然而,离子液体特殊的组成和结构使它具有比有机溶剂更加多样化的溶剂性质,同时决定了离子液体对酶结构及性质的影响是复杂的。因此,酶在离子液体中呈现为酶活性、稳定性和选择性的增加、保持或丧失,甚至功能转化[7-9]。前期研究工作表明,作者开发出的新型对称离子液体1,3-二异丁基咪唑六氟磷酸([DiBIM][PF6])的亲生物性好,且优于有机溶剂正己烷[10]。在此基础上,设计合成了6种在结构、组成上具有递变规律的新型对称烷基咪唑六氟磷酸盐离子液体——1,3-二正丁基咪唑六氟磷酸盐([DnBIM][PF6]);[DiBIM][PF6];1,3-二正戊基咪唑六氟磷酸盐([DnPIM][PF6]);1,3-二异戊基咪唑六氟磷酸盐([DiPIM][PF6]);1,3-二正辛基咪唑六氟磷酸盐([DnOIM][PF6]);1,3-二异辛基咪唑六氟磷酸盐([DiOIM][PF6])。其结构式如图1所示。
以脂肪酶催化外消旋薄荷醇和丙酸酐的立体选择性酯化反应为模型反应,通过考察不同离子液体中酶的活性、选择性和稳定性,研究离子液体的性质对酶促反应影响的规律。
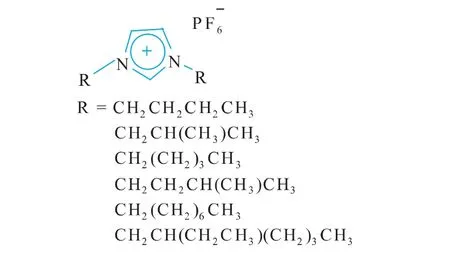
图1 离子液体的分子结构式图Fig.1 Molecular structure of the ionic liquid
1 材料与方法
1.1主要材料
脂肪酶CRL(from Candida rugosa,type VII),Sigma公司(上海)产品;(±)-薄荷醇(纯度99%)及(-)-薄荷醇(纯度99%),Acros公司产品;丙酸酐(纯度>96%),Fluka公司产品;6种新型对称烷基咪唑六氟磷酸盐离子液体,按文献[10]方法自制;其余试剂均为国产分析纯,国药集团化学试剂有限公司产品。
1.2试验仪器与设备
THZ-82B型气浴恒温振荡器,低速自动平衡离心机,金坛市医疗仪器厂产品;9790型气相色谱仪,温岭市福立分析仪器有限公司产品;β-DEX 120手性色谱柱(30 m×0.25 mm×0.25 μm),美国Supelco公司产品;RF-5301型荧光分光光度计,日本岛津公司产品;MOS-450型多功能圆二色光谱仪,法国Bio-Logic公司产品。
1.3试验方法
1.3.1转酯化反应在10 mL的具塞锥形瓶中,依次加入0.156 g(1.0 mmol)(±)-薄荷醇、70 mg脂肪酶和3.0 mL离子液体(或正己烷),最后加入0.130 g(1.0 mmol)的丙酸酐。将具塞锥形瓶置于气浴恒温振荡器中,控制温度为35℃,转速为180 r/min,间隔一定时间取样300 μL,加入到装有500 μL体积分数10%碳酸氢钠和500 μL正己烷的5 mL的离心管中,充分混匀,静置10 min,使之萃取完全。反应混合物在3 000 r/min下离心15 min后,取上层清液100 μL加入500 μL正己烷中,再加入20 μL内标(乙酸苄酯),气相色谱进行分析。(±)-薄荷醇的选择性酯化反应如图2所示。
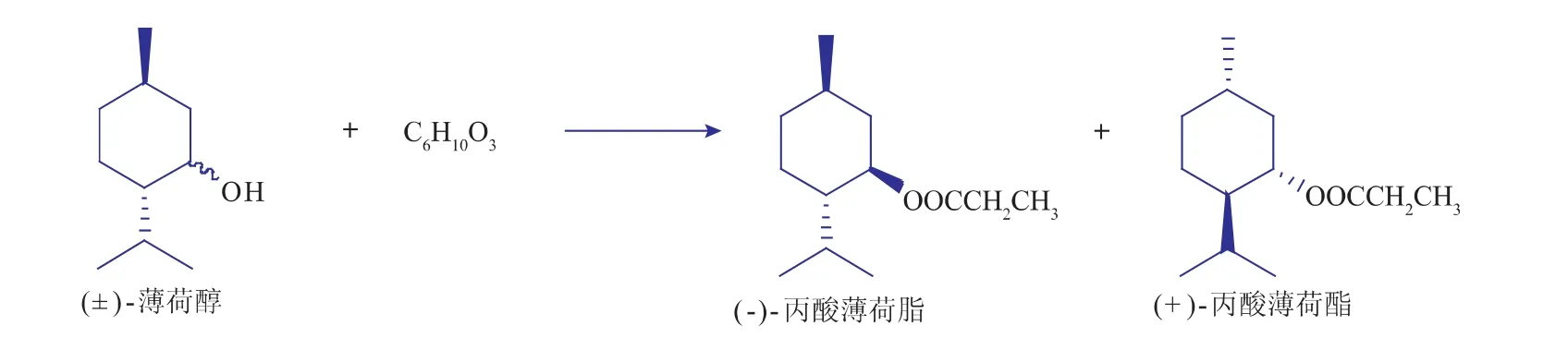
图2 (±)-薄荷醇与丙酸酐的选择性酯化反应示意图Fig.2 Enantioselective esterification of(±)-menthol with propionic anhydride
1.3.2气相色谱条件初始柱温100℃,保温5 min,随后以4℃/min升温至150℃,再以2℃/min升温至160℃,保温10 min;进样口与检测器温度分别为200℃和300℃;载气为氮气,体积流量为2 mL/ min;进样量0.2 μL;分流比1∶33。样品保留时间分别为:(+)-薄荷醇15.383 min,(-)-薄荷醇15.519 min,(-)-丙酸薄荷酯18.224 min,(+)-丙酸薄荷酯18.416 min。
1.3.3手性拆分效果的定量分析薄荷醇转化率的计算公式如式(1)所示,其中c代表转化率,P-和P+分别代表产物(-)-丙酸薄荷酯和(+)-丙酸薄荷酯在反应物混合物中所占的质量比例,S代表未反应底物的含量。

反应的手性选择性由对映体过量率e.e.(P-)和对映体选择率E(enantiomeric ratio)[4-5]表示,计算公式如式(2)与式(3)所示。
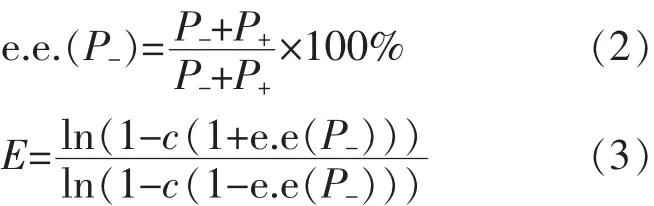
1.3.4酶的稳定性测定在10 mL的具塞锥形瓶中,加入3.0 mL离子液体(或正己烷)和70 mg的脂肪酶CRL,于30℃气浴恒温振荡器中孵育一定时间后,加入1.0 mmol(±)-薄荷醇和1.0 mmol丙酸酐进行酯化反应,按1.3.1方法测定和计算反应结果。
1.3.5酶的荧光发射光谱的检测酶液配制:转酯化反应结束后,迅速过滤,如反应体系中含有离子液体,先用冷丙酮冲洗2~3次,再用4℃冷乙醚洗去吸附于酶上的底物及溶剂,室温挥发除去乙醚后,将酶研磨成粉末状,称取1.0 mg酶粉,用磷酸缓冲液(pH 6.86)充分溶解,过滤后定容至5 mL,低温保存备用。酶液用RF-530型荧光分光光度计测定,荧光光谱激发波长为285 nm,激发与发射光狭缝宽度分别为5 nm和10 nm,氙灯,30℃下检测,扫描范围为300~450 nm。
1.3.6酶的圆二色谱圆二色谱(circular dichroism,CD)测定条件如下:样品池光程为0.1 cm,灵敏度为2 mdeg/cm,扫描测定波长范围为190~250 nm,扫描时间0.5 s,扫描速度为3.3 nm/s,在室温下测定。平均残基相对分子质量取112,CD谱用平均残基摩尔椭圆度表示,单位为deg·cm2/mol,数据经5次扫描取平均值。用K2D2软件计算脂肪酶的二级结构含量。
1.3.7离子液体及酶的重复利用在10 mL的具塞锥形瓶中依次加入1.0 mmol薄荷醇、70 mg CRL和3.0 mL离子液体(或正己烷),混合均匀,加入1.0 mmol丙酸酐开始反应。将具塞锥形瓶置于气浴恒温振荡器中,控制温度为30℃,转速为180 r/ min,反应20 h。对用离子液体作为溶剂的锥形瓶中加入3.0 mL正己烷,剧烈振荡萃取离子液体中的底物和产物,重复两次,然后加入新鲜底物(1.0 mmol薄荷醇和1.0 mmol丙酸酐)并开始反应。对于以正己烷为溶剂的体系,反应混合物在3 000 r/min下离心10 min后除去上层有机相,并用3.0 mL新鲜正己烷洗涤下层酶粉,重新加入3.0 mL正己烷和新鲜底物并开始反应。每次回收试验后用GC分析酯化反应结果,计算转化率及手性选择性。
2 结果与分析
2.1反应介质的选择
固定反应温度为30℃,底物(±)-薄荷醇与丙酸酐物质的量比率为1∶1条件下反应20 h,分别考察了不同离子液体对(±)-薄荷醇的选择性酯化反应效果,并与有机溶剂正己烷相比较,所得结果如图3所示。从图3可以看出,反应介质的选择对脂肪酶CRL催化(±)-薄荷醇的选择性酯化反应的影响很大。其中,以[DiOIM][PF6]中的转化率最高(93.2%),但反应的选择性极低,e.e.(P-)值仅为2.05%;[DnOIM][PF6]和[DnPIM][PF6]中的转化率其次,分别为48.1%与42.9%,均高于有机溶剂正己烷中的转化率(36.6%),而且二者反应的e.e.(P-)值(98.1%与96.3%)也显著高于正己烷(81.3%),其中[DnOIM][PF6]的E值更是高达332.7,是正己烷中E值(15.4)的21.6倍。而其他3种介质在相同条件下转化率分别为26.2%([DnBIM][PF6])、33.0%([DiBIM][PF6])和20.8%([DiPIM][PF6]),E值分别为11.1([DnBIM][PF6])、2.5([DiBIM][PF6])和3.8([DiPIM][PF6]),转化率和反应选择性均较低。可见,6种对称性烷基咪唑离子液体中,随着阳离子咪唑环1、3位N上的正烷基链的增长,反应转化率逐渐增大,e.e.(P-)值和E值也逐渐升高。互为同分异构体的两种离子液体之间,带有支链烷基的离子液体中的反应转化率较高,但是反应的手性选择性较低。
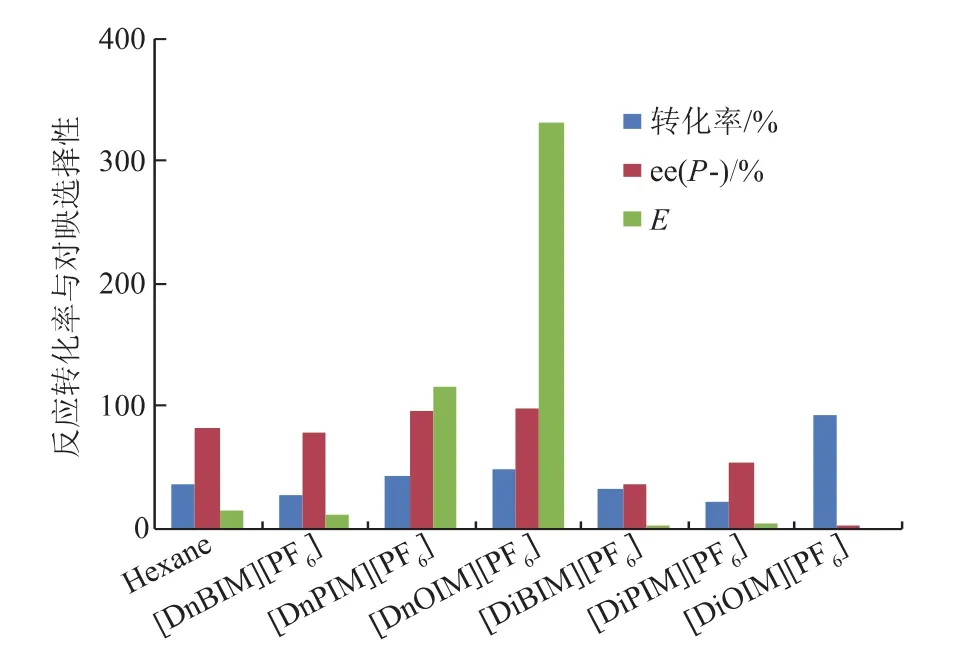
图3 不同反应介质中(±)-薄荷醇酯化反应转化率与对映选择性之比较Fig.3 Comparisonofesterificationconversion,enantiomeric excess and enantiomeric ratio(E)of(±)-menthol in different solvents
为了进一步研究离子液体结构对酶行为的影响,测定了各离子液体在25℃时的黏度和极性,见表1。可知,[DnOIM][PF6]的极性最小,可能因此维持了酶分子表面的必需水层,阻止了酶肽链折叠结构里带电基团之间的静电作用和极性基团之间的偶极-偶极相互作用,提高了酶结构的柔韧性,因而导致了最优的选择性催化性能。虽然同为同分异构体的[DiOIM][PF6]的极性也较弱,但是其黏度最大,是[DnOIM][PF6]的近2倍,高黏度会减慢化学反应过程中热和质的传递,从而导致反应速率降低。然而酶在各反应体系中的最初反应速率显示,酶在[DiOIM][PF6]中的活性最高,最初反应速率为0.507 μmol/(mg·min),是[DnOIM][PF6](0.143 μmol/(mg·min))的3.5倍,是正己烷(0.131 μmol/(mg·min))的3.9倍。但是酶在[DiOIM][PF6]中的选择性却极低,e.e.(P-)值和E值分别只有2.05%与1.2,同比酶在[DnOIM][PF6]中的反应选择性最高,e.e.(P-)值和E值分别高达98.1%与332.7。这是因为当转化率大于50%时,酶的最适底物(-)-薄荷醇耗尽,此时酶也会慢速作用于另一种对映体(+)-薄荷醇,导致产物的光学纯度急剧下降。溶剂对酶的影响因素比较复杂,[DnOIM][PF6]的特殊空间构型可能促成了酶催化活性构象的转变,提供了酶发挥作用的友好微环境,所以立体选择性最优。
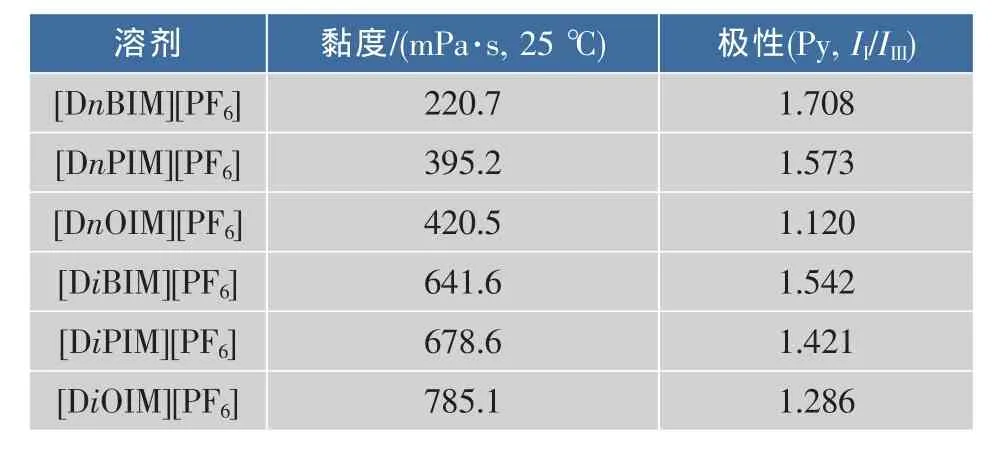
表1 离子液体的黏度和极性Table 1 Viscosities and polarities of various ionic liquids
2.2酶促反应条件的优化
以[DnOIM][PF6]为反应介质,加入70 mg脂肪酶CRL,底物(±)-薄荷醇与丙酸酐物质的量比率为1∶1,反应温度30℃条件下,转化率和立体选择性随反应时间的变化如图4所示。可以看出:反应时间在20 h前,转化率随着反应时间的延长而显著升高,20 h时的转化率为48.1%,而后增速趋于缓和,至48 h时达到最高(50.0%);而e.e.(p-)值随着反应时间的延长最初为小幅增加,至8 h时达到最高98.9%,然后随着反应时间的延长却逐步下降,20 h为98.1%,48 h时仅有93.8%。综合考虑,选择反应时间为20 h。
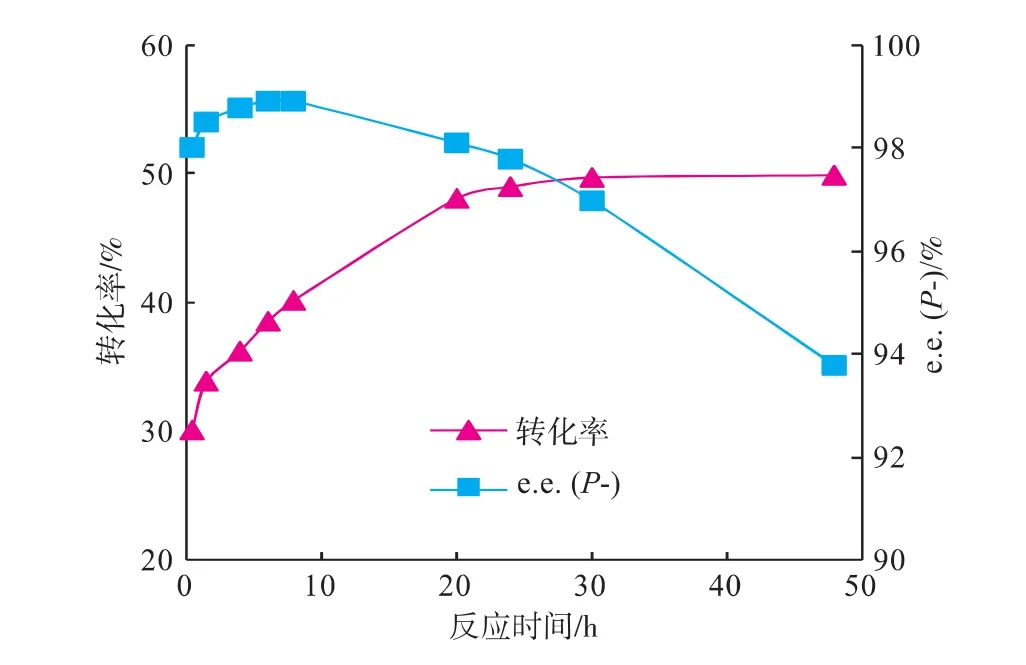
图4 反应时间对转化率和手性选择性的影响Fig.4 Effect of reaction time on the conversion and enantiomeric excess of menthol
温度是影响酶促反应的关键因素。固定以[DnOIM][PF6]为反应介质,加入70 mg脂肪酶CRL,底物(±)-薄荷醇与丙酸酐物质的量比率为1∶1条件下反应20 h,反应转化率和立体选择性随温度的变化如表2所示。可知,当反应温度低于30℃时,反应转化率随着反应温度的升高而增加,这可能是由于反应温度的升高使离子液体黏度降低和反应体系中活化分子数增加的缘故。反应温度在30℃时,转化率与e.e.(p-)值都达到最高,而超过30℃后反应的转化率降低,说明高温会使酶的活性构象受到破坏,从而导致酶活性降低。此外,随着温度的升高,分子的运动速率加快,(-)-薄荷醇的酯化反应活化能与(+)-薄荷醇的酯化反应活化能之间的差值减小,从而导致对映体过量值下降。故选择反应温度为30℃。
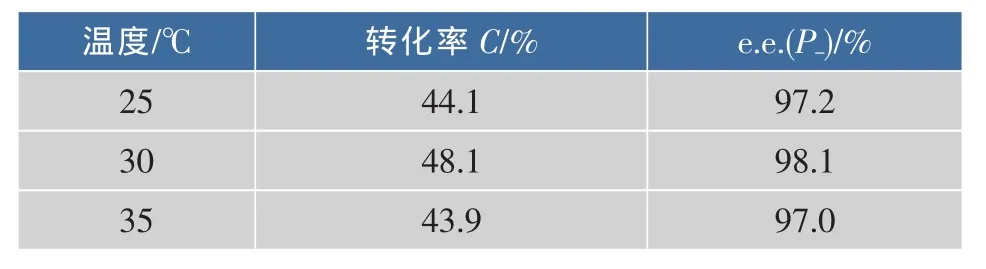
表2 温度对反应转化率和手性选择性的影响Table 2 Effect of temperature on the conversion and enantiomeric excess of menthol
以[DnOIM][PF6]为反应介质,温度为30℃,底物(±)-薄荷醇与丙酸酐物质的量比率为1∶1条件下反应20 h,考察脂肪酶的用量对酯化反应的影响,所得结果见图5。可知,随着酶加入量的增加,薄荷醇酯化速度加快,转化率增加,反应的e.e.(p-)值也随之增大,反应转化率和e.e.(p-)值分别在90 mg用量时和50 mg用量时达到最高值49.0%和98.6%。继续增加酶的用量,e.e.(p-)值反而下降。这是因为过量的酶会造成局部丙酸薄荷酯浓度过高,反而降低酶的催化效率。以(±)-薄荷醇酯化反应的手性选择性为优先考虑出发点,选择脂肪酶CRL的用量为70mg。
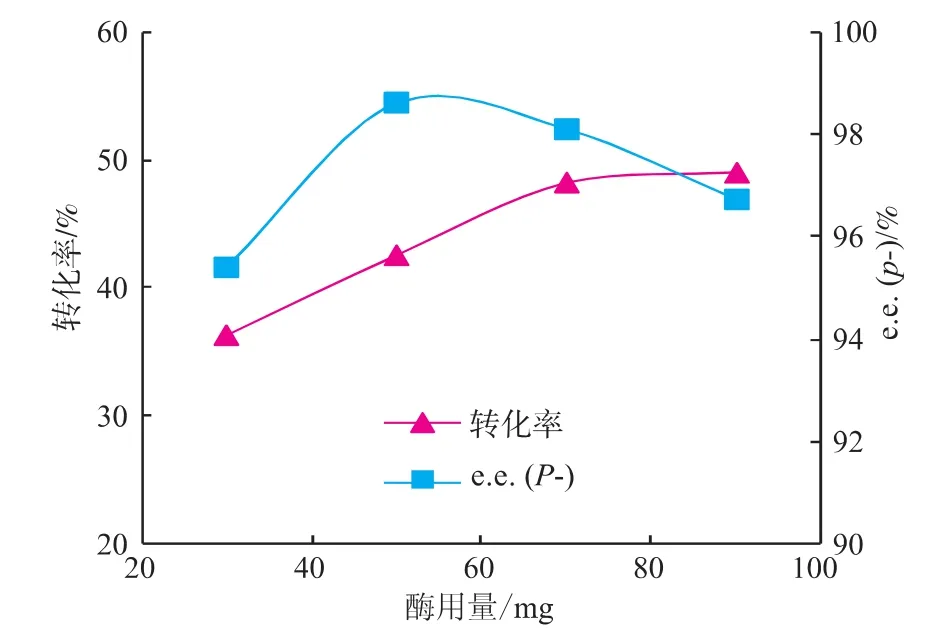
图5 脂肪酶用量对反应转化率和手性选择性的影响Fig.5 Effectoftheamountofthelipaseonthe conversion and enantiomeric excess of menthol
底物(±)-薄荷醇与丙酸酐物质的量比率对CRL催化酯化反应的影响如图6所示。随着丙酸酐物质的量增大,(±)-薄荷醇的转化率迅速升高,在摩尔比为2∶1时达到最高,但同时反应的e.e.(p-)值却显著下降。其原因可能是:在高浓度的丙酸酐存在时,大量酸酐的脱水作用致使酶的活性降低,同时反应产生高浓度的副产物丙酸也可能抑制酶活性,从而导致选择性明显下降。而在很低浓度的丙酸酐条件下,反应速率将会降低,同时随着反应进行酸酐量不断减少和反应产生丙酸的增加,使丙酸成为优势的酰基供体,而丙酸的酰化能力远低于丙酸酐,从而在反应结果上表现出转化率降低的现象。因此,选择酯化反应时底物酸酐和醇物质的量比率为1∶1。
固定反应温度为30℃,反应时间为20 h,脂肪酶CRL的用量为70 mg,底物(±)-薄荷醇与丙酸酐物质的量比率为1∶1条件下加入不同体积的[DnOIM][PF6]为反应介质,所得结果见图7。可以看出,随着离子液体用量的增加,反应的选择性逐渐增大,而反应转化率先下降而后上升。推测由于离子液体用量的增加,使得底物的浓度相应降低,因而底物分子之间的碰撞几率降低,同时底物周围能够结合上溶剂的酶分子也相应增多,导致反应的选择性增大。因此,选择离子液体的用量为3.0 mL。
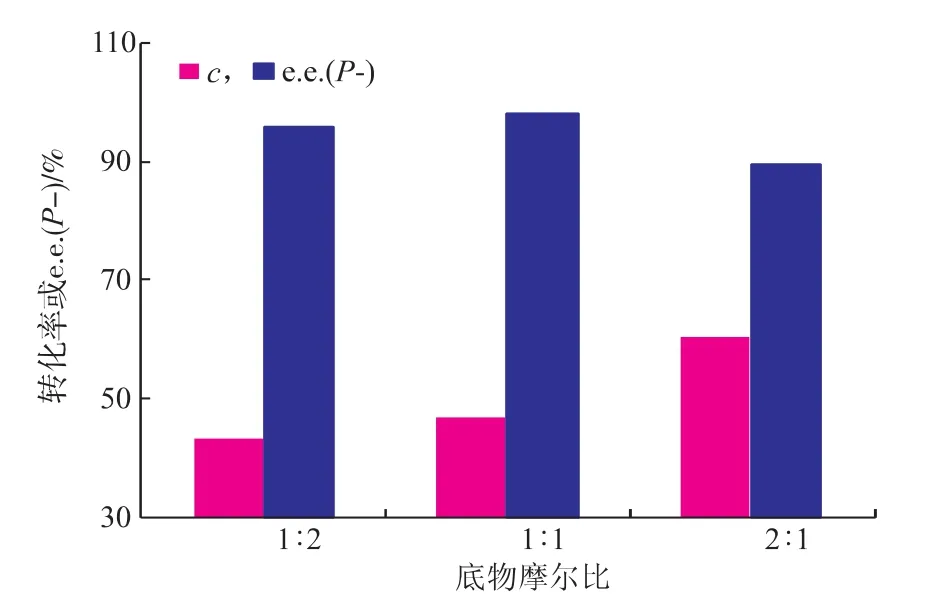
图6 底物物质的量比率对(±)-薄荷醇选择性酯化反应的影响Fig.6 Effectofthesubstratemolarratioonthe conversion and enantiomeric excess of(±)-menthol
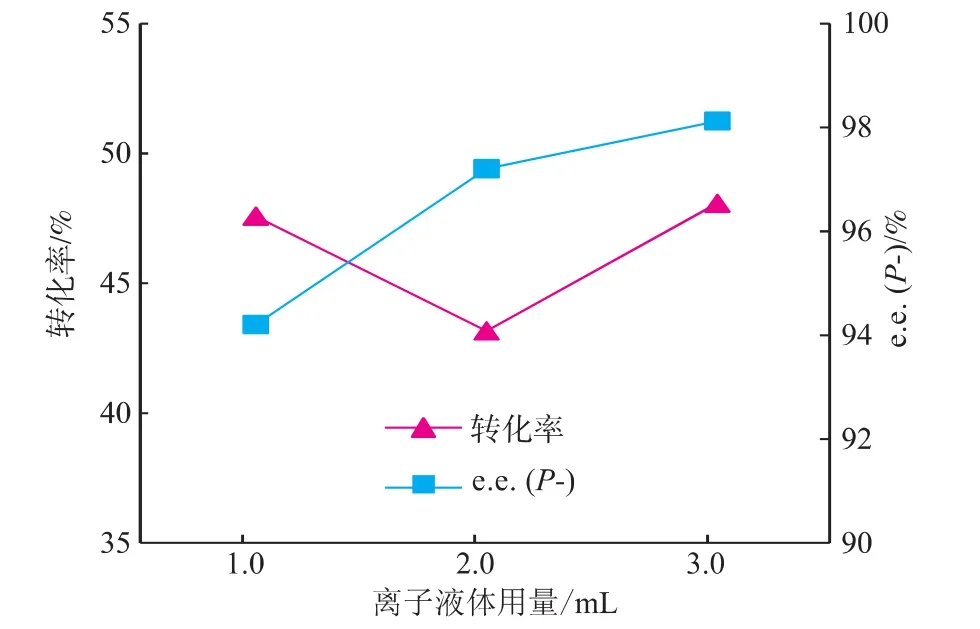
图7 离子液体用量对薄荷醇酯化反应的影响Fig.7 Effect of the amount of IL on the conversion and enantiomeric excess of(±)-menthol
2.3酶的稳定性
选择离子液体作为酶催化反应的一个重要标准是酶在离子液体中的稳定性。按照1.3.4的实验方法分别考察了脂肪酶CRL在[DnOIM][PF6]和正己烷中反应的半衰期,结果分别为270 h和63 h,表明酶在[DnOIM][PF6]中的稳定性是在正己烷中的4.3倍。为了观察脂肪酶CRL在有机溶剂和离子液体介质中的分子构象变化与所使用的介质性质的关系,分别测定了CRL在正己烷和离子液体中于最佳反应条件下反应后的荧光光谱,结果见图8。可知,
不同介质确实会导致脂肪酶CRL的荧光强度发生变化,在348 nm处CRL特征荧光发射峰强度在[DnOIM][PF6]介质中最高,在[DnPIM][PF6]与正己烷中其次,而在[DnBIM][PF6]中最低,荧光强度的增大间接表明酶蛋白质分子更加裸露,酶有可能更好地与底物结合。这与不同离子液体中脂肪酶对(±)-薄荷醇拆分的转化率与选择性的高低顺序相一致,CRL在[DnOIM][PF6]与[DnPIM][PF6]两种离子液体中显示出比在有机溶剂正己烷中更好的结构稳定性。可见,酶活性的表现与酶分子的构象变化有一定的相关性。离子液体使蛋白质分子构象的改变,有可能是酶催化活性改变的原因之一。
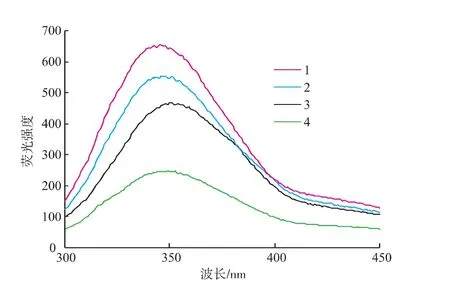
图8 脂肪酶CRL在离子液体与有机溶剂正己烷中的荧光光谱Fig.8 Fluorescence spectra of the lipase CRL in the ionic liquids and organic solvent hexane
圆二色光谱是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法。CD光谱的远紫外区段(178~250 nm)包含着生物大分子主链构象的信息[11]。图9显示了脂肪酶CRL及其在离子液体[DnOIM][PF6]介质中的CD谱。可以看出,离子液体对脂肪酶CD谱线产生了影响。与对照(纯酶)相比,在离子液体中反应后的脂肪酶CD谱线在197 nm处的吸收峰峰位发生了小的蓝移,峰值明显增大,但峰形基本不变。利用K2D2软件计算出在不同溶剂中反应20 h后脂肪酶的二级结构含量,如表3所示。可知,在不同溶剂中反应一定时间后的脂肪酶,其二级结构含量在一定的范围内发生了变化。与对照(纯酶)相比,不同溶剂中的α-螺旋含量均有减少,并按照[DnOIM][PF6]>[DnPIM][PF6]>正己烷>[DnBIM][PF6]的顺序依次减少;β-折叠含量均有一定程度的增加,但是α-helix和β-sheet的总含量按照α-螺旋含量减少的顺序依次减少;β-转角含量与无规卷曲含量没有一定的趋势,但是Loop(β-turn和random)的总含量均有增加,且按照[DnOIM][PF6]<[DnPIM][PF6]<正己烷<[DnBIM][PF6]的顺序依次增加。其中,以[DnOIM][PF6]中的CRL二级结构含量与纯酶最接近。

图9 脂肪酶CRL及CRL在离子液体[DnOIM][PF6]介质中的圆二色谱图Fig.9 Circular dichroism spectrometry of lipase CRL and in[DnOIM][PF6]medium
蛋白质的二级结构是指多肽链骨架中局部肽段的构象,α-螺旋和β-折叠结构中存在较多的氢键,导致规则二级结构具有一定的刚性;β-转角以及无规卷曲中不存在氢键或其他的相互作用,使肽段中的各个残基间有更大的自由度,从而表现出极大的柔性。合适的α-螺旋的含量、一定α/β的比率,以及Loop的含量与酶的特定的功能域的形成,以及酶的构象的变化是相关的,而酶的天然构象以及酶的特定的功能域对酶保持其活性十分重要[12]。如果α-螺旋度过大,由于α-螺旋结构紧密的特殊性,使其不利于酶形成活性中心,从而使底物不能与之结合,使酶假象失去活性;相反,如果α-螺旋度过小,就会彻底破坏酶蛋白质的氢键结构或其他结构而产生酶结构的不可逆破坏。而Loop是一个柔性极强的构象,Loop越多,它就有越多的机会运动到活性中心或是键合位点的上面,从而覆盖这些有可能与底物结合的位点,导致底物与酶结合的失败,从而使酶失去活性。因此,酶的天然构象改变越多,活性中心或是键合位点就越少,酶的活性越差。本研究结果说明,溶剂会影响脂肪酶分子内部的电荷分布,导致酶构象的改变。酶分子适当的柔性增加可能为酶的催化活力所必需,但如果柔性过大,就会使原有维系其螺旋结构的稳定性的氢键取向发生改变、结构过于松散,导致酶稳定性及活性降低。这也与酶在[DnOIM][PF6]中催化的初始反应速率和转化率明显高于其他溶剂中的结论相一致。
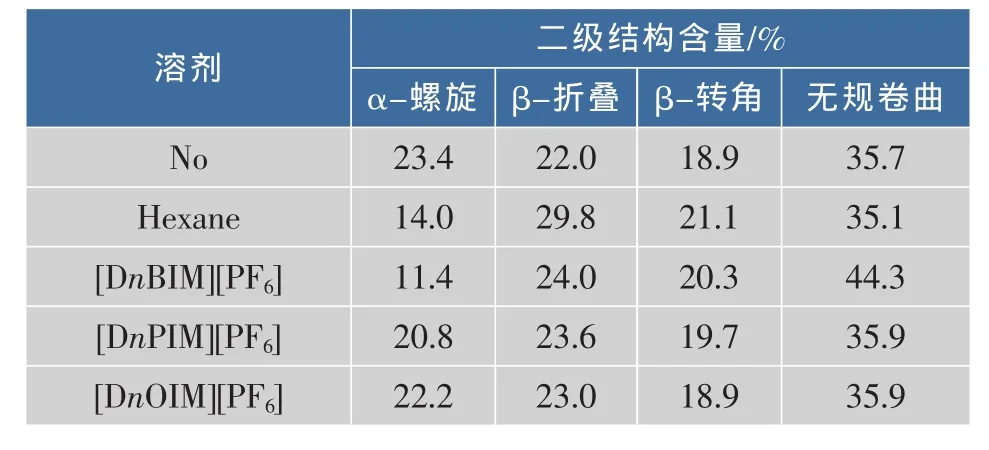
表3 不同溶剂中反应的脂肪酶CRL的二级结构含量Table 3 Contents of secondary structures of lipase CRL in different solvents
2.4离子液体及酶的重复利用
离子液体的优点之一在于它的蒸汽压低、挥发少而对环境友好,且可以回收并进行反复利用。为使操作更方便,在不分离酶的情况下,按照1.3.7的方法,利用多批次间歇反应来考察离子液体[DnOIM][PF6]和脂肪酶CRL的重复利用性,结果如图10所示。反应在初始的转化率设定为100%,每次回收试验后的结果用GC分析酯化反应得到,其转化率用相对转化率表示,选择性用相对对映体过量率表示。
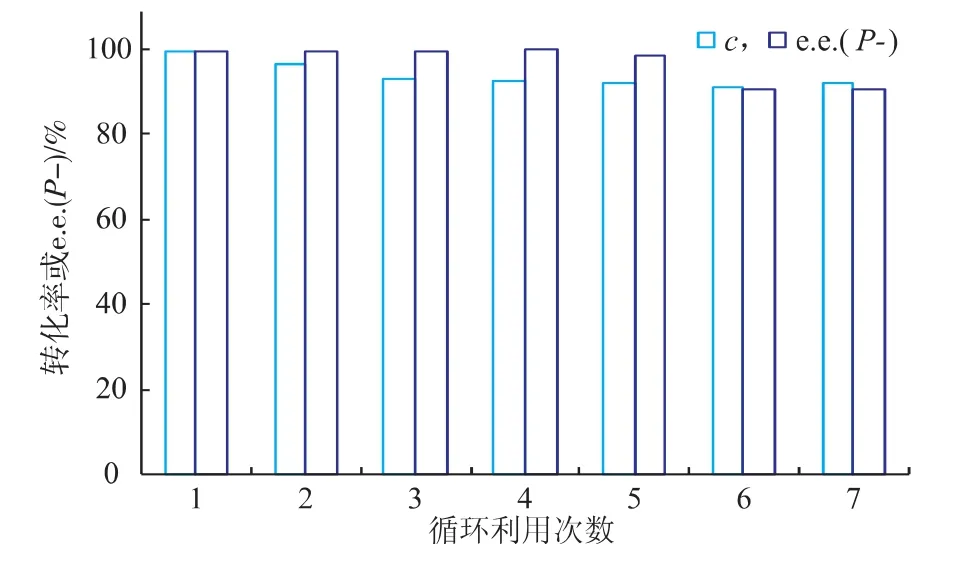
图10 离子液体与酶的重复使用Fig.10 Recycling of the ionic liquids and the lipase CRL
由图10可知,离子液体与脂肪酶CRL回收7次后,反应的相对反应转化率和相对对映体过量率都能保持在90%以上,催化活性没有显著降低。这表明离子液体[DnOIM][PF6]能提供脂肪酶CRL发挥作用的友好微环境,是生物催化的优良溶剂。
3 结语
离子液体阳离子尺寸与构型都会显著影响酶的活性。随着阳离子咪唑环1、3位N上正烷基链的增长,反应转化率逐渐增大,e.e.(P-)值和E值也逐渐升高;互为同分异构体的离子液体之间,带有支链烷基的离子液体中的反应转化率较高,但是反应的手性选择性较低。
酶在[DnOIM][PF6]中的活性、反应性与稳定性均显著高于在正己烷中,对映体选择率E值与半衰期分别是正己烷的21.6倍与4.3倍。
荧光光谱和圆二色谱研究结果表明,脂肪酶CRL在离子液体[DnOIM][PF6]中有较大的酶蛋白质分子裸露程度和良好的二级结构稳定性。
[1]Mc Coy M.Hot market for a cool chemical[J].Chemical and Engineering News,2010,88(35):15-16.
[2]Ashley M,Dixon M,Sisodiya A,et al.Lack of effect of menthol level and type on smokers'estimated mouth level exposures to tar and nicotine and perceived sensory characteristics of cigarette smoke[J].Regulatory Toxicology and Pharmacology,2012,63(3):381-390.
[3]Suankaew N,Matsumura Y,Saramala I,et al.L-Menthol crystal micronized by rapid expansion of supercritical carbon dioxide[J]. Journal of Industrial and Engineering Chemistry,2012,18(3):904-908.
[4]袁毅,白姝,姜晓妍.离子液体和有机溶剂中薄荷醇催化选择性酯化[J].化学工业与工程,2006,23(6):480-485.
YUAN Yi,BAI Shu,JIANG Xiaoyan.Lipase-catalyzed enantioselective esterification of(dl)-menthol in Ionic Liquids and organic solvents[J].Chemical Industry and Engineering,2006,23(6):480-485.(in Chinese)
[5]Chen H,Wu J P,Yang L R,et al.Characterization and structure basis of Pseudomonas alcaligenes lipase's enantiopreference towards D,L-menthyl propionate[J].Journal of Molecular Catalysis B:Enzymatic,2014,102(4):81-87.
[6]Brady D,Reddy S,Mboniswa B,et al.Biocatalytic enantiomeric resolution of L-menthol from an eight isomeric menthol mixture through transesterification[J].Journal of Molecular Catalysis B:Enzymatic,2012,75(1):1-10.
[7]Shah S,Gupta M N.Kinetic resolution of(+/-)-1-phenylethanol in[Bmim][PF6]using high activity preparations of lipases[J]. Bioorganic and Medicinal Chemistry Letters,2007,17(4):921-924.
[8]De Diego T,Lozano P,Gmouh S,et al.Understanding structure-stability relationships of Candida antartica lipase B in ionic liquids[J].Biomacromolecules,2005,6(3):1457-1464.
[9]Shimojo K,Nakashima K,Kamiya N,et al.Crown ether-mediated extraction and functional conversion of cytochrome C in ionic liquids[J].Biomacromolecules,2006,7(1):2-5.
[10]李明,方银军,李在均,等.新型对称烷基咪唑离子液体介质中酶催化合成l-乙酸薄荷酯[J].化学学报,2009,67(11):1252-1258.
LI Ming,FANG Yinjun,LI Zaijun,et al.Synthesis of l-Menthyl acetate catalyzed by lipase in new symmetrical 1,3-Dialkylimidazolium ionic liquids[J].Acta Chimica Sinica,2009,67(11):1252-1258.(in Chinese)
[11]沈琼,黄滨,邵嘉亮,等.运用圆二色谱研究酶与化合物相互作用的机理[J].中山大学学报,2006,45(4):62-64.
SHEN Qiong,HUANG Bin,SHAO Jialiang,et al.Mechanism discussion of interaction between enzyme and several compounds with circular dichroism method[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2006,45(4):62-64.(in Chinese)
[12]Chen Y H,Yang J T,Martinez H M.Determination of the secondary structures of proteins by circular dichroism and optical rotatory dispersion[J].Biochemistry,1972,11(22):4120-4131.
Lipase-Catalyzed Enantioselective Esterification of(±)-Menthol in Novel Ionic Liquids
LI Ming1,2,XU Xiaofeng3,LI Zaijun1,2,ZHU Ting2,PENG Yang2
(1.Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,Wuxi 214122,China;2.School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,China;3.Wuxi No.3 Senior High School,Wuxi 214028,China)
Six novel symmetrical alkylimidazolium hexafluorophosphate ionic liquids(ILs)were designed and synthesized in this study.The enantioselective esterification of(±)-menthol with propionic anhydride catalyzed by Canadida rugosa lipase was used as a model reaction to investigate the catalytic characterization of the lipase in different medium.The results indicated that the activity and selectivity of the lipase in the ionic liquid 1,3-di(n-octyl)imidazolium hexafluorophosphate([DnOIM][PF6])is obviously higher than that in other ILs and hexane.Therefore,[DnOIM][PF6]was chosen as the medium for the reaction.By investigating various factors on the conversion of(±)-menthol,the optimal conditions were determined as reaction temperature of 30℃,70 mg lipase,3.0mL ionic liquid,menthol and propionic anhydride with the molar ratio of 1∶1,and reaction performed for 20 h.Under this optimal condition,the conversion of(±)-menthol and enantiomeric excess of(-)-menthyl propionate was up to 48.1%and 98.1%,respectively.The stability of the lipase in IL was 4.3-fold than that in hexane.Furthermore,the activity of IL and the lipase were not substantial diminution after recycled 7 times.Meanwhile,fluorescence spectroscopy and circular dichroism results showed that the lipase in IL had bigger exposure levels of amino acid residues and excellent secondary structure stability.
ionic liquid,lipase,enantioselective esterification,(±)-menthol
TQ 426.97
A
1673—1689(2015)09—0935—08
2014-07-28
国家自然科学基金项目(21176101);国家“十二五”科技支撑计划项目(2011BAK10B00);浙江省自然科学基金项目(Y407321);江苏省“青蓝工程”资助项目。
李明(1975—),女,江苏淮安人,工学博士,副教授,主要从事天然香料提取、分析及绿色合成研究。E-mail:leeming@jiangnan.edu.cn
李在均(1964—),男,四川苍溪人,工学博士,教授,主要从事功能分子和材料的设计、制备及应用研究。E-mail:zaijunli@263.net

