经微酸性电解水处理的鲜切皇冠梨上的单增李斯特菌生长模型的建立
萨仁高娃,胡文忠,修志龙,姜爱丽,冯 可
(1.大连理工大学生命科学与技术学院,辽宁大连116024;2.大连民族学院生命科学学院,辽宁大连116600)
经微酸性电解水处理的鲜切皇冠梨上的单增李斯特菌生长模型的建立
萨仁高娃1,胡文忠2,*,修志龙1,姜爱丽2,冯可1
(1.大连理工大学生命科学与技术学院,辽宁大连116024;2.大连民族学院生命科学学院,辽宁大连116600)
为了研究鲜活农产品物流过程中单增李斯特菌(L.monocytogenes,LM)的生长动态并研发综合防控技术,本实验建立了经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上LM生长的初级模型。采用Matlab软件拟合在经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上LM生长的Gompertz和Logistic模型,获得了相应的模型参数,即最大比生长速率(U)、延滞期(LPD)和最大细胞密度(MPD)。结果表明:LM在鲜切皇冠梨上可以生长;比较决定系数发现,除了26℃下,LM经微酸性电解水处理的鲜切皇冠梨上的生长用Logistic模型能更好的拟合,其他均用Gompertz模型能更好的拟合本实验的数据;微酸性电解水具有杀菌功效,和不处理组相比,LM在经微酸性电解水处理后,减少了1.7 lg cfu/g;弱碱性电解水是一种具有保健功能的水,不具有杀菌作用。
单增李斯特菌,鲜切皇冠梨,酸性电解水,生长模型
李斯特菌(Listeria)是一种典型的胞内寄生的革兰氏阳性短杆菌,共分为2个群,7个种[1]。其中单增李斯特菌(L.monocytogenes,LM)被认为是引起动物和人类李斯特菌病的主要致病菌[2]。从临床表现来看,李斯特菌病能引起人和动物脑膜炎、败血症;引起妊娠感染,甚至导致孕妇流产,热性胃肠炎以及肝炎等,临床死亡率高[3]。现在,我国初步建立了LM的生长预测模型,大多数建立的是LM在营养肉汤、冷鲜畜禽肉及其肉制品上的生长预测模型[4-5]。国外对LM的研究很广泛,建立了LM在新鲜果蔬、畜禽及其制品、水产品和乳制品上的生长模型[6-9],但多数研究致力于国外市场上普遍存在的果蔬。皇冠梨是我国市场上常见的水果,存在被LM侵染的威胁,所以研究LM在鲜切皇冠梨上的生长情况及控制技术十分必要。国内针对LM的控制技术研究也较少,主要有温度、超高压协同温度处理[10]、温度及气调包装[11]等物理控制技术。酸性电解水(Acidic electrolyzed water,AEW)是现今广泛使用的杀菌液,制备方法是以离子交换膜电解食盐水,在阳极即产生了酸性电解水。由于阳极产生的水含有高活性O2、Cl2、HClO及高浓度的氢离子,所以具有很强的氧化性,能有效地杀灭细菌[12]。电解食盐水的同时,在阴极产生了弱碱性电解水,这是一种安全的保健水,可以调节人体酸碱度,维持体内酸碱平衡,渗透性强,能将体内代谢废物带出体外,可清除体内的自由基,含有多种对人体有益的矿物元素,可降低血糖和血脂水平。但还没有研究显示其有杀菌功效。基于现阶段研究的局限性,本文建立经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上LM生长的初级模型,旨在为LM在鲜活农产品物流过程中的动态变化及研发综合防控技术提供理论依据。
1 材料与方法
1.1材料与仪器
菌株LM标准菌株为本实验室保存菌株;0.1%蛋白胨水取1 g蛋白胨溶解于1000 mL蒸馏水中,校正pH至7.0后分装到三角瓶和试管中,121℃高压灭菌15 min,备用;含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、含0.6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE) 青岛海博生物技术有限公司;牛津琼脂(OXA)基础青岛海博生物技术有限公司,取5.85 g OXA,加热溶解于100 mL蒸馏水中,121℃高压灭菌15 min,冷至50℃时,加入1支牛津琼脂添加剂(多粘菌素E 2 mg、放线菌酮40 mg、吖啶黄素0.5 mg、头孢双硫唑甲氧0.2 mg、磷霉素1 mg),混匀,倾入无菌平皿,备用;微酸性电解水(pH约为6.5)、弱碱性电解水(pH约为8.0) 由多功能电解制水机制得;无菌水蒸馏水121℃高压灭菌15 min,冷却,备用;Lysis Buffer for Microorganism to Direct PCR、引物、ddH2O、10×PCR buffer、MgCl2、dNTP、Tag DNA聚合酶均购自宝生物工程(大连)有限公司。
1300系列A2型二级生物安全柜美国Thermo Fisher Scientific公司;HR40-IIA2二级生物安全柜青岛海尔特种电器有限公司;MLS-3020型全自动高压蒸汽灭菌器日本SANYO公司;BagMixer-400W型均质器法国Interscience公司;AB135-S型分析天平瑞士METTLER TOLEDO公司;TGL-20M型高速台式冷冻离心机湘仪离心机仪器有限公司;Acolsuper全自动菌落计数仪英国Synbiosis公司;TK7505型多功能电解制水机日本Panasonic公司;DNP-9052型电热恒温培养箱上海精宏实验设备有限公司;HYC-326A型医用冷藏箱青岛海尔特种电器有限公司;YLE-1000型电热恒温水浴锅北京东方精瑞科技发展有限公司;Thermo Scientific Arktik热循环仪美国Thermo Fisher Scientific公司;DYCP-31F型电泳仪北京市六一仪器厂。
1.2实验方法
1.2.1原菌液的制备在无菌室的生物安全柜里以无菌操作取TSA-YE斜面上的标准菌株,在TSA-YE无菌平板上平行划线,36℃培养24~48 h活化。挑取单菌落接种于含有10 mL无菌TSB-YE的试管中,充分混匀,将试管放入36℃培养箱,培养24~48 h,在4℃,5000×g条件下离心5 min后,弃去上清。沉淀用0.1%蛋白胨水冲洗,此过程在冰浴中进行。冲洗后在4℃,5000×g条件下离心5 min,弃上清。重复上述冲洗过程3次,最终得到浓度约为107cfu/mL的菌悬液,即原菌液,4℃保存,备用[7]。
1.2.2样品制备在无菌室内,将皇冠梨用无菌水洗净,再用医用酒精将表面擦拭干净。待酒精挥发后,用无菌刀将皇冠梨去皮、去核,切成0.5 cm×0.5 cm× 0.5 cm的小块。均匀取400 g样品,每100 g置于一个无菌容器中。分别接种10 mL浓度约为107cfu/mL的LM悬液于4个容器(1、2、3、4号)中的皇冠梨样品上,充分混匀。所有接种样品在生物安全柜中干燥1 h[7]。
1.2.3样品处理在无菌室内的生物安全柜里,分别加300 mL微酸性电解水、弱碱性电解水和无菌水于2、3、4号无菌容器中,搅拌浸泡15 min[13],1号容器中的样品作为对照,不处理。将对照组和处理组的样品每10 g分装在一个无菌均质袋中,标记后置于36℃恒温培养箱中培养。每隔一定时间取出相应标记的样品,加入90 mL经高压灭菌的0.1%蛋白胨水,在拍击式均质机上连续均质1 min,取上清菌悬液,用涂布平板培养法[14]计活菌数,平板用全自动菌落计数仪分析计数,其中每个处理做一个平行实验。
同样方法将分装好样品的无菌均质袋分别放入4℃和26℃培养,每隔一定时间取出相应标记的样品,按上述方法处理,用平板涂布培养法计数,用全自动菌落计数仪分析。
1.2.4菌落验证挑取牛津琼脂计数平板上有棕黑色晕环的可疑单菌落于TSA-YE平板上划线纯化,36℃培养24 h。挑取纯化后的单菌落于5 mL TSB-YE培养基中,36℃培养24 h。取1 mL菌液,同时加入50 μL Lysis Buffer for Microorganism to Direct PCR,80℃热变性30 min,低速离心30 s。将上清转移至无菌离心管中作为PCR反应的模板。根据参照于旖斯等[15]的方法,LM的hlyA基因核苷酸序列设计引物:
hly-1:5’-GCCAGGTATGACTAATCAAGACAA-3’hly-2:5’-CGAAAAATCTGGAAGGTCTTGTAG-3’取0.2 mL离心管,分别加入29.5 μL ddH2O,5 μL 10×PCR buffer,4 μL MgCl2,4 μL dNTP,5 μL模板,1 μL hly-1,1 μL hly-2,0.5 μL Tag酶,低速离心30 s,置于PCR仪中,反应条件为95℃3 min预变性,94℃30 s,51℃30 s退火,72℃30 s延伸,32个循环,72℃7 min,4℃保存,反应体系为50 μL。将PCR产物进行琼脂糖凝胶电泳。
1.2.5初级模型构建及统计分析建立Gompertz模型和Logistic模型,选择最合适的模型得出LM在经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的生长曲线,并得到相应的初级模型参数。
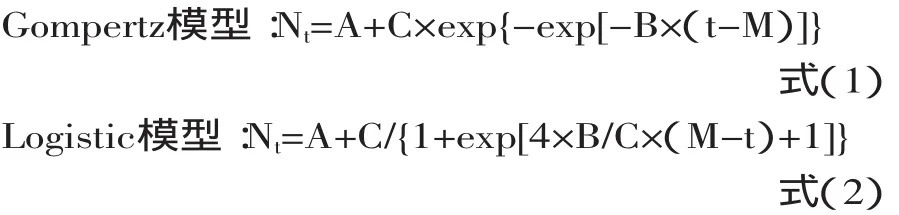
式中:t表示时间(h);Nt表示t时的菌数;A表示初始菌数N0(lg cfu/g);C表示最大菌数Nmax与初始菌数N0的差值(lg cfu/g);B为在时间点M时的相对最大生长速率(h-1);M表示达到最大生长速率所需的时间(h)。
模型用Matlab软件拟合,采用SPSS 17.0进行数据分析,用Microsoft Office Excel 2007作图。
2 结果与讨论
2.1初级模型的选择
经微酸性电解水、弱碱性电解水、无菌水处理和未处理的鲜切皇冠梨上LM生长的Gompertz模型在不同温度下的拟合很好,决定系数均在0.98以上,Logistic模型拟合较Gompertz模型差,均在0.91以上,结果见表1。结果显示,除了26℃下,LM经微酸性电解水处理的鲜切皇冠梨上的生长用Logistic模型能更好的拟合,其他均用Gompertz模型描述更好,因此,选用Gompertz模型建立初级模型。
2.2生长曲线
4、26和36℃下,Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线见图1~图3。由图1~图3可知,LM在鲜切皇冠梨上可以生长,因为鲜切果蔬的加工操作(如去皮、切割及切片等)会使果蔬的组织结构破坏、营养成分外流,极有利于微生物生长繁殖。LM在经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上生长情况不如未处理组,原因是稀释作用导致单位体积菌数减少,初始菌数降低使LM生长受到影响,此结果与其他研究结果相同[16];此外,残留的处理液对LM的杀菌作用导致处理组生长情况不如未处理组。
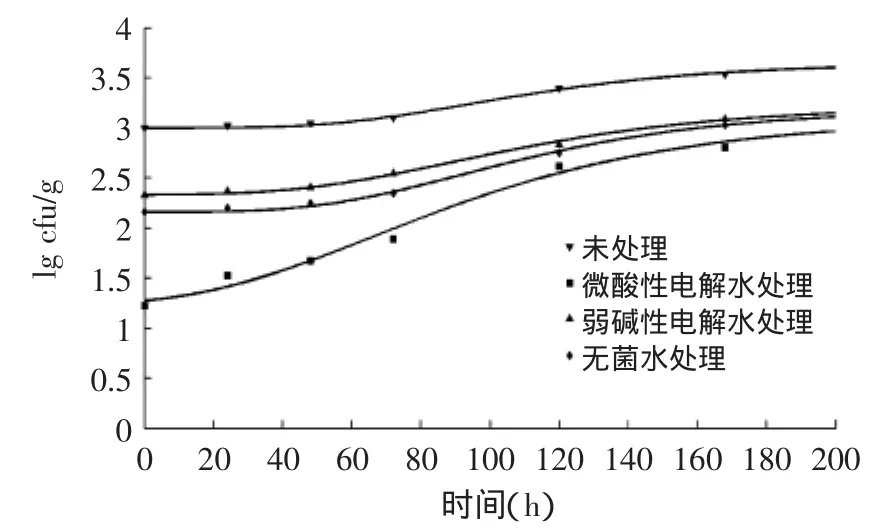
图1 4℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线Fig.1 Gompertz growth model of L.monocytogenes on fresh-cut pearsprocessedbysubacidityandalkalescenceelectrolysedwater,and sterile water at 4℃
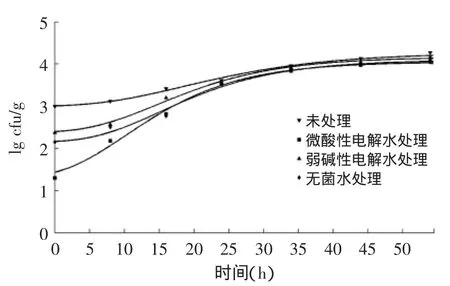
图2 26℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线Fig.2 Gompertz growth model of L.monocytogenes on fresh-cut pearsprocessedbysubacidityandalkalescenceelectrolysedwater,and sterile water at 26℃

图3 36℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线Fig.3 Gompertz growth model of L.monocytogenes on fresh-cut pearsprocessedbysubacidityandalkalescenceelectrolysedwater,and sterile water at 36℃
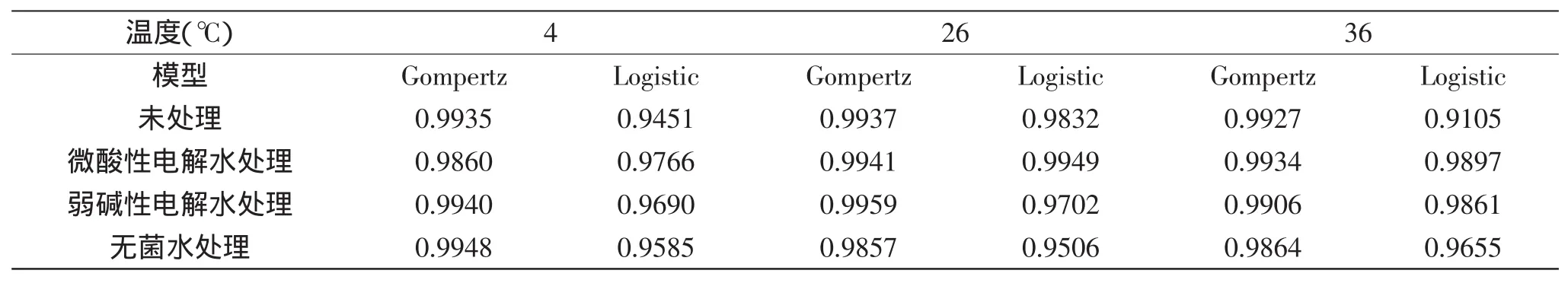
表1 处理后的鲜切皇冠梨上LM生长的Gompertz模型和Logistic模型的决定系数(R2)Table 1 The coefficient of determination(R2)of Gompertz and Logistic model of L.monocytogenes on fresh-cut pears after processing
2.3初级模型的模型参数
由Matlab软件拟合不同温度下经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线,得到相应的生长参数:最大比生长速率U(lg cfu/g·h)、生长延滞期LPD(h)和最大细胞密度MPD(lg cfu/g),结果见表2~表4。
可以看出在三个温度下,最大比生长速率U(lg cfu/g·h)顺序均为:微酸性电解水处理>无菌水处理>弱碱性电解水处理>未处理(4℃下,0.0136>0.0089>0.0073>0.0059;26℃下,0.1098>0.0748>0.0673>0.0388;36℃下,0.1997>0.1205>0.1133>0.1065),证明初始浓度越低,进入对数期以后生长速度越快。
在三个温度下,生长延滞期LPD(h)顺序均为:未处理>无菌水处理>弱碱性电解水处理>微酸性电解水处理(4℃下,53.7649>50.2181>44.2850>15.5458;26℃下,6.3662>5.5715>4.9444>1.1019;36℃下,4.6020>2.5493>2.3127>0.8271),说明初始浓度越低,延滞期越短,越能较快进入对数期,虽然无菌水处理的初始浓度比弱碱性电解水处理的初始浓度低,但无菌水处理的延滞期比弱碱性电解水处理的长,因为两个处理初始浓度很接近,所以延滞期长短也比较接近,还有可能因为弱碱性电解水中某些物质对LM生长产生影响,使其延滞期缩短。
在三个温度下,最大细胞密度MPD(lg cfu/g)的范围是3.0934~4.2625 lg cfu/g,说明LM虽然能在皇冠梨上生长,由于受到营养物质的限制,LM在皇冠梨上生长的MPD不能达到在营养肉汤中生长的MPD(4.0453~7.7709 lg cfu/g)[16]。
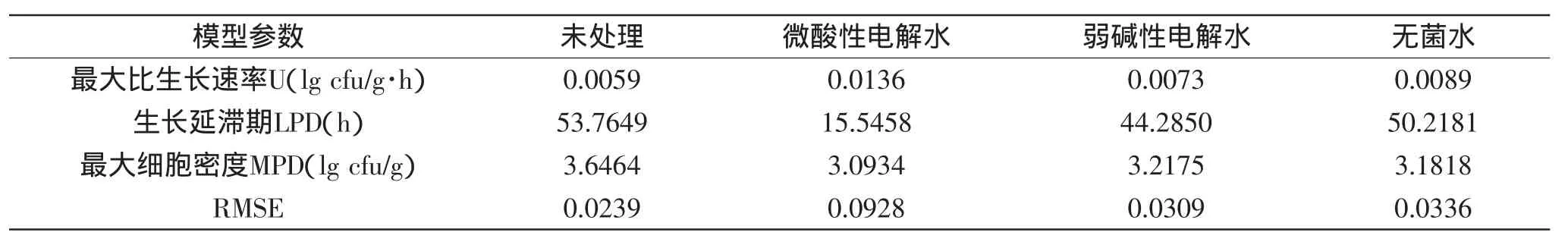
表2 4℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线的模型参数Table 2 Gompertz model parameters of L.monocytogenes on fresh-cut pears processed by subacidity and alkalescence electrolysed water,and sterile water at 4℃
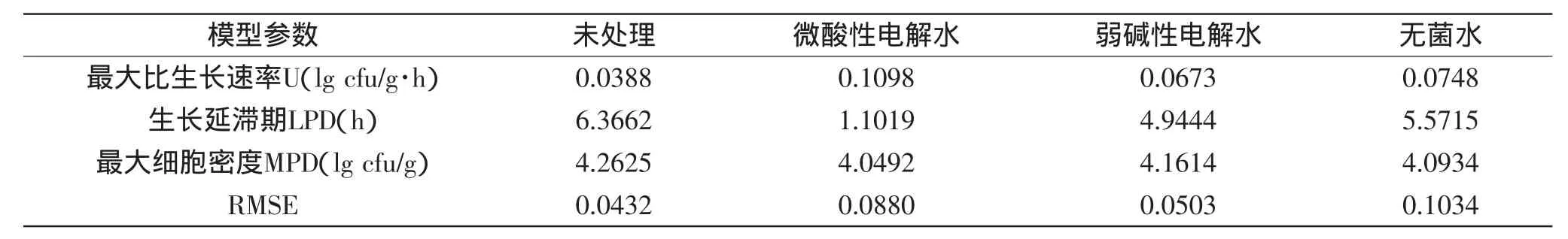
表3 26℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线的模型参数Table 3 Gompertz model parameters of L.monocytogenes on fresh-cut pears processed by subacidity and alkalescence electrolysed water,and sterile water at 26℃
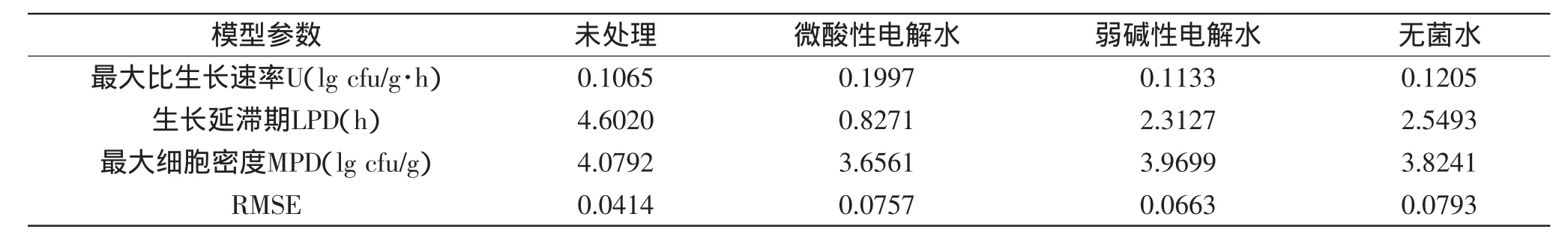
表4 36℃下Gompertz模型拟合的经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上的LM生长曲线的模型参数Table 4 Gompertz model parameters of L.monocytogenes on fresh-cut pears processed by subacidity and alkalescence electrolysed water,and sterile water at 36℃
从表2~表4可以看出,相同处理的LM在4℃下皇冠梨上的最大比生长速率小于在26℃的最大比生长速率(0.0136<0.1098,0.0089<0.0748,0.0073<0.0673,0.0059<0.0388),26℃的最大比生长速率小于36℃的最大比生长速率(0.1098<0.1997,0.0748<0.1205,0.0673<0.1133,0.0388<0.1065),证明随着温度升高,LM生长速度加快。
相同处理条件下,随着温度的升高,生长延滞期LPD(h)缩短。相同处理的LM在不同温度下皇冠梨上生长延滞期顺序为:微酸性电解水处理,4℃(15.5458)>26℃(1.1019)>36℃(0.8271),弱碱性电解水处理,4℃(44.2850)>26℃(4.9444)>36℃(2.3127),无菌水处理,4℃(50.2181)>26℃(5.5715)>36℃(2.5493),未处理,4℃(53.7649)>26℃(6.3662)>36℃(4.6020)。
从最大细胞密度MPD(lg cfu/g)可以看出,相同处理的LM在不同温度下皇冠梨上生长的MPD均在一定范围,即3.0934~4.2625 lg cfu/g,差异不显著。
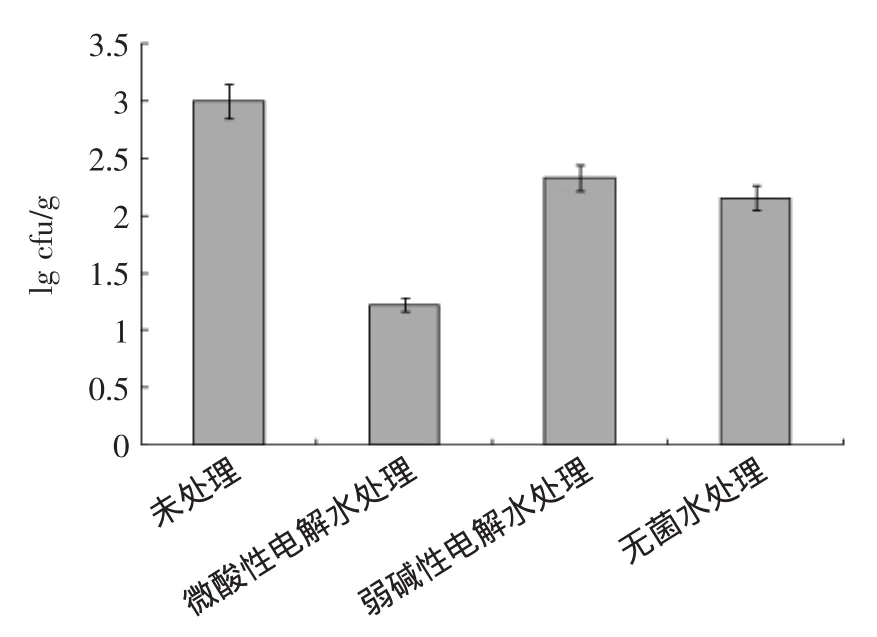
图4 不同处理后LM的对数菌落数Fig.4 The number of colony of L.monocytogenes on fresh-cut pears by different cleaning processes
不同处理后LM的对数菌落数比较见图4,可以看出,处理组比不处理组菌数减少,原因一是处理液的稀释作用,二是处理液的杀菌功能。处理效果最好的是微酸性电解水,比不处理减少了1.7 lg cfu/g。其次是无菌水,比不处理减少了0.8 lg cfu/g。最后是弱碱性电解水,比不处理减少了0.7 lg cfu/g。由于处理组每100 g样品加入处理液300 mL,搅拌浸泡后,稀释造成菌浓度最大可降低约0.6 lg cfu/g,所以,微酸性电解水杀死的菌数最少约为1.1 lg cfu/g,具有杀菌功能(p<0.05)。排除稀释造成的菌数减少后,无菌水和弱碱性电解水比不处理组分别减少0.2和0.1 lg cfu/g,杀菌效果不显著(p>0.05)。
2.4PCR验证结果
PCR电泳鉴定见图5,结果显示,待检样品在350 bp处出现一条特异性条带,与LM阳性对照条带位置一致。因此,可以确认计数菌落是LM而非其他杂菌。

图5 PCR电泳鉴定图Fig.5 The chart of electrophoresis appraisal about PCR
3 结论
利用Matlab的函数资源,拟合了经微酸性电解水、弱碱性电解水和无菌水处理的鲜切皇冠梨上LM生长的初级模型。本文分别拟合了Gompertz模型和Logistic模型,比较决定系数发现,Gompertz模型能更好的拟合本实验的数据。实验结果表明,微酸性电解水显示了较好的杀菌功效(p<0.05),而弱碱性电解水没有杀菌作用(p>0.05)。李华贞等[17]也研究了微酸性电解水杀灭LM的效果,结果也显示了微酸性电解水对LM的抑制作用。
本实验基于目前国内外LM生长预测模型研究的基础,建立了鲜切皇冠梨上LM生长的初级模型,LM在鲜切皇冠梨上可以生长。同时,还建立了经微酸性电解水、弱碱性电解水和无菌水三种处理的鲜切皇冠梨上LM生长的初级模型,为进一步在鲜活农产品上建立LM生长的二级模型和三级模型,研究其他鲜活农产品物流过程中LM生长动态,研发综合防控技术奠定了基础。
[1]王俊霞,王兴龙,秦兰柱.产单核细胞李斯特菌毒力因子及免疫预防研究进展[J].动物医学进展,2007,28(2):78-81.
[2]李郁,魏建忠,王桂军.产单核李斯特菌的研究进展[J].中国卫生检验杂志,2005,15(8):1018-1020.
[3]李翠云.单核细胞李斯特菌研究近况[J].中国热带医学,2010,10(1):120-122.
[4]张培培,刘媛,方春,等.单增李斯特菌在冷鲜猪肉中的生长预测模型比较[J].微生物学报,2010,51(12):1625-1631.
[5]丁甜,董庆利,王璐,等.单增李斯特菌在营养肉汤中最大生长速率的预测模型[J].华中农业大学学报,2010,29(4):522-526.
[6]A M Castillejo R,E Barco A,R M Garcia G,et al.Growth modeling of Listeria monocytogenes in packaged fresh green asparagus[J].Food Microbiology,2000,17(4):421-427.
[7]Anderson S S A,Bernadette D G M F,Donald W S.Modeling the growth rate and lag time of different strains of Salmonella enterica and Listeria monocytogenes in ready-to-eat lettuce[J]. Food Microbiology,2012,30(1):267-273.
[8]Ana L P,Mauro F F L.Growth of Listeria monocytogenes in melon,watermelon and papaya pulps[J].International Journal of Food Microbiology,2004,92(1):89-94.
[9]Shigenobu K,Seiichiro I.Growth of Listeria monocytogenes on iceberg lettuce and solid media[J].International Journal of Food Microbiology,2005,101(2):217-225.
[10]Vazquez-Boland J A,Kuhn M,Berche P,et al.Listeria pathogenesis and molecular virulence determinants[J].Clinical Microbiology Reviews,2001,14(3):584-640.
[11]刘柳,孔保华.温度及气调包装对冷却猪肉中单核细胞增生性李斯特氏菌生长的影响[J].食品科学,2008,29(1):334-337.
[12]冮洁,胡文忠.鲜切果蔬的微生物污染及其杀菌技术[J].食品工业科技,2009,30(6):319-324.
[13]Hua W,Hao F,Yaguang L.Dual-phasic inactivation of EscherichiacoliO157∶H7withperoxyaceticacid,acidic electrolyzed water and chlorine on cantaloupes and fresh-cut apples[J].Journal of Food Safety,2006,26(4):335-347.
[14]李平兰,贺稚非.食品微生物学实验原理与技术[M].北京:中国农业出版社,2005:42-44.
[15]于旖斯,侯红漫,张宇,等.七类食品单核细胞增生性增李斯特菌污染状况调查[J].食品工业,2010(1):21-23.
[16]萨仁高娃,胡文忠,高春红,等.不同初始浓度的单增李斯特菌在营养肉汤中生长预测模型的建立[J].食品工业科技,2013,34(17):173-176.
[17]李华贞,刘海杰,宋曙辉,等.微酸性电解水杀灭菠菜表面微生物的影响因素[J].食品科学,2011,32(17):95-99.
Growth model development of Listeria monocytogenes on fresh-cut pears treated with subacidity electrolyzed water
SAREN Gao-wa1,HU Wen-zhong2,*,XIU Zhi-long1,JIANG Ai-li2,FENG Ke1
(1.College of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024,China;2.College of Life Science,Dalian Nationalities University,Dalian 116600,China)
The predictive model of contaminative fresh-cut pears processed by acidic electrolyzed water(AEW),alkalescence electrolyzed water and sterile water was established to research the growth dynamics of Listeria monocytogenes on fresh agriculture product in logistics process.The data were fit by Gompertz and Logistic model by Matlab software.Parameters from the models were observed,such as maximum specific growth rate(U),lag phase(LPD),maximum population density(MPD).The result demonstrated that L.monocytogenes was able to grow on fresh cut pears.Logistic model showed that a high coefficient of determination for fresh-cut pears inoculated under subacidity electrolyzed water processing at 26℃,while the coefficient of determination of the Gompertz model was higher than that of Logistic model at 4 and 36℃.L.monocytogenes inoculated at fresh-cut pears could decrease 1.7 lg cfu/g by subacidity electrolyzed water processing.Disinfection ability of subacidity electrolyzed water was better than control sample.Alkalescence electrolyzed water had a certain healthcare function,it had not disinfection function.
Listeria monocytogenes;fresh-cut pears;electrolyzed water;growth modeling
TS201.3
A
1002-0306(2015)16-0328-05
10.13386/j.issn1002-0306.2015.16.058
2014-10-08
萨仁高娃(1987-),女,博士研究生,研究方向:食品质量与安全,E-mail:kuailexiaosa@sina.com。
胡文忠(1959-),男,博士,教授,研究方向:食品加工与质量安全,E-mail:hwz@dlnu.edu.cn。
国家科技支撑计划项目(2012BAD38B05);国家自然科学基金项目(31172009);大连市科技计划项目(2012E13SF106);大连市金州新区科技计划项目(2012-A1-049)。

