藜麦总黄酮提取及大孔树脂纯化工艺的研究
董施彬,宁亚萍,杨 喆,张乔会,董洁琼,王丰俊,王建中
(北京林业大学生物科学与技术学院,北京林业大学林业食品加工与安全北京市重点实验室,北京100083)
藜麦总黄酮提取及大孔树脂纯化工艺的研究
董施彬,宁亚萍,杨喆,张乔会,董洁琼,王丰俊,王建中*
(北京林业大学生物科学与技术学院,北京林业大学林业食品加工与安全北京市重点实验室,北京100083)
目的:研究藜麦总黄酮的提取工艺与大孔树脂纯化工艺。方法:在单因素实验的基础上,通过正交实验法,研究藜麦总黄酮的最佳提取和纯化工艺。结果:最佳提取工艺条件为:超声时间25 min、温度90℃、料液比1∶10(g/mL)、回流时间为2 h、乙醇浓度90%。此条件下,藜麦总黄酮提取量为3.861 mg/g。盐析除蛋白,选择NaCl添加量为15%。最佳大孔树脂纯化工艺为:pH2、流速2 BV/h、0.3 mg/mL的黄酮水溶液上样、8 BV水洗、丙酮洗脱。此条件下,纯化黄酮吸附率为80.91%。纯度可由初提物的7.12%提高到28.53%。
藜麦,总黄酮,乙醇提取,大孔树脂纯化
藜麦(Chenopodium quinoa),又称南美藜、藜谷、奎奴亚藜等,是一种1年生的藜科草本作物。原产于南美洲安第斯山脉,中国于1987年由西藏农牧学院和西藏农科院开始引种实验研究。如今山西静乐正在大规模的实验种植藜麦,开启了中国藜麦规模化种植的历程。藜麦黄酮可以从提取油脂后的饼粕中提取。目前,关于藜麦黄酮的提取工艺和大孔树脂纯化的研究尚无相关文献报道。
研究者已用不同方法从银杏(Ginkgo biloba)[1]、甘薯(Ipomoea batatas)[2]、花生(Arachis hypogaea)[3]、大蒜(Allium sativum)[4]、荞麦(Fagopyrum esculentum)[5]、小白菜(Brassica rapa chinensis)[6]、金银花(Lonicera japonica)[7]以及豆科(Leguminosae)[8]等植物中进行了黄酮提取和含量测定。Zhu等[9]从藜麦种子中分离出6种黄酮类化合物。藜麦粒含丰富的黄酮类物质,其含量约是大米的十倍与大豆总黄酮含量相当。黄酮和维生素E组合可明显促进糖、脂代谢和胰岛素分泌,对糖尿病的治疗作用明显。
目前,分离黄酮的方法很多。如色谱法、萃取技术、大孔吸附树脂法、膜分离技术、离心技术[10]等。由于大孔树脂理化性质稳定,不溶于酸碱及有机溶剂,对提取物兼有分离和筛选作用,且不受无机盐类及强离子、低分子化合物的干扰,吸附效果好,再生简便,使用周期长,被广泛应用于天然产物的分离纯化。本实验主要针对藜麦黄酮的超声辅助醇提工艺、大孔树脂纯化工艺展开研究,旨在探索最佳提取工艺条件和最佳纯化工艺条件。
1 材料与方法
1.1材料与仪器
去壳白藜麦山西静乐;芦丁标准品(纯度98.0%)
Sigma公司;牛血清白蛋白上海永叶公司;无水乙醇、亚硝酸钠、硝酸铝、氯化钠、考马斯亮蓝等均为国产分析纯,北京kebio公司;AB-8、D101、HPD400、D001型大孔吸附树脂北京科百奥试剂公司。
T6型紫外可见分光光度计北京谱析通用仪器有限公司;FA10004A型电子天平精天精密仪器厂;R-205型旋转蒸发器上海申顺生物科技有限公司;H/T 16MM型离型机湖南赫西仪器;JAC-600型超声器济宁奥波超声电气有限公司;HY-4A型振荡器江苏省金坛市荣华仪器制造;pHSJ-3F型pH计上海泸西分析仪器;BS-100A型自动收集器上海泸西分析仪器;HHS型恒温水浴锅上海博迅有限公司;蛇形管冷凝回流装置北京kebio公司;BT600S型恒流泵雷弗流体科技有限公司。
1.2实验方法
1.2.1原料前处理称取500 g藜麦粉碎过20目筛,加入石油醚(沸程60~90℃)料液比1∶5(g/mL),摇床振荡5 h,抽滤,重复两次。除去大部分脂类物质后,为减少石油醚残留,室温真空干燥24 h,充分挥干石油醚。
1.2.2工艺流程脱脂藜麦粉(20目)→90%乙醇浸提→超声25 min→90℃加热回流→真空抽滤→滤液旋蒸成水相→盐析除蛋白(15%NaCl)→5500 r/min离心10 min→取上清液→调pH至2→大孔树脂(D101)上样→水洗(8 BV)→丙酮洗脱→纯化总黄酮。
1.2.3黄酮测定方法采用NaNO2-Al(NO3)3比色法[11]测定黄酮含量。精确称取0.0100 g芦丁标准样品,用体积分数60%乙醇溶解,并定容至50 mL,配制得质量浓度0.2 mg/mL的芦丁标准溶液。准确吸取0、0.4、0.8、1.2、1.6、2.0 mL芦丁标准溶液,放入10 mL容量瓶内,分别加入2.0、1.6、1.2、0.8、0.4、0 mL的60%乙醇溶液;再加入5%亚硝酸钠溶液0.5 mL摇匀,放置6 min;加入10%硝酸铝溶液0.5 mL,放置6 min后;加入4%氢氧化钠溶液4.0 mL,加60%乙醇定容,摇匀后,放置15 min;进行全波长扫描,得到最大吸收波长510 nm,于此波长检测。
上述0 mL芦丁标准溶液样作为空白,用芦丁浓度作为纵坐标,510 nm下的吸光值作为横坐标绘制标准曲线。依结果芦丁标准曲线回归方程y=0.0897x+ 0.0005(R2=0.9999)计算总黄酮含量。
1.2.4藜麦中总黄酮含量的测定方法准确吸取样品液1 mL于10 mL比色管中,按照芦丁标准曲线制作方法测定吸光度。由吸光度根据回归方程计算出质量浓度(C),然后由质量浓度计算出藜麦中的黄酮提取量,计算公式如下:
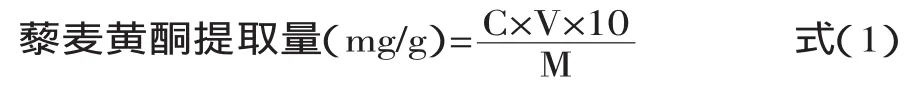
式中,V为提取液体积(mL);M为脱脂藜麦粉质量(g)。
1.2.5盐析浓缩除可溶蛋白盐析前后用考马斯亮蓝G-250测可溶蛋白[12],利用牛血清白蛋白绘制标准曲线。取0.2 mL样品液加入考马斯亮蓝染液5.8 mL混匀,静置3 min在波长595 nm处测量吸光度;依蛋白标准曲线的回归方程y=255.53x-0.6384(R2=0.9991)计算可溶性蛋白含量。黄酮保留率的计算,利用盐析后总黄酮含量除以盐析前总黄酮含量,即得到黄酮保留率。
1.2.6提取单因素实验
1.2.6.1超声时间对提取量的影响称取样品2 g于离心管中分别设定超声时间为0、5、10、15、20、25、30 min的实验组,功率为300 W,乙醇浓度为80%,料液比为1∶10(g/mL),回流温度为90℃,时间为1 h。
1.2.6.2乙醇浓度对提取量的影响分别设定乙醇体积分数为40%、50%、60%、70%、80%、90%、100%,超声时间为25 min,功率300 W,料液比为1∶10(g/mL),回流温度为90℃、时间为1 h,确定最佳乙醇浓度。
1.2.6.3料液比对提取量的影响分别设定料液比为1∶5、1∶10、1∶20、1∶40、1∶80(g/mL),超声时间为25 min,功率300 W,乙醇体积分数为80%,回流温度90℃、时间为1 h,确定最佳的料液比,回流前后测量体积确保料液比一致。
1.2.6.4温度对提取量的影响分别设定温度为40、50、60、70、80、90、100℃,超声时间为25 min,功率300 W,乙醇体积分数为80%,回流时间为1 h,料液比为1∶10(g/mL),确定最佳回流温度。
1.2.6.5回流时间对提取量的影响分别设定回流时间为0、1、2、3、4、5 h,超声时间为25 min,功率300 W,乙醇体积分数为80%,回流温度为90℃,料液比为1∶10(g/mL),确定最佳回流时间。
1.2.7正交实验设计选取乙醇浓度、料液比、提取温度和提取时间组成复合提取条件,每个因素设置三个水平,采用L9(34)进行正交实验(如表1)得出优化的提取条件。

表1 正交实验因素水平设计表Table 1 Factors and levels of orthogonal experiments
1.2.8浓缩盐析除可溶性蛋白50℃真空旋蒸提取液浓缩比为6∶1,加入1体积的纯水,再分别加入5%、10%、15%、20%、25%、30%、35%、40%的NaCl,静置30 min,5500 r/min离心10 min,取上清液测定蛋白清除率和黄酮保留率。
1.2.9树脂的预处理将4种树脂(HPD400、AB-8、D001、D101)先用体积分数95%乙醇充分浸泡24 h,用蒸馏水洗净乙醇;然后用4 BV、5%HCl溶液浸泡3 h,用蒸馏水洗至中性;接着用4 BV、4%NaOH溶液浸泡3 h,最后用蒸馏水洗至中性。湿法装柱,再以95%乙醇清洗,直到流出液澄清为止,用蒸馏水洗至无乙醇味[13]。
1.2.10不同树脂比吸附量测定称取预处理好的4种树脂各2 g(滤纸吸干表面的水)装入具塞磨口三角瓶中,装入0.8 mg/mL的黄酮溶液40 mL,置室温下吸附24 h,重复吸附后取上清液1 mL测总黄酮含量,按下式[14]计算比吸附量。
比吸附量(mg/g)=[(样品液总黄酮浓度-吸附后滤液总黄酮浓度)×溶液体积]/树脂质量式(2)
1.2.11不同树脂比解析量测定取吸附后的树脂2 g加入丙酮溶液5 mL室温振荡解析24 h,充分解析后取上清液1 mL,测定黄酮含量,按下式[15]计算比解析量。

1.2.12树脂静态吸附动力学特性分别取4种预处理好的树脂各两份,每份6.0 g装于8个150 mL三角瓶中,加入质量浓度为0.4 mg/mL的黄酮提取液50 mL封口,室温条件下130 r/min振荡吸附,分别在0.5、1、1.5、2、4、6、8 h后取1 mL测定总黄酮质量浓度,测定树脂的比吸附量,绘制吸附动力学曲线。
1.2.13吸附率和解析率计算公式吸附率是动态吸附实验吸附效果的量化指标。解析率是直观表示树脂解析过程中树脂解析能力的指标。

1.2.14动态实验由于静态吸附、解吸与实际树脂纯化有一定的差异,实际树脂纯化是一个动态的过程,所以有必要进行动态吸附、解吸考察。采用柱长度20 cm,柱内直径1.2 cm的层析柱,装柱10 g大孔树脂D101后,分别进行吸附率单因素实验。
1.2.14.1pH对吸附率的影响采用柱长度20 cm,柱内直径1.2 cm的层析柱,装柱10 g大孔树脂D101。配制浓度为0.2 mg/mL的黄酮溶液,黄酮溶液总量大于大孔树脂的饱和吸附量。用盐酸调pH为1、2、3、4、5、6,取60 mL上柱,流速为3 BV/h。
1.2.14.2浓度吸附率的影响配制浓度为0.1、0.2、0.3、0.4、0.5 mg/mL的黄酮溶液,用盐酸调pH至2,为了确保总的物质量相等分别取180、90、60、45、36 mL上柱,流速为3 BV/h。
1.2.14.3流速对吸附率的影响配制浓度为0.2 mg/mL的黄酮溶液,用盐酸调pH至2取60 mL上柱,控制流速分别为1、2、3、4、5 BV/h。
1.2.15正交实验设计选取pH、浓度和流速每个设置三个因素水平,采用L9(34)进行正交实验(如表2),得出优化的提取条件。
1.2.16最大饱和吸附量的确定准确称取10 g D101树脂湿法装柱,取黄酮溶液150 mL(0.3 mg/mL)按上述确定的最佳条件循环吸附,动态检测流出液的吸光度。当流出液的吸光度与上样液的吸光度基本接近时,可以认为树脂对黄酮的吸附己达到饱和状态,计算树脂对黄酮的饱和吸附量。
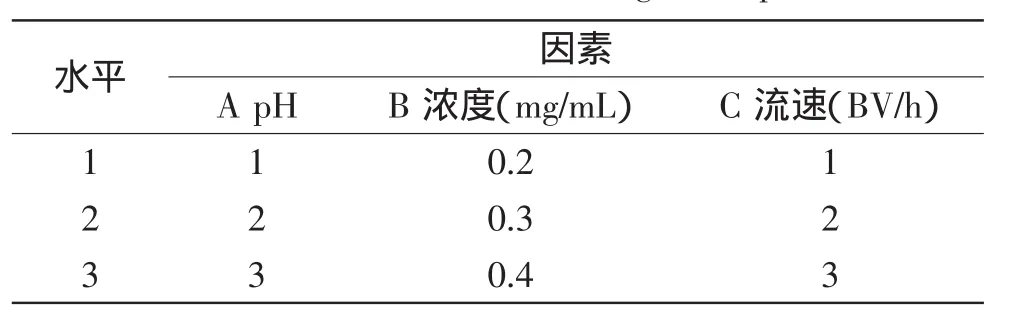
表2 正交实验因素水平设计表Table 2 Factors and levels of orthogonal experiments
1.3数据分析
采用Microsoft Excel(Office 2007)软件整理数据,SPSS 17.0软件进行统计分析。
2 结果及分析
2.1藜麦总黄酮提取工艺
2.1.1超声时间对总黄酮提取量的影响由图1可知,随着超声时间的延长,提取量呈升高趋势,在20 min后达到平衡,且25 min与15 min的提取量差异极显著(p<0.01)。综合考虑效率和超声充分,选择超声时间为25 min。
超声破碎加速有效成分的浸出,缩短了后续回流提取平衡时间。超声本身并不改变化合物分子结构和溶解度,超声具有空化破碎效应和加速质点运动,理论上到一定时间后就达到平衡[16]。
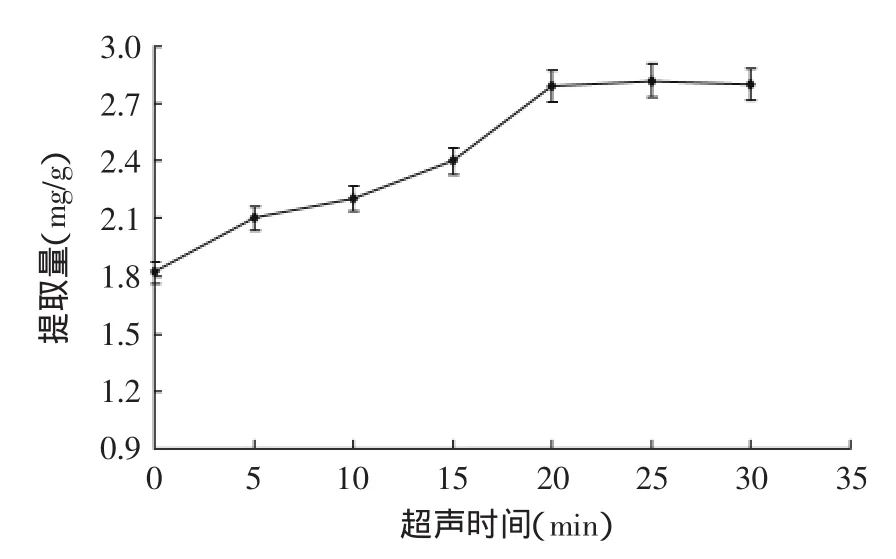
图1 超声时间对提取量的影响Fig.1 Effect of ultrasonic time on yield of total flavonoids
2.1.2乙醇浓度对总黄酮提取量的影响由图2可知,乙醇浓度在40%~70%范围内,藜麦总黄酮提取量随浓度增加呈上升趋势。70%和80%时的提取量无显著差异(p>0.05),当达到100%提取量反而下降。
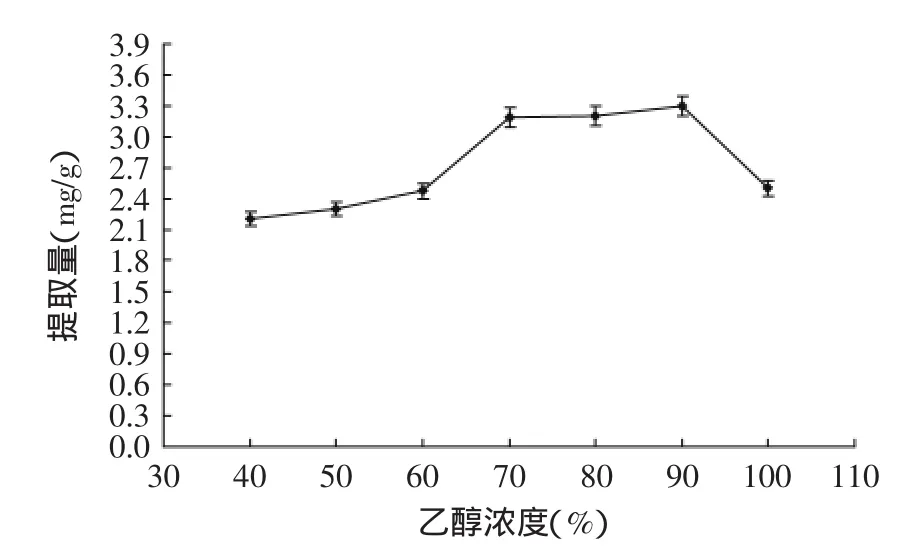
图2 乙醇浓度对提取量的影响Fig.2 Effect of ethanol volume fraction on yield of flavonoids
少量的水能促进水溶成分的分解,促进渗透作用和扩散作用。通过实验发现,当乙醇浓度40%~70%时提取液较浑浊,乙醇浓度80%~100%时溶液澄清,综合考虑提取量和溶液透明度,选择80%乙醇。
2.1.3料液比对总黄酮提取量的影响由图3可知,五水平中料液比1∶10(g/mL)(p<0.01)时提取量最大,1∶10~1∶80(g/mL)提取量下降。可能是因为一定比例的溶剂已经将有效成分溶出完全,再加大料液比反而会使更多杂质溶解,影响黄酮的溶出[17]。

图3 料液比对提取量的影响Fig.3 Effect of ratio of raw material to liquid on yield of flavonoids
2.1.4温度对总黄酮提取量的影响由图4可知,温度在40~90℃时,提取量随温度升高而升高。90℃和100℃的提取量无显著差异(p>0.05)。80℃和90℃的提取量差异极显著(p<0.01)。当80℃以上时提取溶液沸腾,导致热对流作用增强,提取量升高明显。
温度能改变黄酮类物质的溶解度,温度高溶解度变大,加快黄酮的溶出速率。综合考虑,90℃为适合温度。

图4 温度对提取量的影响Fig.4 Effect of extraction temperature on yield of flavonoids
2.1.5回流时间对总黄酮提取量的影响由图5可知,此条件下回流时间在0~3 h范围内,提取量随时间延长增加。3 h有最大提取量,之后呈下降趋势。氧化导致4 h和5 h提取量下降的可能性不大,因为回流装置中的空气已经被饱和乙醇蒸汽取代。可能是回流时间过长,黄酮类物质热变性导致提取量下降。因此,选择回流时间为3 h。
2.1.6正交实验结果由表3和表4可知,4个因素对藜麦总黄酮提取量影响极显著,大小依次为:C提取温度>D回流时间>B料液比>A乙醇浓度。藜麦总黄酮的优化提取工艺为A3B3C1D1,由于实际中70%乙醇提取杂质较多,所以实际改用90%提取。综合考虑实际提取条件为温度90℃、料液比1∶10(g/mL)、提取回流时间为2 h、乙醇浓度90%为最佳提取条件。实际平均提取量为3.861 mg/g,说明优化的提取工艺合理。

图5 回流时间对提取量的影响Fig.5 Effect of extraction time on yield of flavonoids
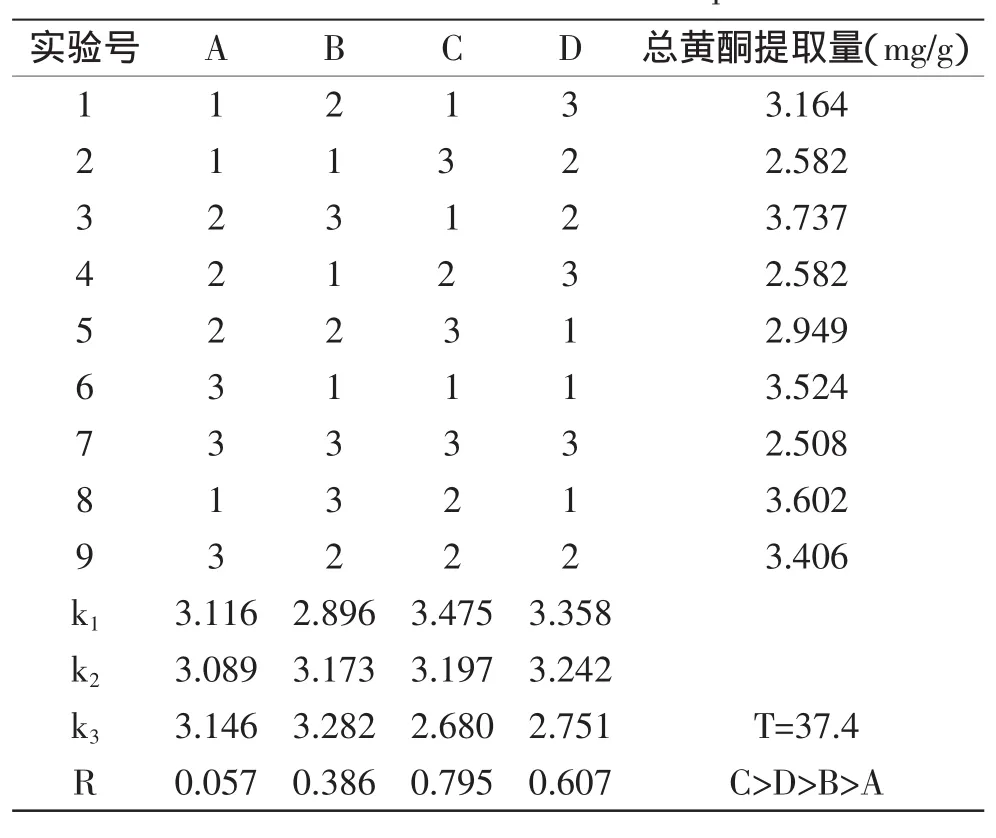
表3 藜麦总黄酮提取正交实实验分析Table 3 Analysis of the results of orthogonal experiment of extraction of total flavonoids from quinoa

表4 藜麦总黄酮提取正交实实验方差分析Table 4 Variance analysis orthogonal test on experiment of extraction of total flavonoids from quinoa
2.2浓缩盐析除可溶蛋白与黄酮回收率
通过考马斯亮蓝测定,发现初提物中可溶蛋白占固形物的35.3%(RSD=2.7)。由图6可知,当提取液中加入15%的NaCl以上时,考马斯亮蓝检测清除率均在90%以上,而此时总黄酮保留率却急剧下降。
蛋白盐析的过程中,同时夹带和吸附了一部分黄酮导致损失,综合考虑选择盐的加入量为15%。此步骤加入的盐,将会在大孔树脂水洗的过程中除去。实验期间尝试过超滤除蛋白,虽然超滤损失率小,但超滤过程耗时比较长,制备效率低,最终选择浓缩盐析除蛋白。
2.3大孔树脂的选择
2.3.1四种大孔树脂对黄酮的静态吸附和解吸树脂D101和AB-8的比吸附量无显著差异(p>0.05),比吸附量的大小顺序为D101、AB-8>HPD400>D001(p<0.01)。比解吸量依次为D101>AB-8>HPD400>D001(p<0.01)。解吸率依次为HPD400>D101>AB-8>D001(p<0.01)。D101属于非极性树脂,HPD400属于弱极性树脂,在吸附过程中HPD400容易吸附杂质中毒,而D101重复使用性能相对较好。AB-8解吸率低于D101,综合考虑各方面因素,选择D101为纯化藜麦总黄酮的理想树脂。
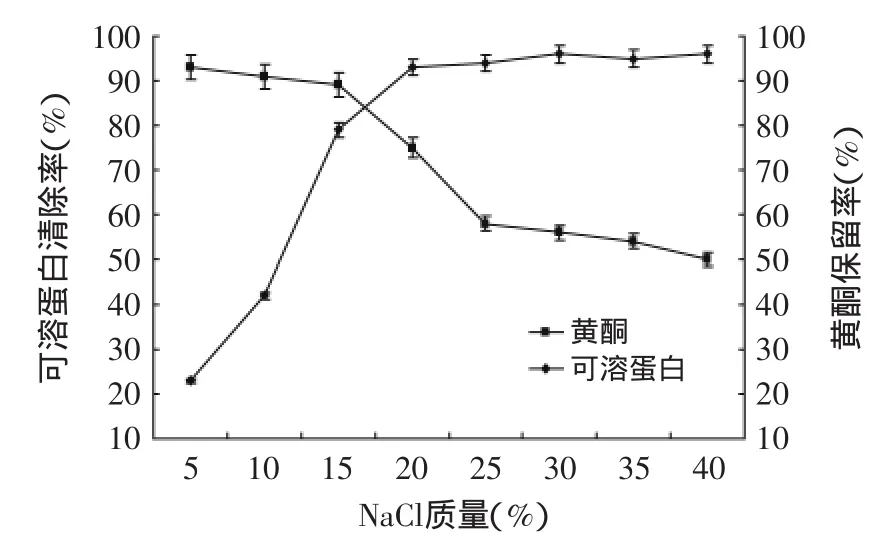
图6 盐析除蛋白与保留率Fig.6 Protein salting-out and retention rate of flavonoids
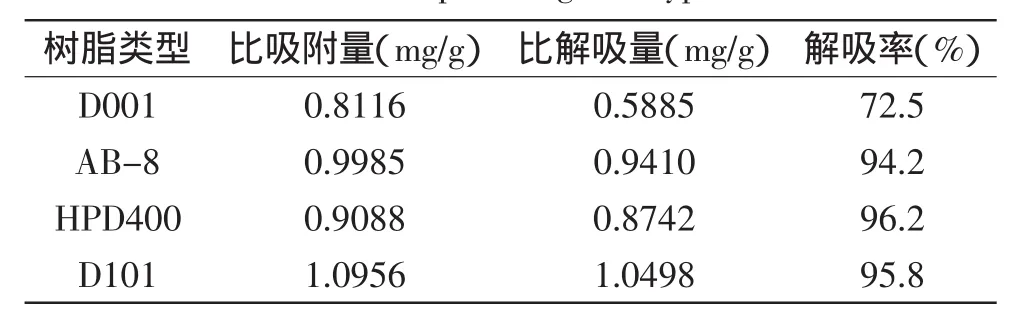
表5 四种大孔树脂对藜麦总黄酮的静态吸附和解吸结果Table 5 Results of adsorption and desorption for total flavonoids sample using four type resin
2.3.2吸附动力学曲线由图7可知,D001吸附的速度比较快但吸附量也少,D101吸附速度相对较慢但最终吸附量大。D101在2 h后基本达到平衡,因此D101对藜麦总黄酮具有良好的静态吸附动力学特性。

图7 四种树脂的吸附动态曲线Fig.7 Dynamic curve of absorption
2.4大孔树脂纯化工艺实验
2.4.1pH对吸附率的影响由图8知,黄酮在酸性条件下比中性条件吸附率大,并且pH2(p<0.01)时达到最大,所以选pH2的黄酮溶液上样。
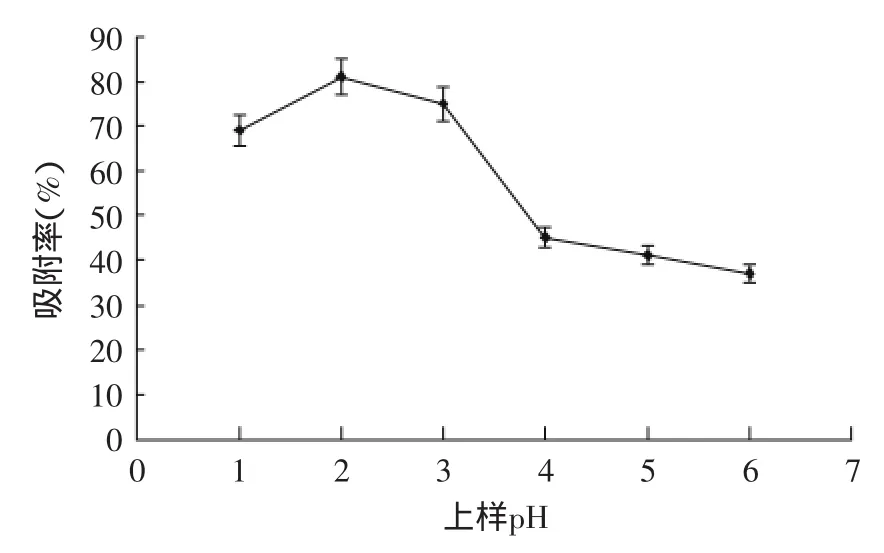
图8 上样pH对D101吸附率的影响Fig.8 Effect of sample Ph on the adsorption ratio on D101 resin
通常情况,酸性化合物在酸性溶剂中吸附充分,碱性化合物在碱性介质中吸附充分。黄酮具有酚羟基结构,呈现一定酸性,它们在弱酸条件下,以分子状态存在,可以凭借范德华力与树脂发生吸附作用[18]。
2.4.2浓度对吸附的影响由图9可知,随着浓度的增加,黄酮吸附率也增加,上样液浓度为0.3 mg/mL(p<0.01)时树脂吸附率最大。
当浓度过大时,会堵塞树脂影响吸附。浓度太低时,黄酮羟基与水的作用力变大阻碍与树脂吸附,导致吸附率下降。水的体积变大后,树脂内部水的冲刷作用增强导致吸附率下降。
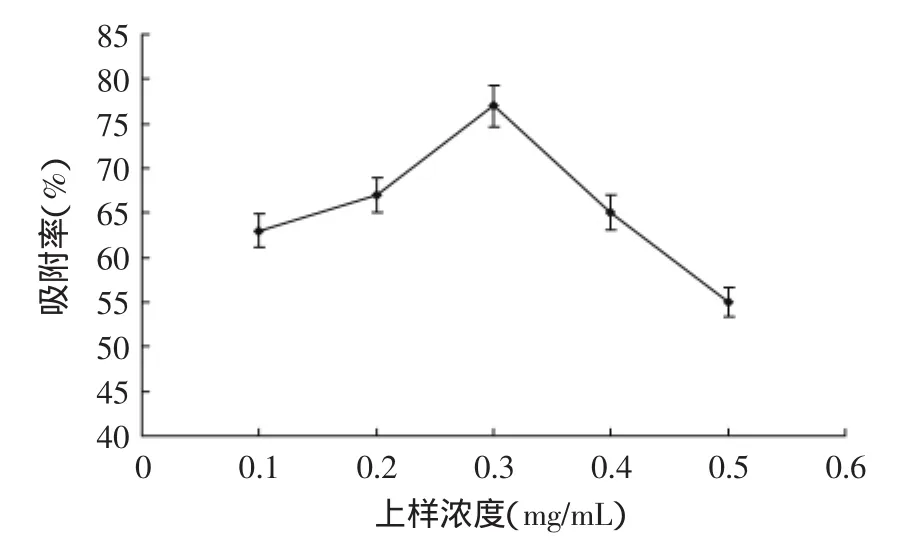
图9 上样浓度对D101吸附率的影响Fig.9 Effect of sample concentration on the adsorption ratio on D101 resin
2.4.3流速对吸附的影响从图10可知,上样液流速为3 BV/h(p<0.01)时,树脂的吸附率最大。所以确定3 BV/h为上样液合适流速。
液体要进入大孔树脂孔内,需要一定的压力差。速度太慢,孔内的液体流动变小,导致接触面减少。由静态吸附动力学特性可知,吸附平衡需要一定的时间。随着流速的增加,泄漏量增加,导致吸附量减少。
2.4.4多因素吸附正交实验由表6和表7可知,流速、pH、浓度对藜麦总黄酮吸附率影响极显著(p<0.01)。3个因素对藜麦总黄酮吸附率影响大小依次为:流速(C)>pH(A)>浓度(B)。D101型大孔树脂吸附藜麦总黄酮的最佳条件为A2B2C2,即pH2、控制流速为2 BV/h、浓度为0.3 mg/mL的黄酮水溶液上样,此条件下总黄酮平均吸附率为80.91%。
2.5饱和吸附量测定
从表8可以看出,D101饱和吸附量为1.5636 mg/g(RSD=1.17),具有良好的饱和吸附量。结果表明,D101型树脂适合藜麦总黄酮的分离纯化。不同物质和不同树脂的饱和吸附量存在差别,据相关文献报道,湿重饱和吸附量0.6~25.45 mg/g[19]差异很大。
2.6洗脱体积与浓度
为了更好分管收集,改用柱长度50 cm,柱内直径1.6 cm的层析柱。装柱40 g大孔树脂D101,0.30 mg/mL黄酮水溶液200 mL(A),0.83 mg/mL黄酮水溶液70 mL(B),0.50 mg/mL黄酮水溶液100 mL(C)。分别调pH2、流速为2 BV/h、8 BV水洗、丙酮洗脱。为了防止树脂过载,设置不同上样体积。自动收集器收集洗脱液,设置每管收集体积为1 mL,能检测出黄酮的第1支管为1号管。结果如图11。
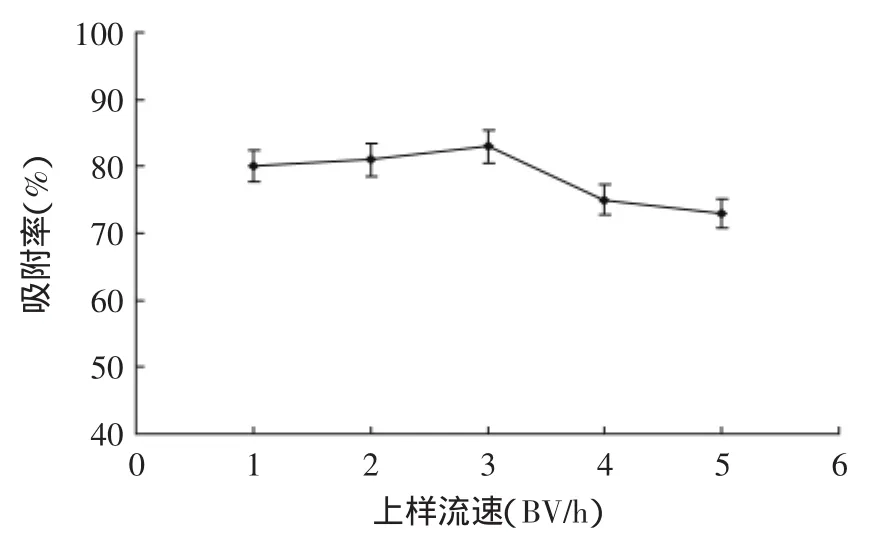
图10 上样流速对D101吸附率的影响Fig.10 Effect of different velocities on the adsorption ratio on D101 resin
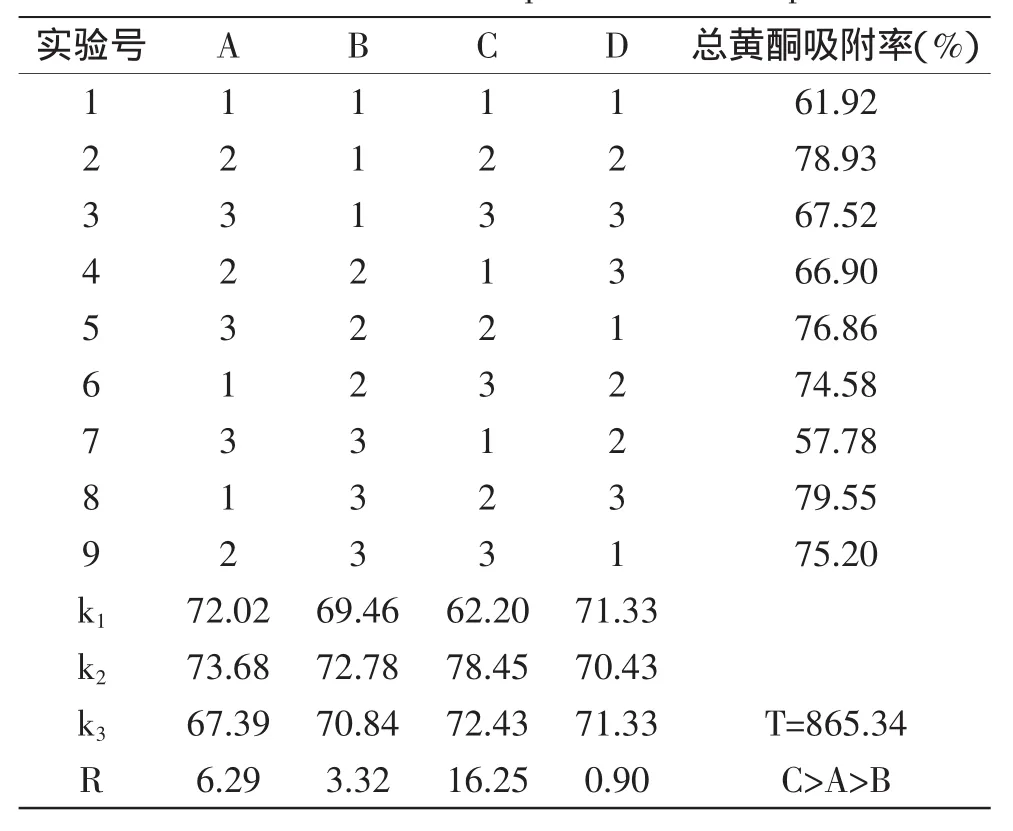
表6 大孔树脂对藜麦总黄酮吸附条件的正交实验结果Table 6 Results and layout of orthogonal test on adsorption conditions of total flavonoids of quinoa with macroporous resin
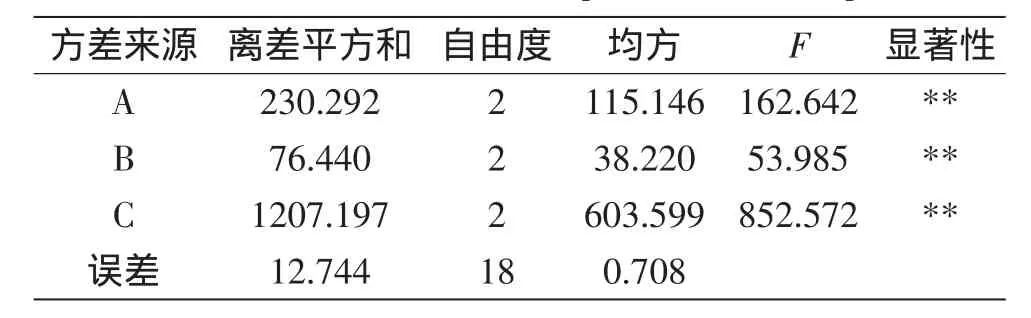
表7 大孔树脂对藜麦总黄酮吸附条件的正交实验结果方差分析Table 7 Variance analysis orthogonal test on adsorption conditions of total flavonoids of quinoa with macroporous

表8 D101饱和吸附量测定结果(n=3)Table 8 Results of saturated adsorption capacity of resin D101(n=3)
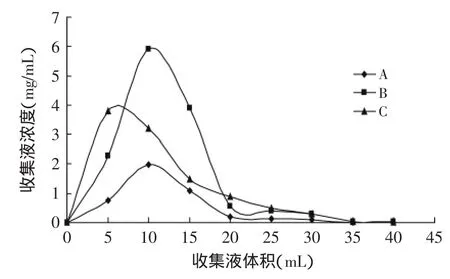
图11 洗脱曲线Fig.11 Dsorption curve of total flavonoids
图11中A、B、C对应起始浓度不同,可以看出各曲线最大浓度是上样浓度的数倍。说明大孔树脂对上样物质具有很好的浓缩效应,最大洗脱液浓度受初始上样浓度的影响。
产生浓缩效应是因为,同体积未饱和的洗脱液流经不同树脂部位时都具有洗脱作用,导致不同部位吸附的黄酮,在同体积洗脱液中洗脱,自上而下叠加产生浓缩效应。这个现象使树脂同一个过程中达到了两个效果,即纯化和浓缩。在实际生产中,有利于生产效率的提高。
由表9可知,通过D101大孔树脂的分离纯化,总黄酮含量达到28.53%。说明D101树脂适合于藜麦总黄酮的纯化,该工艺切实可行。
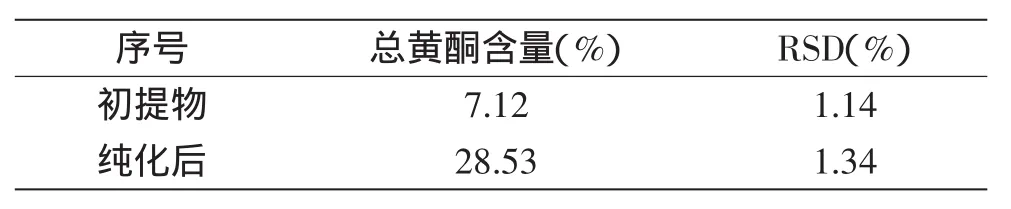
表9 总黄酮含量测定结果Table 9 Content of total flavonoids
3 结论
藜麦深加工可以先提取油脂,然后从饼粕中提取总黄酮,选择利用正交实验法研究了藜麦总黄酮的提取和纯化工艺,获得最佳提取条件。此条件下实际平均提取量为3.861 mg/g。并获得最佳大孔树脂纯化条件,此条件下纯度可由初提物的7.12%提高到28.53%,含量相比原料含量提升了七十多倍。工艺中均未使用剧毒试剂,提取工艺条件切实可行。大孔树脂纯化效率高,树脂可重复使用数十次之久。本研究为藜麦工业化深加工奠定了一定的基础,具有重要的实际意义。
藜麦总黄酮属于食物来源黄酮,不含剧毒杂质、资源量大、安全性高等,具有开发成天然保健品的独特资源优势。本实验还可以进行进一步的深入研究:对藜麦黄酮进行结构鉴定及生理活性实验,以得到已知结构和功能的产品。
[1]LIN Jianyuan,JI Lihong.Optimization of flavonoids from Ginkgo biloba using response surface analysis[J].J ChinInst Food Sci Technol,2013,13(2):83-90.
[2]陆国权,任韵,唐忠厚,等.甘薯黄酮类物质的提取及其基因型差异研究[J].浙江大学学报:农业与生命科学版,2005,31(5):541-544.
[3]张斌,孙兰萍,马龙,等.大孔树脂分离纯化花生壳总黄酮的研究[J].中国粮油学报,2010,25(2):126-130.
[4]高淑云,徐婷婷.响应面优选大蒜中黄酮提取工艺研究[J].中国调味品,2013,38(3):44-49.
[5]王静霞,黄艳菲,赵小燕,等.荞麦和商品苦荞茶中总黄酮的含量测定[J].食品工业科技,2013,34(2):58-60.
[6]李长新,张鲁刚,孙希禄,等.紫色小白菜花青素的提取工艺优化[J].西北农林科技大学学报:自然科学版,2011,39(9):200-206.
[7]贾霖,黄国清,肖军霞.金银花中黄酮类化合物的提取工艺[J].食品研究与开发,2013,34(9):41-43.
[8]李琼.超声波辅助法提取芸豆种子黄酮类化合物研究[J].食品研究与开发,2012,33(2):40-42.
[9]ZHU Nanqun,SHENG Shuqun,LI Dajie,et al.Antioxidative flavonoid glycosides from quinoa seeds(Chenopodium quinoa Willd.)[J].J Food Lipids,2001,8(1):37-44.
[10]阮洪生,葛文中,贾桂燕.大豆异黄酮纯化方法研究进展[J].粮食与油脂,2009,10(4):8-10.
[11]姜秀娟,唐金成,白红进,等.可见分光光度法测定刺山柑花蕾中总黄酮含量[J].食品科学,2010,31(18):59-63.
[12]李如亮.生物化学实验[M].武汉:武汉大学出版社,1998.
[13]陈乃富,张莉,陈科,等.吸附树脂法纯化蔗菜黄酮的初步研究[J].食品工业科技,2007,28(8):82-85.
[14]张素华,王正云.大孔树脂纯化芦笋黄酮工艺研究[J].食品科学,2006,29(2):182-186.
[15]李淑珍,李进.大孔树脂分离纯化黑果构祀总黄酮的研究[J].食品科学,2009,30(1):19-23.
[16]钟玲,尹蓉莉,张仲林.超声提取技术在中药提取中的研究进展[J].西南军医,2007,9(6):84-86.
[17]吕秀亭,葛鸽,呼娜.闪式提取法提取落叶松树皮中原花青素的研究[J].食品工业科技,2014,35(9):199-202.
[18]王东梅,李玫,杨秀萍,等.吸附树脂提取分离翅果油树叶总黄酮的研究[J].西北植物学报,2003,23(9):162-1624.
[19]戚向阳,张俐勤,陈维军,等.大孔吸附树脂分离纯化罗汉果皂甙的新方法[J].农业工程学报,2005,21(9):163-166.
Study on extraction process of quinoa total flavonoids and purification process of macroporous resin
DONG Shi-bin,NING Ya-ping,YANG Zhe,ZHANG Qiao-hui,DONG Jie-qiong,WANG Feng-jun,WANG Jian-zhong*
(College of Biological Sciences and Technology,Beijing Key Laboratory of Forest Food Processing and Safety,Beijing Forestry University,Beijing 100083,China)
Purpose:To study the extraction process of quinoa flavonoids and purification process of macroporous resin.Method:To study the optimal extraction and purification process of quinoa through orthogonal test based on single factor test.Results:The optimal extraction process conditions were:ultrasound time for 25 min,temperature 90℃,material and liquid ratio 1∶10(g/mL),refluxing time 2 h,ethanol concentration 90%.The total extracting amount of Quinoa flavonoids under these conditions was 3.861 mg/g.Perform salting-out to remove protein.Select NaCl additive amount as 15%.The optimal purification process of macroporous resin was:pH2,flow velocity 2 BV/h,0.3 mg/mL flavonoids aqueous solution,8 BV water washing,acetone elution.The purified flavonoids adsorption rate under these conditions was 80.91%.The purity could be improved from 7.12%of the original extracts to 28.53%.
quinoa;total flavonoids;ethanol extraction;macroporous resin purification
TS201.1
B
1002-0306(2015)16-0272-07
10.13386/j.issn1002-0306.2015.16.047
2014-12-03
董施彬(1989-),男,硕士研究生,研究方向:天然产物开发与利用,E-mail:dongshibin77@sina.com。
王建中(1952-),男,硕士,教授,研究方向:天然产物开发与利用,E-mail:62338221@163.com。
林业公益行业科研专项资金(201004081)。

