萌发对芸豆酚类物质及抗氧化活性的影响
梁亚静,韩 飞,梁 盈,第文龙,陈 曦,郑 璐,林亲录,*,管 骁
(1.中南林业科技大学稻谷及副产物深加工国家工程实验室,湖南长沙410004;2.国家粮食局科学研究院,北京100037;3.上海理工大学医疗器械与食品学院,上海200093)
萌发对芸豆酚类物质及抗氧化活性的影响
梁亚静1,2,韩飞2,*,梁盈1,第文龙2,陈曦2,郑璐2,林亲录1,*,管骁3
(1.中南林业科技大学稻谷及副产物深加工国家工程实验室,湖南长沙410004;2.国家粮食局科学研究院,北京100037;3.上海理工大学医疗器械与食品学院,上海200093)
研究了萌发过程对黑芸豆、奶花芸豆、紫花芸豆中多酚、黄酮含量及抗氧活性的影响,并对多酚、黄酮含量及抗氧化能力做了相关性分析。结果表明:三种芸豆萌发(0~6 d)后多酚、黄酮含量及抗氧化活性较未萌发的均显著降低(p<0.05)。且浸泡损失的多酚、黄酮高于萌发期间;黑芸豆萌发6 d后多酚、黄酮含量可能由于内切酶的作用开始增加。萌发期间,三种芸豆的DPPH·清除能力(DPPH)、ABTS+·清除能力(ABTS)、铁离子还原抗氧化能力(FRAP)、氧化自由基吸收能力(ORAC)均有降低趋势。多酚、黄酮含量与抗氧化能力极显著相关(p<0.01),且多酚与ABTS值的相关性最高(r=0.955)。此外,黑芸豆的抗氧化能力萌发4 d后开始增加,萌发6 d时黑芸豆和奶花芸豆的ORAC值高于0 d。合适的萌发条件能更好的保留芸豆的生物活性物质。
芸豆,萌发,多酚,黄酮,抗氧化
芸豆(Phaseolus vulgarisl L.)又名四季豆,是豆科菜豆属一年生草本植物的籽粒。目前,我国芸豆种植面积居世界第3位,种植面积广,资源丰富[1]。芸豆营养价值高,含有人体必需的8种氨基酸,且蛋白质、维生素、微量元素和膳食纤维等含量丰富[2]。近些年来研究表明,人体一些慢性疾病的发生和机体衰老与自由基的产生密切相关,酚类物质对这些自由基有较强的抗氧化清除作用[1]。芸豆中富含天然抗氧化活性物质,如多酚、花色苷、植酸、皂苷和黄酮类化合物[1],这些活性物质具有降血脂[3]、抑制肿瘤细胞的扩散[4]、增强人体的抗病能力、促进机体的新陈代谢等功能[1]。豆类发芽或加工后其营养成分、生物活性成分等会有显著变化[5-6]。因此,有关芸豆加工食用及抗氧化的研究越来越受到重视。
López-Amorós等[5]研究表明,萌发后豌豆、菜豆、扁豆等多酚组成均有较显著的变化,且豌豆、菜豆的抗氧化能力显著增加,扁豆则相反。Ribeiro等[6]发现豇豆和菜豆在萌发过程中肌醇、碳水化合物、蛋白质等含量均显著下降。但目前对于芸豆萌发过程中多酚、黄酮、及抗氧化活性变化的研究鲜有报道。通常测定植物提取物抗氧能力的方法主要有DPPH·自由基清除能力(DPPH)、ABTS+·自由基清除能力(ABTS)、铁离子还原抗氧化能力(FRAP)、超氧化物歧化酶抗氧化能力(SOD)、氧化自由基吸收能力(ORAC)、细胞抗氧化活性(CAA)等,且结果因植物的种类和实验室而异。因此,评价豆类抗氧化活性需多种抗氧化方法协同验证。本文主要研究了黑芸豆、奶花芸豆、紫花芸豆在萌发过程中多酚、黄酮含量及抗氧化值(DPPH、ABTS、FRAP、ORAC)的变化,分析了三种芸豆的多酚、黄酮含量及抗氧化能力的相关性,以期为芸豆资源的食用和开发提供理论依据。
1 材料与方法
1.1材料与仪器
黑芸豆、奶花芸豆、紫花芸豆采自陕西榆林由西北农林科技大学农学院小杂粮育种实验室提供;福林酚试剂(Folin-Ciocalteu)、没食子酸(GA)、2,2-联苯基-1-苦基肼基(DPPH)、水溶性VE(Trolox,)、2,2’-连氮基-双-二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ)、荧光素钠、ABAPSigma公司;芦丁、过硫酸钾、FeCl3·6H2O、乙酸、丙酮等均为分析纯。
TU-1810紫外可见分光光度计北京普析通用仪器有限责任公司;PHSJ-3F pH计上海精科;HY-2A调速多用振荡器金坛市瑞尔电器有限公司;电热恒温水浴锅上海森信实验仪器有限公司;3K15冷冻高速离心机Sigma公司;CF-4B粉粹机创立药材器械;2104 Multilabel Reader酶标仪PerkinElmer;超低温冰箱青岛海尔特种电器有限公司;人工气候培养箱宁波海曙赛福实验仪器厂。
1.2实验方法
1.2.1样品的萌发参考López-Amorós[5]和Ribeiro[6]的方法稍作修改,称取20 g豆样,室温下,用0.7%的次氯酸钠浸泡30 min,洗干净后用去离子水再浸泡5 h,将浸泡后的豆样平铺在含有脱脂棉的盘中,用人工气候箱萌发(95%的湿度,25℃,黑暗),每隔8 h喷一次水,取0、2、4、6 d的样品真空冻干(-80℃,6 Pa)后磨粉存于-20℃待用。
1.2.2多酚的提取参考Xu[7]的方法,准确称取0.5 g的样品于离心管中,加5 mL的酸性丙酮(丙酮/水/乙酸为70∶29.5∶0.5,v/v/v),混匀,室温下,以300 r/min的转速用摇床摇动3 h,将混合物放置12 h,6000 r/min离心10 min,收集上清,所有提取过程再重复一次,收集两次上清存于-80℃待用。每个样品共提取三份。
1.2.3多酚、黄酮含量的测定采用Folin-Ciocalteu法[7]测定提取液中的多酚含量,以没食子酸为标准品作标准曲线,结果以没食子酸当量(GAE)计(mg GAE/g DW)。采用Al(NO3)3比色法[8]测定提取液中黄酮的含量,以芦丁为标准品作标准曲线,结果以芦丁当量(RE)计(mg RE/g DW)。
1.2.4DPPH·自由基清除能力采用Xu[7]和Thaipong[9]的方法稍作修改:加适当稀释的提取液200 μL和3.8 mL 0.1 mmol/L的DPPH·溶液,涡旋混匀后置避光处30 min,在515 nm下测OD值,标准曲线的线性为0~800 mmol/L的水溶性VE(Trolox),结果以μmol TE/g DW计。
1.2.5ABTS+·自由基清除能力采用Thaipong[9]和Arnao[10]的方法,加适当稀释的提取液150 μL和2.85 mL ABTS+·稀释液,避光反应30 min,在734 nm下测OD值,标准曲线的线性为0~600 mmol/L的Trolox,样品的抗氧化结果以μmol TE/g DW计。
1.2.6铁离子还原抗氧化能力FRAP的测定采用Benzie[11]的方法:加适当稀释的提取液150 μL和预热的FRAP工作液2.85 mL,避光反应30 min,在593 nm下测OD值,标准曲线的线性为0~600 mmol/L的Trolox,结果以μmol TE/g DW计。
1.2.7氧化自由基吸收能力ORAC的测定参考Ana and Liu[12]的方法,样品提取物用75 mmol/L(pH7.4)磷酸缓冲液稀释备用,向96孔板加入20 μL的提取物或Trolox标品(6.25~50 μmol/L)和200 μL荧光素(终浓度为0.96 μmol/L),在37℃下预热20 min后,各孔板中加入20 μL浓度为119 mmol/L的ABAP。用酶标仪测定孔板的荧光强度,485 nm激发,520 nm吸收,每5 min一次,共循环35次,结果以μmol TE/g DW计。
1.2.8数据的分析数据的分析使用SPSS 17.0,同一芸豆在萌发过程中显著性差异使用Duncan的多重比较,所有指标的相关性分析使用Pearson双侧检验。
2 结果与分析
三种芸豆萌发0、2、4、6 d及未萌发的多酚、黄酮含量见表1~表2,萌发0、2、4、6 d及未萌发芸豆的抗氧化结果(DPPH、ABTS、FRAP、ORAC)见图1~图4。
2.1萌发对芸豆多酚含量的影响
由表1可知,萌发降低了三种芸豆的多酚含量,且不同品种存在差异。黑芸豆、奶花芸豆、紫花芸豆经过浸泡后多酚含量的损失率分别为44.2%、22.3%、32.3%,而萌发过程中(最高值)与0 d相比,多酚含量的损失率分别为-9.8%、12%、9.7%。由此可知,芸豆在浸泡过程中水溶性酚类物质的损失比萌发期间严重,尤其是黑芸豆。萌发0~6 d,紫花芸豆多酚含量从7.83 mg GAE/g DW降至5.79 mg GAE/g DW;奶花芸豆萌发后多酚含量比0 d的显著降低(p<0.05),但萌发2~6 d时没有显著性差异;黑芸豆多酚含量随着萌发时间的增加先降后升,且6 d时多酚含量最高(4.47 mg GAE/g DW),原因可能是萌发时酶促反应产生了新的酚类单体或释放了与生物大分子结合的酚类物质。
Lin P Y等[13]研究结果表明深色豆类如红小豆、黑大豆等在萌发初期由于种皮色素的损失,酚类物质含量和抗氧化能力显著下降,但萌发一段时间后酚类物质的含量和抗氧化活性又显著增加,这与本实验黑芸豆的结果相似。Paucar等[14]发现大豆发芽后新产生的活性物质有较强的抗氧化性,且受萌发时间和温度的影响。S'wieca M等[15]研究结果表明扁豆在40℃下萌发2~6 d后的总酚、黄酮含量及抗氧化能力高于4℃下萌发,且酚酸和黄酮单体含量也有差异。PAJAK P等[16]研究结果表明绿豆芽中的主要酚类物质有没食子酸、阿魏酸、咖啡酸、绿原酸、木犀草素、芹菜素等,且酚类物质含量显著增加。本实验研究的紫花和奶花芸豆萌发后多酚含量均显著(p<0.05)下降,可能受芸豆种类和萌发条件的影响。
2.2萌发对芸豆黄酮含量的影响
由表2可知,三种芸豆萌发后黄酮含量均显著降低(p<0.05),黑芸豆、奶花芸豆、紫花芸豆的黄酮含量浸泡后损失率分别为65%、18%、35.8%,而萌发后损失率分别为-9.5%、26%、26%,可见芸豆在浸泡过程中会损失大量的黄酮类物质,这与多酚结果的变化趋势较一致。萌发0~6 d,紫花芸豆的黄酮含量从5.71 mg RE/g DW降至2.25 mg RE/g DW;奶花芸豆黄酮含量先降后趋于稳定,0 d时最高(4.51 mg RE/g DW),6 d时最低(2.26 mg RE/g DW);黑芸豆的黄酮含量则是先降后增,萌发6 d时最高(0.92 mg RE/g DW),这与其多酚含量的变化较一致。
WU Z等[17]研究表明芸豆、绿豆、豌豆、红小豆、鹰嘴豆等在萌发4 d内多酚含量和抗氧化活性显著增加,其中鹰嘴豆和黑大豆的异黄酮的种类也有所增加,并初步确定了25个异黄酮,芸豆萌发后黄酮种类也可能会增加,但还需验证。豆类萌发时内源酶被激活,由于酶促反应酚类化合物的组成会发生改变,产生一些次级植物代谢产物如黄酮类。Jeon H Y等[18]发现大豆萌发后产生大量的植物抗毒素香豆雌酚,并认为萌发后抗氧化活性的增强可能是香豆雌酚与其他酚类物质的协同作用。
2.3萌发对芸豆抗氧化能力的影响
2.3.1萌发对芸豆DPPH·清除能力的影响由图1可知,萌发后三种芸豆DPPH·清除能力均显著低于未萌发的(p<0.05),且浸泡后均显著(p<0.05)降低,与多酚、黄酮含量的变化趋势较一致,其中黑芸豆浸泡后DPPH·清除能力降低了36%。萌发0~6 d,黑芸豆和奶花芸豆的DPPH·清除能力先下降,4d后趋于稳定,黑芸豆的DPPH·清除能力从24.73 μmol TE/g DW降至10.86 μmol TE/g DW,奶花芸豆从27.47 μmol TE/g DW降至21.26 μmol TE/g DW;紫花芸豆的DPPH·清除能力显著下降(p<0.05)。

表1 萌发过程中多酚含量(mg GAE/g DW)Table 1 Phenolics content during germination(mg GAE/g DW)

表2 萌发过程中黄酮的含量(mg RE/g DW)Table 2 Flavonoids content during germination(mg RE/g DW)
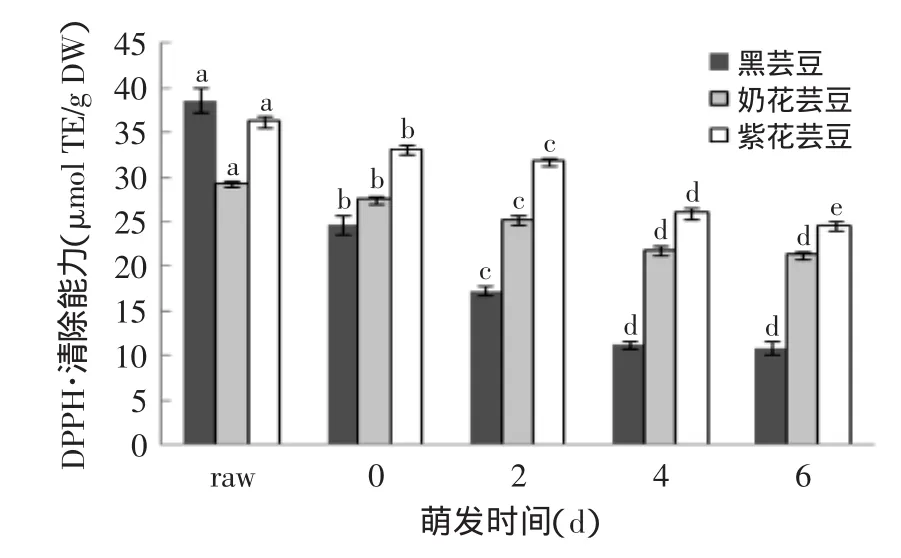
图1 萌发过程中3种芸豆DPPH·自由基清除能力Fig.1 DPPH·radical scavenging capacity of three kidney beans during germination
2.3.2萌发对芸豆ABTS+·清除能力的影响由图2可知,三种芸豆萌发后ABTS+·清除能力均显著低于未萌发的(p<0.05),且浸泡后与DPPH·清除能力的变化趋势较一致,黑芸豆的ABTS+·清除能力降低了56.4%。萌发0~6 d,黑芸豆的ABTS+·清除能力先降后升,且6 d的ABTS+·清除能力显著高于4 d;奶花芸豆的ABTS+·清除能力先降低,4 d之后趋于稳定;紫花芸豆的ABTS+·清除能力显著降低(p<0.05),0 d时ABTS+·清除能力最高(88.47 μmol TE/g DW),6 d时最低(59.23 μmol TE/g DW)。
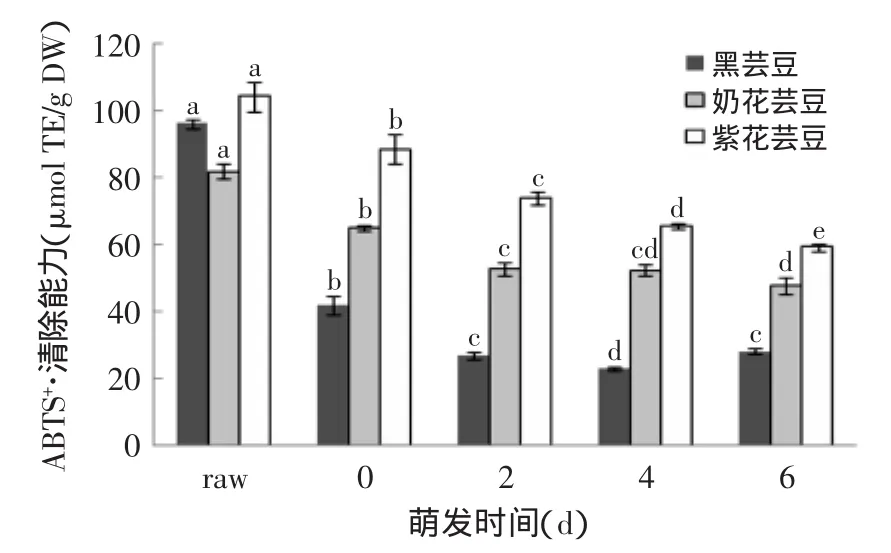
图2 萌发过程中3种芸豆ABTS+·自由基清除能力Fig.2 ABTS+·radical scavenging capacity of three kidney beans during germination
2.3.3萌发对芸豆FRAP值的影响由图3可知,三种芸豆萌发后FRAP值均显著低于未萌发的(p<0.05),其中浸泡后的FRAP值与多酚的变化趋势较一致,黑芸豆、紫花芸豆分别降低了50.4%、21.2%。萌发0~6 d,黑芸豆的FRAP值先降低,4 d后趋于稳定,4 d时最低(12.51 μmol TE/g DW);奶花与紫花芸豆的FRAP值显著下降(p<0.05),萌发0 d时FRAP值最高,分别为34.48、42.95 μmol TE/g DW,6 d时最低,分别为22.8、23.29 μmol TE/g DW。

图3 萌发过程中三种芸豆铁离子还原抗氧化能力FRAP值Fig.3 Ferric reducing antioxidant power FRAP of three kidney beans during germination
AGUILERA等[19]研究表明豇豆和刀豆萌发后多酚含量、黄酮含量、DPPH值和FRAP值都显著增加。PAJAK P等[16]研究的绿豆萌发后酚类物质及抗氧化活性增加。可见,豆类的品种是影响萌发后其活性物质和抗氧化能力的重要因素。
2.3.4萌发对芸豆ORAC值的影响由图4可知,三种芸豆萌发后的ORAC值均显著低于未萌发的(p<0.05),且在浸泡过程中黑芸豆、奶花芸豆、紫花芸豆的ORAC值分别降低了24.8%、17.2%、53.7%,紫花芸豆在浸泡后ORAC值降低最显著,这与其他抗氧化值存在差异。萌发0~6 d,黑芸豆和奶花芸豆的ORAC值先降后升,且6 d时的值均高于0 d,分别为106.71、93.69 μmol TE/g DW,这与黑芸豆多酚含量的变化趋势较一致;紫花芸豆的ORAC值先降低,4 d后趋于稳定,萌发0 d时最高(143.08 μmol TE/g DW)。萌发6 d后,与浸泡后相比,黑芸豆和奶花芸豆的ORAC值略有增加,萌发降低了紫花芸豆的ORAC值。
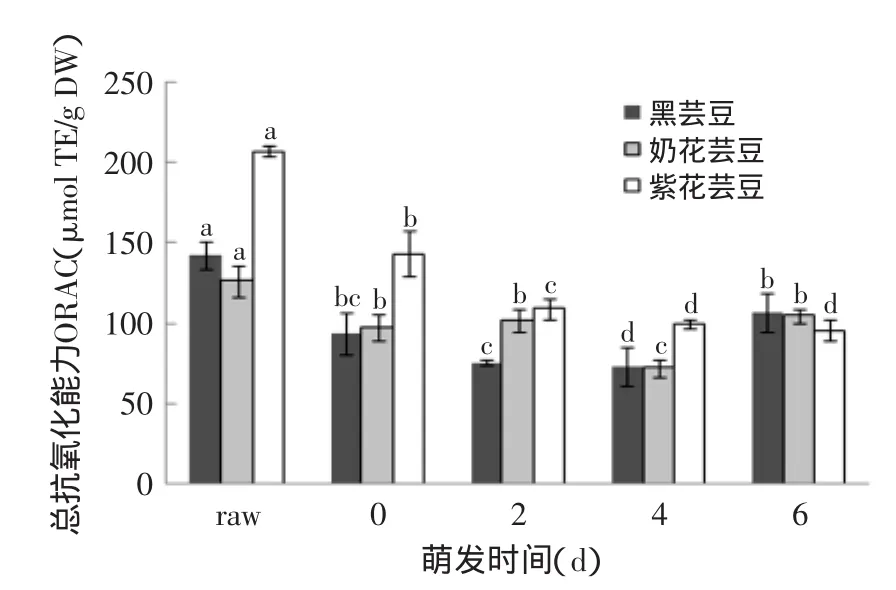
图4 萌发过程中3种芸豆氧化自由基吸收能力(ORAC)Fig.4 Oxygen radical absorbance capacity(ORAC)of three kidney beans during germination
芸豆的抗氧化活性与未萌发和浸泡后相比均显著降低(p<0.05),但萌发6 d时黑芸豆和奶花芸豆的ORAC值却高于0 d,且浸泡后与其他抗氧化值的变化趋势不一致,其原因可能是它针对的自由基源与其他三个抗氧化评价方法不同,但Prior[20]认为ORAC法的测定更准确,它所针对的自由基源与生物相关性更高。
2.4芸豆萌发过程中多酚、黄酮含量与抗氧化能力相关性分析
三种芸豆的多酚、黄酮含量及四种抗氧化值的相关性分析结果见表3。
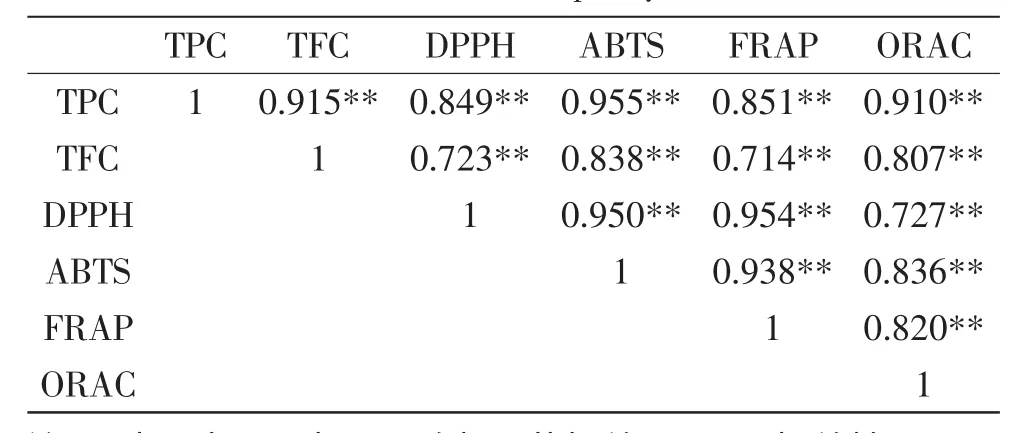
表3 多酚、黄酮及抗氧化能力的相关性Table 3 Correlation between polyphenols,flavonoids and antioxidant capacity
由表3知,多酚、黄酮含量与四个抗氧化值极显著相关(p<0.01),ABTS与多酚含量的相关性最高(r= 0.955)。四个抗氧化值之间极显著相关,且DPPH与FRAP的相关性最高(r=0.954),DPPH与ORAC的相关性最低(r=0.727)。Dudonne等[21]研究结果表明30种植物水提物的抗氧化值相关性最高的是ABTS和FRAP(r=0.946),相关性最低的是ORAC与FRAP(r=0.618),与本文的结果不一致,可能与植物的种类或提取物组成有关。
3 结论
三种芸豆萌发后多酚、黄酮含量及抗氧化能力均显著低于未萌发的(p<0.05),且不同品种存在差异。黑芸豆在浸泡和萌发后多酚、黄酮含量和抗氧化的变化趋势大于奶花和紫花芸豆。黑芸豆的多酚、黄酮含量萌发6 d时高于0 d;奶花和紫花芸豆萌发后多酚、黄酮含量均显著降低(p<0.05)。三种芸豆的萌发后抗氧化活性均显著下降(p<0.05),但黑芸豆的抗氧化能力萌发4 d后开始增加,萌发6 d时黑芸豆和奶花芸豆的ORAC值高于0 d。因此,黑芸豆和奶花芸豆萌发6 d为宜,紫花芸豆萌发4 d为宜。三种芸豆萌发后多酚、黄酮含量及四个抗氧化值极显著相关(p<0.01)。因此,评价萌发芸豆酚类物质的抗氧活性采用四种抗氧化方法都较合适。本实验所研究的芸豆多酚、黄酮含量及抗氧化能力均显著降低,但却高于Xu等[7]研究的豌豆、鹰嘴豆、大豆和Shen Y等[22]研究的白米和红米,可见芸豆萌发仍是生物活性物质良好来源。总而言之,选择合适的芸豆种类与合适的萌发时间能更好地保留芸豆的生物活性物质,有益于芸豆资源的开发利用。
[1]柴岩,冯佰利.中国与杂粮产业[M].杨凌:西北农林科技大学出版社,2013:217-223.
[2]邢亚静,张耀文,李荫藩.小杂粮营养价值与综合利用[M].北京:中国农业科学技术出版社,2009:270-275.
[3]Chokshi D.Subchronic oral toxicity of a standardized white kidney bean(Phaseolus vulgaris)extract in rats[J].Food and chemical toxicology,2007,45(1):32-40.
[4]Xu B,Chang S K C.Comparative study on antiproliferation propertiesandcellularantioxidantactivitiesofcommonly consumed food legumes against nine human cancer cell lines[J]. Food Chemistry,2012,134(3):1287-1296.
[5]López-Amorós M L,Hernandez T,Estrella I.Effect of germination on legume phenolic compounds and their antioxidant activity[J].Journal of Food Composition and Analysis,2006,19(4):277-283.
[6]Ribeiro E S,Centeno D C,Figueiredo-Ribeiro R C,et al. Free cyclitol,soluble carbohydrate and protein contents in Vignaunguiculata and Phaseolus vulgaris bean sprouts[J].Journal of agricultural and food chemistry,2011,59(8):4273-4278.
[7]Xu B J,Chang S K C.A comparative study on phenolic profiles and antioxidant activities of legumes as affected by extraction solvents[J].Journal of food science,2007,72(2):S159-S166.
[8]任顺成,王鹏,王国良.常见食用豆类中黄酮类化合物含量的测定[J].中国粮油学报,2009(7):132-137.
[9]Thaipong K,Boonprakob U,Crosby K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of food composition and analysis,2006,19(6):669-675.
[10]Arnao M B,Cano A,Acosta M.The hydrophilic and lipophilic contribution to total antioxidant activity[J].Food Chemistry,2001,73(2):239-244.
[11]Benzie I F F,Strain J J.Ferric reducing/antioxidant power assay:Direct measure of total antioxidant activity of biological fluids and modified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration[J].Methods in enzymology,1999,299:15-27.
[12]Faller A L K,Fialho E,Liu R H.Cellular antioxidant activity of feijoada whole meal coupled with an in vitro digestion[J]. Journal of agricultural and food chemistry,2012,60(19):4826-4832.
[13]Lin P Y,Lai H M.Bioactive compounds in legumes and their germinated products[J].Journal of agricultural and food chemistry,2006,54(11):3807-3814.
[14]Paucar-Menacho L M,Berhow M A,Mandarino J M G,et al.Effect of time and temperatureon bioactive compounds in germinated Brazilian soybean cultivar BRS 258[J].Food research international,2010,43(7):1856-1865.
[15]S'wieca M,Baraniak B.Nutritional and Antioxidant Potential of Lentil Sprouts Affected by Elicitation with Temperature Stress[J].Journal of agricultural and food chemistry,2014,62(14):3306-3313.
[16]PAJAK P,SOCHA R,GALKOWSKA D,et al.Phenolic profile and antioxidant activity in selected seeds and sprouts[J].Food Chem,2014,143:300-306.
[17]Wu Z,Song L,Feng S,et al.Germination dramatically increasesisoflavonoidcontentanddiversityinchickpea(Cicerarietinum L.)seeds[J].Journal of agricultural and food chemistry,2012,60(35):8606-8615.
[18]Jeon H Y,Seo D B,Shin H J,et al.Effect of Aspergillusoryzaechallengedgerminationonsoybeanisoflavonecontentand antioxidant activity[J].Journal of agricultural and food chemistry,2012,60(11):2807-2814.
[19]Aguilera Y,Díaz M F,Jiménez T,et al.Changes inNonnutritionalFactorsandAntioxidantActivityduring Germination of Nonconventional Legumes[J].Journal of agricultural and food chemistry,2013,61(34):8120-8125.
[20]Prior R L,Hoang H,Gu L,et al.Assays for hydrophilic and lipophilicantioxidantcapacity(oxygenradicalabsorbance capacity(ORACFL))of plasma and other biological and food samples[J].Journal of Agricultural and Food Chemistry,2003,51(11):3273-3279.
[21]Dudonne S,Vitrac X,Coutiere P,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agricultural and Food Chemistry,2009,57(5):1768-1774.
[22]Shen Y,Jin L,Xiao P,et al.Total phenolics,flavonoids,antioxidant capacity in rice grain and their relations to grain color,size and weight[J].Journal of Cereal Science,2009,49(1):106-111.
Effect of germination on the content of polyphenols and antioxidation activity of kidney beans(Phaseolus vulgarisl L.)
LIANG Ya-jing1,2,HAN Fei2,*,LIANG Ying1,DI Wen-long2,CHEN Xi2,ZHENG Lu2,LIN Qin-lu1,*,GUAN Xiao3
(1.Central South University of Forestry and Technology,Changsha 410004,China;2.Academy of State Administration of Grain,Beijing 100037,China;3.Medical Devices and Food Sciences College of Shanghai Polytechnic University,Shanghai 200093,China)
The effect of germination on the content of polyphenols and flavonoids and antioxidant activity of black beans,speckled kidney beans,and purple beans was studied.The correlation between phenolic content,flavonoid content and antioxidant activity was analyzed.It was found that the content of phenolics and flavonoids in all three germinated beans(0~6 d)significantly lower than in raw beans(p<0.05).The loss of phenolics and flavonoids during soaking stage was higher than that during germination stage among all three beans.Interestingly,after germination for 6 days,content of phenolics and flavonoids in black bean began to increase,implying phenolics release caused by endo-enzymes.Generally,the antioxidant activity determined with DPPH·radical scavenging capacity(DPPH),ABTS+·radical scavenging capacity(ABTS),ferric reducing antioxidant power(FRAP)or oxygen radical absorption capacity(ORAC)all showed decreasing trends during germination process,which was highly correlated with content of phenolics and flavonoids in the beans.The most correlated indices with r of 0.955 in this study was content of phenolics and the ABTS values.Research also showed that the antioxidant activity of black beans increased after 4 day germination,and the ORAC value of black beans and speckled kidney beans after 6 day germination were even higher than those of 0 d.In conclusion,better biologically active substance could be obtained for different beans under suitable conditions.
kidney beans;germination;phenols;flavonoids;antioxidation
TS201.2
A
1002-0306(2015)16-0142-05
10.13386/j.issn1002-0306.2015.16.021
2014-12-03
梁亚静(1988-),女,硕士研究生,研究方向:粮油营养,E-mail:lliangyajing@163.com。
林亲录(1966-),男,教授,研究方向:粮食深加工,E-mail:lql0403@yahoo.com.cn。韩飞(1973-),女,副研究员,研究方向:粮油营养,E-mail:hf@chinagrain.org。
国家粮食公益性行业科研专项(201313011-6)。

