葡萄酒泥酵母β-葡聚糖提取工艺条件优化
杨 婷,祝 霞,李 颍,韩舜愈,杨学山(1.甘肃农业大学食品科学与工程学院,甘肃兰州7300700;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州730070;3.甘肃农业大学生命科学技术学院,甘肃兰州730070)
葡萄酒泥酵母β-葡聚糖提取工艺条件优化
杨婷1,2,祝霞1,2,李颍1,2,韩舜愈1,2,杨学山2,3,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州7300700;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州730070;3.甘肃农业大学生命科学技术学院,甘肃兰州730070)
以诱导自溶的葡萄酒泥酵母细胞壁为试材,在料液比、碱液浓度、浸提时间和浸提温度等单因素实验基础上,采用正交实验优化β-葡聚糖提取最优工艺条件。结果表明,葡萄酒泥酵母β-葡聚糖提取优化的最佳工艺条件为:料液比1∶40(g/mL),NaOH浓度3%,浸提温度80℃,浸提时间1.5 h,在此条件下β-葡聚糖提取率为19.38%。此方法提取率较高且简单易行、成本较低。
葡萄酒泥酵母,β-葡聚糖,碱法,提取
酵母β-葡聚糖位于细胞壁内层,占细胞壁干物质量的40%~60%左右[1-2]。β-葡聚糖具有抗癌、抗肿瘤、抗病毒、降低胆固醇和血脂、增强免疫力等生理活性,是一种良好的生物效应调节剂[3-5];同时由于其具有高粘性、高持水性和热稳定性等特点[6],可广泛应用于医药、食品、化妆品、建筑材料等领域[7]。在制备酵母β-葡聚糖过程中,需要大批量发酵培养酵母细胞,既提高了生产成本而且会产生大量废弃物。葡萄酒泥是葡萄酒酿造过程中最主要的副产物,含有大量的酵母细胞[8]。据统计我国每年都会产生约4万吨葡萄酒泥酵母[9],实际生产中大多作为廉价粗饲料出售或直接排放,不仅浪费了生物资源,同时对环境也造成了很大污染[10]。因此开展葡萄酒泥酵母资源化利用研究,既可降低酵母β-葡聚糖生产原料成本,又能实现较高的经济效益和社会效益[11]。
目前国内外主要利用酵母细胞以酸法、碱法和生物酶法提取酵母β-葡聚糖[12]。由于酵母细胞壁质地坚硬,完全破壁困难导致生物酶法提取率较低,生产成本较高。酸法、碱法尽管得率较高,但产品中杂质过多,纯度不高[13-14]。利用诱导自溶后去除细胞内容物的酵母细胞壁提取β-葡聚糖,可通过纯化原料提高产物纯度[15]。本实验利用诱导自溶后的葡萄酒泥细胞壁为原料,分析料液比、碱液浓度、浸提时间和温度对β-葡聚糖提取的影响,并对其工艺技术进行优化,以期为葡萄酒泥酵母β-葡聚糖开发利用提供技术支持。
1 材料与方法
1.1材料与仪器
葡萄酒酵母泥甘肃祁连葡萄酒业有限公司;葡萄糖标准品Sigma公司;冰乙酸、异丙醇、无水乙醇、氢氧化钾、氢氧化钠、氯化钠、乙酸钠、蒽酮等均为国产分析纯。
HH-1数显恒温水浴锅上海梅香仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器上海申安医疗器械厂;TU-1810紫外可见分光光度计北京普析通用仪器有限责任公司;NSKY-100B恒温培养振荡器上海苏坤实业有限公司;AL204电子天平梅特勒-托利多仪器(上海)有限公司;PHS-3C pH计上海雷磁;电热鼓风干燥箱上海一恒科学仪器有限公司;L550台式低速离心机长沙湘仪离心机仪器有限公司。
1.2实验方法
1.2.1提取工艺流程葡萄酒泥→诱导自溶→离心取沉淀(4000 r/min,15 min)→除甘露聚糖→离心取沉淀(4000 r/min,15 min)→碱提→离心取沉淀(4000 r/min,15 min)→有机溶剂处理除脂类→离心取沉淀(4000 r/min,15 min)→干燥(37℃,12 h)→β-葡聚糖含量测定
1.2.2操作要点
1.2.2.1酵母自溶参照本实验室已建立的方法,准确称取4 g葡萄酒泥酵母,加入2%NaCl后溶于pH4.5的醋酸-醋酸钠缓冲液,47.5℃诱导自溶33 h,85℃水浴灭酶15 min,4000 r/min离心15 min,取沉淀。
1.2.2.2除甘露聚糖称取自溶后的酵母细胞壁2.5 g,以料液比为1∶12.5混悬,加入3%的KOH溶液,90℃水浴2 h,冷却至室温,用20%的冰乙酸溶液中和至pH7,搅拌10 min,4000 r/min离心15 min,取沉淀。
1.2.2.3β-葡聚糖碱提取按一定的料液比加入NaOH溶液,水浴保温一定时间,4000 r/min离心15 min,取沉淀[16]。
1.2.2.4有机溶剂处理除脂类将沉淀用蒸馏水洗涤2次,加入4%的冰乙酸溶液3 mL,室温下放置2 h,4000 r/min离心15 min,取沉淀,蒸馏水洗涤2次,以料液比为1∶2加入异丙醇,4℃静置12 h,4000 r/min离心15 min,取沉淀。
1.2.3β-葡聚糖含量测定
1.2.3.1标准曲线的绘制参照文献[17]的方法,准确配制葡萄糖质量浓度分别为0、20、40、60、80、100 μg/mL,加入4 mL 0.2%蒽酮试剂,混合均匀后迅速冷却,待各试管加样完成后一起浸于沸水中,加盖,自煮沸起10 min取出,迅速冷却,室温放置10 min。于620 nm波长下比色,记录吸光值,并绘制标准曲线。
1.2.3.2样品制备准确称取20.0 mg固体样品放入水解管中,加入1.5 mL 72%的浓H2SO4,室温下静置3 h,加入蒸馏水使H2SO4的最终浓度为2 mol/L,置于100℃水浴中水解4 h,冷却至室温,调pH至中性。水解液转入100 mL容量瓶定容备用。
1.2.3.3样品测定准确吸取样品溶液1 mL,加入蒽酮试剂4 mL,在620 nm下测吸光值,以标准曲线计算β-葡聚糖含量。
1.2.3.4β-葡聚糖得率的计算
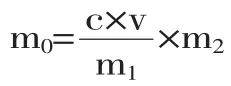
式中:m0-β-葡聚糖质量(g);c-根据线性回归方程计算得到的样品溶液浓度(μg/mL);v-样品溶液体积(mL);m1-样品溶液中β-葡聚糖的质量(g);m2-粗多糖提取物的质量(g)。
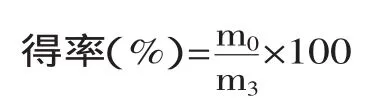
式中:m0-β-葡聚糖质量(g);m3-酵母细胞壁干重(g)。
1.2.4单因素实验
1.2.4.1料液比对β-葡聚糖提取的影响分别称取5份酵母细胞壁各2.5 g,去除甘露聚糖后,分别以1∶10、1∶20、1∶30、1∶40、1∶50(g/mL)的料液比加入4%的NaOH溶液,置于80℃水浴锅中处理2.5 h,冷却至室温后离心取沉淀,蒸馏水洗涤2次,加入4%的冰乙酸溶液3 mL,室温下处理2 h,离心取沉淀,蒸馏水洗涤2次。向沉淀中加入2倍体积异丙醇,4℃静置12 h,离心取沉淀,加入3 mL无水乙醇溶液洗涤2次。将沉淀置于平皿中,37℃干燥12 h,得粗多糖提取物。计算β-葡聚糖得率,重复3次。
1.2.4.2NaOH浓度对β-葡聚糖提取的影响分别称取5份酵母细胞壁各2.5 g,去除甘露聚糖后,以1∶40(g/mL)的料液比分别加入2%、3%、4%、5%、6%的NaOH溶液,置于80℃水浴锅中处理2.5 h,其余步骤同1.2.4.1。计算β-葡聚糖得率,重复3次。
1.2.4.3浸提温度对β-葡聚糖提取的影响分别称取5份酵母细胞壁各2.5 g,去除甘露聚糖后,以1∶40(g/mL)的料液比加入4%的NaOH溶液,分别置于60、70、80、90、100℃水浴锅中处理2.5 h,其余步骤同1.2.4.1。计算β-葡聚糖得率,重复3次。
1.2.4.4浸提时间对β-葡聚糖提取的影响分别称取5份酵母细胞壁各2.5 g,去除甘露聚糖后,以1∶40(g/mL)的料液比加入4%的NaOH溶液,置于80℃水浴锅中分别处理1.5、2、2.5、3、3.5 h,其余步骤同1.2.4.1。计算β-葡聚糖得率,重复3次。
1.2.5正交实验设计根据单因素实验结果,确定葡萄酒泥酵母中提取β-葡聚糖的正交实验因素和水平,采用L9(34)正交实验设计,因素水平如表1所示。对所选最优组合实验条件提取β-葡聚糖进行验证实验,确定碱法提取β-葡聚糖的最优工艺。
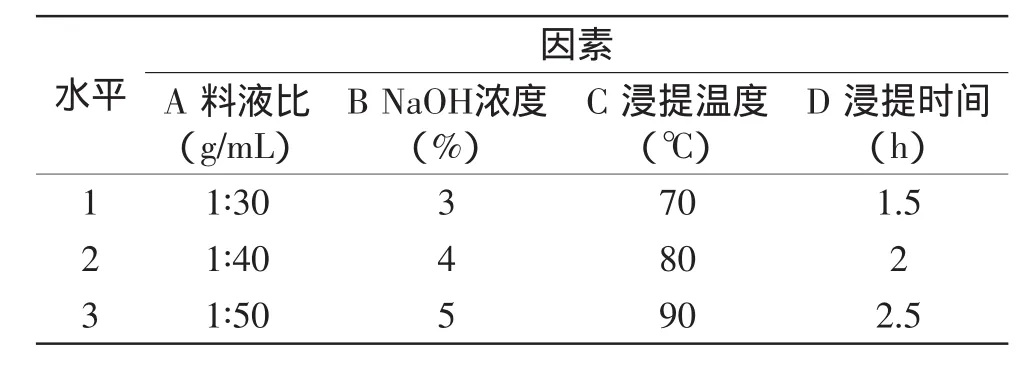
表1 L9(34)正交实验因素水平表Table 1 Factors and levels in L9(34)orthogonal test
1.3统计分析
采用SPSS 18.0软件进行正交实验并对实验结果进行方差分析。
2 结果与分析
2.1标准曲线的制备
通过蒽酮-硫酸法,以β-葡聚糖质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线(图1)。线性回归方程为:y=0.0072x+0.0019(R2=0.9993),符合测定要求。
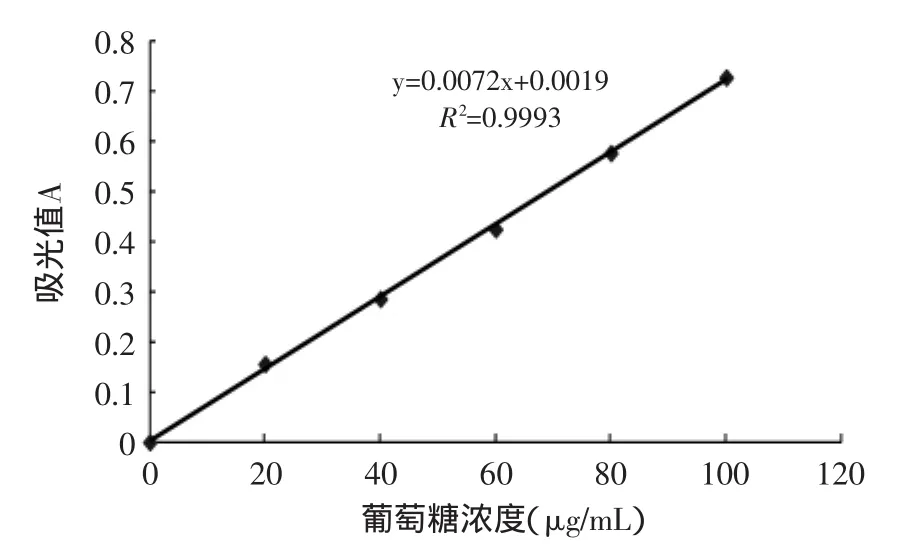
图1 葡萄糖含量标准曲线Fig.1 The standard curve of various concentration of the glucose
2.2单因素结果与分析
2.2.1料液比对β-葡聚糖提取的影响由图2可知,随着料液比的增加,β-葡聚糖得率逐渐增高,当料液比为1∶40(g/mL)时,β-葡聚糖得率最大,为17.85%。所以选择1∶40(g/mL)料液比为提取β-葡聚糖的较佳料液比。当料液比小于或大于1∶40(g/mL)时,都会使β-葡聚糖提取率下降。出现这一结果的原因是起始原料浓度过高不利于酵母细胞壁分散,与提取液接触不充分影响β-葡聚糖的浸出,造成提取率较低;当料液比大于1∶40(g/mL)时,过量的NaOH会破坏β-葡聚糖结构,导致得率下降[3]。
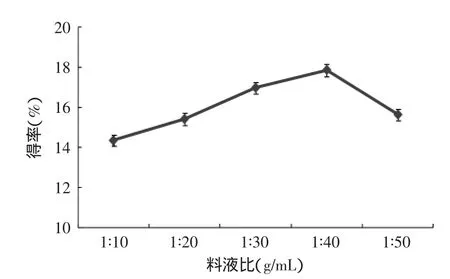
图2 料液比对β-葡聚糖提取的影响Fig.2 Effect of solid-liquid ratio on the extraction rate of β-glucan
2.2.2NaOH浓度对β-葡聚糖提取的影响由图3可知,NaOH浓度不同时,β-葡聚糖得率不同。当NaOH浓度为4%时,β-葡聚糖得率最大,为17.73%,所以选择4%NaOH浓度为提取β-葡聚糖的较佳NaOH浓度。当NaOH浓度小于4%时,随着碱浓度的增加,β-葡聚糖提取率增加,这是由于β-葡聚糖本身具有一定碱溶性,碱浓度的增加有利于其从细胞壁中溶出[18];当NaOH大于4%时,得率反而降低,这是由于碱浓度过高,破坏β-葡聚糖的结构,导致β-葡聚糖损失。
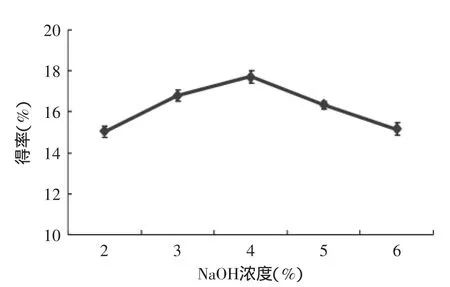
图3 NaOH浓度对β-葡聚糖提取的影响Fig.3 Effect of NaOH concentration on the extraction rate of β-glucan
2.2.3浸提温度对β-葡聚糖提取的影响由图4可知,浸提温度为80℃时,β-葡聚糖得率最大,为17.68%,所以选择80℃为提取β-葡聚糖的较佳温度。当温度为60、70℃时,β-葡聚糖提取率比80℃时小,可能是由于碱溶性物质在较低温度下未能充分溶解,致使β-葡聚糖得率较低;当提取温度为90、100℃时β-葡聚糖得率反而随温度的升高降低,可能是由于在高温作用下,部分β-葡聚糖降解为低聚糖,以至β-葡聚糖得率下降。
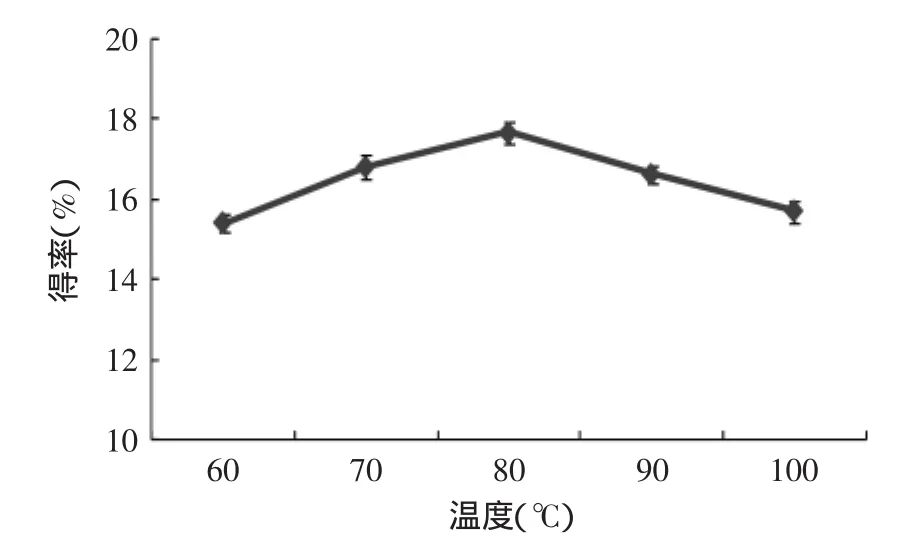
图4 浸提温度对β-葡聚糖提取的影响Fig.4 Effect of temperature on the extraction rate of β-glucan
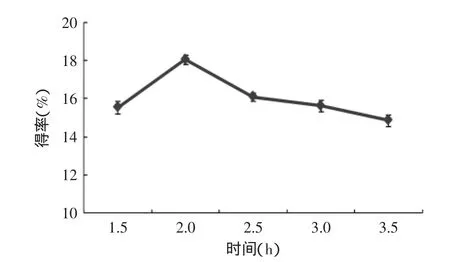
图5 浸提时间对β-葡聚糖提取的影响Fig.5 Effect of time on the extraction rate of β-glucan
2.2.4浸提时间对β-葡聚糖提取的影响由图5可知,不同浸提时间下,β-葡聚糖得率也有所差异。当浸提时间为2 h时,β-葡聚糖得率最大,为18.10%,所以选择2 h为提取β-葡聚糖的较佳时间。当浸提时间小于2 h时,碱溶性物质不能完全溶于碱液中,反应不充分,致使β-葡聚糖得率较小;时间过长时,会使β-葡聚糖降解,杂质相应的也被提取出来导致β-葡聚糖得率减小[19]。
2.3正交实验结果与分析
根据单因素实验结果,以β-葡聚糖得率为指标,按L9(34)正交表进行正交实验,结果见表2。由表2实验结果可以得出,影响碱法提取葡萄酒泥酵母β-葡聚糖因素的主次顺序为:NaOH浓度>浸提时间>料液比>浸提温度。提取葡萄酒泥酵母β-葡聚糖的最优组合是A2B1C2D1,即料液比1∶40(g/mL),NaOH浓度3%,浸提温度80℃,浸提时间1.5 h。由表3方差分析可知,NaOH浓度、浸提时间对β-葡聚糖得率影响显著(p<0.05)。
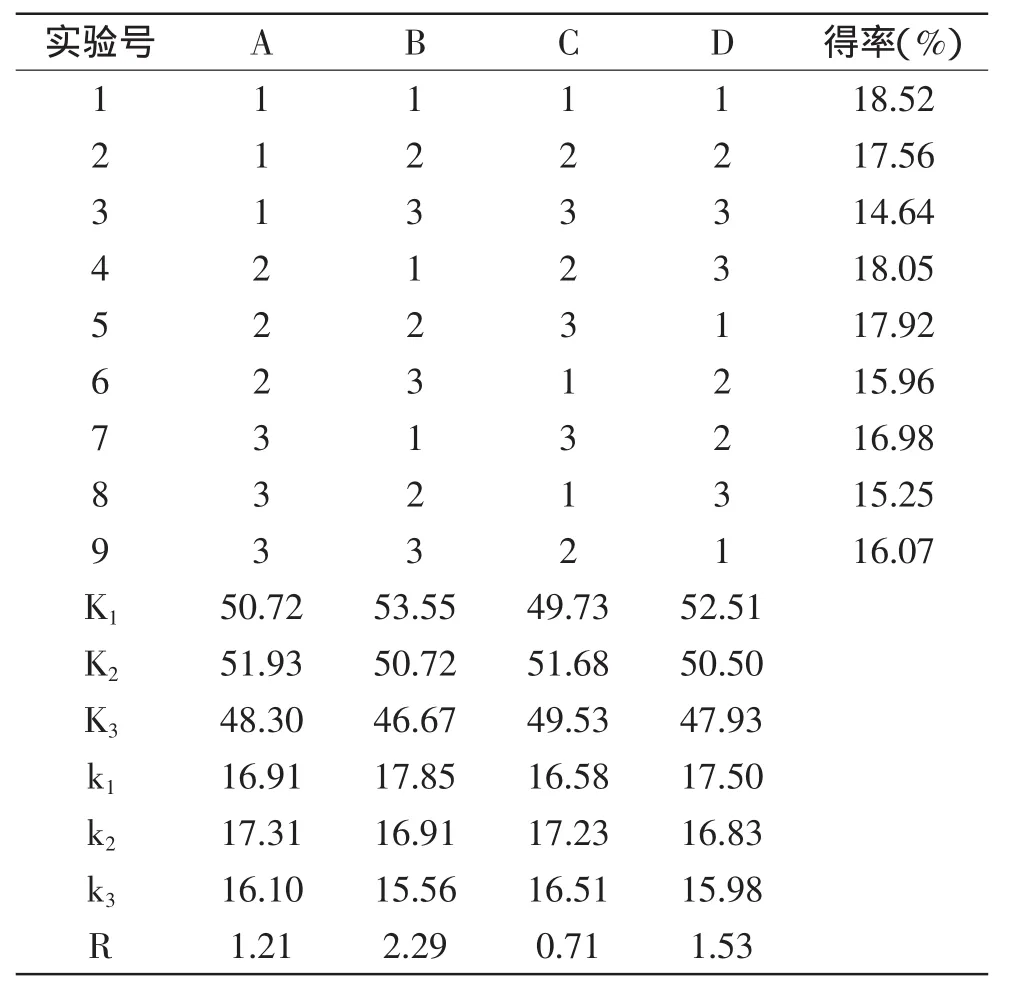
表2 L9(34)正交实验结果Table 2 Results of L9(34)orthogonal experiments
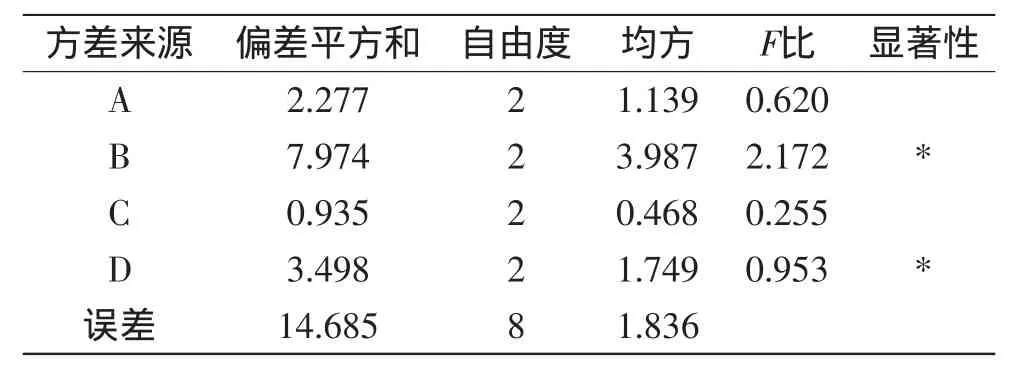
表3 正交实验方差分析表Table 3 Analysis results of variance
2.4验证实验结果
因正交实验所得最优组合在L9(34)正交实验设计中未出现,需要对所得最优组合进行验证实验。在料液比1∶40(g/mL),NaOH浓度3%,提取温度80℃,提取时间1.5 h条件下提取β-葡聚糖,重复3次取平均值,测得β-葡聚糖得率为19.38%。该得率高于正交实验中各组合得率。因此确定该组合为葡萄酒泥酵母β-葡聚糖提取的最佳工艺参数。
3 结论
利用诱导自溶后的葡萄酒泥酵母细胞壁提取β-葡聚糖,研究了碱法提取β-葡聚糖的最佳关键工艺参数。在单因素实验基础上利用L9(34)正交实验对葡萄酒泥酵母β-葡聚糖提取最佳工艺条件进行了优化。确定的最佳工艺参数为料液比为1∶40(g/mL),NaOH浓度为3%,提取温度为80℃,提取时间为1.5 h,在此条件下所得β-葡聚糖的平均得率达到19.38%。与龚炎杰等[4]利用碱法提取酵母细胞壁β-葡聚糖所得得率10%相比,提高了大约2倍;与黄丹等[20]使用质量浓度6%的NaOH,β-葡聚糖得率8.73%相比,碱用量降低了3%,提取率提高了2.2倍。由此可见,该工艺条件的建立可为利用葡萄酒泥酵母开发β-葡聚糖奠定基础。
[1]朱益波,翟丽君,朱明,等.啤酒废酵母中β-D-葡聚糖非降解提取工艺[J].食品科学,2011,32(20):121-125.
[2]BORHANI C,FONTEYN F,JAMIN G,et al.Enzymatic process for the fractionation of baker’s yeast cell wall(Saccharomyces cerevisiae)[J].Food Chemistry,2014,163:108-113.
[3]张朝,任文彬,刘颖.从破壁酵母中提取β-1,3-D-葡聚糖的研究[J].农产品加工,2010(11):60-62.
[4]龚炎杰,郭祀远,魏东,等.从酿酒酵母细胞提取β-1,3-D-葡聚糖的研究[J].中国食品添加剂,2006,1(2):57-59.
[5]LIMBERGER-BAYER V M,DE FRANCISCO A,CHAN A,et al.Barley β-glucans extraction and partial characterization[J]. Food chemistry,2014,154:84-89.
[6]黄国宏.酵母β-1,3-D-葡聚糖提取酶解工艺的研究[J].食品工业科技,2007,28(5):200-203.
[7]张民,白鑫,边东哲,等.燕麦多糖的提取工艺及分子量分布研究[J].食品工业科技,2010,31(2):218-219.
[8]杜娜,杨学山,韩舜愈,等.葡萄酒泥酵母超氧化物歧化酶分离提取工艺条件优化[J].食品工业科技,2013,34(15):242-245.
[9]李莹,苏婷婷,王战勇.葡萄加工副产品的综合利用研究[J].食品科学,2012,28(4):106-108.
[10]王淮,唐治玉,熊善柏.废啤酒酵母中β-1,3-D-葡聚糖的提取及成分分析[J].华中农业大学学报,2006,24(6):626-629.
[11]王静,戴军,陈尚卫,等.提取酵母细胞壁中β-D-葡聚糖的新方法[J].食品与发酵工业,2011,37(1):189-193.
[12]FREIMUND S,SAUTER M,KAPPELI O,et al.A new nondegrading isolation process for 1,3-β-D-glucan of high purity from baker’s yeast Saccharomyces cerevisiae[J].Carbohydrate Polymers,2003,54(2):159-171.
[13]LIU X Y,WANG Q,CUI S W,et al.A new isolation method of β-D-glucans from spent yeast Saccharomyces cerevisiae[J]. Food Hydrocolloids,2008,22(2):239-247.
[14]冯文娟,徐泽平,周传兵,等.酵母β-1,3-D-葡聚糖提取及结构鉴定[J].食品与机械,2013,29(5):151-153.
[15]李杨,包清彬,孔凌,等.酵母抽提物自溶工艺优化[J].食[16]VALAQUES JUNIOR G L,DE LIMA F O,BOFFO E F,et al. Extraction optimization and antinociceptive activity of(1,3)-β-D-glucanfromRhodotorulamucilaginosa[J].Carbohydrate polymers,2014,105:293-299.
品工业,2011(5):62-65.
[17]祁业明.酵母葡聚糖的研制[D].天津:天津科技大学,2008.
[18]董兴叶,孙楚,刘瑶,等.超声波法对燕麦β-葡聚糖提取及性质的影响[J].食品工业科技,2014,35(16):294-297.
[19]马国刚,王建中.超声波辅助提取青稞β-葡聚糖的工艺条件优化[J].食品科技,2009(11):168-174.
[20]黄丹,刘达玉.酿酒酵母中活性多糖的提取工艺研究[J].食品工业,2004(4):27-29.
Optimization of extracting processing condition of β-Glucan from wine yeast
YANG Ting1,2,ZHU Xia1,2,LI Ying1,2,HAN Shun-yu1,2,YANG Xue-shan2,3,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Key Lab of Viticulture and Enology,Lanzhou 730070,China;3.College of Life Science&Technology,Gansu Agricultural University,Lanzhou 730070,China)
The induced autolytic wine yeast cell wall was used as raw materials to extract β-glucan.On the basis of single factor test including solid-liquid ratio,alkali concentration,extraction time and extraction temperature,the orthogonal test was applied to determine the optimal extraction conditions.The results showed that the optimum conditions of β-glucan were as following:solid-liquid ratio 1∶40(g/mL),the concentration of NaOH 3%,extraction temperature 80℃and extraction time 1.5 h.Under these conditions,the yield of β-glucan was 19.38%.The process was simple and inexpensive and had higher extraction rate.
wine yeast;β-glucan;alkaline process;extraction
TS209
B
1002-0306(2015)18-0286-05
10.13386/j.issn1002-0306.2015.18.049
2015-01-22
杨婷(1991-),女,硕士研究生,研究方向:葡萄及葡萄酒研究,E-mail:lalating2009@163.com。
杨学山(1977-),男,副教授,研究方向:生物化学与生物产品研发,E-mail:yangxs@gsau.edu.cn。
甘肃省农业生物技术研究与应用开发项目(GNSW-2013-21)。

